需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
细胞模拟支持和悬浮脂质双分子层模型的组装用于分子相互作用研究
摘要
该协议描述了模拟单脂质和多脂质囊泡,支持脂质双分子层和悬浮脂质双分子层的细胞的形成。这些 体外 模型可以适应于结合各种脂质类型,并可用于研究各种分子和大分子相互作用。
摘要
模型细胞膜是一种有用的筛选工具,其应用范围从早期药物发现到毒性研究。细胞膜是所有细胞类型的重要保护屏障,将内部细胞成分与细胞外环境分开。这些膜主要由脂质双层组成,其包含外部亲水性头基团和内疏水尾基团,以及各种蛋白质和胆固醇。脂质本身的组成和结构在调节生物功能方面起着至关重要的作用,包括细胞与细胞微环境之间的相互作用,其中可能含有药物,生物毒素和环境毒物。在这项研究中,描述了配制单脂质和多脂支持和悬浮细胞模仿脂质双分子层的方法。以前,开发了单脂磷脂酰胆碱(PC)脂质双分子层以及多脂胎盘滋养层启发的脂质双分子层,用于理解分子相互作用。在这里,将介绍实现这两种类型的双层模型的方法。对于模拟多脂双分子层的细胞,首先通过从原代细胞或细胞系中提取脂质,然后通过液相色谱-质谱(LC-MS)确定所需的脂质组成。使用该组合物,使用薄膜水合和挤出方法制备脂质囊泡,并表征其流体动力学直径和zeta电位。然后,可以使用具有耗散监测功能的石英晶体微量天平(QCM-D)和多孔膜分别用于平行人工膜渗透率测定(PAMPA)形成支撑和悬浮的脂质双分子层。代表性结果突出了 体外 细胞膜脂质双层模型的再现性和多功能性。所提出的方法可以帮助快速,方便地评估各种分子和大分子与细胞膜的相互作用机制,例如渗透,吸附和嵌入,有助于筛选候选药物和预测潜在的细胞毒性。
引言
细胞膜主要由磷脂,胆固醇和蛋白质组成,是所有活细胞1的重要组成部分。在脂质两亲性的驱动下,细胞膜起到保护屏障的作用,并调节细胞如何与其周围环境相互作用2。一些细胞过程依赖于膜1、2的脂质和蛋白质组成。例如,细胞膜相互作用对于有效的药物递送很重要3。药品、生物制剂、纳米材料、生物毒素和环境毒物都会影响细胞膜的完整性,从而影响细胞功能4。基于细胞膜脂质组成的体外细胞模拟膜模型的构建有可能提供简单的工具,以大大增强对这些材料对细胞的潜在影响的研究。
模型脂质双层包括脂质囊泡、支持脂质双层和悬浮脂质双层。负载脂质双分子层是磷脂细胞膜的模型,通常用于生物技术应用,其中脂质囊泡在支撑的底物材料5,6,7,8,9上破裂。用于监测双层形成的一种常用技术是具有耗散监测功能的石英晶体微量天平(QCM-D),它检查囊泡的吸附与原位8,10,11,12,13,14的体积液体性质的比较.以前,QCM-D已被用于证明在流动条件下,一旦在表面上实现磷脂酰胆碱(PC)脂质囊泡的关键囊泡覆盖,它们就会自发破裂成刚性脂质双层15。先前的工作还研究了具有不同脂质组成的支持脂质双层形成16,脂质蛋白17,18,19的掺入,并利用聚合物垫20,产生能够模仿细胞膜功能各个方面的负载脂质双层。
脂质双分子层已被用于通过改变磷脂,胆固醇和糖脂成分来模仿从亚细胞到器官水平(包括线粒体,红细胞和肝细胞膜)的各种生物屏障21。这些更复杂的多脂质囊泡可能需要额外的方法来实现囊泡破裂,这取决于脂质组成。例如,以前的研究已经利用来自丙型肝炎病毒的非结构蛋白5A的α螺旋(AH)肽,通过破坏吸附的脂质囊泡22,23来诱导双层的形成。使用这种AH肽,支持脂质双层模仿胎盘细胞先前已经形成24。支持脂质双分子层在生物医学应用中的巨大潜力已经通过分子和纳米颗粒运输25、26、环境毒物相互作用27、蛋白质组装和功能17、18、19、肽排列和插入28、29、药物筛选30和微流体平台31的研究得到了证明。
悬浮脂质双分子层已通过平行人工膜渗透率测定法(PAMPA)用于药物筛选研究,其中脂质双分子层悬浮在多孔疏水插入物32,33,34,35上。PAMPA脂质模型已经开发用于不同的生物界面,包括血脑,颊,肠和透皮界面36。通过结合支持的脂质双分子层和PAMPA技术,可以彻底研究化合物在所需组织或细胞类型的脂质成分中的吸附,渗透性和包埋。
该协议描述了 体外 细胞膜脂质双层模型的制备和应用,以研究几种分子相互作用。详细介绍了单脂和多脂支持和悬浮脂质双分子层的制备。为了形成支持的脂质双层,首先使用薄膜水合和挤出方法开发脂质囊泡,然后进行物理化学表征。讨论了使用QCM-D监测形成支持的脂质双层和制造用于PAPA的悬浮脂质膜。最后,检查用于开发更复杂的细胞模拟膜的多脂囊泡。使用两种类型的制造脂质膜,该协议演示了如何使用该工具来研究分子相互作用。总体而言,该技术构建了具有高可重复性和多功能性的模拟脂质双分子层的细胞。
研究方案
1. 发展单脂囊泡
- 薄膜水合法
- 脂质储备溶液的制备和储存
注:使用氯仿的所有步骤都需要在化学通风橱中执行。氯仿应始终使用溶剂安全的碳纤维移液器吸头进行移液。含有氯仿的溶液应始终储存在玻璃瓶中。- 通过将适当体积的氯仿加入含有脂质粉末的小瓶中并充分混合,制备10mg / mL脂质储备溶液。例如,将20毫升氯仿加入200毫克L-α磷脂酰胆碱(鸡蛋,鸡肉)(鸡蛋PC)。如果需要,储备溶液可以以不同的浓度制成。
注意:如果粉末脂质储存在安瓿中,则在将氯仿转移到带有聚四氟乙烯(PTFE)衬里盖的玻璃小瓶中后。 - 用Parafilm密封小瓶盖,并在-20°C下储存长达6个月。
- 通过将适当体积的氯仿加入含有脂质粉末的小瓶中并充分混合,制备10mg / mL脂质储备溶液。例如,将20毫升氯仿加入200毫克L-α磷脂酰胆碱(鸡蛋,鸡肉)(鸡蛋PC)。如果需要,储备溶液可以以不同的浓度制成。
- 形成干脂膜
- 将适当体积的脂质储备溶液加入干净的玻璃瓶中,最终囊泡浓度为2.5mg / mL。例如,以2.5mg / mL形成1mL的卵PC囊泡,将250μL的卵PC储备溶液移液到小瓶中。
注意:制备的体积可能取决于所使用的挤出机工艺(见步骤1.3)。迷你挤出机的最大推荐容积为 1 mL,而大型挤出机容积范围为 5-50 mL。 - 使用N2 气体流从脂质储备溶液中除去氯仿(超纯5.0级)。
- 为确保完全去除氯仿,将干燥的脂质膜连接到真空并放置至少4小时。
注意:该过程可以在此处停止。如果真空干燥后不会立即使用脂质膜,请存放在干燥器中直至使用。我们已经观察到,在这些条件下储存1周后,这些脂质膜产生相似质量的囊泡;如有必要,应进一步探讨较长储存时间后的囊泡质量。
- 将适当体积的脂质储备溶液加入干净的玻璃瓶中,最终囊泡浓度为2.5mg / mL。例如,以2.5mg / mL形成1mL的卵PC囊泡,将250μL的卵PC储备溶液移液到小瓶中。
- 执行冻融涡旋循环
- 制备含有10 mM Tris碱和100 mMNaCl的Tris氯化钠(NaCl)缓冲溶液。用所需体积的Tris NaCl缓冲液重新水合干燥的脂质膜,以产生2.5mg / mL的最终囊泡浓度,并涡旋约15-30秒。
- 将囊泡悬浮液转移到装有干冰的容器中,直到冷冻约30分钟。样品完全冷冻后,在30-40°C水浴中解冻悬浮液。涡旋解冻的囊泡悬浮液。
注意:液体N2 可用于代替干冰。将囊泡悬浮液转移到液氮中30秒,然后立即在80°C水浴中解冻。 - 重复步骤1.1.3.2再重复4次,共5次冻融涡旋循环。
- 脂质储备溶液的制备和储存
- 挤压
注意:在冻融涡旋循环完成后,形成多层囊泡。挤出有助于减小尺寸和形成大型单层囊泡。- 迷你(1 mL)挤出机工艺
- 使用超纯水中的温和洗涤剂彻底清洁挤出机的所有部件,并用超纯水冲洗至少三次,确保去除所有洗涤剂。用 N2 气体干燥。
- 组装两个内部膜支架和O形圈(内径为12.7毫米;外径为15.2毫米)。放置每个膜支架,使O形圈朝上。
- 用超纯水预湿过滤器支架。将其放在O形圈内的膜支撑表面上。对第二个内部膜支撑重复上述步骤。
- 将一个内部膜支架定位到挤出机外壳中。将一块 100 nm 聚碳酸酯膜直接放在过滤器支撑物上方的内部膜支架上。
注:聚碳酸酯膜单独存放在蓝色纸张之间。在插入膜支架之前,请先取出分离纸。 - 将第二个内部膜支架定位到挤出机外壳中,O形圈和过滤器支撑侧面向聚碳酸酯膜。将 PTFE 轴承连接到固定螺母中,并用挤出机外壳拧紧螺钉。将挤出机夹入加热块中。
- 将脂质囊泡悬浮液装入其中一个注射器中,并将注射器放入挤出机加热块中,将针头完全插入挤出机的一端。将第二个空注射器插入另一侧,并使用加热块上的臂夹锁定两个注射器。
注意:如果需要,将挤出机加热块放在热板上,并将温度设置为高于脂质转变温度的值。将温度计插入内置于加热块中的支架中,以获得准确的温度读数,并等待达到所需温度(约15分钟)。卵PC脂质囊泡在挤出过程中不需要加热。 - 慢慢地将囊泡悬浮液推入空注射器中,然后推回原来的注射器中。监测整个挤出过程中表明泄漏的压力变化。重复20次,总共21次通过聚碳酸酯膜。将脂质囊泡转移到干净的玻璃小瓶中储存。
注意:可以根据脂质组成优化挤出的数量。 - 如果使用热量,则允许挤出的囊泡悬浮液达到室温。将挤出的脂质囊泡储存在4°C直至进一步使用。
注意:推荐的囊泡储存持续时间高度依赖于脂质组成,并且应随着时间的推移监测囊泡的物理化学性质(例如,流体动力学直径,zeta电位)。例如,卵PC囊泡已经储存了至少两周,囊泡大小或双层形成能力没有变化。
- 大型 (5-50 mL) 挤出机工艺
注意:如果所选脂质需要加热,请遵循步骤1.2.2.1-1.2.2.5。如果不需要加热,请跳到步骤 1.2.2.5。步骤1.2.2.1-1.2.2.4对于蛋PC不是必需的。- 在 1 L 烧瓶中加入反渗透 (RO) 水。
注意:请勿使用超纯水在 50 mL 系统中循环,因为它会导致金属离子从挤出机气缸中浸出。 - 将1L烧瓶放入热板上的水浴中,并将热板设置为高于脂质转变温度的温度。
- 通过样品筒上的入口,用柔性管将样品筒连接到烧瓶上。将气缸出口处的管子连接到 1 L 烧瓶的顶部。根据需要在入口和出口处固定管道。这将产生通过样品圆柱体的单向水流。
- 打开泵以启动水循环。如果需要加热,请等待大约30-45分钟,以使样品筒达到所需的温度。
- 通过连接到泄压阀单元的柔性连接器将样品瓶的盖子连接到氮气罐。
- 用70%(v / v)乙醇清洁50 mL挤出机的所有部件。
- 通过将大孔筛支撑、烧结盘、排水盘和聚碳酸酯膜放入挤出机下部支撑的空间来组装挤出机。使用四个螺钉连接挤出机的上部和下部支撑并拧紧。
- 将挤出机单元连接到样品筒上,拧紧底部并用扳手拧紧以固定。
注意:如果使用热量,请将温度计放入圆筒中,等到水达到所需温度后再继续。这将确保样品温度在整个挤出过程中保持。 - 用超纯水填充样品瓶。在将样品加入样品筒之前,通过挤出机单元挤出水。这样做是为了预润膜,类似于小型挤出机。
注:在打开氮气之前,请确保盖子已完全拧紧,并且泄压阀已完全关闭。此步骤需要最小压力(~5-10 psi)。 - 将脂质囊泡悬浮液加入样品筒中,并将顶部拧紧。缓慢增加压力,直到样品开始以大约2-3滴/秒的速度从挤出机单元滴入干净的玻璃瓶中。
注意:在此步骤中不要快速增加压力,因为压力过大可能会对膜产生负面影响并导致挤出不成功。 - 一旦所有样品都被挤出,关闭N2 供应,并通过缓慢打开泄压阀释放样品缸中的压力。将脂质囊泡倒回样品筒中,重复步骤1.2.2.11,再进行9次,共10次挤出。
注意:随着挤出次数的增加,挤出所需的压力可能会降低,因为样品变得更加均匀,尺寸更接近聚碳酸酯膜孔径。 - 将挤出的脂质囊泡悬浮液储存在4°C直至进一步使用。
- 在 1 L 烧瓶中加入反渗透 (RO) 水。
- 迷你(1 mL)挤出机工艺
2. 表征脂质囊泡
- 使用动态光散射 (DLS) 进行流体动力学直径测量
- 涡旋脂质囊泡并将50μL脂质囊泡悬浮液移入一次性小容量比色皿中。盖子可防止灰尘和碎屑污染。
- 将囊泡悬浮液加载到DLS仪器中,输入样品详细信息,并使用相关软件执行测量。
- 泽塔潜力
- 通过使用连接到细胞输入的注射器用超纯水,70%乙醇和超纯水洗涤来制备折叠的毛细管zeta细胞。轻轻地将液体推过细胞3-4次,并在切换到下一个溶液之前完全清空细胞。
- 涡旋脂质囊泡,并在超纯水中制备1:10(v / v)稀释的脂质囊泡。
- 加载稀释的脂质囊泡悬浮液。通过在注射器之间来回推动悬浮液来去除气泡。将塞子连接到每个入口。
注意:去除所有气泡至关重要,因为这会影响测量。 - 将zeta池置于样品室中,确保电极接触。关闭样品室顶部。在相关软件中,输入样品详细信息并收集测量结果。
3. 使用QCM-D形成单脂支持脂质双分子层
- 溶液制备
- 在超纯水中制备2%(w / v)十二烷基硫酸钠(SDS)溶液。在搅拌板上混合直至完全溶解。等分试样工作溶液至少10 mL超纯水,2%SDS和Tris NaCl。
- 在Tris NaCl缓冲液中制备脂质囊泡的稀释液。囊泡的浓度取决于应用。对于卵PC,浓度在0.01-0.5mg / mL范围内已被证明可以成功形成支持的脂质双层。
- 清洗硅涂层石英晶体传感器
注:QCM-D晶体的清洁取决于所用传感器的表面材料。为了形成负载的脂质双分子层,本方案中使用了二氧化硅包被的石英晶体,下面根据制造商的标准操作程序进行了详细说明。- 将二氧化硅涂层的石英晶体传感器插入流动模块,确保晶体上的"t"与模块上的"t"对齐。拧紧流量模块。
注:如果使用的 QCM-D 允许同时连接和运行多个流量模块,请根据需要对其他模块重复以下过程。 - 将流量模块插入仪器底座,将流量模块中的电极与分析仪系统连接。将模块锁定到位。
- 将入口和出口管连接到流量模块和泵。将管道放入保温罩中,然后关闭分析仪系统的盖子。在泵的出口处放置一个废物容器,以收集废液。
- 要进行清洁,请先打开泵。将流速设置为400 μL/min。将进气管插入超纯水中,以 5-10 mL 的流量流经模块。
- 将入口管切换为 2% SDS,以 5-10 mL 的流量流经模块。将进气管切换回超纯水,以 10-20 mL 的流量流经模块。从溶液中取出进气管,使空气流过管路,直到所有液体都喷出。
注意:上述清洁方案在每次测量之前和之后每天使用。可以根据需要进行彻底的清洁。简而言之,要进行彻底的清洁,请拆卸流量模块。除流动模块的电极侧外,所有组件都应浸入2%(w / v)SDS中并进行超声处理,然后用超纯水彻底冲洗并用N2 气体流干燥。包含电极销的流动模块组件不应与液体接触。 - 从流量模块中取出传感器,然后用超纯水冲洗传感器。用 N2 气流干燥传感器。用 N2 气流干燥流动模块。确保电极始终不含任何液体。
- 在化学通风橱中,将二氧化硅涂层的石英晶体传感器插入紫外线(UV)/臭氧清洁仪器中。打开仪器,让治疗至少2分钟。小心地卸下传感器,然后返回到流量模块中。
- 将二氧化硅涂层的石英晶体传感器插入流动模块,确保晶体上的"t"与模块上的"t"对齐。拧紧流量模块。
- 形成Tris NaCl基线
- 打开分析仪以连接到相关软件,并将温度设置为所支持的脂质双分子层的所需值。允许温度稳定到所需的输入。
注意:如果设定温度高于室温,则应使用加热块将所有溶液加热到相同的温度。 - 在开始测量之前,配置测量并查找泛音3、5、7、9、11和13的所有传感器谐振频率和耗散。
注意:可以忽略第一个泛音, 因为这种谐波过于敏感并产生噪声数据。 - 打开泵并将流速设置为 175 μL/min 或所需的实验流速。
- 在插入Tris NaCl之前,用乙醇擦拭入口管。开始测量并开始流动Tris NaCl。
注:数据是实时收集和监控的。在流量模块中,从空气到液体的变化将在数据采集软件中通过快速耗散变化(ΔD)增加和频率变化(ΔF)降低来观察。 - 让Tris NaCl流经模块5-10分钟,确保液体中的基线 ΔF 和 ΔD 值保持稳定。
- 打开分析仪以连接到相关软件,并将温度设置为所支持的脂质双分子层的所需值。允许温度稳定到所需的输入。
- 形成单脂支持脂质双层
- 停止泵并从Tris NaCl溶液中取出入口管,并小心地插入脂质囊泡溶液中。回流5秒,以除去进气管上的任何气泡,然后继续向前流动。在软件中重新启动测量以将基线归零。
注:小心避免管道中的气泡,这些气泡可能流过模块并破坏双层形成和数据记录。 - 流动脂质囊泡,直到在数据采集软件中实时观察到双层形成(卵PC囊泡至少8分钟)。
- 重复步骤3.4.1,将进气管从脂质囊泡更换回Tris NaCl缓冲液。
注意:如果所需的应用是研究分子相互作用,请直接继续执行步骤6.1,而不停止溶液流或数据采集。如果双层形成是终点,请继续执行步骤 3.4.4。 - 在软件中,停止测量并保存文件。停止泵。
- 按照实验方案步骤3.2.4和3.2.5清洁流动模块和二氧化硅涂层石英晶体传感器。
- 停止泵并从Tris NaCl溶液中取出入口管,并小心地插入脂质囊泡溶液中。回流5秒,以除去进气管上的任何气泡,然后继续向前流动。在软件中重新启动测量以将基线归零。
4. 形成悬浮的脂质双层
注意:用于形成悬浮脂质双层的方案改编自过滤板制造商37提供的平行人工膜通透性测定(PAMPA)方案。
- 以20mg / mL(例如,1,2-二油酰基-sn-甘油-3-磷酸胆碱(DOPC))溶解十二烷中的所需脂质。
- 将5μL脂质溶液加入供体室,这是多孔聚偏二氟乙烯(PVDF)96孔多屏过滤板(孔径为0.45μm)。
- 立即将滤板浸入受体室,该受体室是含有300μL1×磷酸盐缓冲盐水(PBS)的运输接收器板。向供体室中加入200μL的1×PBS。
注意:可能包括仅使用脂质的过滤器和暴露于1×PBS的未经处理的过滤器的控制。 - 直接继续到第6.2节,以研究与悬浮脂质双分子层的分子相互作用。建议在形成悬浮双层后16小时内完成研究。
5. 开发模仿囊泡和双层的多脂细胞
- 从哺乳动物细胞中提取脂质
注:脂质提取遵循Bligh-Dyer方法38。- 根据需要培养所需的细胞系。在达到70-80%汇合(T75烧瓶)后,使用胰蛋白酶 - 乙二胺链烷乙酸在37°C下分离细胞5分钟。
- 将细胞以200×g离心5分钟。 除去上清液并将细胞沉淀重悬于1mL超纯水中。
- 将3.75mL氯仿:甲醇的1:2(v / v)混合物加入细胞悬浮液中并涡旋15分钟。然后,加入1.25毫升氯仿和涡旋1分钟。最后,加入1.25毫升水,涡旋1分钟。
- 将细胞混合物以1000×g离心10分钟。收集液体的底层,其中含有有机相中的脂质。在N2气体流下干燥。
- 使用液相色谱 - 质谱(LC-MS)定量脂质含量,使用C18反相,3.5μm×50 mm柱。
- 对于流动相,制备两种溶液,第一种溶液用60:40(v / v)乙腈:水,第二种用90:10(v / v)异丙醇:乙腈。甲酸铵应以10mM的终浓度加入两种溶液中。超过60分钟,将流动相梯度从第二种溶液的35%(v / v)增加到95%(v / v)。
- 在负电离模式下检测流出物,使用连续全扫描MS和串联MS / MS.从其质量与电荷(m / z)比中识别单个磷脂物种。使用脂质谱分析工具分析来自碰撞诱导的解离碎片的质谱。获得提取的离子色谱图以整合曲线下的面积,确定每种脂质物种的丰度。
- 对包含主要脂质类别的脂质标准品执行步骤5.1.5-5.1.7,以确定每个不同磷脂类别的相对检测灵敏度。
- 发育多脂囊泡
- 按照步骤1.1.1中的步骤制备代表每个所需双层组分的脂质储备溶液,如步骤5.1中所述。
- 根据从步骤5.1获得的脂质组合物,将适当体积的脂质/氯仿储备液加入到最终囊泡浓度为2.5mg / mL所需的清洁玻璃瓶中。除去N2 气体流下的散装氯仿干燥溶液。
- 按照步骤1.1.2,1.1.3和1.2形成多脂囊泡。按照步骤 2 进行囊泡表征。
- 使用 QCM-D 形成多脂支持脂质双分子层
注意:一些多脂囊泡可导致自发性脂质囊泡破裂和双层形成,类似于步骤 3 中出现的单脂 PC 囊泡。然而,更复杂的多脂囊泡可能需要外部输入来帮助囊泡破裂。在这里,AH肽用于破坏囊泡外叶的稳定性,从而导致双层形成。如果需要,可以考虑其他实现不稳定和囊泡破裂的方法。- 按照步骤3,利用步骤5.2中形成的多脂质囊泡形成多脂支持脂质双层。
- 如果未观察到囊泡自发破裂为双层,请尝试使用AH肽破坏囊泡稳定。制备AH肽(肽序列:H-Ser−Gly−Ser−Trp−Leu−Arg−Asp−Val−Trp−Asp−Trp−Ile-Cys−Thr−Val−Thr−Asp−Phe-Lys−Thr−Trp−Leu−Gln−Ser−Lys−Leu−Asp−Tyr−Lys−Asp-NH2)溶液,在Tris NaCl中含有1%(v/v)二甲基亚砜,DMSO。
- 按照步骤 3.4.1-3.4.3 操作。在步骤3.4.3之后,将入口管换成AH肽溶液。将溶液引入流动模块,直到从新的溶液添加中观察到 ΔF 和 ΔD。 停止泵,让AH肽与囊泡一起孵育10分钟。
- 将入口管切换到Tris NaCl并开始流动以从破裂的囊泡中除去AH肽,从而成功形成脂质双层。
注意:如果所需的应用是研究分子相互作用,请继续向步骤6.1方向学习,而不停止溶液流或数据采集。 - 在软件中,停止测量并保存文件。停止泵。
- 按照实验方案步骤3.2.4-3.2.6清洁流动模块和二氧化硅涂层石英晶体传感器。
- 悬浮多脂双分子层
- 将所需脂质的混合物溶解在20mg / mL的十二烷中。
- 使用所需的细胞模拟组合物组成5μL脂质混合溶液。
- 按照步骤 4.2 和 4.3 操作。
注意:直接继续执行步骤6.2以研究与悬浮脂质双分子层的分子相互作用。
6. 单脂和多脂双分子层的分子相互作用研究
- 使用QCM-D研究与支持的脂质双分子层的分子相互作用
- 制备所需分子的溶液,以研究与支持的脂质双分子层的吸附。例如,在Tris NaCl中制备200μM二(2-乙基己基)邻苯二甲酸酯(DEHP)的溶液,其中含有1%(v / v)DMSO。
- 如果分子溶液是在Tris NaCl中制备的,则可以按照步骤3.4.3直接流动用于单脂双分子层或5.3.4用于多脂双分子层。如果分子必须在不同的溶剂中制备,则将入口管单独插入所需溶剂中至少5分钟(例如,Tris NaCl与1%(v / v)DMSO用于DEHP)。
注意:由于溶剂引起的粘度变化可以通过在引入目标分子之前和之后流动来监测和考虑。 - 将入口管切换到含有目标分子的溶液中并流动至少5分钟。如果需要,还可以停止流动并且允许含有所需分子的液体与双层一起孵育。
- 如果Tris NaCl以外的物质,则将入口管更换回分子溶剂。流动至少5分钟。然后,将入口管切换到Tris NaCl并流动至少5分钟。
- 在软件中,停止测量并保存文件。停止泵。
- 按照实验方案步骤3.2.4-3.2.6清洁流动模块和二氧化硅涂层石英晶体传感器。
- 使用PAMPA研究与悬浮脂质双分子层的分子相互作用
- 制备所需分子的溶液。例如,在1×PBS中制备200μM DEHP,其中DMSO为1%(v / v)。
- 准备一个新的运输接收器板,每孔300μL新鲜1x PBS。
- 对于单脂悬浮双层,紧接着步骤3.3或对于多脂悬浮双层,立即在步骤3.3之后,从多屏滤板的供体室中取出1×PBS,并用200μL测试溶液替换。立即浸没在步骤6.2.2制备的运输接收板中。
- 在25°C下轻轻摇动孵育所需的时间(例如,2小时)。
- 孵育后,从供体和受体室收集150μL溶液。根据该分子的性质,使用适当的方法测量两个样品中的分子浓度。
- 例如,使用具有适当吸光度波长的微孔板分光光度计,例如DEHP为280nm,并与目标分子的标准曲线进行比较。
- 使用以下等式计算目标分子的表观渗透率(Papp):
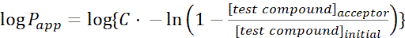 (1)
(1)
其中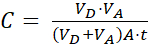 (2)
(2)
注:[测试化合物]受体 是目标分子(例如DEHP)在受体室中时间t的浓度;[测试化合物]初始 值是分子的初始浓度。A是膜面积,t是时间,VD 是供体室体积,VA 是受体室体积。
结果
该协议详细介绍了形成支持和悬浮脂质双层的方法(图1)。形成支持脂质双层的第一步是发育脂质囊泡。小型挤出机允许制备小体积的脂质囊泡(1 mL或更少),而大型挤出机允许在一批中制备5-50 mL脂质囊泡。由小型或大型挤出机形成的单脂质囊泡的尺寸分布如图 2A所示。由于大型挤出机使用高压N2 气体将囊泡溶液推过聚碳酸酯膜,脂质囊泡?...
讨论
该协议允许形成脂质囊泡,支持的脂质双层和悬浮脂质双层。在这里,提出了形成这些结构的关键步骤。当形成脂质囊泡时,重要的是挤出高于脂质39的转变温度 。当低于转变温度时,脂质物理上存在于其有序的凝胶相39中。在这个有序阶段,碳氢化合物脂质尾部完全伸展,允许紧密包装,使挤出具有挑战性39。当加热到转变温度以上时,脂质...
披露声明
作者声明他们没有利益冲突或竞争性经济利益。
致谢
本材料基于美国国家科学基金会根据授予A.S.的第1942418号赠款以及授予C.M.B.H.的国家科学基金会研究生研究奖学金(第1644760号赠款)支持的工作。本材料中表达的任何意见,发现和结论或建议均为作者的观点,并不一定反映美国国家科学基金会的观点。作者感谢Noel Vera-González博士的脂质囊泡表征数据采集。作者感谢罗伯特·赫特教授(布朗大学)使用他的Zetasizer。作者感谢布朗大学质谱设施,特别是沈敦立博士在量化脂质组成方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-glycero-3-phosphocholine (POPC, 16:0-18:1 PC) | Avanti Polar Lipids | 850457 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phospho-L-serine (sodium salt) (POPS, 16:0-18:1 PS) | Avanti Polar Lipids | 840034 | |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphoethanolamine (16:0-18:1 PE) | Avanti Polar Lipids | 850757 | |
| 1,2-dioleoyl-sn-glycero-2-phospho-L-serine (DOPS, 18:1 PS) | Avanti Polar Lipids | 840035 | |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC, 18:1 (Δ9-Cis) PC) | Avanti Polar Lipids | 850375 | |
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE, 18:1 (Δ9-Cis) PE) | Avanti Polar Lipids | 850725 | |
| 1,2-distearoyl-sn-glycero-3-ethylphosphocholine (chloride salt) (18:0 EPC (Cl Salt)) | Avanti Polar Lipids | 890703 | |
| 3 mL Luer-Loc syringes | BD | 309657 | |
| 40 mL sample vial, amber with polytetrafluoroethylene (PTFE)/rubber liner | Duran Wheaton Kimble | W224605 | |
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Alconox | Fisher Scientific | 50-821-781 | |
| Ammonium formate | Millipore Sigma | LSAC70221 | |
| C18, 3.5 um x 50 mm column, SunFire | Waters | 186002551 | |
| Chloroform | Millipore Sigma | LSAC288306 | |
| Cuvette UV Micro LCH 8.5 mm, 50 um, RPK | Sarstedt | 67.758.001 | |
| Di(2-ethylhexyl) phthalate (DEHP) | Millipore Sigma | 36735 | |
| Dimethyl sulfoxide (DMSO) | Millipore Sigma | LSAC472301 | |
| Ethanol | Pharmco | 111000200 | |
| Filter supports, 10 mm | Avanti Polar Lipids | 610014 | Size for mini extruder |
| Folded capillary zeta cell | Malvern Panalytical | DTS1070 | |
| Isopropanol | Sigma-Aldrich | 190764-4L | |
| Kimwipes | Kimberly Clark | 34256 | |
| L-α-phosphatidylinositol (soy) (Soy PI) | Avanti Polar Lipids | 840044 | |
| L-α-phosphitidylcholine (Egg, Chicken) | Avanti Polar Lipids | 840051 | |
| LiposoFast ® LF-50 | Avestin, Inc. | ||
| Methanol | Sigma-Aldrich | 179337 - 4L | |
| Mini-extruder set with holder/heating block | Avanti Polar Lipids | 610000 | |
| MultiScreen-IP Filter Plate, 0.45 µm, clear, sterile | Millipore Sigma | MAIPS4510 | for PAMPA studies |
| Nitrogen gas, ultrapure | TechAir | NI T5.0 | |
| Nuclepore hydrophilic membranes, polycarbonate, 19 mm, 0.1 um | Whatman | 800309 | Size for mini extruder |
| Nuclepore hydrophilic membranes, polycarbonate, 25 mm, 0.1 um | Whatman | 110605 | Size for large extruder |
| Parafilm | Bemis | PM999 | |
| Phosphate buffer saline (PBS), 10x | Genesee Scienfitic | 25-507X | Dilute to 1x |
| Qsoft 401 software | Biolin Scientific | ||
| Quartz Crystal Microbalance with Dissipation Q-Sense Analyzer | Biolin Scientific | ||
| Scintillation vials, borosilicate glass vials, 20 mL | Duran Wheaton Kimble | 986561 | |
| Silicon Dioxide, thin QSensors | Biolin Scientific | QSX 303 | |
| Sodium chloride (NaCl) | Millipore Sigma | LSACS5886 | |
| Sodium dodecyl sulfate (SDS) | Fisher Scientific | BP166-100 | |
| Solvent Safe pipette tips | Sigma-Aldrich | S8064 | |
| Sphingomyelin (Egg, Chicken) | Avanti Polar Lipids | 860061 | |
| Trizma base | Millipore Sigma | LSACT1503 | |
| Trypsin-ethylenediaminetretaacetic acid | Caisson Labs | TRL01-6X100ML | |
| Whatman drain disc, 25 mm | Whatman | 230600 | Size for large extruder |
| Zetasizer ZS90 | Malvern Panalytical | ||
| Zetasizer 7.01 software | Malvern Panalytical |
参考文献
- Lucio, M., Lima, J. L. F. C., Reis, S. Drug-Membrane Interactions: Significance for Medicinal Chemistry. Current Medicinal Chemistry. 17 (17), 1795-1809 (2010).
- Mayne, C. G., et al. The cellular membrane as a mediator for small molecule interaction with membrane proteins. Biochimica et Biophysica Acta - Biomembranes. 1858 (10), 2290-2304 (2016).
- Bunea, A. I., Harloff-Helleberg, S., Taboryski, R., Nielsen, H. M. Membrane interactions in drug delivery: Model cell membranes and orthogonal techniques. Advances in Colloid and Interface Science. 281, 102177 (2020).
- Peetla, C., Stine, A., Labhasetwar, V. Biophysical interactions with model lipid membranes: Applications in drug discovery and drug delivery. Molecular Pharmaceutics. 6 (5), 1264-1276 (2009).
- Richter, R., Mukhopadhyay, A., Brisson, A. Pathways of Lipid Vesicle Deposition on Solid Surfaces: A Combined QCM-D and AFM Study. Biophysical Journal. 85 (5), 3035-3047 (2003).
- Lind, T. K., Cárdenas, M., Wacklin, H. P. Formation of supported lipid bilayers by vesicle fusion: Effect of deposition temperature. Langmuir. 30 (25), 7259-7263 (2014).
- Mingeot-Leclercq, M. -. P., Deleu, M., Brasseur, R., Dufrêne, Y. F. Atomic force microscopy of supported lipid bilayers. Nature protocols. 3 (10), 1654-1659 (2008).
- Richter, R. P., Bérat, R., Brisson, A. R. Formation of solid-supported lipid bilayers: an integrated view. Langmuir the ACS journal of surfaces and colloids. 22 (8), 3497-3505 (2006).
- Chan, Y. -. H. M., Boxer, S. G. Model membrane systems and their applications. Current Opinion in Chemical Biology. 11 (6), 581-587 (2007).
- Edvardsson, M., Svedhem, S., Wang, G., Richter, R., Rodahl, M., Kasemo, B. QCM-D and reflectometry instrument: applications to supported lipid structures and their biomolecular interactions. Analytical chemistry. 81 (1), 349-361 (2009).
- Rodahl, M., et al. Simultaneous frequency and dissipation factor QCM measurements of biomolecular adsorption and cell adhesion. Faraday Discussions. 107, 229-246 (1997).
- Keller, C. A., Glasmästar, K., Zhdanov, V. P., Kasemo, B. Formation of Supported Membranes from Vesicles. Physical Review Letters. 84 (23), 5443-5446 (2000).
- Keller, C. A., Kasemo, B. Surface specific kinetics of lipid vesicle adsorption measured with a quartz crystal microbalance. Biophysical journal. 75 (3), 1397-1402 (1998).
- Cho, N. -. J., Frank, C. W., Kasemo, B., Höök, F. Quartz crystal microbalance with dissipation monitoring of supported lipid bilayers on various substrates. Nature protocols. 5 (6), 1096-1106 (2010).
- Bailey, C. M., Tripathi, A., Shukla, A. Effects of Flow and Bulk Vesicle Concentration on Supported Lipid Bilayer Formation. Langmuir. 33 (43), 11986-11997 (2017).
- van Meer, G., Voelker, D. R., Feigenson, G. W. Membrane lipids: where they are and how they behave. Nature reviews. Molecular cell biology. 9 (2), 112-124 (2008).
- Rossi, C., Chopineau, J. Biomimetic tethered lipid membranes designed for membrane-protein interaction studies. European Biophysics Journal. 36 (8), 955-965 (2007).
- Hatty, C. R., et al. Investigating the interactions of the 18 kDa translocator protein and its ligand PK11195 in planar lipid bilayers. Biochimica et Biophysica Acta - Biomembranes. 1838 (3), 1019-1030 (2014).
- Min, Y., Kristiansen, K., Boggs, J. M., Husted, C., Zasadzinski, J. a., Israelachvili, J. Interaction forces and adhesion of supported myelin lipid bilayers modulated by myelin basic protein. Proceedings of the National Academy of Sciences of the United States of America. 106 (9), 3154-3159 (2009).
- Heath, G. R., et al. Layer-by-layer assembly of supported lipid bilayer poly-l-lysine multilayers. Biomacromolecules. 17 (1), 324-335 (2016).
- Alberts, B., Lewis, J. The Lipid Bilayer. Molecular Biology of the Cell. , 6-11 (2013).
- Cho, N. J., Wang, G., Edvardsson, M., Glenn, J. S., Hook, F., Frank, C. W. Alpha-helical peptide-induced vesicle rupture revealing new insight into the vesicle fusion process as monitored in situ by quartz crystal microbalance-dissipation and reflectometry. Analytical Chemistry. 81 (12), 4752-4761 (2009).
- Hardy, G. J., Nayak, R., Munir Alam, S., Shapter, J. G., Heinrich, F., Zauscher, S. Biomimetic supported lipid bilayers with high cholesterol content formed by α-helical peptide-induced vesicle fusion. Journal of Materials Chemistry. 22 (37), 19506-19513 (2012).
- Bailey-Hytholt, C. M., Shen, T. L., Nie, B., Tripathi, A., Shukla, A. Placental Trophoblast-Inspired Lipid Bilayers for Cell-Free Investigation of Molecular Interactions. ACS Applied Materials and Interfaces. 12 (28), 31099-31111 (2020).
- Domenech, O., Francius, G., Tulkens, P. M., Van Bambeke, F., Dufrêne, Y., Mingeot-Leclercq, M. -. P. Interactions of oritavancin, a new lipoglycopeptide derived from vancomycin, with phospholipid bilayers: Effect on membrane permeability and nanoscale lipid membrane organization. Biochimica et biophysica acta. 1788 (9), 1832-1840 (2009).
- Bailey, C. M., Kamaloo, E., Waterman, K. L., Wang, K. F., Nagarajan, R., Camesano, T. a. Size dependence of gold nanoparticle interactions with a supported lipid bilayer: A QCM-D study. Biophysical Chemistry. 203-204, 51-61 (2015).
- Bailey-Hytholt, C. M., Puranik, T., Tripathi, A., Shukla, A. Investigating interactions of phthalate environmental toxicants with lipid structures. Colloids and Surfaces B: Biointerfaces. 190, 110923 (2020).
- Wang, K. F., Nagarajan, R., Camesano, T. A. Antimicrobial peptide alamethicin insertion into lipid bilayer: a QCM-D exploration. Colloids and surfaces. B, Biointerfaces. 116, 472-481 (2014).
- Lozeau, L. D., Rolle, M. W., Camesano, T. A. A QCM-D study of the concentration- and time-dependent interactions of human LL37 with model mammalian lipid bilayers. Colloids and Surfaces B: Biointerfaces. 167 (1), 229-238 (2018).
- Kongsuphol, P., Fang, K. B., Ding, Z. Lipid bilayer technologies in ion channel recordings and their potential in drug screening assay. Sensors and Actuators B: Chemical. 185, 530-542 (2013).
- Ren, X., et al. Design, fabrication, and characterization of archaeal tetraether free-standing planar membranes in a PDMS-and PCB-based fluidic platform. ACS Applied Materials & Interfaces. 6 (15), 12618-12628 (2014).
- Seo, P. R., Teksin, Z. S., Kao, J. P. Y., Polli, J. E. Lipid composition effect on permeability across PAMPA. European Journal of Pharmaceutical Sciences. 29 (3-4), 259-268 (2006).
- Avdeef, A. The rise of PAMPA. Expert Opinion on Drug Metabolism & Toxicology. 1 (2), 325-342 (2005).
- Avdeef, A., Artursson, P., Neuhoff, S., Lazorova, L., Gråsjö, J., Tavelin, S. Caco-2 permeability of weakly basic drugs predicted with the Double-Sink PAMPA method. European Journal of Pharmaceutical Sciences. 24 (4), 333-349 (2005).
- Campbell, S. D., Regina, K. J., Kharasch, E. D. Significance of Lipid Composition in a Blood-Brain Barrier-Mimetic PAMPA Assay. Journal of Biomolecular Screening. 19 (3), 437-444 (2014).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Schmidt, D., Lynch, J. Evaluation of the reproducibility of Parallel Artificial Membrane Permation Assays (PAMPA). EMD Millipore Corporation. , (2020).
- Bligh, E. G., Dyer, W. J. A Rapid Method of Total Lipid Extraction and Purification. Canadian Journal of Biochemistry and Physiology. 37 (8), 911-917 (1959).
- Nayar, R., Hope, M. J., Cullis, P. R. Generation of large unilamellar vesicles from long-chain saturated phosphatidylcholines by extrusion technique. BBA - Biomembranes. 986 (2), 200-206 (1989).
- Lind, T. K., Skida, M. W. A., Cárdenas, M. Formation and Characterization of Supported Lipid Bilayers Composed of Phosphatidylethanolamine and Phosphatidylglycerol by Vesicle Fusion, a Simple but Relevant Model for Bacterial Membranes. ACS Omega. 4 (6), 10687-10694 (2019).
- Berben, P., et al. Drug permeability profiling using cell-free permeation tools: Overview and applications. European Journal of Pharmaceutical Sciences. 119, 219-233 (2018).
- Bermejo, M., et al. PAMPA-a drug absorption in vitro model: 7. Comparing rat in situ, Caco-2, and PAMPA permeability of fluoroquinolones. European Journal of Pharmaceutical Sciences. 21 (4), 429-441 (2004).
- Kerns, E. H., Di, L., Petusky, S., Farris, M., Ley, R., Jupp, P. Application of parallel artificial membrane permeability assay and Caco-2 permeability. Journal of Pharmaceutical Sciences. 93 (6), 1440-1453 (2004).
- Masungi, C., et al. Parallel artificial membrane permeability assay (PAMPA) combined with a 10-day multiscreen Caco-2 cell culture as a tool for assessing new drug candidates. Pharmazie. 63 (3), 194-199 (2008).
- Vera-González, N., et al. Anidulafungin liposome nanoparticles exhibit antifungal activity against planktonic and biofilm Candida albicans. Journal of Biomedical Materials Research - Part A. 108 (11), 2263-2276 (2020).
- Barenholz, Y., Gibbes, D., Litman, B. J., Goll, J., Thompson, T. E., Carlson, F. D. A simple method for the preparation of homogeneous phospholipid vesicles. Biochemistry. 16 (1), 2806-2810 (1977).
- El Kirat, K., Morandat, S., Dufrêne, Y. F. Nanoscale analysis of supported lipid bilayers using atomic force microscopy. Biochimica et Biophysica Acta - Biomembranes. 1798 (4), 750-765 (2010).
- Tawa, K., Morigaki, K. Substrate-supported phospholipid membranes studied by surface plasmon resonance and surface plasmon fluorescence spectroscopy. Biophysical Journal. 89 (4), 2750-2758 (2005).
- Koenig, B. W., et al. Neutron Reflectivity and Atomic Force Microscopy Studies of a Lipid Bilayer in Water Adsorbed to the Surface of a Silicon Single Crystal. Langmuir. 12 (5), 1343-1350 (1996).
- Lind, T. K., Cárdenas, M. Understanding the formation of supported lipid bilayers via vesicle fusion-A case that exemplifies the need for the complementary method approach (Review). Biointerphases. 11 (2), 020801 (2016).
- Castellana, E. T., Cremer, P. S. Solid supported lipid bilayers: From biophysical studies to sensor design. Surface Science Reports. 61 (10), 429-444 (2006).
- Isaksson, S., et al. Protein-Containing Lipid Bilayers Intercalated with Size-Matched Mesoporous Silica Thin Films. Nano Letters. 17 (1), 476-485 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。