需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
短发夹RNA介导的基因敲低在造血干和祖细胞系体外发育的树突状细胞发育研究
摘要
在这里,我们提供了一种方案,用于筛选参与树突状细胞(DC)发展的潜在转录因子,使用shRNA的慢病毒转导来获得稳定的敲低细胞系,用于 体外 DC分化。
摘要
树突状细胞(DC)是连接先天性和适应性免疫应答的重要抗原呈递细胞。DC是异质的,可分为常规DC(cDC)和浆细胞样DC(pDC)。cDC专门向幼稚T细胞呈递抗原并激活它们。另一方面,pDC可以在病毒感染期间产生大量的I型干扰素(IFN-I)。DC的规范发生在骨髓中DC祖细胞(BM)的早期阶段,由转录因子(TF)网络定义。例如,cDC高度快速ID2,而pDC高度快速E2-2。由于越来越多的DC子集被识别出来,人们越来越有兴趣了解控制DC发展的特定TF。在这里,我们建立了一种方法,通过将携带短发夹RNA(shRNA)的慢病毒递送到永生化的造血干细胞和祖细胞(iHSPCs)系 中,在体外 筛选对DC分化至关重要的TF。在选择和 体外 分化后,通过流式细胞术分析稳定敲低细胞系的cDC和pDC电位。这种方法提供了一个平台,可以在 体外识别可能控制祖细胞DC命运的基因。
引言
DC是先天免疫和适应性免疫的关键调节因子1。发展中国家主要分为两个功能不同的群体,即pDC和cDC。此外,cDC包括两个子集,即I型和II型cDC或cDC1和cDC2s2。pDC在小鼠中表达BST2,Siglec-H和CD11c的中间水平3,4,是在炎症和病毒感染期间可以分泌大量IFN-I的细胞5。由于其强大的IFN-I产生能力,它们也被怀疑在自身免疫性疾病的进展中起关键作用,包括系统性红斑狼疮(SLE)6。cDC1s由小鼠中XCR1,CD8a,CLEC9A和CD103的表面表达定义7,专门用于通过抗原交叉递送激活和极化细胞毒性CD8 + T细胞(CTL),从而启动I型免疫以响应细胞内病原体和癌症8,9。另一方面,在人类和小鼠中表达CD11b和CD172α(也称为Sirpα)的cDC2s可以激活CD4 + T细胞并促进针对过敏原和寄生虫的II型免疫反应10,以及调节细胞外细菌和微生物群识别后的III型免疫11,12。
DC的多样化由BM中造血干和祖细胞(HSPCs)的一组TF决定.E2-2(由 Tcf4编码)是pDCs分化和功能的主调节因子13,14。相反,DNA结合2(ID2)的抑制剂通过阻断E蛋白活性来驱动cDC规范并抑制pDC的发展15。此外,cDC1s的开发需要IRF8和BATF3,而cDC2的区分高度依赖于IRF416。最近的工作探索了pDC17 和cDC的异质性及其转录调节18。由于直流网络的复杂性,需要建立一个平台来识别控制DC开发和功能的其他TF。
在这里,我们使用一种iHSPC,该iHSPC是通过在BM细胞(也称为Hoxb8-FL细胞)中表达Hoxb8的雌激素调节核易位而产生的19。在β雌二醇和Flt3配体(FL)存在下,iHSPCs可以增殖并保持在未分化阶段,而当β雌二醇退出时,它们在FL存在下开始分化成不同的DC类型19。基于这一特征,我们可以在祖细胞阶段敲低感兴趣的基因,然后检查对pDC和cDC 体外 分化的影响。因此,这种方法是发现调节DC发育和功能的基因的有力工具。
研究方案
慢病毒的处理是按照国立台湾大学医学院环境健康与安全系的规定进行的。
1. 永生化造血干和祖细胞系(iHSPCs)的制备
- 在含有100 ng / mL FL和1μM β雌二醇的完整RPMI 1640培养基中维持iHSPC细胞系。
- 每3天以1:10的比例传代细胞。
注意:通过补充10%胎牛血清(FBS),5 x 10-5M β巯基乙醇和10μg/ mL庆大霉素,制成完整的RPMI 1640培养基。重组小鼠 FL 也是市售的。
2. 慢病毒转导
- 将密度为1 x 105 个细胞/孔的iHSPCs加入1 mL含有100 ng / mL FL,1μM β雌二醇和8μg/ mL聚苯乙烯的完整培养基中的12孔板中。
注意:聚苯乙烯的浓度取决于细胞类型,通常在4-8μg/ mL的范围内。 - 在每个孔中加入携带shRNA的慢病毒,感染的多重性(MOI)为100。
注:慢病毒载体为pLKO.1-Puro,带有嘌呤霉素选择标记物(图1)。分别针对 LacZ, Tcf4和 Id2 的shRNA靶序列列在 材料表中。MOI由感染期间每个细胞添加的病毒粒子数量定义。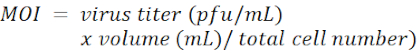
- 在37°C下以1,100× g 旋转板90分钟。
注:旋转感染是使用回转斗转子进行的。 - 将含有受感染细胞的板在培养箱中在37°C下孵育过夜。
注意:如果细胞对聚苯乙烯敏感,则在旋转感染后用不含聚苯乙烯的完整培养基刷新细胞。 - 感染后24小时,用含有100 ng / mL FL和1μM β雌二醇的完整培养基刷新细胞。
- 在另外24小时后向培养基中加入6μg/ mL嘌呤霉素以选择感染的细胞。
注意:转导慢病毒载体表达基因通常需要48小时,包括嘌呤霉素耐药基因。确保针对每个细胞系优化嘌呤霉素的浓度。 - 每3天刷新含有100 ng / mL FL,1μM β雌二醇和6μg/ mL嘌呤霉素的选择培养基,并保持细胞至少一周以扩增稳定转导的iHSPC细胞。
注意:嘌呤霉素的选择通常在48小时后生效,选择的周期取决于细胞类型。
3. 通过逆转录和实时荧光定量 PCR (RT-PCR) 测量敲低效率
- 使用商用RNA提取试剂从1 x 107 shLacZ,shTcf4和shId2 稳定敲低iHSPC细胞中提取总RNA,并用异丙醇从水层沉淀RNA,然后用75%乙醇洗涤RNA沉淀物。
- 用5μLDEPC处理的H2 O溶解RNA(〜5μg),并将浓度调节至1μg/ μL。
- 取1-3μgRNA,与DEPC处理的H2O混合至最终体积为17.4μL,加入1μL1单位/ μL无RNase的DNase I,并在37°C下孵育20分钟。
注意:此步骤是消化RNA样品中的基因组DNA。 - 向RNA样品中加入1μL20mM EDTA,在65°C下孵育10分钟以灭活DNase I,并立即将RNA样品置于4°C。
- 向RNA样品中加入11.6μL含有1μL寡核苷酸(dT)引物(45μM),6μL5x第 一链缓冲液,3μLdNTP(2mM),0.6μLRNase抑制剂(50单位/ μL)和1μL逆转录酶(200单位/ μL)的反应混合物,并在40°C下孵育1小时。
- 通过在70°C下加热10分钟停止反应,并用30μLH 2 O稀释反应混合物。
- 取2μL稀释的RT反应混合物作为DNA模板,并使用针对Tcf4或Id2的引物进行PCR扩增(热循环器条件见 表1 )。
注:引物序列包含在 材料表中。
4. 稳定敲低iHSPC细胞系的 体外 分化
- 在含有100 ng / mL FL和1μM β雌二醇的完整培养基中,在iHSPCs中保持 LacZ (shLacZ), Tcf4 (shTcf4)或 Id2 (shId2)的稳定单次敲低。
- 将shLacZ,shTcf4和shId2 未分化的iHSPCs收集到15mL管中,并在500× g 下离心5分钟以沉淀细胞。
- 弃去上清液并加入10mL PBS以洗涤细胞。重复此步骤两次。
- 以2×105 个细胞/mL的密度重悬iHSPC细胞并将其接种到1mL仅含有100ng / mL FL的完整培养基中的12孔板中。
- 三天后加入1 mL含有100 ng / mL FL的新鲜完整培养基。
- 两天后通过流式细胞术分析分化细胞(shLacZ,shTcf4和shId2 iHSPCs)。
5. 分化DC的流式细胞术分析
- 通过将细胞在板中上下移液2-3次,将细胞收集到1.5mL管中,并在室温(RT)下以500× g 离心5分钟。
注意: 体外 分化的DC将略微附着在板上。轻柔的移液将有助于从板中恢复DC。 - 弃去上清液并将细胞重悬于50μLFACS缓冲液中。接下来,加入50μL抗CD16 / 32杂交瘤上清液,并在冰上孵育5-10分钟。
注意:Fc阻断抗体可防止抗体与某些骨髓细胞和B细胞上表达的Fc受体的非特异性结合,并通过各种供应商进行商业销售。 - 将荧光染料偶联抗体(每种抗体0.04μg)直接加入细胞中,并在黑暗中的冰上孵育15分钟。使用的抗体有APC/cy7抗小鼠CD11c、FITC抗小鼠CD11b和PE抗小鼠B220。
注:pDC 定义为 CD11c+CD11b-B220+,cDC 定义为 CD11c+CD11b+B220-。 - 用1mL FACS缓冲液洗涤细胞,并在室温下以500× g 离心5分钟。
- 将细胞重悬于100μLFACS缓冲液中,并通过流式细胞术分析。
结果
图中显示了慢病毒载体pLKO.1-Puro的图谱(图1)。在iHSPCs中递送表达shRNA的shRNA慢病毒后,通过iHSPCs中对LacZ(非靶向对照),Tcf4和Id2,RT-qPCR证实的敲低效率显示,与shLacZ iHSPCs相比,tcf4 iHSPCs在shTcf4 iHSPCs中的表达降低(图2A)。另一方面,与shLacZ iHSPCs对照组相比,在shId2 iHSPCs中也观察到Id2表达?...
讨论
基于慢病毒的shRNA载体通常用于通过病毒转导到细胞中的基因沉默,并允许稳定地整合到宿主基因组中。然而,需要考虑不同细胞类型的各种转导效率,并且已经采取了许多方法来克服这个问题。
聚苯乙烯是一种聚阳离子聚合物,可以中和细胞膜上的电荷,从而增强病毒粒子在转导过程中与细胞的结合20。虽然它是增加转导率的有效方法,但当添加过量时,...
披露声明
作者没有什么可透露的。
致谢
我们非常感谢陈志玲博士的技术支持。我们感谢国家RNAi核心设施(台湾中央研究院)提供shRNA慢病毒(http://rnai.genmed.sinica.edu.tw)。这项工作得到了台湾科技部(MOST 108-2320-B-002-037-MY3和MOST 109-2320-B-002-054-MY3)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| APC/Cy7 anti-mouse CD11c Antibody | Biolegend | 117324 | (Clone: N418) |
| FITC anti-mouse/human CD11b Antibody | Biolegend | 101206 | (Clone: M1/70) |
| PE anti-mouse/human B220 Antibody | Biolegend | 103208 | (Clone: RA3-6B2) |
| Cell culture | |||
| 1.5 mL Micro tube | ExtraGene | TUBE-170-C | |
| 12-well tissue culture-treated plate | Falcon | 353043 | |
| Fetal bovine serum (FBS) | Corning | 35-010-CV | |
| RPMI 1640 medium | gibco | 11875-085 | |
| Reagent | |||
| β-estradiol | Sigma-Aldrich | E2758-250MG | |
| β-mercaptoethanol (β-ME) | Sigma-Aldrich | M6250 | |
| FACS buffer | home-made | Formula: 1xPBS+0.5 %FBS+0.1%NaN3 | |
| Flt3 ligand (FL) | home-made | ||
| Polybrene | Sigma-Aldrich | TR-1003-G | |
| Puromycin | Invivogen | ant-pr-1 | |
| TRIsure | BIOLINE | BIO-38032 | |
| shRNA (Taregt sequence/clone ID) | Company | ||
| shId2 (GCTTATGTCGAATGATAGCAA/TRCN0000054390) | The RNAi Consortium (TRC) | ||
| shLacZ (CGCGATCGTAATCACCCGAGT/TRCN0000072224) | The RNAi Consortium (TRC) | ||
| shTcf4 (GCTGAGTGATTTACTGGATTT/TRCN0000012094) | The RNAi Consortium (TRC) |
参考文献
- Steinman, R. M., Witmer, M. D. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proceedings of the National Academy of Sciences. 75 (10), 5132-5136 (1978).
- Guilliams, M., et al. Dendritic cells, monocytes and macrophages: a unified nomenclature based on ontogeny. Nature Reviews Immunology. 14 (8), 571-578 (2014).
- Blasius, A. L., Cella, M., Maldonado, J., Takai, T., Colonna, M. Siglec-H is an IPC-specific receptor that modulates type I IFN secretion through DAP12. Blood. 107 (6), 2474-2476 (2006).
- Swiecki, M., Colonna, M. Unraveling the functions of plasmacytoid dendritic cells during viral infections, autoimmunity, and tolerance. Immunology Reviews. 234 (1), 142-162 (2010).
- Liu, Y. -. J. IPC: Professional Type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annual Review of Immunology. 23 (1), 275-306 (2005).
- Panda, S. K., Kolbeck, R., Sanjuan, M. A. Plasmacytoid dendritic cells in autoimmunity. Current Opinion in Immunology. 44, 20-25 (2017).
- Durai, V., Murphy, K. M. Functions of murine dendritic cells. Immunity. 45 (4), 719-736 (2016).
- Mashayekhi, M., et al. CD8α(+) dendritic cells are the critical source of interleukin-12 that controls acute infection by Toxoplasma gondii tachyzoites. Immunity. 35 (2), 249-259 (2011).
- Anderson, D. A., Dutertre, C. -. A., Ginhoux, F., Murphy, K. M. Genetic models of human and mouse dendritic cell development and function. Nature Reviews Immunology. 21 (2), 101-115 (2021).
- Plantinga, M., et al. Conventional and monocyte-derived CD11b(+) dendritic cells initiate and maintain T helper 2 cell-mediated immunity to house dust mite allergen. Immunity. 38 (2), 322-335 (2013).
- Persson, E. K., et al. IRF4 transcription-factor-dependent CD103(+)CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 38 (5), 958-969 (2013).
- Kumamoto, Y., et al. CD301b+ dermal dendritic cells drive T helper 2 cell-mediated immunity. Immunity. 39 (4), 733-743 (2013).
- Cisse, B., et al. Transcription factor E2-2 is an essential and specific regulator of plasmacytoid dendritic cell development. Cell. 135 (1), 37-48 (2008).
- Grajkowska, L. T., et al. Isoform-specific expression and feedback regulation of E protein TCF4 control dendritic cell lineage specification. Immunity. 46 (1), 65-77 (2017).
- Jackson, J. T., et al. Id2 expression delineates differential checkpoints in the genetic program of CD8α+ and CD103+ dendritic cell lineages. The EMBO Journal. 30 (13), 2690-2704 (2011).
- Suzuki, S., et al. Critical roles of interferon regulatory factor 4 in CD11bhighCD8alpha- dendritic cell development. Proceedings of the National Academy of Science U. S. A. 101 (24), 8981-8986 (2004).
- Rodrigues, P. F., et al. Distinct progenitor lineages contribute to the heterogeneity of plasmacytoid dendritic cells. Nature Immunology. 19 (7), 711-722 (2018).
- Brown, C. C., et al. Transcriptional basis of mouse and human dendritic cell heterogeneity. Cell. 179 (4), 846-863 (2019).
- Redecke, V., et al. Hematopoietic progenitor cell lines with myeloid and lymphoid potential. Nature Methods. 10 (8), 795-803 (2013).
- Abe, A., Miyanohara, A., Friedmann, T. Polybrene increases the efficiency of gene transfer by lipofection. Gene Therapy. 5 (5), 708-711 (1998).
- Sorgi, F. L., Bhattacharya, S., Huang, L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Therapy. 4 (9), 961-968 (1997).
- Kirkling, M. E., et al. Notch signaling facilitates in vitro generation of cross-presenting classical dendritic cells. Cell Reports. 23 (12), 3658-3672 (2018).
- Pearce, E. J., Everts, B. Dendritic cell metabolism. Nature Reviews. Immunology. 15 (1), 18-29 (2015).
- Wculek, S. K., Khouili, S. C., Priego, E., Heras-Murillo, I., Sancho, D. Metabolic Control of Dendritic Cell Functions: Digesting Information. Frontiers in Immunology. 10 (775), (2019).
- Saxton, R. A., Sabatini, D. M. mTOR signaling in growth, metabolism, and disease. Cell. 168 (6), 960-976 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。