需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活植物细胞中的Förster共振能量转移测量
摘要
提供了一个方案,用于设置标准的共聚焦激光扫描显微镜,用于 体内 Förster共振能量转移测量,然后进行数据评估。
摘要
基于敏化发射的Förster共振能量转移(FRET)实验很容易完成,但取决于微观设置。共聚焦激光扫描显微镜已成为生物学家的主力军。商用系统在激光功率调整和探测器灵敏度方面具有高度的灵活性,并且通常组合不同的探测器以获得完美的图像。然而,由于这种灵活性,通常不可能比较来自不同实验和设置的基于强度的数据。生物学家友好的程序具有优势,可以简单可靠地调整激光和探测器设置。
此外,由于活细胞中的FRET实验受到蛋白质表达和供体 - 受体比的变异性的影响,因此必须考虑蛋白质表达水平以进行数据评估。这里描述的是用于可靠和可重复的FRET测量的简单方案,包括用于估计蛋白质表达和调整激光强度和检测器设置的例程。数据评估将通过校准已知FRET效率的荧光团融合来执行。为了提高简单性,已经比较了在细胞中通过测量重组荧光蛋白获得的校正因子。
引言
Förster共振能量转移((F)RET)通常通过荧光光谱观察,尽管该过程本身并不局限于荧光团之间发生。潜在的偶极子-偶极子耦合只需要一个发光的供体分子和一个光吸收受体。这是从归一化供体发射和受体吸光度谱1所需的光谱重叠积分J导出的。然而,由于RET与荧光竞争,能量转移可以通过荧光发射的改变来测量:RET诱导供体猝灭和敏化受体发射。
基于荧光团的RET被称为荧光共振能量转移(FRET),以将其与生物发光共振能量转移(BRET)分开。RET在很大程度上取决于供体和受体之间的距离,其范围广泛为0.5-10 nm2 ,因此与蛋白质及其复合物的尺寸范围相同。其次,RET取决于偶极子-偶极子取向kappa的平方。结合蛋白质结合的荧光团由于分子量和缓慢的旋转弛豫而可以忽略的事实,RET允许分析构象改变3。
所谓的Förster半径基于光谱重叠积分和重叠的波长范围,因此吸收红光的发色团比蓝光吸收染料产生更长的Förster半径。由于FRET测量的动态范围受到0.5×R0 和1.5×R0的限制,FRET对ECFP-EYFP的动态范围为2.5-7.3 nm,因为它的R0 为4.9 nm4。
荧光团的亮度由其摩尔消光系数和量子产率的乘积给出。对于FRET测量,选择亮度几乎相似的荧光团是有利的。这增强了对供体淬火和敏化受体发射的检测。它还有利于显微镜系统的校准。观察常用的FRET对青色和荧光蛋白,青色荧光蛋白的较低亮度变得明显(图1A)。
但是,受体的寿命必须低于供体的寿命,从而确保受体可用于能量转移。如果受体的寿命超过供体的寿命,则当供体再次激发时,受体可能仍处于激发状态。先进的青色荧光蛋白(如mTurquoise)显示出更长的使用寿命,因此有助于增加FRET的可能性(图1B)。FRET的概率还取决于受体的摩尔消光系数。
研究方案
注意:对于以下方案,如前所述,进行了原生质体的瞬时转染12。下面给出了简要说明。
1. 原生质体的瞬时转染
- 将拟 南芥 生态型哥伦比亚的约4克健康叶子切成1毫米切片,并将它们转移到20毫升酶溶液中(1.5%纤维素酶;0.4%马克酶;0.1%牛血清白蛋白V级分;0.4米甘露醇;20mM KCl;20mM 2-(N-吗啉)乙磺酸(MES),pH 5.7;10mM CaCl2)。
- 真空浸润叶片,然后在室温下搅拌孵育2小时。通过在100× g下离心3分钟收获细胞。
- 用W5溶液(154mM NaCl;125mM CaCl2;5 mM KCl;2 mM MES,pH 5.7)洗涤原生质体,并将其重悬于MMG溶液(0.4 M甘露醇;15 mM MgCl2;4 mM MES,pH 5.7)中。
- 在聚乙二醇(PEG)4000存在下通过渗透冲击在8孔载玻片中进行转染。将20μL原生质体悬浮液与5μL质粒DNA(5μg/ μL)和25μLPE溶液(0.2M甘露醇,0.1M CaCl2,40%PEG 4000)混合。
- 通过轻柔地重新调整渗透条件来逆转渗透冲击。
注:除感兴趣的样品外,还需要单独供体和单独受体的表述来确定供体和受体的光谱渗漏。供体和受体的融合蛋白也必须表达用于校准目的。荧光蛋白表达在花椰菜花叶病毒35S启动子(pCaMV35S)的控制下。对于所有测量,使用两个共聚焦激光扫描显微镜(LSM1和LSM2)。LSM1有两种类型的探测器:对于FRET测量,供体信号由GaAsP探测器检测,而FRET和受体发射则用光电倍增管记录。LSM2具有两个光电倍增管,用于检测供体,FRET和受体发射。
2. 激光调节
注意:在这里,458 nm和514 nm的氩离子激光器线已被应用于增强青色荧光蛋白(ECFP)和增强型黄色荧光蛋白(EYFP)标记蛋白之间的FRET分析。为了获得可重复的数据采集,将两条线调整为相似的强度。这是通过透射光电倍增管或反射模式实现的。
- 使用透射光电倍增管进行激光调节
- 使用空孔进行调整。
- 选择 线扫描模式 和 直方图视图。
- 将激光强度降至最低,并将检测器增益调整为可检测的背景噪声。
- 以0.5%的步长增加激光强度并记录相应的信号。
- 将例程应用于两条激光线。
- 带反射模式的激光调节
- 使用空孔进行调整。
- 应用反射滤镜,打开 反射模式(如果可用)。
- 确保探测器波长范围覆盖激光器的波长。
- 选择 线扫描模式 和 直方图视图。
- 将激光强度降至最低,并将检测器增益调整为可检测的背景噪声。
- 将目标移动到最低位置。
- 将物镜向上移动,直到盖玻片的反射可见。
- 以0.5%的步长增加激光强度并记录相应的信号。
- 将例程应用于两条激光线。
- 数据评估
- 将数据制成表格并按信号强度对数据进行排序。
- 根据相对激光功率绘制信号强度。
- 选择产生相似信号强度的激光强度。
3. 光电倍增管的调整
注:激光调整后,光电倍增管根据单个增益进行调整,以获得相似的灵敏度。该校准是使用514 nm激光线完成的,该激光线位于目标波长范围的中心。
- 使用空孔进行调整。
- 应用反射滤镜,并切换到反射模式(如果可用)。
- 确保探测器波长范围覆盖激光器的波长(514 nm)。
- 选择 线扫描模式 和 直方图视图。
- 将探测器增益降低到最大值的一半,并将激光强度调整到可检测的背景噪声。
- 将目标移动到最低位置。
- 将物镜向上移动,直到盖玻片的反射可见。
- 以50至100 V的步长增加检测器增益,并记录相应的信号。
- 对两个探测器应用步骤 3.1 到 3.8。
- 数据评估
- 将强度与每个检测器的检测器增益进行对比。
- 选择单个探测器增益以获得相似的灵敏度。
4. FRET图像采集
注意:从设置图像采集的相关示例开始。
- 选择合适的滤光片/二向色镜,例如,为 FRET 对 ECFP/EYFP 选择双二向色镜 MBS 458/514。对所有通道使用相同的二向色镜,以实现逐行扫描。选择用于活细胞成像的水浸物镜。选择 12 位或 16 位扫描以及中等扫描速度。
- 定义检测范围,在ECFP / EYFP的情况下,优选470-510 nm用于供体检测,530-600 nm用于受体/ FRET检测。当使用445 nm或440 nm二极管激光器时,请使用450至510 nm作为检测范围。对于声光分束器 (AOBS),将供体检测定义为 450 至 500 nm 范围内,以防止不必要的受体检测。
- 根据 3.10.2 应用检测器设置。
- 根据2.3.2应用激光设置。如果需要,根据获得的激光功率表修改激光强度。确保信噪比覆盖探测器的整个动态范围(12位扫描的强度范围为0至4095)。
- 保持激光强度和检测器增益恒定。使用针孔直径进行微调。
注意:请记住,针孔直径的变化会影响空间分辨率。 - 执行测量(拍摄至少20个细胞的图像)。
5. 串扰校正的确定
注意:仅表达供体或受体的细胞需要分别确定供体光谱渗出(DSBT)和受体谱渗漏(ASBT)。保留第 4 节中描述的相同设置。
- 使用表达供体荧光团的细胞进行FRET测量。
- 对表达受体荧光团的细胞进行FRET测量。
6. 根据Beemiller等人13对测量进行校准
注意:需要表达已知FRET效率的供体 - 受体融合的细胞。这里使用了EFT效率为0.46的ECFP-5 aa-EYFP融合4。保留第 4 节中描述的相同设置。
- 对表达供体-受体融合的细胞进行FRET测量
7. 数据评估
- 获取单元格的线轮廓,确保每个轮廓包含不超过一个单元格。将配置文件另存为文本文件。
- 使用"数据"部分中的文本文件导入选项将文本文件导入电子表格。
- 通过应用 Max 函数读出最大值。
- 在表中列出获得的值,各有一列供体发射ID,FRET发射IF,受体发射IA,以及至少四个数据集:仅供体,仅受体,供体 - 受体融合和测量。
注:供体的激发也会导致受体的直接激发,并导致由α值描述的ASBT。 - 使用等式 (1) 使用仅接受方数据集计算 ASBT α值。
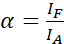 (1)
(1)
注意:在以下等式中使用所有α值的中位数。供体显示出较宽的发射光谱,导致与受体的敏化发射发生发射串扰。此 DSBT 由β值给出。 - 使用公式 (2) 计算仅供体数据集的供体光谱渗漏β值。
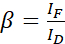 (二)
(二)
注意:在以下等式中使用所有β值的中位数。校准因子ξ描述了FRET衍生的供体淬灭和受体敏化发射的线性关系。在以下等式中使用中位数 7.5 和 7.6。 - 使用供体-受体融合数据集计算校准因子ξ,并使用方程(3)计算其FRET效率E(0.46)。
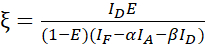 (3)
(3)
注意:在以下等式中使用所有 ξ 值的中位数。 - 使用方程(4)和(5)计算感兴趣蛋白质对的FRET效率。
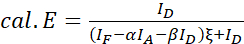 (4)
(4)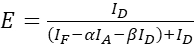 (5)
(5) - 估计表达强度和/或供体-受体比值的影响:将 ID、IF 和 IA 的总和与 FRET 效率绘制。执行线性回归;请注意,图越陡峭,R2 越高,表达水平的影响越大,供体和受体丰度的差异就越大。
结果
共聚焦激光扫描显微镜的调整
激光调整显示,随着激光强度的增加,发射线性增加(图2 和 表1)。正如氩离子激光器所预期的那样,514 nm线的发射远高于458 nm线的发射,正如更陡峭的斜率所证明的那样。在随后的实验中,分别为514 nm线和458 nm线选择了4.5%和6.5%的激光功率。这导致1123(514 nm)和1141(458 nm)的发射强度几乎相等。
讨论
供体淬灭和敏化受体发射的特点是线性关系,允许基于供体或受体计算FRET。线性的相应因子称为 G 因子(供体对受体)或 xi(受体对供体),它们是倒数值4。由于荧光蛋白的广泛吸收和发射光谱,通过荧光显微镜测量荧光蛋白之间的FRET通常需要校正DSBT和ASBT。但是,许多校正依赖于可测量的 ASBT,这是协议第 7 节中方程分母的一个因素,α = 0 会导致未定义的方程5<...
披露声明
我们确保所有作者都披露了任何和所有利益冲突,并且没有竞争性的经济利益。
致谢
实验在比勒费尔德大学生物学院的光学显微镜技术平台(LiMiTec)进行。这项工作由比勒费尔德大学资助。
材料
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
参考文献
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。