Method Article
一种简单有效的斑马鱼胚胎移植装置
摘要
胚胎学操作,如细胞的灭绝和移植是研究早期发育的重要工具。该协议描述了一种简单有效的移植装置,用于在斑马鱼胚胎中执行这些操作。
摘要
经典的胚胎学操作,例如在胚胎内部或胚胎之间移除细胞和移植细胞,是研究复杂发育过程的强大技术。斑马鱼胚胎非常适合这些操作,因为它们易于接近,尺寸相对较大且透明。然而,以前开发的用于细胞去除和移植的设备使用起来很麻烦或购买成本高昂。相比之下,这里介绍的移植装置经济,易于组装且易于使用。在该协议中,我们首先介绍了移植设备的处理以及从商业和广泛使用的零件组装。然后,我们提出了三种应用:产生异位克隆以研究来自局部来源的信号扩散,细胞灭绝以产生尺寸减小的胚胎,以及种系移植以产生母体 - 合子突变体。最后,我们表明该工具还可用于其他物种的胚胎操作,例如日本稻鱼青鲽。
引言
从Mangold和Spemann的经典实验中,证明了存在指导胚胎轴形成的组织者1,胚胎之间的细胞移植已成为研究胚胎发育的既定技术2,3,4,5,6,7,8,9,10.常用的移植装置包括一个千分尺驱动控制的气密注射器,通过柔性管和充满矿物油的储液器连接到微量移液器支架12,13。在此设置中,注射器的柱塞通过螺钉移动。以这种方式产生的压力被转移到微量移液器中,并用于从一个胚胎中抽出细胞并将其沉积到另一个胚胎中。然而,这种液压操作的设备由许多部件组成,从头开始组装起来很费力。类似的设备也可以作为完整的工作装置购买,通常作为手动显微注射器出售,这些商业版本通常花费超过1500美元。在自制和商业版本中,用于胚胎操作的微量移液管通过充油管与压力发生装置(气密注射器)分离。因此,微量移液器的操作和柱塞的运动必须用不同的手单独操作,从而降低了吞吐量和实用性。此外,这些装置对于准备移植很麻烦,因为管子需要小心地装满油,同时避免形成气泡。在这里,我们描述了一种用于细胞去除和移植的替代气动操作设备,该设备价格低廉,易于组装且易于使用。
这里展示的设备包括一个装有微量移液管支架的25μL气密注射器,总成本不到80美元。通过鲁尔锁接头将微量移液管支架插入注射器,可轻松组装该设备(图1A)。然后将设备直接安装在显微操纵器上,允许用户直接在显微操作器上用一只手控制其位置和吸力。这方便地使另一只手可以自由地稳定和移动包含供体和宿主胚胎的移植皿。该装置通过直接吸入空气工作,不需要填充矿物油。由于水和玻璃针壁之间的吸引力,注射器柱塞中的大运动被转化为针内水位的较小运动,只要水位在玻璃针的锥形端。这允许精确控制吸出细胞的数量及其插入位置。
为了证明该装置的实用性,我们介绍了斑马鱼(Danio rerio)胚胎中的三种应用。首先,我们展示了如何生成分泌信号分子的局部来源,可用于研究梯度形成2,4,6。在这里,供体胚胎被注射编码荧光标记的信号分子的mRNA。然后将荧光标记的供体细胞移植到野生型宿主胚胎中,在那里可以成像和分析信号梯度的形成。其次,我们描述了如何使用该装置通过灭绝去除细胞,以产生尺寸减小的胚胎5,13。最后,我们展示了如何将携带原始生殖细胞报告基因的细胞移植到生殖系已被烧蚀的宿主胚胎中来稳健地产生母体 - 合子突变体6,10。将来,这里描述的移植装置可以很容易地适应其他需要切除或移植细胞的胚胎学操作。
研究方案
1. 组装和使用移植装置
- 组装移植装置。
- 连接鲁尔吸头25 μL气密注射器和带鲁尔锁接头的微量移液管支架,以组装移植装置(图1A)。
注:用一层薄薄的水膜润湿鲁尔尖端有助于通过水的附着力和内聚力将部件固定在一起,从而增强连接。 - 将设备直接安装到手动显微操作器上(图1B)。该设备可以仅用惯用手控制,从而腾出另一只手来完成其他任务。
- 连接鲁尔吸头25 μL气密注射器和带鲁尔锁接头的微量移液管支架,以组装移植装置(图1A)。
- 准备移植针。
- 通过用微量移液器拉动玻璃毛细管移液器(无细丝)来生产移植针。
- 尽可能顺利地折断针尖,因为锋利的边缘增加了移植时划伤蛋黄的机会,这对胚胎是致命的。
注意:在立体显微镜下,用直边剃须刀片可以很容易地打破尖端。但是,使用微锻件可以生成所需尺寸的精确开口。对于异位源的产生,外径约为50-60μm是合适的。对于拔除和种系移植,针头的外径应测量约80-90μm以增加移植细胞的数量。 - 将即用型针头插入移植装置(图1A)。
- 使用移植装置。
- 将带有移植装置的显微操作器放在立体显微镜旁边(图1B)。
- 取下柱塞,将移植针以45°角放入充满林格溶液的移植皿中(见步骤2.2.1),直到针尖浸入(图1B)。由于毛细血管的作用,水会冲上针头。
- 将柱塞插入大约一半以冲洗出Ringer溶液,在针的薄而锥形的部分只留下少量水(图1C)。
注意:这是中性位置,水位应该在那里稳定一段时间(>20分钟)。如果水位不稳定,则空气泄漏;重新连接鲁尔锁接头或更换注射器。 - 第一次使用移植针时,通过从牺牲的胚胎中吸取蛋黄,然后完全排出蛋黄材料来涂覆其内部。涂层将有助于减少细胞在随后的程序中粘附在玻璃上的粘附。
- 在针头的帮助下轻轻定位供体胚胎,然后将针头开口正交定位到胚胎表面(图1D)。
注意:对于不同的测定,位置会有所不同。对于异位信号分子源的产生和细胞灭绝,这将是动物极的顶部(图1E);对于种系移植,这将是边缘(图1D,F)。 - 缓慢而小心地拉起柱塞,将细胞吸入针头。
注意:如果细胞被吸收得太快,它们可能会受损。如果操作正确,细胞应以圆柱形柱的形式出现。避免将蛋黄带入针头,因为移植的蛋黄对宿主胚胎有毒。 - 一旦吸入所需数量的细胞,通过轻轻向下推动柱塞来停止吸力。通过以短而快速的动作将针头抽搐到一侧,将针头从胚胎中取出。在细胞柱的两侧留下一些林格氏溶液,并将细胞限制在针的锥形端(图1C,D)。
注意:在沉积细胞柱时,细胞柱前面的液体将有助于迫使宿主胚胎的细胞分开。 - 通过缓慢上下移动柱塞来清除任何剩余的蛋黄或细胞碎片 - 而针头保持浸泡状态 - 用Ringer溶液洗涤细胞。如果操作正确,未损坏的细胞将保持粘附在柱子中,同时将碎片冲走。
注意:在此步骤中必须格外小心,因为水位将超过针的锥形端。这将导致水的突然涌入,可用于洗涤细胞。但是,一旦水位超过锥形端,柱塞的精细控制就会减少,柱塞必须更缓慢,更小心地移动。 - 用非惯用手移动移栽盘,将针头正交于宿主胚胎的表面(动物杆或边缘)(图1D-F)。
- 轻轻地施加轻微的压力,然后给予快速,尖锐的运动以刺穿宿主胚胎的包裹层。注意不要用针刮伤蛋黄。
注意:通过小心地将其挤压在孔壁上来对胚胎施加轻微的压力会增加胚胎的表面张力,从而促进包络层的穿孔。 - 一旦针头进入,轻轻推动柱塞将细胞柱挤出到胚胎中,同时缓慢地缩回针头(图1D-F)。
- 清洁移植针头。
- 在将针头浸入去离子水中时,通过上下移动柱塞来冲洗针头。
注意:如果针头仍然脏污,请先用10 M氢氧化钠溶液冲洗,然后再用水冲洗。 - 将针头存放在适当的盒子中以备将来使用。
- 在将针头浸入去离子水中时,通过上下移动柱塞来冲洗针头。
2. 在斑马鱼胚胎中产生分泌信号分子的异位来源
- 准备宿主和供体胚胎。
- 通过交配斑马鱼收集新鲜产下的胚胎。
- 通过在0.5mg / mL的pronase溶液中在小玻璃培养皿中孵育多达100个胚胎约15分钟来去除1细胞阶段斑马鱼胚胎(该过程的详细说明已由Rogers,K.W.等人发表)。
注意:或者,胚胎也可以在移植前的高阶段进行去鞘化(步骤2.2),但这需要分别对注射的供体胚胎和未注射的宿主胚胎进行去鞘化。 - 将胚胎浸没在200 mL烧杯中的胚胎培养基中。
注意:去鞘胚芽和胃裂期胚胎非常脆弱。它们暴露的蛋黄会粘附在塑料表面上,并在与空气接触时破裂。因此,它们必须完全浸入胚胎培养基中,用玻璃移液管转移,并保持在琼脂糖涂层(胚胎培养基中为1%)的塑料皿或玻璃培养皿中。 - 小心地清空大部分胚胎培养基,并用新鲜的胚胎培养基慢慢填充烧杯。以这种方式引起的轻度躁动将有助于去除减弱的绒毛膜。重复此步骤2-3次。
- 使用玻璃巴斯德移液管将去角质的胚胎转移到琼脂糖涂层的注射皿中。
注意:将玻璃巴斯德移液器的尖端暴露在本生燃烧器火焰中可以熔化并平滑边缘,有助于防止对胚胎的损伤。 - 将编码荧光标记蛋白的mRNA注射到胚胎的子集中(Rogers,K.W.等人已经发表了对该程序的详细说明)。将mRNA注射到细胞中,而不是蛋黄中,以获得近乎均匀的表达。注射的胚胎将作为供体,而未注射的胚胎将作为宿主。
注意:注射的mRNA的数量和类型将取决于所研究的信号分子,通常范围为20至200 pg2,4,5,6 (但在某些情况下可高达1000 pg4)。 - 将注射的胚胎转移到充满胚胎培养基的琼脂糖涂层的六孔培养皿中。在28°C下孵育,直到胚胎达到早期球体阶段。
- 移植细胞以产生异位源。
- 用林格氏溶液(116 mM NaCl,2.8 mM KCl,1 mM CaCl2,5 mM HEPES;将HEPES缓冲液储存在4°C)填充移植培养皿(具有单个三角形楔形孔,见材料表)。
注意:Ringer溶液中的钙促进细胞粘附,并帮助胚胎从移植过程中愈合。 - 将胚胎转移到移植皿中。
- 将宿主和供体胚胎放置在交替的柱中,在每种情况下,动物杆都朝向移植针。
- 按照第1.3节所述进行移植。对于异位源移植,从动物极的顶部取源细胞并将其沉积到宿主胚胎中的相同位置(图1E)。
注意:按照步骤1.3.8中的详细介绍,用Ringer溶液洗涤细胞对于异位源的产生非常重要,以确保已经分泌的信号分子不会携带到宿主。不要移植太多细胞,以确保源头不分散。直径约 80 μm、长度约 100 μm 的色谱柱适用于许多应用。 - 让宿主胚胎在林格的溶液中停留30分钟至1小时以恢复。
- 使用荧光立体显微镜检查细胞是否成功移植(图2)。
- 恢复后,将胚胎转移到充满胚胎培养基的琼脂糖包被的六孔板中,并在28°C下孵育。
- 用林格氏溶液(116 mM NaCl,2.8 mM KCl,1 mM CaCl2,5 mM HEPES;将HEPES缓冲液储存在4°C)填充移植培养皿(具有单个三角形楔形孔,见材料表)。
3. 通过细胞灭绝产生尺寸减小的胚胎
- 准备胚胎灭绝。
- 从所需基因型的斑马鱼中收集新鲜产下的胚胎。
- 将胚胎在28°C孵育至达到高阶段。
- 当胚胎达到高阶段时,按照步骤2.1.2-2.1.5所述对胚胎进行脱壳。
注意:在本例中,细胞灭绝是在球体阶段进行的。因此,胚胎在大约30分钟至1小时前被去鞘化。
- 可选:标记蛋黄合胞层 (YSL)。
注意:如果需要,在灭活细胞之前将荧光葡聚糖注射到YSL中。该技术可以确定YSL在细胞移除后是否保持完整,这对于正常的胚胎发生很重要15。或者, 体外 合成的mRNA或蛋白质也可以注射到YSL中。- 使用巴斯德移液管将去脉的胚胎转移到充满胚胎水的琼脂糖涂层注射皿中。
- 将胚胎横向定向,胚芽孢子边缘指向注射针(图3A)。
- 将0.5 nL的1.5μg/ μL 10 kDa Alexa568-Dextran注入YSL中,目标是胚芽细胞和蛋黄之间的区域,深度约为胚胎直径的三分之一。在一排内注射所有胚胎。
注意:由于注射针不需要刺穿绒毛膜,因此小(~4μm)和尖锐的开口是有利的。 - 将胚胎旋转180°,使胚芽孢子边缘的另一侧指向注射针(图3A)。
- 如步骤3.2.3所述,将另外0.5 nL的1.5μg/ μL 10 kDa Alexa568-葡聚糖注入YSL中,每个胚胎的总注射体积为1 nL。
注意:从两侧注射允许荧光葡聚糖在YSL内更均匀地分布。 - 在荧光立体显微镜下检查注射结果。如果操作正确,荧光信号将被限制在YSL(图3B)中,并且在胚泡的细胞间空间中不可见。
- 灭活细胞
- 用林格溶液填充移植皿(见步骤2.2.1)。
- 将胚胎转移到移植皿中。
- 将胚胎与动物杆朝向移植针(图3C)。
- 如步骤1.3.5-1.3.7所述,小心地从动物极点区域除去细胞,从而将胚泡减小到所需的大小。
- 通过从移植针中排出去除的细胞来丢弃它们。
- 一旦程序完成,让胚胎在Ringer的溶液中停留30分钟至1小时以恢复。
- 可选:在荧光立体显微镜下检查YSL的完整性(图3D)。
- 将胚胎转移到充满胚胎培养基的琼脂糖包被的板中,并在28°C下孵育。
4. 通过种系移植产生母体-合子突变体
- 准备宿主和供体胚胎。
- 从突变型和野生型斑马鱼中收集新鲜产下的胚胎。来自具有突变背景的斑马鱼的胚胎将作为供体,而来自具有野生型背景的斑马鱼的胚胎将作为宿主。
注意:种系移植需要大量的起始胚胎(供体约为50个,宿主约为500个),以确保大量成功的种系移植存活到成年期。 - 使用巴斯德移液管将胚胎转移到带有胚胎培养基的琼脂糖涂层注射皿中。
注意:注射在脱壳前完成,以提高通量。通过绒毛膜注射的针需要钝化并具有较大的开口(〜10μm)以防止堵塞。 - 用1 nL的100 ng / μL mRNA注射供体胚胎,编码带有 nos1 3'UTR的GFP。将mRNA注射到蛋黄中以增加通量。
注意: Nos1 3'UTR将稳定原始生殖细胞中的mRNA,使生殖细胞在受精后1天成像时发出强烈的荧光10。 - 向宿主胚胎注射1 nL 0.33 mM(3μg/ μL) 死端(dnd) 吗啉。将吗啉蛋白注入蛋黄中以增加通量。
注意: dnd 吗啉阻断原始生殖细胞的形成,这确保了宿主胚胎的生殖系在移植后将专门填充来自供体的细胞10。 - 将注射的胚胎转移到具有胚胎培养基的塑料培养皿中。在28°C下孵育,直到胚胎达到高阶段。
- 当胚胎达到高阶段时,按照步骤2.1.2-2.1.5所述对胚胎进行脱壳。
- 从突变型和野生型斑马鱼中收集新鲜产下的胚胎。来自具有突变背景的斑马鱼的胚胎将作为供体,而来自具有野生型背景的斑马鱼的胚胎将作为宿主。
- 生殖细胞移植
- 用林格溶液填充移植皿(见步骤2.2.1)。
- 将去角球到圆顶阶段的胚胎转移到移植皿中。
- 将宿主胚胎和供体胚胎交替放置柱中,将细胞从一个供体胚胎移植到六个不同的宿主胚胎中。这增加了来自给定宿主胚胎的生殖细胞成功移植的机会。
- 将边缘的胚胎朝向移植针,并按照第1.3节所述进行移植。对于种系移植(图1D,F),从边缘(原始生殖细胞所在的位置)取源细胞并将其沉积到宿主胚胎中的相同位置。
注意:移植一个大柱(直径约80μm,长度约600μm)将增加获得成功种系移植的机会。 - 让胚胎在林格的溶液中停留30分钟至1小时,以便在移植完成后恢复。
注意:如果不是所有的供体胚胎都被认为是纯合突变体 - 例如,如果它们是由杂合杂交产生的 - 它们需要在移植后进行基因分型,以确定宿主移植的未来种系的基因型。在这种情况下,请确保宿主和供体胚胎的位置在处理过程中不会混淆。 - 使用荧光立体显微镜检查细胞是否成功移植(图4A,B)。
- 将胚胎转移到24孔琼脂糖包被的板中。将所有从同一供体接收细胞的宿主胚胎分组到同一孔中,并相应地标记它们。将它们孵育至第二天在28°C。
- 如果需要,将供体胚胎转移到标记的PCR条中进行基因分型。
- 筛查成功的种系移植
- 在受精后约30小时(hpf)的荧光立体显微镜下筛选宿主胚胎以成功进行种系移植。生殖细胞位于蛋黄延伸上方的凹槽处(图4C)。
注意:使用此处介绍的设备和策略的典型实验将具有〜60%-80%的成功率,以获得每个供体胚胎至少一个携带移植生殖细胞的宿主胚胎。之前的一份报告描述了约 10% 的效率10。 - 如果适用,丢弃从具有不正确基因型的供体胚胎接收细胞的胚胎。根据标准饲养条件并遵循机构指南,用成功移植的生殖细胞将幼虫培养至成年期。
- 在受精后约30小时(hpf)的荧光立体显微镜下筛选宿主胚胎以成功进行种系移植。生殖细胞位于蛋黄延伸上方的凹槽处(图4C)。
结果
在上述三种应用中使用移植设备的成功和失败可以通过在立体显微镜下进行目视检查来轻松评估。在成功的移植中,胚胎应该看起来正常,形状和卵黄清晰度与未移植的胚胎相似,胚泡中没有大撕裂。如果胚胎明显受损(图4B),它将无法正常发育。理想情况下,在荧光立体显微镜下观察时,表达荧光标记物的移植细胞应显示为连续柱(图2A, 图4A)。如果柱子是碎片的,这表明细胞被吸入移植针中剪切,或者细胞的沉积太用力。这可以通过更慢和更轻柔地移动柱塞来防止。
虽然移植装置主要用于处于胚泡期的斑马鱼胚胎5,6,但对于日本稻鱼青鲽(Oryzias latipes)的去脉裂胚,移植和细胞灭绝同样有效(图2B)。除了Porazinski,S.R.等人描述的胚胎去角化之外,还可以遵循上述相同的程序。
在种系移植的特定情况下,良好的移植将导致胚胎在卵黄边缘正上方具有长水平细胞柱(图4A)。然而,由于GFP在胚芽阶段的背景表达,生殖细胞是否成功移植只能在第二天进行评估(图4C-F)(图1F)。原始生殖细胞将在蛋黄延伸正上方的凹槽中显示为小荧光球(图4C-E)。这些细胞在正确位置的存在表明生殖系移植成功。具有不同形状的细胞不是生殖细胞(例如,细长的细胞通常是肌肉细胞,图4F)。此外,如果在凹槽外发现原始生殖细胞,这意味着它们无法正常迁移,并且它们将无法为胚胎的生殖系做出贡献。最后,移植胚胎的一般形态应与未移植的胚胎相似(图4D);尾巴不应变形,头部不应缩小或缺少眼睛(图4E)。这些缺陷通常是由于吗啉浓度过高或移植过程中的胚胎损伤引起的。此处描述的种系移植实验通常会导致6个宿主胚胎中的1-2个成功移植生殖细胞,用于60%-80%的供体胚胎,具体取决于实验者的经验。因此,来自40-50个纯合供体胚胎的细胞需要移植到200-300个宿主胚胎中,以培养大约30个具有突变生殖细胞的个体。
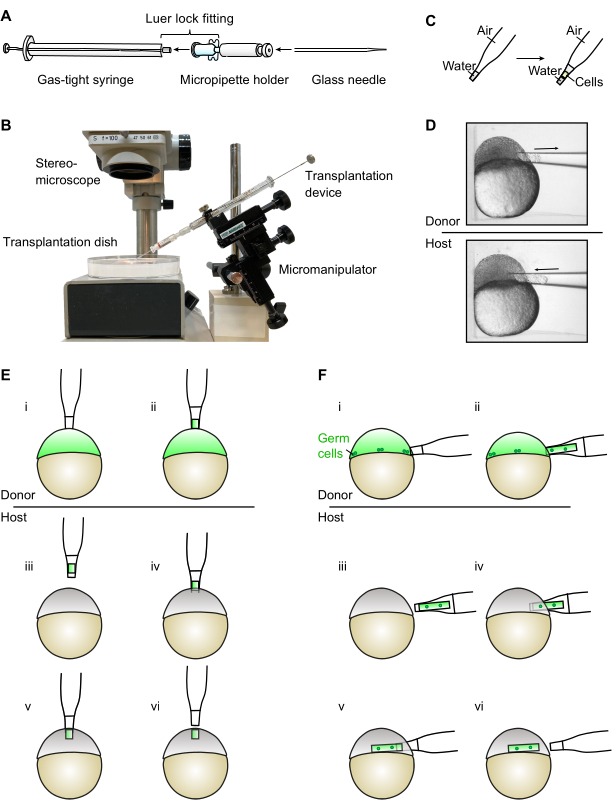
图 1:移植装置的组装和使用。 (A) 移植装置是通过 Luer 锁接头将气密注射器与微量移液管支架连接在一起的。然后将用于移植的玻璃针插入微量移液管支架中。(B)安装在显微操作器上的组装移植装置的照片(请注意,背景和标签已从图片中删除)。(C)使用移植装置时,重要的是要确保移植针中的水位保持在锥形末端。(D)该装置在立体显微镜下用于将细胞从放置在移植皿的单个孔中的硬骨胚胎中取出并插入和插入。(E)对于异位源的产生,细胞从供体胚胎的动物极(i-ii)中取出并转移到宿主胚胎(iii-vi)的动物极中。(F)对于生殖系移植,从生殖细胞所在的供体胚胎(i-ii)的边缘取出大量细胞。然后将细胞转移到宿主胚胎的边缘(iii-vi)。 请点击此处查看此图的放大版本。
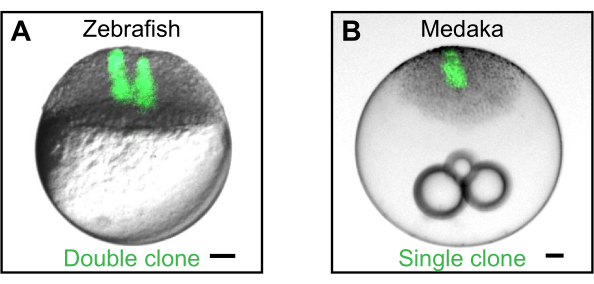
图2:通过细胞移植生成克隆。 (A)通过连续移植从斑马鱼供体到斑马鱼宿主胚胎中的荧光细胞(绿色)生成的双克隆的示例。单克隆和双克隆可用于研究分泌的信号分子如何形成时空梯度2,4,5,6。(B)通过将来自表达 eGFP的转基因鳏鱼供体(温布尔登)17的细胞移植到野生型鳔鳉宿主中而产生的单个克隆的例子。比例尺代表100μm。 请点击此处查看此图的放大版本。
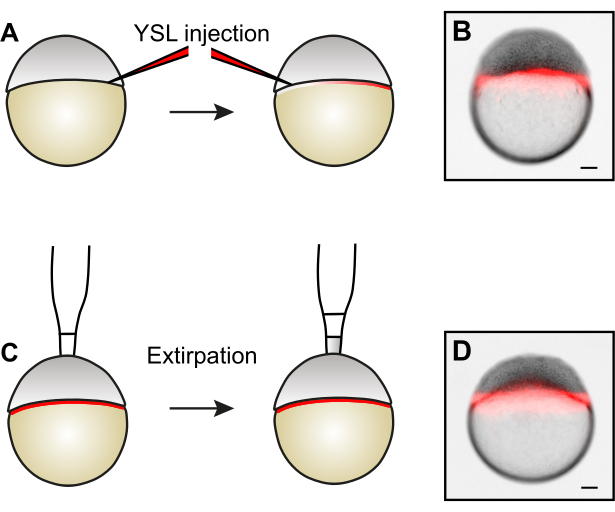
图3:通过细胞灭绝产生尺寸减小的胚胎。 (A)在通过灭绝去除细胞之前,可以通过将荧光染料注射到YSL的两个相对侧来标记YSL。(B)YSL注射后胚胎的例子。(C)为了产生尺寸减小的胚胎,通过灭绝从动物极中移除细胞5。(D)细胞灭绝后胚胎的例子。请注意,YSL 保持不变。比例尺代表100μm。 请点击此处查看此图的放大版本。
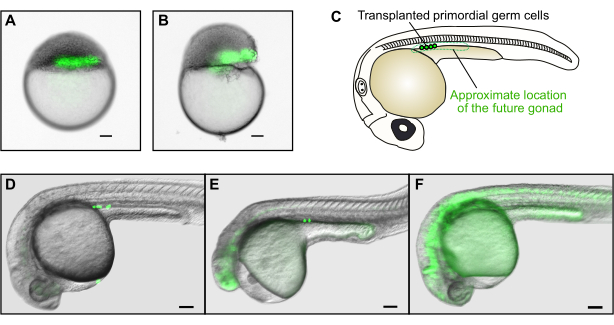
图4:种系移植(A)将供体细胞成功移植到宿主边缘区域的示例(绿色)。(B)移植不成功的示例。宿主胚胎的蛋黄严重受损,胚胎将无法正常发育。(C)在30 hpf时,成功移植的生殖细胞将仅在蛋黄延伸前部区域的性腺中胚层中发现。(D)成功移植的例子,其中几个GFP标记的供体生殖细胞已经填充了宿主未来的性腺。(E) 移植不成功的事例。虽然生殖细胞已经到达性腺中胚层,但宿主胚胎严重变形,不会正常发育。(F) 移植不成功的例子。未能迁移到正确位置的荧光生殖细胞不会重新填充性腺。比例尺表示 100 μm。D-F格式的图像以大约50倍的总放大倍率拍摄。请单击此处查看此图的放大版本。
讨论
移植实验的成功很大程度上取决于实验者的精细运动技能。为了成功执行这些程序,需要实践。然而,与市场上的其他仪器相比,这里介绍的工具相对容易学习和使用,并且通常只需要几天的练习。
通过采取一些预防措施可以提高移植过程的成功率。一个步骤是确保显微操纵器质量好,能够平稳运行。在立体显微镜中添加具有更高倍率的眼部可以帮助精确定位针头相对于胚胎的位置。使用繁殖良好的斑马鱼或青鳉来获得健康的胚胎,并注意在处理过程中(特别是在去角质步骤期间和之后)不要损坏胚胎,这也将提高成功率。
延迟毒性问题可能更难解决。如果胚胎在几个小时后死亡 - 但不是在移植后立即死亡 - 蛋黄可能被针头损坏(例如,由于进入胚胎太深),或者细胞被弹出太强。延迟毒性和胚胎死亡也可能是由于与供体细胞一起注射的蛋黄或细胞碎片引起的;另一个原因可能是林格溶液中HEPES缓冲液恶化。这些问题可以通过洗涤细胞(参见步骤1.3.8)或简单地使用一批新的缓冲液来克服。此外,种系移植实验中变形的宿主胚胎可能是由于吗啉浓度过高引起的。使用足够的吗啉素来完全消融宿主的野生型种系是至关重要的,从而防止这些细胞对后代做出贡献 - 但与此同时,需要避免过高的吗啉浓度。因此,所有注射的宿主胚胎中一致的吗啉蛋白量(典型实验中为几百个)是种系移植成功的关键。这可以通过用易于看到的示踪剂14补充吗啉注射混合物来帮助,该示踪剂可以在荧光立体显微镜下跟踪,以确保所有胚胎接受相同的注射量。
该协议中描述的程序仅涉及对胚泡期斑马鱼或青鳉胚胎中细胞的操作,但将来,通过改变移植针的直径和形状,可能会使该装置适应不同的阶段和物种。
披露声明
作者没有利益冲突要声明。
致谢
该项目得到了马克斯·普朗克学会的支持,并获得了欧洲研究理事会(ERC)根据欧盟地平线2020研究和创新计划(赠款协议号637840(QUANTPATTERN)和第863952号赠款协议(ACE-OF-SPACE))的资助。
材料
| Name | Company | Catalog Number | Comments |
| 1.0 mm glass capillary, ends cut without filament | To make the transplantation needle | ||
| 1.0 mm glass capillary, ends cut with filament | To make injection needles | ||
| 200 mL glass beaker | For embryo dechorionation | ||
| 24-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| 5 cm diameter glass Petri dish | For embryo dechorionation | ||
| 6-well plastic plate | To be coated with agarose in order to incubate embryos | ||
| Agarose | To coat plastic dishes | ||
| dnd1 morpholino | Gene Tools | Sequence: GCTGGGCATCCATGTCTCCGAC CAT | |
| Embryo medium | 250 mg/L Instant Ocean salt, 1 mg/L methylene blue in reverse osmosis water adjusted to pH 7 with NaHCO3 | ||
| Fluorescence stereomicroscope with GFP/RFP filters and light source | To assess YSL injections and germ-line transplantations | ||
| Glass micropipette puller | Sutter Instrument Company | P-1000 | To make the transplantation needle |
| Glass pasteur pipette | Kimble Chase (via Fisher) | 63A53WT | For pipetting embryos; the tips can be flamed to smoothen out the edge |
| Incubator at 28 °C | For incubating zebrafish embryos | ||
| Luer tip 25 μL Hamilton syringe, 1700 series | Hamilton | Ref: 80201 | Part of the transplantation device |
| Manual micromanipulator with 3 axes of movement | Narishige | M-152 | For controlling the transplantation device |
| Manual pipetting pump | Bio-Tek | Cat. # 641 | For use with the glass pipettes to transfer embryos |
| Metal dissecting probe | For moving and rotating zebrafish embryos | ||
| Microforge | Narishige | MF2 | To make the transplantation needle |
| Microinjection apparatus | For injection of mRNA and morpholino into embryos | ||
| Microinjection molds, triangular grooves | Adaptive Science Tools | TU-1 | To prepare microinjection plates with agarose |
| Microinjection-molds, single wells | Adaptive Science Tools | PT-1 | To prepare transplantation plates with agarose |
| Micropipette holder with Luer fitting for a 1.0 mm glass capillary | World Precision Instruments | MPH6S10 | Part of the transplantation device |
| mMessage mMachine Sp6 transcription kit | Life Technologies | AM1340M | To generate capped mRNA for injection into embryos |
| Plasmid with GFP-nos1 3'UTR | Plasmid that can be transcriped to produce mRNA encoding GFP with the 3'UTR of nos1 | ||
| Plastic petri dish 100 mm | To be coated with agarose in order to make injection and transplantation dishes | ||
| Protease from Streptomyces griseus | Sigma | P5147 | For embryo dechorionation: Make a 5 mg/ml stock and use at 1 mg/ml to dechorionate embryos |
| Ringer’s solution | For 1 L: Add 6.78 g of NaCl, 0.22 g of KCl, 0.26 g of CaCl2 and 1.19 g of HEPES; then fill to 1 L; adjust pH to 7.2; sterilize by filtration | ||
| Stereomicroscope | For injection and transplantation |
参考文献
- Spemann, H., Mangold, H. Induction of embryonic primordia by implantation of organizers from a different species. Archives for Microscopic Anatomy and Developmental Mechanics. 100 (3-4), 599-638 (1924).
- Müller, P., et al. Differential diffusivity of Nodal and Lefty underlies a reaction-diffusion patterning system. Science. 336 (6082), 721-724 (2012).
- Donovan, P., et al. Paracrine Activin-A signaling promotes melanoma growth and metastasis through immune evasion. Journal of Investigative Dermatology. 137 (12), 2578-2587 (2017).
- Pomreinke, A. P., et al. Dynamics of BMP signaling and distribution during zebrafish dorsal-ventral patterning. eLife. 6, 25861(2017).
- Almuedo-Castillo, M., et al. Scale-invariant patterning by size-dependent inhibition of Nodal signaling. Nature Cell Biology. 20, 1032-1042 (2018).
- Soh, G. H., Pomreinke, A. P., Müller, P. Integration of Nodal and BMP signaling by mutual signaling effector antagonism. Cell Reports. 31 (1), 107487(2020).
- Mahalwar, P., Walderich, B., Singh, A. P., Nüsslein-Volhard, C. Local reorganization of xanthophores fine-tunes and colors the striped pattern of zebrafish. Science. 345 (6202), 1362-1364 (2014).
- Frohnhöfer, H. G., Krauss, J., Maischein, H. M., Nüsslein-Volhard, C. Iridophores and their interactions with other chromatophores are required for stripe formation in zebrafish. Development. 140 (14), 2997-3007 (2013).
- Chen, Y., Schier, A. F. The zebrafish Nodal signal Squint functions as a morphogen. Nature. 411 (6837), 607-610 (2001).
- Ciruna, B., et al. Production of maternal-zygotic mutant zebrafish by germline replacement. Proceedings of the National Academy of Sciences of the United States of America. 99 (23), 14919-14924 (2002).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). 4th edn. , University of Oregon Press. (2000).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating chimeric zebrafish embryos by transplantation. Journal of Visualized Experiments:JoVE. (29), e1394(2009).
- Capek, D., Müller, P. Positional information and tissue scaling during development and regeneration. Development. 146 (24), 177709(2019).
- Rogers, K. W., Bläßle, A., Schier, A. F., Müller, P. Measuring protein stability in living zebrafish embryos using fluorescence decay after photoconversion (FDAP). Journal of Visualized Experiments: JoVE. (95), e52266(2015).
- Carvalho, L., Heisenberg, C. P. The yolk syncytial layer in early zebrafish development. Trends in Cell Biology. 20 (10), 586-592 (2010).
- Porazinski, S. R., Wang, H., Furutani-Seiki, M. Dechorionation of medaka embryos and cell transplantation for the generation of chimeras. Journal of Visualized Experiments: JoVE. (46), e2055(2010).
- Centanin, L., Hoeckendorf, B., Wittbrodt, J. Fate restriction and multipotency in retinal stem cells. Cell Stem Cell. 9 (6), 553-562 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。