需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
荧光显微镜用于人肿瘤细胞和肿瘤异种移植小鼠中巨细胞增多介导的ATP内化
* 这些作者具有相同的贡献
摘要
我们开发了一种可重复的方法,以可视化具有高细胞分辨率的不可水解荧光三磷酸腺苷(ATP)的内化,ATP替代物。我们使用独立的 体外 和 体内 测定验证了我们的方法 - 人肿瘤细胞系和用人类肿瘤组织异种移植的免疫缺陷小鼠。
摘要
三磷酸腺苷(ATP),包括细胞外ATP(eATP),已被证明在肿瘤发生的各个方面起重要作用,例如耐药性,上皮间充质转变(EMT)和转移。肿瘤内eATP的浓度比正常组织高103 至104 倍。虽然eATP作为激活嘌呤能信号传导的信使进行EMT诱导,但它也通过上调巨噬细胞增多症(一种特定类型的内吞作用)被癌细胞内化,以执行各种生物学功能。这些功能包括为需要ATP的生化反应提供能量,在信号转导期间捐赠磷酸基团,以及促进或加速作为转录辅因子的基因表达。ATP唾手可得,其在癌症等领域的研究无疑将会增加。然而,eATP研究仍处于早期阶段,在eATP和内化细胞内ATP所发挥的重要和多功能活动可以完全解开之前,尚未解决的问题仍未得到解答。
这些作者的实验室对这些早期eATP研究的贡献包括不可水解荧光ATP的显微成像,以及高分子量和低分子量荧光葡聚糖,其用作巨噬细胞增多和内吞作用示踪剂,以及各种内吞作用抑制剂,以监测和表征eATP内化过程。该成像方式应用于肿瘤细胞系和免疫缺陷小鼠,异种移植人癌症肿瘤, 以研究eATP在体外 和 体内的内化。本文描述了这些 体外 和 体内 方案,重点是修改和微调测定条件,以便可以在不同的系统中成功进行巨噬细胞增生/内吞作用介导的eATP内化测定。
引言
肿瘤内细胞外(即)营养素的机会性吸收最近被命名为癌症代谢的关键标志1。这些重要的营养素之一是ATP,因为IEATP的浓度比正常组织中发现的浓度高103和104倍,在几百μM到低mM 2,3,4,5的范围内。作为一种关键的能量和信号分子,ATP在癌细胞和健康细胞的细胞代谢中起着核心作用6,7,8。细胞外ATP不仅参与癌细胞生长,而且还促进耐药性9。最近已经确定了以前未被识别的ATP功能,例如亲水活性,因此涉及ATP参与阿尔茨海默氏症等疾病10。事实上,我们对ATP及其在癌细胞,健康细胞和其他患病细胞中的功能的理解似乎远未完成。然而,由于ATP在细胞中的不稳定性和高周转率,监测ATP穿过细胞膜并进入细胞的运动在技术上具有挑战性。
为了解决这个问题并满足该研究领域的需求,开发了一种方法,其中使用不可水解的荧光ATP(NHF-ATP)(图1)作为替代物,以可视化ATP的内化并观察内化ATP的细胞内空间定位,无论是在体外还是在体内11,12.NHF-ATP已被证明可以替代内源性ATP来研究ATP在动物细胞膜上的运动,无论是在癌细胞系中还是在免疫缺陷小鼠上异种移植的人肿瘤组织中11,12。此外,将巨噬细胞增多抑制剂施用于阻断eATP内化的细胞,表明eATP的细胞内摄取涉及巨噬细胞机制9,11,12。该协议允许针对细胞特异性蛋白质的免疫基colabel,从而鉴定哪种细胞类型内化NHF-ATP。使用体内肿瘤异种移植物和高分辨率显微镜,NHF-ATP可以在组织样品甚至单个细胞内的空间上可视化。这些方法还允许定量分析,例如细胞摄取的百分比,大卵子细胞囊泡的数量和内化动力学。本文详细描述了NHF-ATP如何单独或与内吞作用 - 示踪剂荧光葡聚糖13,14,15,16一起工作,可以在不同的实验环境中用于研究ATP的内化和细胞内定位,在细胞内化之后。

图1:不可水解荧光ATP和四甲基罗丹明标记的高分子量荧光葡聚糖的结构。(B) HMWFD的示意图。缩写: ATP = 三磷酸腺苷;NHF-ATP = 不可水解荧光 ATP;TMR = 四甲基罗丹明;HMWFD = 高分子量荧光葡聚糖。请点击此处查看此图的放大版本。
Access restricted. Please log in or start a trial to view this content.
研究方案
本文报告的所有程序均按照俄亥俄大学的IACUC和NIH进行。
1. 选择非水解荧光ATP(NHF-ATP)和葡聚糖
- 根据优选的发射波长(例如,配备适当滤光片的成像系统)和要研究的特定内吞过程,选择荧光团偶联的NHF-ATP(图1A)和内吞作用示踪剂,高分子量和低分子量荧光葡聚糖(TMR-HMWFD和TMR-LMWFD)(图1B)。
2. ATP定位研究,体外(图2)
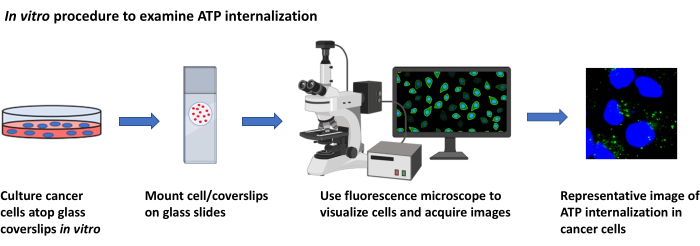
图2:检查ATP内化的 体外 程序。 使用荧光显微镜可视化培养癌细胞中细胞外ATP内化的方案的示意图。 请点击此处查看此图的放大版本。
- 细胞培养和细胞制备
注意:在组织培养罩中的无菌条件下进行细胞培养。- 在37°C的水浴中制备Dulbecco的改性鹰培养基(DMEM),含有10%(v / v)胎牛血清(FBS)和1%(v / v)青霉素/链霉素(以下简称DMEM / FBS),无菌磷酸盐缓冲盐水(PBS)和0.25%胰蛋白酶/乙二胺四乙酸(EDTA)。
- 在100mm组织培养皿中在DMEM / FBS中培养人癌细胞。将细胞保持在设置为37°C的培养箱中,具有5%CO2 气氛。
- 当细胞达到汇合时,通过首先除去培养基传代细胞。接下来,用5 mL无菌PBS冲洗培养皿,取出PBS,加入3 mL 0.25%胰蛋白酶。在37°C下在5%CO2 气氛中孵育5分钟。
- 取回培养皿,然后加入6 mL DMEM / FBS以停止胰蛋白酶消化。将悬浮液中的细胞转移到15mL锥形管中,并以800×g离心5分钟以沉淀细胞。
- 离心后,吸出上清液并使用10mL DMEM / FBS通过移液重悬细胞沉淀。
- 使用血细胞计数器计数细胞密度和活力。使用DMEM / FBS将细胞悬浮液稀释至约7.5×104 个细胞/ mL的密度。
- 盖玻片和接种细胞的制备
- 用70%乙醇清洗12毫米盖玻片,并用精致的任务湿巾仔细擦拭。通过高压灭菌对盖玻片和一对镊子进行灭菌。
- 在组织培养罩中,使用镊子将一个盖玻片放入24孔组织培养板的每个孔中。
注意:稍后,带有细胞的盖玻片将直接安装在显微镜载玻片上进行成像。 - 以每孔约2.5×104 个细胞的接种密度分配300μL细胞悬浮液(DMEM / FBS中的细胞)到含有灭菌盖玻片的24孔板中。在无菌条件下孵育37°C,CO2 流量为5%。
- 细胞饥饿
- 播种后24小时,从每个孔中取出DMEM / FBS。立即向每个孔中加入300μL预热的无血清DMEM,使细胞饥饿15-18小时,以诱导细胞外营养物质的摄取。
注:饥饿期为15-18小时,是一个关键参数。
- 播种后24小时,从每个孔中取出DMEM / FBS。立即向每个孔中加入300μL预热的无血清DMEM,使细胞饥饿15-18小时,以诱导细胞外营养物质的摄取。
- NHF-ATP和HMWFD/LMWFD解决方案的制备
- 使用分析天平称量高分子量(70 kDa)荧光TMR-葡聚糖(TMR-HMWFD,1 mg / mL),用于可视化大卵子体的示踪剂,或1.5 mL微量离心管中无血清DMEM中的NHF-ATP(10μmol/ L)。将避光的管子置于37°C水浴中15分钟。
- 在室温下以12,000×g离心5分钟。小心地将透明上清液转移到新的1.5 mL微量离心管中,保持任何沉淀或碎屑完好无损以除去不溶性晶体。
- 将步骤2.4.1中的溶液加入每个孔中的细胞中,并在37°C下孵育细胞30分钟。
注意:如果要将HMWFD和NHF-ATP溶液混合以与细胞共育,请以终浓度的2倍制备两种溶液。稍后将以1:1的比例混合溶液,以达到最终准确的工作浓度。避免光照,因为试剂对光敏感。
- 细胞治疗和固定
- 在新鲜的24孔板中,将500μL预热PBS分配到五个孔中的每一个中。
- 细胞孵育后,使用镊子小心地拿起每个盖玻片。通过将每个盖玻片浸入500μL预热PBS中冲洗每个盖玻片。使用五个装满PBS的孔重复五次。
注意:轻柔地清洗盖玻片上的细胞对于本实验的成功至关重要。 - 在最终的PBS洗涤后,在精致的任务湿巾上轻拍盖玻片以吸收多余的PBS,并立即将盖玻片转移到冷(4°C)3.7%甲醛中,预装在24孔板中。在室温下固定细胞15分钟。
- 在固定细胞时,用70%乙醇预清洁显微镜载玻片。从孔中取出盖玻片并将其安装到载玻片上,使用5μL含有核染色剂4',6-二氨基-2-苯基吲哚(DAPI)的水性安装介质,每个盖玻片。用纸巾或精致的任务擦拭器轻轻擦拭多余的PBS。
- 荧光显微镜和图像采集
- 完成上述步骤后2至24小时,使用落射成像系统和数据采集软件捕获细胞和内化HMWFD和/或NHF-ATP的图像。
注:本小节介绍使用配备落射荧光成像功能的尼康NiU显微镜和尼康NIS Elements软件采集图像的步骤。但是,可以使用其他类似的成像系统和采集软件。按照制造商的操作说明进行操作。- 将载玻片放在双目模式下直立落射荧光显微镜的载物台上。访问映像程序。
- 选择10倍物镜,调整载物台以定义焦点,然后以蛇形方式从左到右扫描载玻片以识别感兴趣的区域。
注意:识别感兴趣的区域因细胞类型而异,一些细胞系/癌症类型表现出不同程度的TMR-HMWFD和/或NHF-ATP摄取。 - 选择40倍物镜,并使用显微镜上的开关从双目模式切换到图像捕获模式。
- 单击成像程序上的" 实时质量 "图标可查看并随后获取图像。
- 使用"注释和测量"工具栏上的"OC 面板",为每个滤光片立方体或荧光灯通道定义曝光参数。
注:由于信号强度不同,请为每个通道选择适当的曝光时间。例如,为 DAPI 选择 200 毫秒的曝光时间,为 HMWFD 选择 2 秒,为 NHF-ATP 选择 4 秒的曝光时间。确定每个通道的曝光时间后,请对每个通道的所有图像使用此设置,并具有不同的处理或条件。 - 为每个通道设置曝光设置后,使用多通道采集工具栏获取具有定义曝光设置的 3 通道图像。
注:通过多通道ND采集模式进行图像采集,可以自动捕获同一视场的每个通道的图像。快门在刀塔更换之间自动关闭。 - 或者,通过在滤镜立方体之间切换、设置曝光时间、在每个通道的图像采集之间关闭/打开快门以及叠加为单个通道拍摄的每个图像来手动获取多通道图像。
注:ND 采集模式可自动执行此过程并提供合并图像。 - 将图像另存为 .nd2 文件(尼康元素格式保存元数据)。保存 TIF 文件,包括合并的频道图像和单个频道图像。
注:TIF 文件可以与更广泛的软件应用程序一起使用。 - 使用"分析"工具栏上的"对象计数"功能可以计算保存的 .nd2 图像文件上的 NHF-ATP、TMR-HMWFD 和/或 TMR-LMWFD 阳性细胞的数量。
- 通过分析程序将数据导出到电子表格。
- 完成上述步骤后2至24小时,使用落射成像系统和数据采集软件捕获细胞和内化HMWFD和/或NHF-ATP的图像。
- 数据量化和分析
- 对于每个条件测定,成像50至100个细胞进行定量。使用数据分析软件(落射荧光成像系统中包含的软件或其他软件),计数并计算每个细胞的平均荧光囊泡数。
- 使用适当的统计方法来分析量化结果。
3. 肿瘤中ATP内化,离体(图3)

图3:检查ATP内化的 体内 程序。 使用冷冻切片和荧光显微镜可视化肿瘤异种移植物中细胞外ATP内化的方案示意图。 请点击此处查看此图的放大版本。
- 用于植入的细胞培养物的制备
- 使用补充FBS的DMEM在37°C下将癌细胞在37°C下生长至80%汇合,使用补充FBS的DMEM,最终浓度为10%(v / v)和青霉素/链霉素为1%(v / v)。
- 用10 mL PBS洗涤细胞两次。将0.25%胰蛋白酶/ EDTA预热至37°C。 加入8 mL胰蛋白酶/ EDTA,并在37°C下孵育2分钟。
- 一旦细胞开始从烧瓶底部分离,使用10mL无菌血清学移液管加入8mL DMEM / FBS。吸出两次以移走任何贴壁细胞。使用移液器将分离的细胞从烧瓶转移到50mL锥形管中。
- 使用10 mL移液器加入10 mL DMEM / FBS,并将所有剩余的漂浮细胞收集在相同的50 mL锥形管中。
- 将细胞悬浮液在600×g,4°C下离心4分钟。除去上清液并将细胞重悬于1mL冰冷的PBS中。
- 使用血细胞计数器计数细胞密度。计数时将细胞悬浮液保持在冰上。
- 将细胞悬浮液在600×g,4°C下离心4分钟。除去上清液并将细胞悬浮在冰冷的PBS中,使得细胞密度变为5×每100μLPBS106个细胞。将细胞悬浮液转移到1.5mL微量离心管中。
- 皮下注射癌细胞用于异种移植肿瘤的发展
- 使用无乳胶注射器(1 mL)和精密滑动针(27 G针头)进行癌细胞注射。
- 将细胞悬浮液(5×106 在100μLPBS中)转移到1.5mL微量离心管中。将细胞吸入注射器中。
- 选择免疫缺陷(裸)小鼠侧腹的注射部位,然后用75%乙醇轻轻清洁皮肤。用精致的任务擦拭擦拭多余的乙醇。
- 对于皮下注射,将针头与皮肤成约10°角。插入针尖,斜面朝上,正好在皮肤下方,这样在皮肤外只能看到1-2毫米的针。从注射器中缓慢分配细胞约10秒。
- 注射整个体积后,继续将针头固定到位3-5秒,然后取出针头并用手指对注射部位施加轻柔但牢固的压力3-5秒,以防止注射内容物泄漏。
- 使用游标卡尺监测和测量肿瘤生长,直到肿瘤达到200-500 mm3的体积。
- 肿瘤切除后使用的HMWFD和NHF-ATP溶液的制备
- 将300μL16mg / mLHMWFD溶解在无血清DMEM(培养基)中,在37°C水浴中孵育30分钟,并如上所述以12,000×g离心5分钟。 将溶液转移到1.5mL微量离心管中。
- 加入40μL NHF-ATP模拟储备液(1mM)到160μL无血清DMEM中,以制备0.2mM NHF-ATP溶液。
- 实验井的制备
注意:该实验设计将测定HMWFD + NHF-ATP的细胞内化,表明大卵子体的摄取。- 按如下方式准备孔:孔#1,对照:200μL无血清DMEM;孔#2,对照:100μL16mg / mL LMWFD + 100μL无血清DMEM = 200μL 8mg / mLLMWFD;孔#3,对照:100μL0.2mM NHF-ATP + 100μL无血清DMEM = 200μL0.1mM NHF-ATP;好吧#4;实验性:100 μL 16 mg/mL HMWFD + 100 μL 0.2mM NHF-ATP = 200 μL 0.1 mM NHF-ATP 和 8 mg/mL HMWFD。
- 肿瘤组织的制备
- 通过宫颈脱位或根据IACUC批准的协议对小鼠实施安乐死。
- 使用10号手术刀将厚度约为500-1,000μm的分离肿瘤切片。
- 将肿瘤切片在补充有100μM NHF-ATP和/或8mg / mL H / LMWFD的无血清DMEM中孵育在微量离心管中40分钟,在37°C下具有5%CO2 流量。
注意:孵育后,肿瘤组织代谢导致培养基的颜色发生变化。 - 在37°C预热PBS中冲洗组织(在24孔板中每次冲洗2mL)。
- 将组织转移到具有预热的新鲜PBS的新24孔板中,冲洗并轻轻摇动重复四次。
- 冷冻包埋(制备冷冻组织块)
- 为要收获的每个肿瘤准备识别标签。切一块2厘米长的实验室胶带,折成两半,粘合面并拢,纵向。使用标记笔标记标签,例如,使用鼠标/肿瘤识别号。
- 通过将不锈钢组织模具直接放在干冰上来准备嵌入模具。
注意:干冰可能导致冻伤、烧伤和窒息。处理干冰时戴上绝缘手套。在通风良好的地方使用干冰。不要将干冰储存在密封的容器中。相反,请存放在允许气体逸出的容器(如聚苯乙烯泡沫塑料冷却器)中。 - 当霉菌冷却时,将一小池组织冷冻培养基放入10mm组织培养板中。确保体积足以淹没将要收获的肿瘤组织。
- 使用穿孔的勺子舀起切除的肿瘤组织,并立即将组织放入冷冻培养基中,确保组织被淹没。使用穿孔勺子,在冷冻介质中轻轻滚动组织,确保介质沐浴所有组织表面。
- 小心地将组织移动到含有冷冻介质的包埋模具中。将相应的标签标签垂直放入冷冻介质/模具中以冻结到位。确保书面标签在介质外可见。
- 冷冻完成后(冷冻介质变成不透明白色),从模具中取出组织块,将其放在干冰上,然后对每个肿瘤重复。在冷冻切除程序之前,将组织块储存在-80°C下数月。
- 组织样品载玻片的制备
- 为了最大限度地提高发现内化阳性细胞并具有更具代表性的组织区域的机会,使用低温恒温器在-18至-20°C下收集连续冷冻切片。
- Prechill低温恒温器工具(刀片,剃须刀片,防卷板,组织卡盘支架,画笔),并通过将其置于-18至-20°C的低温恒温器室中来平衡肿瘤组织块。 将刀片支架角度设置为 5-10°。根据需要,用剃须刀片小心地修剪组织块,并使用组织冷冻介质作为"胶水"将其安装到卡盘支架上。
- 将卡盘支架锁定在切片机单元上的垂直位置,随着手摇曲柄的每次转动,该位置会前进到设定的距离(例如,10μm)。将防侧倾板放置在刀片高度的正上方。为了在推进切片机之前防止组织卷曲,请小心地将拇指滑过组织块的底部边缘。
- 当切片机前进并且组织切片落在金属板上时,使用画笔引导组织切片并展开组织(如有必要)。
- 将显微镜载玻片悬停在组织切片上而不接触,以便该切片被吸引到切片上。
注:低温恒温器刀片(高调、一次性)非常锋利,可造成严重伤害。处理刀片和操作低温恒温器时要小心。使用刀片式服务器保护器(如果可用)。需要适当的培训。 - 将肿瘤切成10μm厚度的切片。立即将切片部分转移到带正电荷的玻璃显微镜载玻片上。
注意:对于连续切片,首先将10μm厚的切片收集到八个带正电荷的载玻片的左上角。将低温恒温器推进到随后的100-200μm组织中,并丢弃组织。立即将所有切片部分转移到玻璃显微镜载玻片上。 - 接下来,为八张载玻片中的每张收集另一个10μm厚的切片,靠近先前放置的组织切片。重复这个连续收集过程,直到八张载玻片中的每张都包含八个组织切片,每个切片相距100-200μm。将组织切片保持在黑暗中以保持荧光。
注意:载玻片上的组织切片可以在-80°C的载玻片盒中储存数月。
- 为了最大限度地提高发现内化阳性细胞并具有更具代表性的组织区域的机会,使用低温恒温器在-18至-20°C下收集连续冷冻切片。
- 组织载玻片的固定
- 关键步骤:将组织切片在-18至-20°C下用95%乙醇固定5分钟。
- 用室温PBS洗涤固定部分5分钟,然后使用10μL含DAPI的水性安装介质将固定的肿瘤切片安装在玻璃盖玻片下。
- 安装后12至24小时,通过荧光显微镜检查固定的肿瘤切片并获得图像,如上述培养的细胞所述。
- 荧光显微镜和图像采集
- 识别感兴趣的区域并获取图像,如第2.6节所述。
- 数据量化和分析
- 量化细胞并应用适当的统计分析,如第2.7节所示。
4. ATP在肿瘤体内的内化
- 准备用于植入的细胞培养物,如第3.1节所述。
- 皮下注射癌细胞用于异种移植肿瘤的发展
- 生成异种移植肿瘤,如第3.2节所述。
- ATP和/或葡聚糖注射到异种移植肿瘤中
- 如上所述,在DMEM中制备DMEM(载体)或8mg / mL HMWFD或LMWFD的处理溶液,有或没有NHF-ATP(100μM)。
- 使用1mL注射器收集50μL一种治疗溶液,并将溶液直接注射到每个异种移植肿瘤中。重复该过程,对每种治疗进行四次生物重复。
- 组织采集和冷冻包埋
- 为要收获的每个肿瘤准备识别标签。切一块2厘米长的实验室胶带,折成两半,粘合面并拢,纵向。使用标记笔标记标签,例如,使用鼠标/肿瘤识别号。
- 注射后约5分钟,通过宫颈脱位或根据IACUC批准的方案对小鼠实施安乐死。
- 使用10号手术刀,在肿瘤附近做一个切口,大约垂直于针头注射的方向。使用镊子和手术剪刀从周围组织中切除肿瘤组织。
- 根据肿瘤总大小,将肿瘤分成两到四个1cm2 块。
- 准备包埋模具并包埋组织,如上文第3.6节所述。确保从肿瘤内葡聚糖注射到冷冻包埋的收获时间不超过7-8分钟。
- 组织样品载玻片的制备
- 收集连续肿瘤切片,如第3.7节所述。
- 组织载玻片的固定
- 固定组织,如第3.8节所述。
- 荧光显微镜和图像采集
- 识别感兴趣的区域并获取图像,如第2.6节所述。
- 数据量化和分析
- 量化细胞并应用适当的统计分析,如第2.7节所述。
Access restricted. Please log in or start a trial to view this content.
结果
体外 研究
NHF-ATP的细胞内化通过NHF-ATP与HMWFD或LMWFD的共定位来证明(图4)。该程序的成功主要取决于使用适当浓度的NHF-ATP和葡聚糖,以及确定右旋糖酐的适当类型(聚赖氨酸与中性)。例如,为了研究宏卵酸细胞增多症,选择HMWFD,因为它仅由宏卵子体13,14,15,16内化...
Access restricted. Please log in or start a trial to view this content.
讨论
开发了一种用于不可水解ATP的细胞内化的空间,时间和定量分析方法。该方法广泛适用于各种生物系统,包括各种致瘤模型,我们为其提供技术指导和代表性数据。为了 在体内 ATP内化研究期间获得可解释的数据(方案第4节),限制从肿瘤内葡聚糖注射到冷冻包埋的实验时间至关重要。固定组织载玻片 - 肿瘤后切片 - 是荧光显微镜成像之前的必要步骤。这两个关键步骤共同确保肿瘤细胞在?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有竞争利益。
致谢
冷冻切除术在俄亥俄大学组织病理学核心现场进行。这项工作部分得到了创业基金(俄亥俄大学艺术与科学学院)对C Nielsen的支持;NIH授予R15 CA242177-01和RSAC奖给X Chen。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker - orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical - sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
参考文献
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008(2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101(2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg's contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154(2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。