Method Article
癫痫小鼠模型中热诱发癫痫发作的行为筛查
摘要
该方法的目标是在小鼠模型中筛查热疗或热诱发的癫痫发作。该协议描述了使用定制的腔室,连续监测体温,以确定体温升高是否会导致癫痫发作。
摘要
转基因小鼠模型已被证明是研究人类神经系统疾病各个方面(包括癫痫)的强大工具。 SCN1A 相关的遗传性癫痫包括广泛的癫痫发作疾病,具有不完全外显率和临床变异性。SCN1A 突变可导致多种癫痫发作表型,从简单的自限性发热相关性热性惊厥 (FS)、伴有热性惊厥的中度遗传性癫痫 (GEFS+) 到更严重的 Dravet 综合征 (DS)。虽然FS常见于6-7岁以下没有遗传性癫痫的儿童,但GEFS +患者中的FS继续发生到成年期。传统上,通过将动物暴露于干燥的空气流或加热灯,在小鼠中诱导了实验性FS,并且体温的变化率通常不能得到很好的控制。在这里,我们描述了一个定制的加热室,带有有机玻璃前部,配有数字温度控制器和配备加热器的电风扇,可以以温度控制的方式将加热的强制空气送入测试场地。通过直肠探头监测放置在腔室中的小鼠的体温可以通过增加腔室内的温度以可重复的方式增加到40-42°C。在加热期间对动物的持续视觉监测表明,在体温下携带FS突变的小鼠中热诱导的癫痫发作不会引发野生型窝伴侣的行为癫痫发作。动物可以很容易地从腔室中取出并放置在冷却垫上,以迅速将体温恢复到正常水平。该方法为癫痫小鼠模型中热诱导癫痫发作的发生提供了简单,快速且可重复的筛查方案。
引言
癫痫是美国第四大最常见的神经系统疾病家族1,其特征在于中枢神经系统中兴奋性和抑制性驱动的不平衡,导致反复发作。热性惊厥(FS)或与发烧相关的癫痫发作可能发生在一般人群中,最常见于早在3个月到6-7岁的儿童中。然而,在一些具有基因突变的个体中,最常见的是钠通道基因,FS可以持续超过7岁直到成年期。这种情况被称为热性惊厥加或FS +。基因组测序的快速发展已经在人类钠离子通道基因 SCN1A中发现了1,300多个突变,使其成为癫痫突变的热点。SCN1A 突变与广泛的癫痫发作有关,包括热性惊厥(FS),伴有热性惊厥加(GEFS+)的遗传性癫痫和Dravet综合征(DS)2,3,4,5,6。大约20%的SCN1A错义突变导致GEFS +5,7,8。儿童期复杂或长期FS的儿科病史随后可发展成更虚弱的癫痫形式,如颞叶癫痫(TLE)9,10,11。Dravet 综合征是由于 SCN1A 中的截断突变或功能丧失而引起的,是一种严重的顽固性癫痫,伴有儿童期热性惊厥,发展为难治性癫痫发作,通常与认知、发育和运动障碍相关2,5,12.由于许多患有GEFS +和/或DS的个体表现出热性惊厥,因此开发新的疗法以更好地对抗这些癫痫发作变得势在必行。
SCN1A相关癫痫的动物模型已被证明在表征不同类型的癫痫发作(发热与全身性)和剖析癫痫发作产生的神经元机制方面具有无可估量的价值13,14,15,16,17,18。虽然通过EEG / EMG记录在啮齿动物大脑中自发性癫痫发作的研究已经建立起来,并且是一个非常有用的工具,但只有少数研究试图模仿小鼠模型中的热性惊厥14,16,19,20,21,22,23.以前的研究已经使用加热干燥空气的射流,或装有热系统的甲基丙烯酸酯圆筒,或在封闭的测试场所中使用带有温度控制器的加热灯9,16,21,22,23,24 通过热疗诱导癫痫发作。为了在更受控的环境中提高体温,这里描述的协议使用带有温度控制加热系统的定制室,允许室内小鼠体温的可重复增加速率。加热室由木材制成(长40厘米x宽34厘米x高31厘米),并配有带K热电偶的数字温度控制器。在腔室后面板上装有加热器的小型轴流风扇将加热的空气引导到由数字温度控制器调节的腔室中。这种强制空气加热系统使人们能够控制腔室温度升高的速率。(图1A、B)。位于木制加热室内部的K热电偶向数字温度控制器发送反馈,以在测定过程中保持盒子内部的恒定温度。在数字温度控制器上设置温度,使电风扇能够通过通风口发送加热的强制空气,以均匀加热腔室(图1A)。加热室的前面板是一块透明的有机玻璃板,可以轻松录制试验的视频。
每个实验都选择了成年(P30-P40)小鼠,杂合子,用于SCN1A中的错义突变,导致GEFS +和相同数量的野生型幼崽作为对照组。在这些研究中使用的动物,包括雄性和雌性,体重至少为15克,因为体重较小的野生型小鼠比同龄的较重动物对热诱发的癫痫发作更敏感。在试点研究中,观察到突变型和野生型小鼠在后面寻找腔室的凉爽角落,并在那里停留很长时间。为了规避这种情况,通过将木块B(尺寸20厘米x 8厘米x 7.2厘米)放在试验室右侧,将加热室测试场内的有效地板尺寸减少到16.5厘米x宽21.5厘米x高27.5厘米(图1A)。加热室由1.9厘米厚的胶合板(长40厘米x宽34厘米x高31厘米)制成,覆盖有白色层压板,并配有带K热电偶的数字温度控制器。腔室壁的层压板表面不透水,可以通过用70%乙醇擦拭在试验之间轻松消毒。加热室的温度最初设定为50°C,并在实验开始前预热至少1小时,以确保在室内均匀加热。每只小鼠都装有直肠温度计,用于在整个实验过程中连续监测体温。一次将一只小鼠放入腔室中,并在第1-10分钟之间将温度保持在50°C。然后将温度升高到55°C第11-20分钟,最后在第21-30分钟升至60°C。这导致小鼠体温的可重复增加速率(图2A)。每次试验都进行了录像,并离线进行了行为分析。
可以很容易地修改加热方案以改变加热室的初始温度和室的加热速率,这反过来又改变了测定过程中小鼠体温升高的速度。因此,与传统方法相比,该方法在设置涉及热诱发癫痫发作的行为筛查方面提供了更大的灵活性。热诱导癫痫发作方案也可用于筛选抗癫痫药物,使突变小鼠对热诱导的癫痫发作更具抵抗力或增加观察癫痫发作的阈值温度。同样,限制性饮食方案(如生酮饮食)对热诱导的癫痫发作的有益影响可以在正常chow喂养与生酮喂养的小鼠中检查。
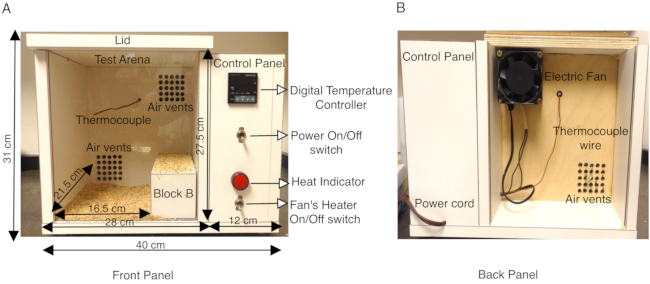
图 1:定制鼠标加热室的说明。(A) 木制鼠标加热室的前面板显示了包含电源开/关开关的侧面控制面板,该开关可打开数字温度控制器、K 热电偶、风扇加热器的开/关开关和热量指示器。盒子的外部尺寸和内部测试竞技场以厘米为单位显示。还显示了用于有效减少测试竞技场表面的木块B。测试竞技场的底部覆盖着玉米棒垫料,以防止老鼠直接接触加热的木制表面。(B)加热室的后面板显示安装在顶部通风口上的风扇和电源线,以向加热室供电。该数字根据Das等人,2021,eNeuro14中的图3进行了修改。请点击此处查看此图的放大版本。
研究方案
所有动物程序均按照加州大学欧文分校机构动物护理和使用委员会(IACUC)的指导方针进行。
1. 热诱导癫痫发作测定的准备
- 打开加热室上的 "开机 "按钮,然后打开 "加热 "按钮。
- 使用数字温度控制器上的键盘将加热室的温度设置为50°C。
- 等待至少1小时以将腔室预热至50°C,然后将第一只鼠标引入腔室。预热可确保腔室内均匀加热。
- 用玉米棒垫料排列小鼠加热室的地板。
- 在加热室前安装一个视频记录摄像机,用于记录每个热诱导的癫痫发作测定试验。
- 用厚厚的薄纸将直径为140毫米的培养皿排成一行,然后将其放在冰上作为冷却垫。
注意:在测定结束时,个体小鼠将被转移到预冷的冷却垫上,以帮助降低其升高的体温。
2.准备小鼠进行热诱导癫痫发作测定
- 选择10只成年小鼠(P30-P40),5只携带癫痫致突变,5只野生型窝伴侣进行热诱导癫痫发作筛查测定。
注意:野生型小鼠,不携带任何引起癫痫的突变,在低于44°C的温度下不表现出热诱导的癫痫发作,并作为对照组。 - 称量用于筛选测定的每只小鼠并记录其体重。只有重15g或以上的小鼠才应该用于测定。
- 在鼠标加热室中一次筛选一个鼠标。
- 在铃铛罐底部使用几滴异氟醚短暂麻醉小鼠10-15秒。
- 将动物从铃铛罐中取出,放在纸巾上。
- 通过检查鼠标对有害的脚趾夹击无反应,确保鼠标完全麻醉。
- 用润滑剂(如凡士林)涂覆直肠温度探头的金属尖端,并将其轻轻插入小于或等于2厘米的深度的鼠标中。
- 用胶带将直肠探针固定在小鼠的尾巴上,这样探针在测定过程中不会脱落。
注意:或者,将动物放在小鼠约束锥中,并插入直肠温度探头。通过贴在尾巴上来固定它。 - 确保直肠探头连接到显示鼠标内部体温的万用表。
- 将动物放在衬有玉米棒垫料的新鲜笼子中,即恢复笼。
- 启动计时器并等待5分钟。观察小鼠,直到它从麻醉中完全恢复,小鼠活跃并梳理。
- 同时,监测小鼠的核心体温,直到其稳定在35-36°C。
- 在5分钟结束时,注意鼠标的体温。这是时间"0"分钟时的初始体温。
注意:如果小鼠的核心体温低于35°C,请等待额外的时间让动物从麻醉诱导的体温过低中恢复过来。 - 快速,将单个鼠标转移到预热的鼠标室中。这标志着实验试验的开始。在给定时间仅筛选一个鼠标。
3. 热诱导癫痫发作测定
- 将鼠标轻轻地放在预热的鼠标加热室的地板上后,关闭有机玻璃门并启动相机进行视频记录实验。
- 启动秒表。在实验期间,以1分钟的间隔从直肠温度计记录小鼠的体温。
- 每隔一段时间,增加小鼠热室的温度,使小鼠的体温以0.25-0.5°C/min的速度升高。
注意:体温的快速升高可导致中暑或死亡,应避免。 - 按照该协议,每10分钟将小鼠加热室的温度提高5°C,如图 2A所示。
- 在9.5分钟时,将加热室的温度设置为55°C,以在第 10分钟之前将加热室的温度稳定到55°C,如数字温度显示屏上所示。
- 同样,在19.5分钟时将温度升高至60°C,以使热室的温度在第 20分钟时稳定在60°C。每次癫痫筛查试验持续30分钟。
- 如果小鼠有癫痫发作(发声、显示头部点头、前肢阵挛、后肢伸展、侧跌或经历全身强直/阵挛抽搐),请记录以下信息。
- 从直肠温度计记录癫痫发作期间小鼠的体温(癫痫发作阈值温度)。
- 记录癫痫发作行为特征,如头部点头、前肢阵挛、后肢伸展、侧倒和/或小鼠显示的全身强直/阵挛发作 (GTCS)。
- 快速但轻轻地从腔室中拿起鼠标,并将其放在步骤1.6中准备的冷却垫上。
注意:如果小鼠正在经历Racine鳞片5癫痫发作并表现出不受控制的跳跃,则可能很难从加热室中捡起动物并将其转移到外面的冷却垫上。然而,典型的热诱发癫痫发作持续30秒至60秒,因此,应将小鼠从热室中取出,并在热诱发癫痫发作开始后60秒内放在冷却垫上。 - 等待小鼠体温降至36-37°C,然后再将其转移到恢复笼中。一次只能将一只鼠标放在恢复笼中。
注意:不要将尚未用于热诱导筛选的小鼠与已经经历过热诱导癫痫发作实验试验的小鼠混合。 - 轻轻而小心地,用一把剪刀剪开小鼠尾巴和直肠探针之间的胶带,从小鼠身上取下直肠探针。
- 用70%酒精和软组织湿巾擦拭直肠探头的金属尖端,以使其为下一次试验做好准备。
- 在恢复笼中继续观察小鼠,直到它恢复正常活动(行走,梳理等),然后将小鼠返回其家庭笼子。这标志着该小鼠实验试验的结束。
- 记录测定后动物的状态 - 活着,并从测试会话中恢复或死亡。涉及不受控制的跳跃和全身性强直/阵挛发作的高强度癫痫发作有时可导致小鼠死亡。
- 如果小鼠在30分钟的观察期内没有经历热诱导的癫痫发作或小鼠的体温达到44°C,则将小鼠从加热室中取出并放在冷却垫上,直到小鼠的体温恢复到36-37°C。
- 将鼠标加热室的温度重置为50°C,并允许其平衡,直到数字温度控制器上的显示温度显示为50°C。
- 在单个小鼠试验之间更换玉米棒垫料。
- 按照第 2 节中所述,准备下一个鼠标进行筛选试验,并重复第 3 节中的步骤。
4. 对动物实施安乐死
- 虽然大多数动物在热诱发的癫痫发作后恢复,但根据我们的经验,一些小鼠在热诱发的癫痫发作的24-48小时内在家中笼子里经历SUDEP(EPilepsy中突然不明原因的死亡)。在30分钟试验结束后,对所有小鼠分别进行热诱导癫痫发作的筛查后,根据该机构的IACUC指南对所有小鼠实施安乐死。
5. 分析热诱发的癫痫发作数据
- 完成对一组动物的筛选后,使用以下公式计算给定基因型中显示癫痫发作的小鼠的百分比:
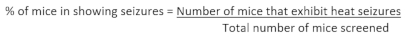
- 通过平均表现出热诱发癫痫发作的基因型中所有小鼠的癫痫发作阈值温度(在步骤3.7中注明)来估计给定基因型内小鼠的平均癫痫发作阈值温度。
- 虽然仍然对身份和基因型视而不见,但在计算机屏幕上进行热诱导的癫痫发作测定筛选期间,重播每只小鼠的视频记录,以评估癫痫发作的严重程度。
- 通过使用先前研究中描述的改良的Racine量表13 ,对表现出热诱导癫痫发作行为的个体小鼠给予评分13,14。有关详细信息,请参见 表 1 。
- 如果一只老鼠在经历热诱发的癫痫发作时,只显示点头,给它2分。如果一只老鼠开始癫痫发作时会点头,但也有前肢阵挛,摔倒和/或跳跃,则得分为5分。
- 如上所述,使用修改后的Racine scale13 记录每只小鼠的最高分。
- 绘制给定基因型中所有小鼠表现出的最大拉辛评分的散点图。
- 统计比较不同小鼠组的最大拉辛评分,作为确定行为癫痫发作(如热诱发癫痫发作)严重程度的方法。
注意:Racine评分有助于比较不同突变小鼠组或基因型之间的癫痫发作特征。预计野生型小鼠不会经历热诱导的癫痫发作,并且不必考虑用于Racine评分比较。 - 基于实验设计,进行适当的统计分析,以确定野生型和突变小鼠之间表现出癫痫发作的小鼠百分比及其平均癫痫发作阈值温度值是否彼此显着不同。
| 拉辛得分 | 癫痫发作特征 | ||
| 0 | 无癫痫发作 | ||
| 1 | 嘴巴和面部动作 | ||
| 2 | 点头 | ||
| 3 | 前肢阵挛,通常为一肢 | ||
| 4 | 前肢阵挛伴饲养 | ||
| 5 | 全身强直阵挛发作、饲养、跳跃、摔倒 | ||
表1:拉辛得分。
结果
具有热性惊厥突变的动物模型预计将在升高的体温下经历热诱发的癫痫发作,而不会在野生型猫砂伴侣中诱发癫痫发作。SCN1A 突变与热性惊厥有关,包括 K1270T GEFS+ 患者,他们同时出现发热性和无发热性全身性癫痫发作7。我们筛选了CRISPR生成的SCN1A K1270T GEFS +突变小鼠,这些小鼠最近在一项研究14 中描述了两种遗传背景中的热发作 - 癫痫发作抵抗性129X1 / SvJ(129X1)和癫痫发作易感C57BL / NJ(B6N)背景。小鼠热室中年龄匹配的野生型凋落物配偶不携带任何GEFS +突变,因此预计不会表现出热诱导的癫痫发作,作为对照组。通过绘制测定期间每分钟记录的小鼠的平均体温来评估随时间变化的速率。在各自的129X1和B6N遗传背景中测试的杂合突变小鼠和野生型凋落物伴侣之间的体温变化率没有差异(图2B,C)。这表明K1270T GEFS +杂合突变小鼠的体温调节没有改变。
来自129X1(n = 15)或B6N(n = 9)遗传背景的所有杂合突变小鼠都表现出热诱导的癫痫发作(图2D)。在129X1富集背景(n = 13)中,没有野生型小鼠表现出热诱导的癫痫发作(图2D)。相比之下,在癫痫发作敏感的B6N背景下测试的小鼠中有三分之一(n = 9只小鼠中的3只)表现出热诱导的癫痫发作。统计比较表明,在129X1和B6N遗传背景中,表现出热诱导癫痫发作的杂合突变小鼠的百分比显着高于它们各自的野生型对应小鼠(图2D,Fisher的精确测试,129X1 p <0.0001;B6NJ p = 0.009)。129X1和B6N遗传背景的杂合突变小鼠之间的平均癫痫发作阈值温度相似。129X1突变小鼠的平均癫痫发作阈值温度为42.6±0.20°C,与B6N小鼠42.7±0.06°C的平均癫痫发作阈值温度没有显着差异(图2E;双尾不成对的学生 t检验, p = 0.782)。值得注意的是,3只表现出热诱发癫痫发作的B6N野生型小鼠的平均癫痫发作阈值温度为43.7±0.08°C,明显高于B6N杂合突变小鼠显示的平均癫痫发作阈值42.7±0.06°C(图2E,双尾不成对学生 t检验, p <0.0001)。
腔室的有机玻璃前部可以在测定过程中进行连续的视频记录,以后可用于在改良的Racine量表上对每只小鼠的癫痫发作严重程度进行评分,如前所述14,20。在典型的测定过程中,杂合子突变小鼠将显示热诱导的癫痫发作,伴有发声和/或点头(Racine评分2),并且当体温达到约42°C时,迅速转变为前肢阵挛,侧落,跳跃,后肢伸展和/或全身强直/阵挛发作(Racine评分3-5)。 最高拉辛评分代表了突变小鼠中最严重的热诱导癫痫发作行为。129X1富集背景(n = 15)中杂合突变小鼠的最大Racine评分与B6N(n = 9)遗传背景中的杂合突变小鼠没有差异(图2F;曼-惠特尼检验, p >0.9999)。这表明K1270T GEFS+突变小鼠中热诱导的癫痫发作行为特征与菌株背景无关。
综上所述,数据表明,所有突变小鼠都以与菌株无关的方式表现出具有相似频率,癫痫发作阈值温度和行为癫痫发作严重程度的热诱导癫痫发作。大多数野生型凋落物配偶在44°C或以下不表现出这种癫痫发作。 在癫痫发作敏感的B6N背景中,约有三分之一的野生型对照小鼠确实表现出热诱导的癫痫发作(可能是由于遗传背景效应),但与相同背景中的突变小鼠相比,癫痫发作阈值温度显着更高。这些结果表明,B6N遗传背景中的突变小鼠由于携带 SCN1A GEFS +突变,在较低的温度阈值下容易受到热诱导的癫痫发作的影响。因此,使用该协议,人们可以评估癫痫突变小鼠的热诱发性癫痫发作,并与野生型窝交配小鼠区分开来,后者要么不经历热诱导的癫痫发作,要么在显着更高的温度下显示热癫痫发作。
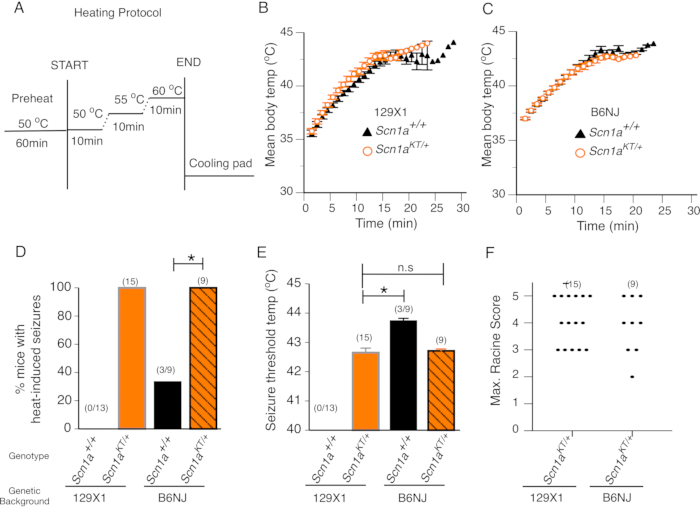
图2:突变小鼠表现出热诱导的癫痫发作。(A)用于小鼠热诱导癫痫发作行为筛查的加热方案。(B-C)野生型(Scn1a+/+ - 黑色三角形)和杂合突变体(Scn1aKT/+ - 橙色圆圈)小鼠的平均体温分别为129X1和B6N。(D)在两种遗传背景中表现出热诱发癫痫发作的小鼠的百分比。野生型(Scn1a +/+)和杂合子(Scn1aKT/+)小鼠分别由黑色和橙色条表示。129X1和B6N背景中的杂合突变体分别以橙色实心条和带有黑色条纹的橙色条显示。(E)两种菌株中野生型(Scn1a +/+)和杂合突变体(Scn1aKT/+)小鼠热诱导癫痫发作的癫痫发作温度阈值。(F)杂合子(Scn1aKT / +)小鼠在两种遗传背景中表现出的热诱导癫痫发作的最大拉辛评分的散射分布。每个点代表单个鼠标中拉辛的最大分数。每个基因型中的动物数量显示在括号内。面板 B-F 中显示的数据均值± S.E.M。该数字根据Das等人,2021,eNeuro14中的图3进行了修改。请点击此处查看此图的放大版本。
讨论
我们描述了一种简单有效的方案来筛查小鼠中热诱发的癫痫发作的发生,其行为相当于人类患者的热性惊厥。该测定评估几个参数 - 包括显示癫痫发作的小鼠百分比,癫痫发作阈值,拉辛量表上癫痫发作的严重程度,以比较对照和测试小鼠组对体温升高的敏感性。
该协议中的一个关键步骤涉及增加腔室中的热量,同时持续监测小鼠的体温。在这些测定中,小鼠将经历的最高体温必须为44°C,因为野生型动物可以在体温>44°C时经历热诱导的癫痫发作。 全身麻醉或镇痛药预处理可能会降低动物的核心体温或干扰体温调节,这反过来又会混淆癫痫发作阈值温度数据收集。因此,在30分钟的试验窗口内,不能为该筛选方案下的小鼠提供这些试剂。所有程序必须得到该机构IACUC委员会的批准。为了确保在测定过程中连续监测小鼠的核心体温,请将直肠温度探针牢固地贴在小鼠的尾巴上。如果在测定过程中,即使在增加小鼠腔室的温度后,发现小鼠体温仍长时间保持不变,请确保直肠温度探针没有从小鼠中出来或松散地附着在尾巴上。
小鼠模型的遗传背景可以影响对SCN1A突变和药理学诱导的癫痫发作的敏感性18,25,26,27。如上述结果所述,小鼠的遗传背景会影响它们对热诱导的癫痫发作的易感性。 Scn1a K1270T GEFS +突变小鼠在两种遗传背景 - 129X1和B6NJ中进行测试,并且在癫痫发作敏感的B6NJ背景下,一小部分野生型小鼠(33%)也被观察到经历热诱导的癫痫发作。然而,与杂合子突变体 Scn1aKT / + 小鼠相比,B6NJ野生型小鼠在显着更高的温度阈值下经历了热诱导的癫痫发作。这证实了CRISPR敲入引入的基因突变(Scn1a K1270T)使突变小鼠更容易受到体温过高诱导的癫痫发作的影响。
采用此协议有几个优点,总结如下。首先,与使用干燥空气流或加热灯不同,在封闭空间内设置的温度控制强制空气为实验者提供了对以所需速率加热测试竞技场的更多控制。加热方案中的步骤可以很容易地修改,以增加/减少起始温度,每个步骤的持续时间等,以筛选更重或更大的啮齿动物(如大鼠)的老年小鼠。其次,通过连接的直肠探针连续监测小鼠体温,在整个测定过程中提供有关个体小鼠体温变化速率的宝贵信息。这使得实验者能够密切观察小鼠的温度变化率不超过0.25-0.5°C / min(这对动物来说可能是有压力的),当将此方案应用于其他测试领域时。重要的是,不同小鼠组随时间变化的体温变化率可以揭示它们的体温调节能力,并且可能有助于了解引起突变的热性惊厥是否也改变了小鼠的体温调节。第三,连续体温监测确保使用此方案的癫痫发作阈值温度测量是准确的,因为它们与小鼠经历的第一次癫痫发作同时记录。如果在将动物带出试验场后没有连续监测动物的体温或测量癫痫发作阈值温度,则癫痫发作阈值可能会因癫痫发作后处理小鼠所花费的时间而变化。最后,这种方法避免了使用侵入性方法在小鼠中诱导发烧(通过注射病原体)以模仿人类患者的热性惊厥的需要。
该协议的局限性之一是很难筛查幼年(年龄小于P30)小鼠的热诱导癫痫发作。该协议旨在筛查成年小鼠(P30-P40及以上)对热或高热诱导的癫痫发作的敏感性。根据我们的经验,年轻的野生型小鼠,特别是那些体重低于15克的小鼠,更有可能经历热诱导的癫痫发作,这可能是由于不发达的体温调节机制,生理热应激或两者兼而有之。因此,使用该协议对幼年小鼠进行热诱导的癫痫发作筛查并不理想。
未来的研究结合了脑电图监测,同时将小鼠置于热诱发的癫痫发作中,可以揭示热诱发癫痫发作的脑电图癫痫发作模式,类似于以前的研究19。通过结合光遗传学方法和收获脑组织后基于免疫组织化学的研究,可以追踪小鼠大脑中特定区域的神经元活动。此外,限制性饮食(如生酮饮食)对减少热性惊厥的影响可以通过对生酮喂养的小鼠和正常chow喂养的小鼠进行热诱导的癫痫发作方案来评估。同样,可以开发癫痫药物筛选范例来测试和鉴定与载体喂养或对照小鼠相比,在药物喂养或治疗的小鼠中改善或抑制热诱导癫痫发作的候选抗癫痫药物。
披露声明
作者声明没有利益冲突。
致谢
我们要感谢Connor J. Smith在构建定制的鼠标热室方面的帮助。我们感谢O'Dowd实验室成员Lisha Zeng和Andrew Salgado在测定开发的早期阶段标准化加热方案的帮助。我们还感谢Danny Benavides和Kumar Perinbam为手稿录制了部分实验过程。这项工作得到了NIH授予D.O.D.的赠款(NS083009)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Axial fan | Farnam | AF20-200-120-xx10-3.1 | Farnam custom products -Axial Fan Heater with Fan |
| Digital temperature controller | Inkbird | ITC-100RH | Inkbird digital PID temperature controller ITC-100RH with K thermocouple |
| Mouse rectal temperature probe | ThermoWorks, Braintree Scientific, Inc | RET-3 | Mouse rectal temperature probe with thermometer |
参考文献
- Hirtz, D., et al. How common are the 'common' neurologic disorders. Neurology. 68, 326-337 (2007).
- Catterall, W. A. Sodium Channel Mutations and Epilepsy. Jasper's Basic Mechanisms of the Epilepsies. , Center for Biotechnology Information. US. Internet (2012).
- Mantegazza, M., Broccoli, V. SCN 1A /Na V 1.1 channelopathies: Mechanisms in expression systems, animal models, and human iPSC models. Epilepsia. 60, (2019).
- Stafstrom, C. E. Persistent Sodium Current and Its Role in Epilepsy. Epilepsy Currents. 7, 15-22 (2007).
- Schutte, S. S., Schutte, R. J., Barragan, E. V., O'Dowd, D. K. Model systems for studying cellular mechanisms of SCN1A-related epilepsy. Journal of Neurophysiology. 115, 1755-1766 (2016).
- Wei, F., et al. Ion Channel Genes and Epilepsy: Functional Alteration, Pathogenic Potential, and Mechanism of Epilepsy. Neuroscience Bulletin. 33, 455-477 (2017).
- Abou-Khalil, B., et al. Partial and generalized epilepsy with febrile seizures plus and a novel SCN1A mutation. Neurology. 57, 2265-2272 (2001).
- Zhang, Y. -H., et al. Genetic epilepsy with febrile seizures plus: Refining the spectrum. Neurology. 89, 1210-1219 (2017).
- Patterson, K. P., et al. Enduring memory impairments provoked by developmental febrile seizures are mediated by functional and structural effects of neuronal restrictive silencing factor. Journal of Neuroscience. 37, 3799-3812 (2017).
- Rossi, M. A. SCN1A and febrile seizures in mesial temporal epilepsy: An early signal to guide prognosis and treatment. Epilepsy Currents. 14, 189-190 (2014).
- Zhang, Y., et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet. Epilepsy Research. 145, 163-168 (2018).
- Meng, H., et al. The SCN1A mutation database: Updating information and analysis of the relationships among genotype, functional alteration, and phenotype. Human Mutation. 36, 573-580 (2015).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Das, A., et al. Interneuron dysfunction in a new mouse model of SCN1A GEFS. eNeuro. , (2021).
- Kalume, F., et al. Sudden unexpected death in a mouse model of Dravet syndrome. Journal of Clinical Investigations. 123, 1798-1808 (2013).
- Martin, M. S., et al. Altered function of the SCN1A voltage-gated sodium channel leads to gamma-aminobutyric acid-ergic (GABAergic) interneuron abnormalities. Journal of Biological Chemistry. 285, 9823-9834 (2010).
- Rubinstein, M., et al. Dissecting the phenotypes of Dravet syndrome by gene deletion. Brain. 138, 2219-2233 (2015).
- Yu, F. H., et al. Reduced sodium current in GABAergic interneurons in a mouse model of severe myoclonic epilepsy in infancy. Nature Neuroscience. 9, 1142-1149 (2006).
- Dutton, S. B. B., et al. Early-life febrile seizures worsen adult phenotypes in Scn1a mutants. Experimental Neurology. 293, 159-171 (2017).
- Cheah, C. S., et al. Specific deletion of NaV1.1 sodium channels in inhibitory interneurons causes seizures and premature death in a mouse model of Dravet syndrome. Proceedings of the National Academy of Science U.S.A. 109, 14646-14651 (2012).
- Oakley, J. C., Cho, A. R., Cheah, C. S., Scheuer, T., Catterall, W. A. Synergistic GABA-enhancing therapy against seizures in a mouse model of Dravet Syndrome. Journal of Pharmacology and Experimental Therapeutics. 345, 215-224 (2013).
- Ricobaraza, A., et al. Epilepsy and neuropsychiatric comorbidities in mice carrying a recurrent Dravet syndrome SCN1A missense mutation. Scientific Reports. 9, (2019).
- Warner, T. A., Liu, Z., Macdonald, R. L., Kang, J. -Q. Heat induced temperature dysregulation and seizures in Dravet Syndrome/GEFS+ Gabrg2+/Q390X mice. Epilepsy Research. 134, 1-8 (2017).
- Eun, B. -L., Abraham, J., Mlsna, L., Kim, M. J., Koh, S. Lipopolysaccharide potentiates hyperthermia-induced seizures. Brain and Behavior. 5, 00348(2015).
- Miller, A. R., Hawkins, N. A., McCollom, C. E., Kearney, J. A. Mapping genetic modifiers of survival in a mouse model of Dravet syndrome. Genes Brain and Behavior. 13, 163-172 (2013).
- Mistry, A. M., et al. Strain- and age-dependent hippocampal neuron sodium currents correlate with epilepsy severity in Dravet syndrome mice. Neurobiology of Disease. 65, 1-11 (2014).
- Ogiwara, I., et al. Nav1.1 localizes to axons of parvalbumin-positive inhibitory interneurons: a circuit basis for epileptic seizures in mice carrying an Scn1a gene mutation. Journal of Neuroscience. 27, 5903-5914 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。