Method Article
使用光学镊子测量禁闭中的亚细胞力学的直接力
摘要
在这里,我们提出了一种方案,用于研究分离的胚胎斑马鱼细胞在三维限制下的细胞内力学性质,并通过光学陷阱进行直接力测量。
摘要
在多细胞生物体的发育过程中,单个受精细胞分裂并产生具有不同功能的多个组织。组织形态发生与单细胞水平的分子和结构变化密切相关,导致亚细胞力学性质的变化。因此,即使在同一个细胞内,不同的细胞器和隔室对机械应力的抵抗也不同。和机械转导途径可以主动调节其机械性能。因此,细胞适应组织生态位微环境的能力部分是由于感知和响应机械应力的能力。我们最近提出了一种新的机械感觉范式,其中核变形和定位使细胞能够测量物理3D环境,并赋予细胞本体感觉来解码细胞形状的变化。在本文中,我们描述了一种测量塑造活细胞内细胞核的力和材料特性的新方法,例如贴壁细胞和机械限制细胞。测量可以使用细胞内的光学陷阱进行非侵入性测量,并且通过对光动量的免校准检测可以直接获得力。这允许独立于细胞表面变形测量细胞核的力学,并允许解剖外感受和内感受机械转导途径。重要的是,捕获实验可以与光学显微镜相结合,使用细胞骨架,钙离子或核形态的荧光成像来研究细胞反应和亚细胞动力学。所提出的方法易于应用,与用于力测量的商业解决方案兼容,并且可以轻松扩展以研究其他亚细胞区室的机制,例如线粒体,应力纤维和内体。
引言
组织形态发生是一个复杂的过程,其中生化信号和物理力在时空协调。在发育中的胚胎中,生化信号传导因子的梯度决定了命运规范并确保正确的组织模式1,2。同时,内在和外在力在构建胚胎结构中发挥作用3,4。在这种情况下,细胞皮层力学的影响已被广泛研究5,6。形态发生过程中机械化学过程之间的紧密互连依赖于单个细胞的特性来感知和响应其组织微环境中的机械力。因此,细胞 通过 力敏感的亚细胞和分子元素的存在来解码机械信号,这些元素将机械信息转换为控制细胞行为,细胞命运和细胞力学的特定信号通路。
发育过程的一个标志是细胞组织成组以构建多细胞结构。因此,单个细胞很少重新排列和单独移动,而是在紧密的社会拓扑中相关,其中它们表现出集体行为,例如细胞上迁移7,(不)干扰过渡8,9 或囊胚压实10。细胞内和细胞之间产生的机械力是指导集体细胞动力学的重要线索7,11。但是,即使细胞单独移动,例如在组织膜或狭窄的组织生态位之间挤压的祖细胞,它们在三维环境中导航时也会经历广泛的各向异性机械力。这些对细胞的机械应力对细胞行为有深远的影响12,13。已经研究了几种机制,这些机制收敛于细胞核作为主要的机械转导元件14,15,在致密的3D组织环境中迁移过程中作为被动或主动机械元件15,16。
我们最近提出了一种机制,使细胞能够使用细胞核作为弹性细胞内机械仪表来测量形状变形12。细胞核是细胞中最大的细胞器,当细胞在机械拉伸、限制或渗透应力下极化、迁移或改变形状时,细胞核会经历大变形16,17,18,19。我们发现,核包膜的拉伸以及细胞核的细胞内定位为细胞提供了有关细胞变形的大小和类型(例如细胞压缩与细胞肿胀)的信息。细胞核的拉伸与内核膜(INM)的展开有关,INM促进INM处的钙依赖性cPLA2(胞质磷脂酶A2)脂肪酶活性,随后释放花生四烯酸(AA)和细胞皮层处肌球蛋白II的快速激活。这导致细胞收缩力增加,变形杆菌细胞迁移超过皮质收缩力阈值6。对细胞变形的机械敏反应发生在不到一分钟的时间内,并且在限制释放时是可逆的,这表明细胞核充当细胞本体感觉的应变片,调节机械应激条件下的适应性细胞行为。这种机械敏感性途径在源自斑马鱼胚胎的祖干细胞中具有活性,无论是在多能细胞还是谱系细胞12 中,并且在不同的物种和细胞系中都是保守的20。
除了作为细胞力学传感器的核特性外,核结构和力学在发育过程中以及响应细胞命运规范21时受到内在调节,因此调整了细胞机械灵敏度22,23。其后果可能是核遵守情况发生变化,从而允许形态变化和从迁移前状态过渡到迁移状态,反之亦然8。
已经应用了几种测量细胞核力学的技术,例如原子力显微镜24,25,微量移液管抽吸26,27,微流体技术28和微针29。然而,这些技术中的许多技术都是侵入性的,因为整个细胞必须变形,限制了细胞核本身的机械特性和力依赖性反应的测量。为了规避细胞表面及其机械敏感细胞皮层30的同时变形,在各种背景下研究了分离的细胞核31,32。然而,不能排除核隔离与机械核性质及其调节的变化有关(参考文献24 和自己未发表的观测结果)。
光学镊子(OT)是一种多功能技术,允许在细胞机械生物学上进行大量实验,并有助于我们理解分子机器如何将化学转化为机械能33,34。光学镊子使用紧密聚焦的激光束将光学力施加到折射率高于周围介质的介电粒子上33。这种力可以是数百皮牛顿的数量级,并导致粒子在激光陷阱焦点内的有效限制,从而能够在三维空间中操纵被捕获的粒子。光的使用具有重要的优势,因为测量可以在活细胞内非侵入性地进行。光学操作进一步限制为激光束的陷阱焦点。因此,可以在不刺激周围细胞膜的情况下进行操作,并且不会扰动肌动蛋白皮层或质膜上的机械敏感过程,例如离子通道的力依赖性激活。
光学镊子方法的难点在于使用经典方法精确确定施加到微球上的力,这些方法依赖于基于均分定理的间接力校准或使用定义的斯托克斯阻力来测量激光功率相关的逃逸力35。虽然这些方法在 体外实验中 很容易实现,但它们通常不能被翻译成细胞环境。该领域已经引入了几种依赖于直接力校准的策略,这些策略源自动量守恒的第一原理36,37。与其他力光谱方法不同,力测量是从光动量与任意形状的捕获粒子的局部交换中推导出来的38,39。在我们的实验设置中,直接测量由光学力产生的光动量变化,而无需 原位 陷阱校准40,41,42,43。因此,在粘性环境中(例如细胞内部甚至组织内部)中测量成为可能,并且可以很容易地将力量化到pN水平。
在该协议中,我们描述了一种测定,用于机械地操纵细胞内细胞器或结构,并通过光学镊子设置定量评估其机械性能。该装置被集成到旋转盘荧光显微镜中,可以对细胞行为或细胞内动力学进行平行成像。该测定允许表征特定细胞区室(如细胞核)的机械性能,同时研究由于变形本身而导致的分子信号通路的可能机制反应和激活。此外,与细胞核(n~1.35)与细胞质(n~1.38)的内在折射对比44 相比,聚苯乙烯珠的折射率(n = 1.59)要高得多,因此细胞内注射的微珠的光学捕获允许增加压痕力。所提出的策略可以很容易地适应其他细胞内结构和细胞器的研究,以及其他涉及主动微流变学的方法,使用多个光学陷阱同时探测相同/不同的亚细胞结构,以及针对活胚胎中细胞力学生物学的测量。
研究方案
所有使用的协议均已获得机构动物护理和使用伦理委员会(PRBB-IACUEC)的批准,并根据国家和欧洲法规实施。所有实验均按照3R原则进行。斑马鱼(Danio rerio)如前所述。
1. 分离出的原代胚胎斑马鱼祖细胞干细胞的制备
- 微量移液和琼脂糖制备
注意:有关完整的斑马鱼胚胎显微注射方案,请参见参考文献45。- 使用微量移液器拉拔器,拉动1.0 mm玻璃毛细管以获得两根针45。将未使用的针头存放在连接到橡皮垫上的150毫米培养皿中,或存放在由内而外的实验室胶带环中,以保护薄尖端在运输过程中免受损坏。
- 在标准厨房/实验室微波炉中将1%的超纯琼脂糖在E3(5mM NaCl,0.17mM KCl,0.33mM CaCl2,0.33mM MgSO4)中熔化10秒。反复加热混合物短时间(几秒钟),直到琼脂糖融化。
- 当琼脂糖完全融化时,让它短暂冷却,然后将其倒入10厘米的培养皿中。在琼脂糖的顶部缓慢加入三角形显微注射模具(见 材料表),避免出现气泡。不要推动模具,确保它停留在琼脂糖表面。
- 当琼脂糖完全凝固时,通过施加轻柔的力非常缓慢地去除三角形霉菌,以避免琼脂糖的任何断裂。板可以在4°C下倒置储存2-4周。
- 在显微注射前30分钟,将板从冰箱中取出,加入预热至28°C的E3,使其在室温下稳定。
- 注射液混合物制备
- 为了制备注射混合物,在不含RNase的水中以1:5的比例稀释1μm微珠(聚苯乙烯,非荧光)。
- 制备mRNA用于荧光标记物的瞬时表达或重组基因构建体的表达和/或以所需浓度共注射吗啉。
注意:用于将微珠与每个胚胎100 pg的mRNA一起共注射的典型注射混合物用于标记,例如,具有H2A-mCherry的细胞核是:1μL珠子+ 1μLmRNA(储备浓度为1μg/ μL)+ 2.5μLRNA游离水+ 0.5μL酚红(储备溶液0.5%,酚红不是强制性的;它用于更好地可视化注射液滴,但未标记的注射对于有经验的实验者来说,下降也是可见的)。RNA注射也可用于选择注射的胚胎。可以注射荧光微珠,而不是非荧光,以可视化它们。
- 显微注射针加载和校准
- 使用 时间门控 选项打开微型注射器。此设置对于正确校准注射量非常重要。将门控时间设置为大约 500 ms。
- 使用微型装载机移液器将3μL注射混合物倒入针中。
- 将针头插入显微操作器并密封。检查显微操作器是否处于良好位置,是否有足够的自由度在注射板上沿x-y方向移动。
- 使用千分尺载玻片(5 mm/100分度)测量液滴尺寸,在top45 上滴一滴矿物油,然后将一滴注射混合物直接喷射到矿物油中。
- 用锋利的镊子以陡峭的角度裁剪针头,以产生尖锐的尖端。将液滴尺寸调整为 0.1 mm,相当于 0.5 nL 的注入材料。
注意:如果通过切割针头,超过此体积,建议使用新针重新执行校准过程。微注射器的浇口时间可以稍微调整,以匹配滴量;然而,较短的门控时间对应于大针径,这可能会损害胚胎。
- 斑马鱼胚胎在单细胞阶段的显微注射
- 在受精后不久收集斑马鱼胚胎,以便在第一次细胞分裂发生之前将珠子混合物直接微注射到单细胞(受精卵)阶段的胚胎中。
注意:这确保了微球的适当分布和分离的卵裂球的足够高的产量,每个细胞在进行实验的后期发育阶段(胚泡 - 胃裂殖质阶段)至少有一个微球。如果细胞内有两个球体,仍然可以进行压痕实验,但应排除没有微球的细胞(即使可以进行没有球体的压痕)。该协议中使用AB野生型菌株,但可以使用任何其他菌株,例如TL。 - 使用塑料巴斯德移液管将单细胞阶段胚胎(受精卵)置于预热的三角形1%琼脂糖模具中,如图 1A所示。
- 用相同的移液器去除多余的培养基,以避免胚胎漂浮在周围。 通过 刷子将胚胎轻轻推入三角形模具中。在胚胎之间保留一些空间,以促进正确的方向(图1B)。
- 用刷子轻轻地对齐胚胎,使胚胎横向定向,受精卵的一个细胞清晰可见,如图 1B所示。当胚胎的一个细胞朝向针方向( 通过 胚胎的动物极注射)或相反的方式面向蛋黄细胞( 通过 胚胎的植物极注射)时,达到理想的显微注射方向,如图 1C所示。
- 用一只手握住盘子,用另一只手使用显微操纵器控制器定位针尖。将针尖朝向胚胎。
- 刺穿绒毛膜并用针头进入单细胞胚胎,同时通过立体显微镜监测该过程。确保针头的正确位置,并在注射后,注射液滴的正确位置 如图1C所示。
- 对所有胚胎重复:向上移动针头,将培养皿与胚胎一起滑动,直到下一个胚胎居中,放下针头并注射。
- 一旦注射了整套胚胎,通过冲洗一些E3将它们从琼脂糖霉菌/培养皿中取出,然后使用塑料巴斯德移液器将它们放入新的培养皿中。建议在注射板上放置足够的培养基,以避免在显微注射过程中干燥胚胎。
- 重复该过程,直到注射所需数量的胚胎。胚胎必须处于一个细胞阶段,以确保磁珠的最大和均匀扩散。
注意:该程序针对早期胚芽孢杆菌胚胎进行了优化,如果要研究不同的发育阶段,则可能需要优化。 - 将注射的胚胎置于28-31°C的培养箱内约4小时或直到所需的阶段(图1D),然后继续进行原代细胞培养方案。
注意:可选地,让胚胎发育超过胚泡阶段(或所需的测量时间点),以确保存活并排除毒性伪影。在幼虫阶段,用三卡因在0.75%琼脂糖中安装麻醉的幼虫,并对各种组织中微球的分布进行成像。要制备储备溶液,将400mg三卡因粉末混合在97.9mL蒸馏水中,约2.1mL的1 M TRIS碱(pH 9),并调节至pH 7。该溶液可以储存在4°C。 要使用三卡因作为麻醉剂,请将4.2毫升储备溶液稀释在100毫升鸡蛋培养基(或所需的培养基)中;在这种情况下,使用了E3。有关详细信息,请参阅参考46 。
- 在受精后不久收集斑马鱼胚胎,以便在第一次细胞分裂发生之前将珠子混合物直接微注射到单细胞(受精卵)阶段的胚胎中。
2. 单细胞制备和染色
- 使用塑料巴斯德移液器将球体阶段胚胎(4 hpf,受精后数小时)置于玻璃培养皿中。选择对注射的珠子的信号呈阳性的胚胎,并且在mRNA注射的情况下表达荧光蛋白的胚胎。一些胚胎可能显示出高珠簇,可以排除。
- 使用镊子手动去脉对胚胎进行去脉。使用玻璃巴斯德移液器将约10-15个胚胎转移到1.5 mL反应容器中。
注意:当胚胎被剥离时,它们附着在塑料上,并且需要使用玻璃器皿。作为玻璃板的替代品,可以使用带有1%琼脂糖薄层的塑料培养皿。与酶促Pronase处理相比,应首选手动去角蛋白,以防止对细胞表面蛋白的蛋白水解损伤以及细胞和组织机械特性的潜在变化,从而防止延长恢复时间47。
- 使用镊子手动去脉对胚胎进行去脉。使用玻璃巴斯德移液器将约10-15个胚胎转移到1.5 mL反应容器中。
- 除去E3培养基并加入500μL预热的CO2非依赖性组织培养基(DMEM-F12;与L-谷氨酰胺和15mM HEPES,不含碳酸氢钠和酚红,补充10单位青霉素和10mg / L链霉素)。
注:除非使用显微镜培养箱,否则不要使用 CO2 依赖性培养基。例如,在碳酸盐缓冲条件下使用 RPMI 会导致培养基 pH 值的变化,并可能影响细胞存活。另一个关键方面是避免含有血清的培养基。血清可能含有溶血磷脂酸(LPA),这是Rho / ROCK途径的有效激活剂,能够控制祖干细胞的细胞收缩力和运动性6。培养基的渗透压应保持在300 mOsm,以避免可能干扰核形态或力学的渗透压挑战12。 - 通过轻轻摇动管手动解离细胞。确保管内内容物变得浑浊,眼睛看不到大块。避免气泡的形成,以尽量减少细胞的损害和损失。
- 以200× g 离心3分钟。颗粒必须清晰可见。
- 取出上清液,然后按照下面详述的步骤之一进行操作。
- 如果不需要染色,加入500μLDMEM。用200 μL移液器轻轻重悬,将液体射流射向沉淀。不要对细胞施加过多的剪切力。起泡表明细胞受损。
- 为了用DNA染料(如Hoechst)标记细胞核,将0.5μLDNA-Hoechst(储备液2mg / mL)混合在1,000μL DMEM中,以获得1μg/ mL的最终浓度。将500μL该染色溶液加入细胞中并轻轻重悬。在黑暗中孵育7分钟。
- 要用荧光化学钙指示剂Calbryte-520染色细胞,将Calbryte-520加入DMEM中的5μM浓度。在黑暗中孵育20分钟。
注意:步骤 2.5.2 和 2.5.3 中指示的协议已针对这些特定产品进行了优化。其他染色可以使用制造商指定的协议进行。
- 使用与步骤2.4中相同的设置再次离心;除去上清液,并将细胞轻轻重悬于50μLDMEM中(用于悬浮样品)或20μLDMEM用于限制细胞。
3. 使用聚二甲基硅氧烷(PDMS)间距制备光学捕获室
注:基于光动量检测的光力测量需要捕获从光学陷阱中产生的所有光40。为了不变校准因子 α (pN/V)的鲁棒性,光力传感器后焦平面(BFP)的光分布必须与光子动量精确对应。这决定了从收集透镜表面到捕获平面的距离约为2 mm,这是光学捕获室的最大高度。
- #1.5玻璃底皿的PDMS旋涂。
注意:以下食谱适用于大约40道菜。由此产生的微室将具有不同的高度,具体取决于是在悬浮或密闭的细胞上进行实验(图1D)。- 将9 mL基础聚合物PDMS和1 mL PDMS固化剂混合在50 mL锥形管中。积极混合两种产品,以确保固化剂的适当分布。
- 使用真空泵对混合物进行脱气以避免气泡。将锥形管引入真空瓶中并排空腔室。等到混合物中没有气泡。
注意:慢慢打开真空吸尘器,以防止PDMS起泡和从猎鹰管中溢出。 - 将玻璃底盘放在旋涂机卡盘上(图2A)。要小心,不要抓挠,指纹或弄脏盘子。用铝箔保护旋涂机盒免受PDMS泄漏的影响。
- 对于用于悬浮细胞实验的OT室,在底部培养皿的中心加入约250μLPDMS混合物,并以750rpm旋转1分钟。PDMS层的高度约为50μm48。
- 对于用于在密闭细胞上进行实验的OT室,加入一小滴PDMS(约50μL),并以4,000rpm旋转5分钟。PDMS层的高度约为10μm。有关如何获得不同 PDMS 厚度的详细协议,请参见参考 48。
- 将PDMS涂层的玻璃底培养皿在70°C下固化1小时。
- 用手术刀在PDMS层上切下1 x 1厘米的正方形,然后用镊子将其剥离(图2C)。在密闭细胞的情况下,用异丙醇洗涤PDMS碎片。
- 腔室涂层,用于悬浮液中轻度附着的细胞的实验
- 以0.5mg / mL加入100μL康佳伐林A(ConA)以覆盖方形腔的整个表面,并使其孵育30分钟。
注意:ConA是一种凝集素,与细胞表面糖结合并将单个细胞耦合到盖玻片表面。 - 取出ConA液滴,并用DMEM介质仔细冲洗表面,不要划伤ConA处理过的表面。
- 将30μL先前制备的样品(步骤2.6)加入孔中,并轻轻重悬以除去任何细胞簇。
- 通过在PDMS轮辋顶部轻轻放置一个22 x 22 mm #1.5盖玻片来关闭腔体(避免让它突然掉落,如果可能的话使用镊子, 图2B,C)。
注:任何盖玻片厚度都适用于上部玻璃盖(收集镜头的工作距离为2 mm)。
- 以0.5mg / mL加入100μL康佳伐林A(ConA)以覆盖方形腔的整个表面,并使其孵育30分钟。
- 用于禁闭细胞实验的腔室准备
- 将10μL含有细胞的溶液滴(步骤2.6)放入方形腔中(图2B)。
- 非常轻柔地,用22 x 22 mm盖玻片夹在样品中,使液滴在整个区域扩散并且不观察到气泡。同样,使用镊子很方便,如图 2C所示,以防止盖玻突然掉落。
4. OT腔室间距的替代选项
注意:如果没有微细加工车间或旋涂机可用,可以遵循这些步骤。
- 用于悬浮细胞实验的腔室准备
注:如果没有可用的旋涂机,可以使用普通的双面透明胶带(高度约100μm)制作垫片。- 切一块双面透明胶带,中间有一个约 10 cm x 10 cm 的正方形孔(尺寸与 PDMS 中的尺寸相同, 图 2B)。
- 将胶带的一个保护层剥离,然后将其取下,然后将胶带的未覆盖面放在#1.5 H玻璃底盘的中心。轻轻按压,使所有表面粘附在玻璃上,同时避免气泡,然后通过剥离胶带去除胶带的剩余保护层。
- 按照步骤 3.2 中的说明进行操作。
- 用于禁闭细胞实验的腔室准备
注意:为了精确地限制细胞,已知直径的单分散微粒可以用作两个盖玻片之间的垫片。- 将10μm聚苯乙烯珠以104 微珠/ μL的浓度加入悬浮细胞中。
- 将10μL含有细胞和微球的溶液滴在22 x 60 mm盖玻片上。
- 非常轻柔地将样品与另一个22 x 60 mm盖玻片夹在中间,使液滴在整个区域扩散并且不观察到气泡。要轻轻地放置上盖玻璃(避免它突然掉落),使用镊子很方便。
- 由于样品会变干,因此建议迅速进行制备。
5. 设置用于细胞内测量的光学陷阱
注:以下步骤针对商用光学镊子平台进行了优化,该平台包括基于声光偏转(AOD)的光学显微操作模块和基于直接检测光动量变化的光学力传感器(图2,参考12,40,49)。该设置的细节和光学元件如图 2F所示。为了观察光学镊子操作过程中的力诱导变形,将Nipkow旋转盘共聚焦显微镜耦合到倒置显微镜的左端口中进行双色荧光成像。在不缺乏通用性的情况下,该协议可以应用于任何配备基于光动量检测的直接力测量的动态OT系统。详细的分步程序可用于构建用于 体内 应用的自制光学梯度陷阱50。基于AOD调制的那些在具有多个陷阱和快速测量的最终实验中脱颖而出51,52。文献中存在几种构建基于光动量的仪器的方案36,39,40,53,并且可以采用任何其他成像方式(微分干涉对比度,宽场荧光等)。
- 光学镊子启动
- 为了优化输出功率稳定性,请在实验前至少30分钟以相当高的功率(例如3 W)打开激光器。
- 打开光学显微操作和力测量单元的电子模块。
注意:应用所有激光安全措施,并且只能使用机构委员会批准的设备。切勿在激光开启时使用光学显微镜的目镜。始终使用经批准的红外防护镜(OD7在950-1080 nm范围内),用落射荧光端口2中的快门阻挡红外激光,并且在步骤5.3之后完成光力传感器对准之前不要执行光学捕获软件。通常,不要使用高反射率的样品,因为背反射可能会对激光造成损坏。 - 使用光学显微操作模块入口处的旋转HWP(图2F)控制陷阱功率。
注:该协议中使用的商用光学显微操作模块已经包含此功能。对于自制光学捕获系统,请集成此工具进行功率控制,以便可以使用更高,更稳定的激光功率。
- 使用空的微室进行校准
- 将一个1 x 1厘米的正方形切到双面透明胶带上,然后将其贴在1毫米厚的显微镜载玻片上。
- 将水加入正方形中,然后用#1.5盖玻片(22 x 22毫米)从顶部关闭。建议加入稍微高一点的水,例如30-40μL,以避免在覆盖的腔室内产生气泡。轻轻擦拭校准室,以防水溢出。
- 光学力传感器的对准
- 将一滴水滴放在60x/1.2水浸物镜上。将校准室放在台上,#1.5盖玻片面向物镜。将焦点集中在下表面,细胞样品最终将在那里。
- 在覆盖样品的上部载玻片顶部加入一滴浸没油(图2D)。小心地放下力传感器单元的收集透镜,直到它接触到油滴。
注意:液滴必须足够大,以便覆盖收集从陷阱中产生的激光的整个透镜。通常,200 μL足以覆盖整个表面并提供稳定的浸入接触。保守并避免过量灌装,因为它可能会泄漏到样品中。 - 按照制造商的光学力传感器对准协议,查看辅助相机上的样品平面图像,该图像将用于定位OT(AUX,图2F)。非常轻柔地降低光学力传感器,直到场停止(FS,图2F-G)与样品平面共轭。这将确保通过光动量变化的样本不变检测进行适当的直接力测量40。
注:将FS关闭得足够近,使其图像小于视场(FOV),因此可见。格外小心,不要将光学力传感器的收集透镜推向样品。光学力传感器的垂直位置也可以通过分析具有定义数值孔径(NA)的光锥在BFP处的捕获光分布来确定。 - 确保油滴中没有气泡;这些可以直接影响力测量。要检查气泡,请将Bertrand透镜就位(BL, 图2G)并观察通过目镜的成像路径。如果可见任何污垢或气泡或需要更多油(图S1A),请用无尘镜片组织清洁镜片和腔室,然后重复步骤5.3.2和5.3.3中的步骤。 图S1B描绘了一条畅通无阻的光路。
- 使用放置在光学力传感器支架上的横向螺钉,将FS居中放入FOV。为获得准确性,请打开FS,使其几乎填满辅助相机上可见的FOV(AUX, 图2F)。
6. 光学镊子优化
注意:直接力测量仅依赖于施加在被捕获粒子上的力所产生的光动量的变化,因此,与间接方法相比,捕获刚度不需要在每次实验之前进行校准。仪器特定的偏转/力因数(α; pN/V,reference41)的转换由制造商校准,因此是实验不变的。然而,由于激光光斑是在70 μm x 70 μm的区域内操纵的,因此步骤6.2-6.5对于确保最佳捕获和功率稳定性至关重要。制造商软件中提供了以下步骤,以便OT以半自动方式在工作区域上进行优化。
- 启动用于相机AUX的OT软件和采集软件。
- 通过单击光学镊子驱动软件的"系统校准"子菜单中的" 步骤 1:电子偏移 "步骤来减去初始电压基线。
- 要在OT工作区域执行疏水阀功率压平,请通过相应地旋转HWP将疏水阀功率设置为其最大值的一半。不要通过改变激光输出来改变陷阱功率,而是使用旋转的HWP(图2F)。单击 "步骤 2:电源 "以启动陷阱功率平坦化的自动例程。
注:这是补偿OT工作区域内陷阱功率变化的关键步骤(图S1D)。一个成功的例程使整个OT工作区域的陷阱功率变化降低到2%,并在2分钟后收敛。 - 要执行陷阱位置校准,请取下红外滤光片,以便激光的光在相机上可见。通过将聚焦到微室下表面的图像平面设置为红外光斑。通过在相机AUX采集软件中调整图像平面(物镜位置)和直方图对比度,获得尽可能小的红外光斑。如果需要,通过旋转HWP来降低光学陷阱的功率(图2F)。单击 步骤3:定位 以启动自动例程或陷阱定位校准。
注意:此例程可实现相机AUX中OT的位置坐标与AOD转向角的精确对应。成功的例程会在几秒钟内生成角度到位置的映射。 - 初始动量补偿
注:光学陷阱在样品上的移动导致BFP处的光动量分布发生变化(图S1E,F)。这导致与工作区域上的激光位置相关的力无关的信号变化,即使陷阱功率已像步骤6.3中那样变平。结果是,由于位置(与作用在光学捕获的磁珠上的实际力无关),力基线会发生变化,需要在每次实验之前进行校正。- 通过旋转HWP来设置实验中将使用的陷阱功率(图2F)。
- 单击"工具"子菜单中的"全局偏移量"选项。这将打开光学镊子软件的"偏移取消"助手,用于校正初始动量基线。
- 单击 "偏移|补偿 以校正位置变体初始动量。
注意:如果在持续的几周内没有修改影响光路,则陷阱功率平坦化(步骤6.3)和位置(步骤6.4)映射将保持不变。因此,我们建议始终使用可能影响激光陷阱路径的相同光学元件组合(二向色镜、滤光片等),或执行新的陷阱功率平坦化程序。关于初始动量补偿(步骤6.5),OT平台的制造商提供了动态校准,必须针对每个新的捕获功率和实验会话进行更改。步骤6.3和6.4必须在步骤5.2中描述的空校准载玻片上进行。在含有细胞或其他物体的样品中,步骤6.5应在没有可能改变OT工作区域中光散射的物体的情况下进行。
- 或者,捕获微球并以已知速度移动陷阱,同时记录力信号。例如,将陷阱设置为执行三角振荡:记录的力信号将是方形信号。
注:力值应根据作用在磁珠上的阻力随速度线性增加。该测试可作为正确进行力测量的阳性对照38。或者,光学力传感器可用于从功率光谱分析中获得光学捕获刚度 κ [pN/μm]和位置校准因子 β [μm/V]35。在正确对准下,制造商提供的不变校准因子为α = κ·β [pN/V]。- 通过单击制造商软件中"测量"子菜单中的"绘图 1"来启动实时力读取。这将提供当前光学捕获力和功率的读数。
- 从"工具"子菜单中打开"振荡参数"对话框。分别在形状和类型选择器环中设置三角形空间波形形状。例如,将振幅设置为 10 μm,频率设置为 3 Hz。这将导致直径为1μm38的微珠上产生约1 pN的粘性力。
- 在相机的 AUX 窗口中,右键单击微珠,然后选择 开始振荡。力读数将变为平方力信号,在±1 pN处呈平台。
- 右键单击微珠,然后选择停止 振荡。
7. 旋转盘共聚焦显微镜
- 打开旋转盘共聚焦显微镜和附件设备、集成的激光引擎和采集相机。
- 启动映像软件。
- 为细胞核的Hoechst染色和细胞质膜的GFP设置成像通道。
- 激活 405 nm 和 488 nm 激发激光器线。
- 添加多波段二向色性以将激发反射到样品中,并允许发射的光传递到相机。
- 用500nm长通边缘二向色镜分离荧光发射。
- 分别在两个采集相机前使用DAPI/BFP(~445 nm)和GFP(~521 nm)发射滤光片。参见 图2F,G。
- 将每个通道的曝光时间设置为 100 毫秒。
- 设置激光发射以在样品平面上获得5 mW的功率。要测量功率,请使用商用功率计。
- 设置映像协议。为避免光谱从Hoechst通道渗入GFP通道,需要按顺序对两种染料进行成像。
注:如果光学陷阱的AOD和相机采集之间存在硬件同步,请确保正确设置了触发极性。如有疑问,请咨询您的设施经理或显微镜制造商。
8. 进行细胞核压痕实验
注:当抬起力传感器模块并更换样品时,请始终关闭光学陷阱 - 使用软件和关闭落射荧光端口2上的快门。否则,可能会对光学元件和实验者造成严重损害。寻找细胞时,请小心镜片支架和底部培养皿边缘之间的横向距离,以避免将晶状体撞入载物台/培养皿(图2)。
- 将样品置于显微镜中,并按照该方案的步骤5.3进行操作。
- 使用旋转的HWP(图2F),如果所研究的细胞核或细胞内结构的刚度未知,则将陷阱功率设置为200 mW作为起始值。将OT工作区域(使用显微镜载物台)转换为没有细胞的地方,以便通过步骤6.5补偿初始动量基线。
注意:根据亚细胞结构的刚度,应将陷印功率值调整为较低或较高的值,以获得相似的压痕深度。 - 使用显微镜载物台软件控制器,通过透射明场显微镜寻找具有一个或两个微珠的细胞(图3A)。
- 定义陷阱轨迹。
- 打开"工具"子菜单中的"轨迹"对话框,然后在"轨迹类型"选择器环中选择"位移"。
- 在数值表中,写下每个后续轨迹步长的位移和时间。下面是两个示例。
- 对于应力松弛实验,对梯形载荷进行编程,如图 3B所示。在 表S1中,施加两个梯形压痕,行程距离为5μm;速度为5μm/s;撤回前的等待时间:10秒。
- 对于以恒定速度重复压痕实验以获得三角形例程,而无需在原子核上停留时间,设置轨迹振幅,例如5μm,以及步骤的时间,例如,2 s的速度为2.5μm/ s。在 表 S2 中,以相同的速度应用八次。
注意:这些值需要针对每种细胞类型和实验来确定,但梯形例程的以下参数捕获了此处介绍的实验中最重要的动力学。等待时间应足以使细胞核在压痕后显示其完全的应力松弛
- 捕获微球
- 使用显微镜载物台软件控制器将图像平面设置在珠子的略上方。
- 使用OT软件激活陷阱,然后单击相机AUX成像窗口中的磁珠(按照步骤6.4进行校准)。通过光学陷阱成功约束磁珠将大大降低磁珠的运动。
- 点击并拖动珠子穿过细胞质,并将其放置在距核包膜约2μm的距离处(图3A)。确保设置轨迹,使磁珠压痕垂直于核膜。
- 或者,如果需要对磁珠进行相对于捕集器的位置测量,可以扫描磁珠上的陷印以确定陷印刚度 k [pN/μm]54,从而 Δxbead = -F/k(参见讨论)。该协议中使用的光学显微操作模块具有用于此目的的内置例程。
- 打开"工具"子菜单中的"粒子扫描"对话框。
- 选择要扫描的陷阱和 高频 作为 扫描方法。选择磁珠扫描测量的压痕轨迹方向(x 或 y)。
- 将出现一个窗口,其中包含陷印刚度的测量值。在图中,拖动两个光标以选择与 F = -kx 对应的线性陷印区域。所选数据部分的线性拟合将自动刷新。
注意:设置磁珠的初始位置远离细胞膜(~5μm),因为介质细胞界面处的光动量偏转会影响力测量的适当性。如果细胞核位置太靠近细胞膜,请尝试从相反的部位缩进细胞核。如果不可能,请丢弃单元格。
- 通过单击成像软件中的采集按钮开始图像采集。
- 通过单击"数据|"开始捕获位置和力测量 数据保存保存 在实时力读取窗口中(如步骤6.6.1中打开)。
注:光学陷阱配有触发输入,可连接到相机的定时输出。因此,图像和力数据是硬件同步的,电子设备能够在采集过程中将陷阱周期与图像的帧数映射。 - 通过右键单击磁珠并选择"开始轨迹"来启动先前加载 的轨迹。
- 等到轨迹完成,系统稳定下来。
- 停止陷阱力测量数据保存。将弹出一个数据保存对话框。
注意:要优化数据存储,可以通过选择此对话框中的抽取参数(10、100 或 1000)来抽取数据。 - 停止图像采集,并将结果绘制在用户选择的后处理软件中。
- 如果微球在例行过程中丢失并且原子核无法缩进(图S2),请放弃测量并增加功率。请注意,必须重复步骤 6.5。在我们手中,至少95%的例程成功完成,而不会丢失陷阱中的珠子。
结果
捕获珠的显微注射:
在形态发生过程中,注入单细胞斑马鱼胚胎的微球分布在整个动物帽上。为了更清晰地可视化,我们用红色荧光微珠重复注射方案,并在不同的发育阶段用共聚焦显微镜拍摄体积图像。在图4A-D中,注射的珠子以5 hfp在体内祖干细胞的细胞质中可视化。后来,微球以24 hpf的速度分布在整个胚胎上(图4E)。两个阶段的胚胎发育正常,存活率与对照非注射或模拟注射胚胎相当(见图S3)。这与其他研究报告珠状注射斑马鱼在受精后5天内无扰动存活率一致55。
我们的旋转盘共聚焦显微镜与多通道荧光显微镜兼容。在图5A中,我们显示了在细胞质中具有一个或两个微球的分离干细胞。可以使用多个荧光标记来研究细胞的不同方面(图5B)。核形态可以用Hoechst染料或使用H2A::mCherry mRNA表达来跟踪,而内核膜可以用Lap2b-eGFP12进行分析。肌动蛋白皮层的动力学以及细胞内钙水平可以分别通过My12.1::eGFP转基因系56和Calbryte-520孵育观察到。这里描述的方案旨在比较粘附底物(后来称为悬浮液)和机械约束下固定野生型细胞的细胞核力学。限制在10μm高度的微室中的孤立干细胞表现出内核膜(INM)的部分展开和随后的肌动蛋白收缩性增加12。在图5C中,显示了细胞质中具有一个或两个微球的密闭细胞。通过扁平的,扩增的细胞可以看到成功的限制,细胞核的横截面更宽。核膜在密闭细胞中进一步展开,与悬浮细胞相比,应该显得平滑(图5C)。
力-时间和力-变形分析
对所得结果的分析在很大程度上取决于所研究的标本和感兴趣的问题,因此不能在这里一概而论。例如,分析压痕测量的常用方法是通过将修改后的赫兹模型拟合到力压痕数据57来提取杨氏模量。然而,这种处理的假设需要仔细评估,并且可能并不总是适当的合理性(例如所研究的结构是各向同性的,均匀的,线性弹性和压痕小于珠半径)。因此,我们在这里只考虑与模型无关的测量,以便比较所研究结构的机械行为在不同的实验场景中。
作为起点,在一定压痕深度下测量力-位移曲线的斜率可以测量与模型无关的原子核结构刚度58 。然后可以从多个样本中收集该值,并在不同的实验设置和样本扰动之间进行比较。
压痕测量
在下面的行中,我们专注于细胞核在细胞内变形期间的机械反应。该协议步骤8中的实验通常导致压痕深度约为2-3μm的力峰值高达200 pN。然而,根据细胞类型和实验条件的不同,这些值可能大不相同,较软的细胞核会导致给定压痕的力更小。因此,需要精确测量核变形以及力,以便对细胞核进行准确的机械表征。在本节中,我们将从代表性力压痕测量中获得细胞核刚度。
在 图6中,我们显示了悬浮和封闭细胞中细胞核远端和近端的变形。可以观察到丰富的机械行为。在粘合基板上的典型悬浮细胞中,细胞核被珠子强烈缩进,但在重复推动事件时也会轻微移位。我们通过分析从Hoechst染色的细胞核的荧光成像中获得的kymographs来测量细胞核上的珠子压痕。使用斐济的Multi Kymograph插件沿着缩进方向轻松计算Kymographs(图6A,B),并将其导入Matlab(版本2021,Mathworks)进行进一步处理。将阶跃函数拟合到原始强度曲线上,目的是沿着压痕例程的轨迹跟踪原子核的分隔边缘。可以看出,它具有关于核形状变化的准确信息(图6 和 图S2)。我们使用以下双西格线曲线作为阶跃函数的分析版本:
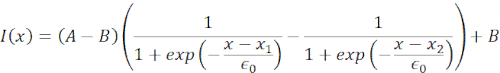 (等式1)
(等式1)
这里,x1和x2表示细胞核的远端和近端边缘,而A和B是图像的蓝色通道(Hoechst染料)的最大和背景灰度值(图6B)。已考虑边缘宽度 (e0 = 0.25 mm)。虽然缩进的近端核边缘(x2)遵循微球 - 原子核接触后光学陷阱例程所应用的轨迹,但相反的远端边缘(x1)显示粘弹性材料(如细胞质)的预期弛豫动力学(图6D)。相反,限制在10μm高微室中的细胞中的细胞核在细胞内压痕时不会表现出细胞核的这种易位行为(图6B,D)。图6D中也显示了细胞核的后边缘,不会受到来自近端侧的磁珠推动而改变,这很可能是由于细胞收缩力和摩擦作用于压痕力而产生的更强的力。为了获得正确的变形深度,从缩进测量值 x2 中减去位移 x1:Δx = x2 - x1(另请参见图 6D)。
力数据分析
引起核变形的力是通过来自光学捕获的微珠的光动量变化来测量的(图7A)。施加梯形轨迹时的力(步骤8.4.3,图7B)最初线性增加,直到陷阱停止移动,但随后松弛到稳态值。该行为表明粘弹性材料表现出损失和存储模量。紧接着压痕事件后,力达到峰值Fp,然后是应力松弛(图7C):
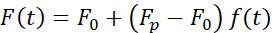 (等式2)
(等式2)
其中 F0 是弹性分量的存储力,f(t) 是无维弛豫函数。我们通过三种方式分析了这种行为:
1. 考虑具有指数应力松弛的标准线性固体,即 f(t) = e-t/τ,示意性地表示在图 7C 插图中。
2. 使用一般的双指数衰减:
F(t) = A + B1e-t/τ1 + B2e-t/τ2。
3. 使用幂律后跟指数衰减59:
f(t) = t-pe-t/τ,拟合于图7C。
虽然模型 1 的拟合可以直接执行,但我们建议分别估计模型 2 和模型 3 的 (τ1, τ2) 和 (p, τ) 的初始猜测。这可以通过分别将线拟合到对数对线性(图7D,左)和对数对数(图7D,右)刻度的数据上来实现。表 S3 总结了图 7 中分析的示例的结果。在下一节中,我们将考虑幂律和指数定律的组合,以表征细胞核力学。
力位移关系
同样,所述实验设置可用于获得多个压痕事件的力-位移关系。通过执行三角形例程(步骤8.4.4, 图8A),可以将力与变形相关联并绘制力压痕曲线。 图8B显示了一个示例性结果,其中一旦磁珠与原子核接触,平坦的基线就会平滑地改变斜率。在噪声数据中识别真正的接触点是一项挑战,必须注意查看接触区域是否适合弹性模型60。在这个特殊的实验中,还可以看到,随后的压痕导致具有更深接触点的曲线,表明磁珠缩回后的核形状恢复太慢,并且由原子核粘弹性材料特性定义的滞后循环发生变化(图8C)。因此,研究人员应该意识到是否发生这种情况,并将其纳入分析管道,或限制后续测量的数量,以使这种效应不会改变测量。
悬浮液和10μm限制下细胞中的细胞核力学
上述方法用于分析粘附基质和密闭细胞上悬浮细胞中细胞核应力松弛的动力学。我们的结果表明,限制导致投影区域的扩大(图9A),但核刚度的变化不显著(图9B)。我们测量了类似的弛豫,τ = 6.08 ±1.1 s(无侧限),τ = 4.00 ±0.6 s(限制),这表明快速粘弹性耗散,然后是对应于原子核弹性模量的存储力值。为了解释实验变化,其可能由压痕例程中的不同初始条件产生,测量的存储力被归一化为压痕深度,如 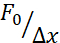 。此参数考虑了原子核刚度,并描述了某个压痕所需的力或应力。我们在限制下和在无限制细胞中获得了相似的刚度:
。此参数考虑了原子核刚度,并描述了某个压痕所需的力或应力。我们在限制下和在无限制细胞中获得了相似的刚度: 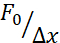 分别为20.1±12.6 pN / μm和
分别为20.1±12.6 pN / μm和  = 24.6±13.6 pN / μm(平均±标准偏差)。
= 24.6±13.6 pN / μm(平均±标准偏差)。

图1:斑马鱼胚胎在单细胞(受精卵)阶段的显微注射。 (A)注射板:用于注射的三角形注射板。该板由E3(鸡蛋培养基)中的1%超纯琼脂糖制成。顶部和侧面视图显示在右侧。(B)胚胎定位:使用刷子轻轻地定向胚胎并定向,使单细胞清晰可见,并且易于用针头接触。我们建议将胚胎定向,细胞位于针的另一侧,如草图所示。(C)注射到单细胞期胚胎中:用针刺穿胚胎周围的绒毛膜和单细胞。确保针尖在细胞内,并释放注射压力。(D)将胚胎在28-31°C下孵育,直到它们发育到胚泡(球状)阶段(4 hpf)。执行细胞分离方案和细胞染色(步骤2),并制备具有悬浮和/或限制的分离细胞并结合相应的基底表面涂层的光学捕获室(步骤3)。 请点击此处查看此图的放大版本。

图2:光学镊子设备的制备(A)将PDMS层以规定的高度旋转涂覆到玻璃底皿上。由于离心力,PDMS液滴将均匀地扩散。(B)将样品室的制备方法从PDMS层中取出。1:用手术刀切一个正方形,2:用康卡伐林A(ConA)涂在内孔中,洗净并接种细胞;3:盖上载玻片或盖玻片以密封油井。(C)用手术刀切割并用镊子取出PDMS井的正方形图片。(D)将光学力传感器的收集透镜安装在捕获室上。一滴浸没油作为收集镜头和上部玻璃盖之间的浸入介质。原理图不按比例缩放。降低收集透镜时要小心,不要触摸样品盘的玻璃盖。(E)与样品接触的力检测单元的图片。(六)实验设置示意图。光学显微操作模块使用连续波激光束(5W,λ = 1064 nm),通过半波板(HWP)和偏振分束器(BS)进行功率控制。在用一对AOD进行调制后,它被耦合到倒置显微镜的上落射荧光端口。然后激光束被950nm短通二向色镜(IR-DM)反射,允许荧光激发和发射的透射率。捕获激光被引导到显微镜的后部落射荧光端口(上转塔)。OT是在水浸物镜(60x,NA = 1.2)的焦平面上产生的。光学力传感器由显微镜转塔照射,并使用高数值孔径油浸透镜捕获从OT中产生的激光。同时,力传感器可实现明场照明。旋转盘共聚焦单元耦合到左侧端口。它配备了两个集成的激光引擎(ILE),可控制七个荧光激发激光器和两个背照式sCMOS相机,从而实现并行的双荧光团成像Abb:TI,Transilluminator;FS,现场停止;AOD,感应偏转器;HWP,半波板;CAM,相机(G)光学捕获设备的照片。红色圆圈表示Bertrand镜头,可以手动切换到光路。请点击此处查看此图的放大版本。
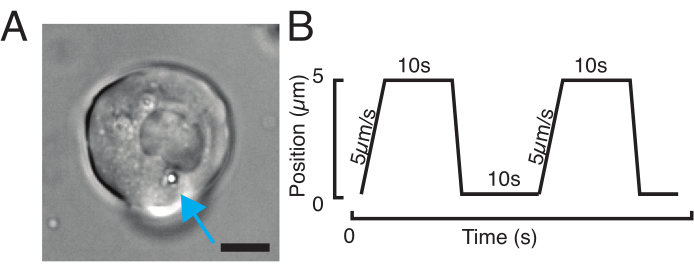
图3:选择正确的样品和参数。 (A)分离的斑马鱼祖细胞干细胞的代表性图像,其单个微球的位置足够靠近细胞核以进行压痕实验。比例尺 = 10 μm. (B) 示例性陷阱轨迹;压痕深度 5 μm;压痕速度 = 5 μm/s;放松时间 10 s. 请单击此处查看此图的放大版本。

图4:发育过程中斑马鱼胚胎内的微珠定位。 将0.5 nL的1μm红色荧光珠与GPI-GFP mRNA(100 pg /胚胎,质膜)一起注射到WT胚胎中,以可视化微球定位。(A-D)注射后5小时微球分布在装在0.75%琼脂糖中的胚胎内。(A)明场和荧光图像。珠子均匀地分散在胚胎组织中,如共聚焦显微照片所示。(B) 共聚焦荧光z-堆栈的最大投影。珠子根据其在图像堆栈中的z位置从紫色到黄色进行颜色编码。紫色/洋红色对应于最外层的珠子/细胞(EVL;上皮包络层;或位于EVL表面附近的祖细胞干细胞),黄色对应于内珠(祖细胞深层细胞),如右图所示。(C)切割和最大投影(B)的子堆栈对应于橙色框中的区域:大部分深层细胞包含1-2个珠子。(D)切割和最大投影对应于洋红色盒子的(B)子堆栈:一些EVL电池包含1-2个珠子。(E)明场图像和安装在0.75%琼脂糖中并用三卡因麻醉的24 hpf胚胎的z-stack的最大投影。胚胎用三卡因预育15分钟。从左到右:微球(直径1μm),GPI-GFP和图像重叠。珠子分布在胚胎的整个身体。每个面板中指示的比例尺尺寸。请点击此处查看此图的放大版本。
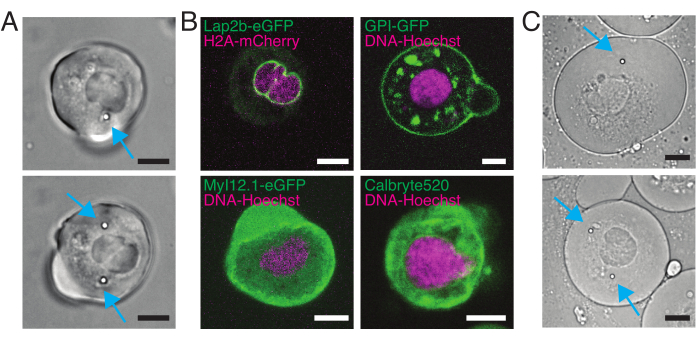
图5:分离出的斑马鱼祖细胞干细胞,具有不同的标记。 (A)具有1(顶部)或2(底部)注射的微珠的悬浮细胞的透射光显微镜图像。青色箭头指向珠子。(B)具有不同染色的悬浮细胞的荧光共聚焦图像。左上角:Lap2b-eGFP(内核膜,80 pg/胚胎)和H2A-mCherry。右上:GPI-GFP(质膜,100 pg/胚胎)和DNA-Hoechst(染色如第2节所述)。左下角:MyI12.1-eGFP(转基因系)和DNA-Hoechst。右下角:Calbryte488 和 DNA-Hoechst(染色如第 2 节所述)。(C)具有1(顶部)或2个(底部)注射珠子的受限细胞的透射光显微镜图像。青色箭头指向珠子。比例尺 = 10 μm。 请单击此处查看此图的放大版本。
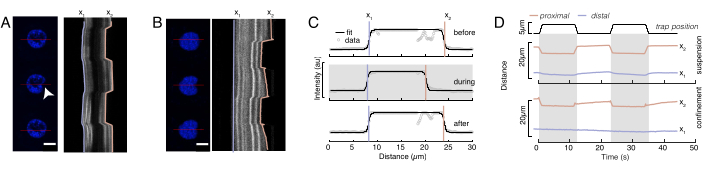
图6:从旋转的圆盘电影中估计核变形。(A,B)悬浮细胞和(B)密闭细胞中细胞核压痕实验的延时。比例尺10μm。Hoechst标记的原子核的代表性快照显示在用光学捕获的微球(白色箭头)压痕前,期间和压痕后5秒。沿压痕段的移动记录仪(红线,右面板)。x1和x2是压痕实验期间细胞核的远端和近端(靠近珠子)边界,从强度曲线与等式1的拟合中提取。(C)沿着压痕段的强度曲线,用于三个不同框架(压痕前,压痕期间和之后),并拟合到等式1以评估核边缘的远端x1和近端x2位置。(D)在悬浮和密闭细胞(10μm)的压痕实验中蓝色的x1(t)和琥珀色x2(t)的代表性轨迹。阴影区域表示缩进,x1 和 x2 之间的距离表示原子核直径。请点击此处查看此图的放大版本。
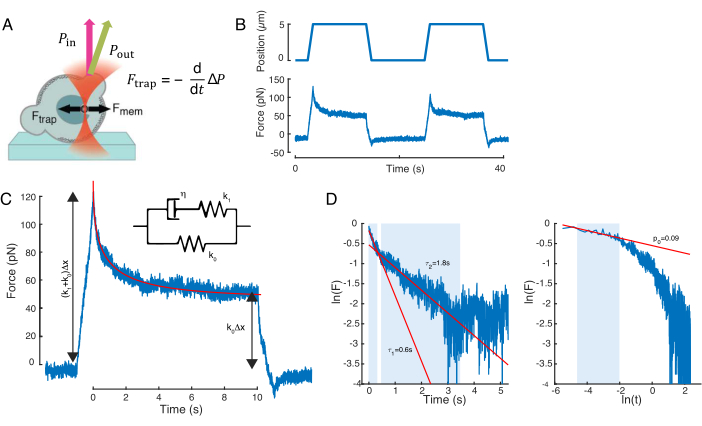
图7:力信号处理。 (A)光学捕获的微球在压痕时使细胞核变形的示意图。核膜和光力由黑色箭头表示。光束动量的变化由绿色箭头Pout表示。(B)光学捕获微球在重复核压痕实验中经历的陷阱轨迹(顶部)和力(底部)。(三)力松弛衰减后力在最大压痕深度处达到峰值。插图显示了标准线性固体的示意图,其动力学近似于此处的现象学观察结果。(D)左:归一化力与时间的对数。阴影区域表示用于拟合双指数衰减(红线)的数据部分。右图:归一化力与时间对数的对数。阴影区域表示用于拟合幂律的数据部分。 请点击此处查看此图的放大版本。
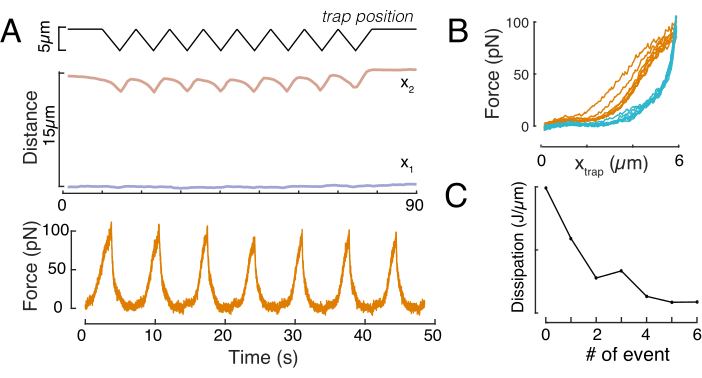
图 8:具有三角形陷阱位移的力压痕例程。(A) 在对 10 μm 限制高度的单元进行的三角压痕实验中,蓝色的 x1(t) 和琥珀色 x2(t) 的代表性轨迹。顶部:陷阱位置。中:细胞核形状分析。x1 和 x2 之间的距离表示原子核直径。底部:力信号。(B) 连续八次压痕的力与陷阱位置。(C)从f-d曲线的接近和退出部分之间的迟滞得出的耗散的演变,对于每个后续的压痕事件, 原子核。请点击此处查看此图的放大版本。

图 9.悬浮液(粘附表面)细胞的核特性和梯形例程的限制。 (A)悬浮和10μm限制下的细胞核的投影面积。黑条表示中位数。(B)悬浮和禁闭中细胞的核硬度。黑条表示中位数。P 值源自使用 MatLab 的 Kruskal-Wallis 测试。 请点击此处查看此图的放大版本。
补充表1:由光学镊子软件定义的梯形轨迹。 第一(第二)行是陷阱将线性置换的 x (y) 距离。在第三行,给定步骤的持续时间以秒为单位进行设置。该轨迹由七个点组成,对应于 图7B中对原子核加载两次的梯形。 请点击此处下载此表格。
补充表2:由光学镊子软件定义的三角形轨迹。 与表2类似,该轨迹由16个点组成,对应于深度为5μm,速度为2.5μm/s的8个压痕事件 。
补充表3:图7中数据的拟合参数。IG:初步猜测。请点击此处下载此表格。
补充图S1:光学力传感器对准和动量基线补偿。 (A) 通过Bertrand镜头在辅助相机(AUX, 图2)处拍摄的场停止。浸没油中出现气泡,通过目镜不可见。(B) 清洁光路。要获得精确对齐,请打开场光挡并使其与 NA = 1.2 光锥重合。(C)样品平面的图像。红色方块表示 OT 工作区域。比例尺:20 μm. (D) 在视场中测量的陷阱功率,沿白色双箭头(以 C 表示)。红色表示未应用校正时的陷阱功率变化。蓝色表示在整个视场内校正陷印功率。(E) 沿同一幅度的动量基线的X分量。红色,未更正的迹线。蓝色,已针对陷阱电源校正了迹线。绿色表示使用制造商软件中的全局偏移补偿校正动量基线的迹线。(F) 与 E 中相同,用于 Y 分量。请注意,在正常操作下,阴影分量用于力学和力测量,例如,沿x坐标运动期间的x力分量和沿y轴运动期间的y力分量。完成所有校正后,得到<0.5 pN的RMSD噪声。 请点击此处下载此文件。
补充图S2:由于陷阱较弱而导致的例程失败。 (A) 运动记录仪显示失败例程的细胞核缩进。由于磁珠从陷阱中逸出,只能看到短暂的瞬态变形。重要的是,陷印激光器仍然在没有磁珠的情况下移动以完成预定义的轨迹(绿色虚线)。比例尺 = 10 μm. (B) 顶部:陷阱位置与时间的关系。中:近端和远端核边缘缩进的边缘跟踪结果。请注意,如果没有压痕,远端边缘不会移动,这在粘合基板上的分离细胞上完成的例程中通常观察到。底部:力与时间的关系,显示微球的损失,表明热噪声降低和力突然下降到零。 请点击此处下载此文件。
补充图S3:注射胚胎的存活率。 将注射1μm珠子和100pg /胚胎的mRNA的胚胎与未注射的胚胎进行比较,并且在受精后24小时没有显着差异。对于每个实验,每个实验的N>每个条件的3个独立实验的平均和标准偏差为21个胚胎。 请点击此处下载此文件。
讨论
在该协议中,我们描述了一种独特的方法来询问活细胞内细胞核的机械性能。与其他力光谱技术不同,非侵入性光学捕获使我们能够将细胞膜和细胞骨架的贡献与细胞核刚度分离。重要的是,光学显微操作与多模态显微镜兼容,这将使实验者能够研究细胞核力学生物学中涉及的不同过程。作为代表性的结果,我们使用DNA-Hoechst染色来测量由数百皮牛顿的力执行的压痕时的细胞核变形。
除本协议中概述的示例外,我们的方法的潜在应用
从活细胞内的测量中提取定量机械信息而不受外部扰动的可能性使得许多前所未有的机会刚刚开始被探索。因此,我们光学显微操作平台的方案可以扩展到更复杂的实验,具有很大的多功能性。声光导流板(AOD)可以生成多个光学陷阱,用于不同单元位置的同步力测量,并可用于宽频率范围内的主动微流变学51,61。如前所述,压痕时的力响应可以克服最大的捕获力,从而导致磁珠从光学陷阱中逸出。在这种情况下,可以使用AOD配置力反馈,以钳位光学力。总而言之,可以使用该平台通过实验获得多种微流变学方法,例如本协议中描述的应力松弛,以及主动微流变学或蠕变顺应性,并通过新颖的软件包进行彻底分析61,62,63,64,65.此外,力的应用不仅限于细胞核,原则上可以进行测量不同的细胞内结构和复杂组织中的复杂组织,如将流动的红细胞捕获在完整血管内66,67 或捕获和变形叶绿体和线粒体68.光动量校准与被困物体的形状和大小无关,因此可以对任何形状任意的力探头进行直接力测量38,39。与直接操纵细胞结构相比,注入微球的使用使我们能够以相对较低的激光功率将高力施加到细胞核上69,70,71。然而,给定足够高的折射率差异,不需要外部施加的力探针,并且无需注射珠子即可直接操纵细胞内细胞器(未发表的观察结果和参考70)。
我们的方法可能修改以扩展应用程序
根据实验的不同,可以注射不同大小的微珠,但必须进行相对对照。例如,为了在后期阶段研究细胞,可以注射较小的磁珠。这将降低光学陷阱可以施加的最大力(如参考55所示)。可以注射较大的珠子以施加更高的力,但这些可能会影响胚胎发育,具体取决于它们的大小或感兴趣的阶段。在微珠注射不是一种选择的实验中,与细胞质相比,显示出折射率差异的各种细胞器仍然可以进行光学操作,从而产生可通过光动量变化测量的光学力42。如上所述,Bambardekar等人已经使用这些方法来变形果蝇胚胎中的细胞 - 细胞连接70。同样,细胞核的折射率低于周围的介质44,即使捕获强度较低,也允许无珠压痕(未发表的观察结果和参考72)。因此,原子核不能轻易被困住并逃脱陷阱。
旋转涂层的PDMS垫片 通过 方便快捷的方法制造,但对于无法获得微/纳米制造设施或工程实验室的实验室来说,这可能是遥不可及的。因此,垫片可以很容易地从实验室胶带或parafilm组装(步骤4)。该协议还可以通过制造微流体通道来适应,这些通道自动将单个细胞输送到预定义的测量孔或具有定义高度的腔室中,以估计同一样品内的限制效应。然而,这种微流体装置的设计必须使它们适合显微镜物镜和光学力传感器的收集透镜之间的空间,约为2毫米(见步骤3)。请注意,光学力传感器必须放置在适当的高度,以便散焦引起的光学像差不会影响光子动量测量。
其他修改可能包括生物报告者的改变。我们发现Hoechst荧光光谱渗入GFP通道,因此我们倾向于与mCherry标记的组蛋白组合作为核标记物,以便在两个荧光通道中同时测量。或者,可以使用靶向内核膜的标签(例如Lap2b-GFP)轻松跟踪核变形(图2)。
细胞核上的压痕量级为2-3微米,我们可以通过衍射极限旋转盘共聚焦显微镜的图像分析来精确测量。对于更硬的原子核或更小的力,使用这种方法几乎无法测量压痕。但是,绝对力校准光学镊子也可以使用具有纳米精度的 BFP 干涉仪进行 原位 测量,以对捕获的磁珠进行原位测量51。使用这种方法,电压信号和光学力传感器可以通过参数β [nm/V]转换为被捕获探头的位置,而不变参数α [pN/V]通过上述光动量校准产生力值41 (有关详细信息,请参见下文)。
故障 排除
我们发现在实验过程中可能会出现以下挑战:
没有形成稳定的捕集器,微球很容易逸出
显微镜物镜上的任何污垢或校正环错位都可能导致稳定疏水阀失效。如果未立即找到解决方案,则测量物镜的点扩散功能。如果感兴趣的标本位于光学致密组织深处,激光聚焦可能会经历严重的光学像差,导致不稳定的捕获(这种效应在分离的细胞中通常可以忽略不计,但在较厚的组织中变得更加明显)。对于高刚度,原子核的恢复力可能超过陷阱的逃逸力,使得微球丢失并且压痕例程失败。最初,光学陷阱附近的核膜边缘几乎不会缩进(图S2A)。发生这种情况时,捕获激光不再受力和布朗运动的影响,这导致力降至零并降低信号噪声(图S2B)。如果发生这种情况,激光功率可以增加以具有更强的陷阱,可以将磁珠推入原子核的梯形轨迹的振幅减小,或者可以进一步设置被捕获的微珠的初始位置。
细胞在刺激期间移动
如果细胞没有充分附着,光学梯度陷阱将在执行细胞内压痕程序时移动细胞,使得细胞核的力和潜在力学是人为的。为了防止整个细胞的置换,我们建议增加细胞粘附分子在表面上的浓度,例如ConA。
初始动量补偿
如果OT平台中没有初始动量补偿例程(步骤6.5),则需要校正人为的、与力无关的基线信号。这可见于力曲线上的斜率,即使没有夹住磁珠(图S1E)。要进行校正,需要在没有磁珠的情况下在细胞外部以完全相同的位置执行相同的轨迹。为此,请使用载物台控件将单元移离陷阱。作为参考,在我们的系统中,在200 mW时,力偏移在整个FOV上变化5 pN;因此,对于短轨迹,它可以忽略不计。或者,可以使用压电扫描台来移动样品上的细胞,使激光位置保持不变。
所提出方案的关键步骤
微球应在正确的1细胞阶段注射,以确保胚胎的最大分布。磁珠不应是荧光的,这样就不会有光泄漏到用于成像的荧光通道中。例如,即使是典型的红色荧光珠子,由于其亮度(激发:405nm;发射:445nm),在Hoechst染色后用于成像细胞核的蓝色通道中也清晰可见。细胞与基质的稳定附着对于防止压痕过程中的横向位移至关重要。如果细胞在例行过程中移动,则力被低估。如果这种情况经常发生,请优化附件协议。对于组织培养细胞,其他细胞粘附蛋白,如纤连蛋白,胶原蛋白或聚L-赖氨酸导致令人满意的附着(未发表的观察结果)。在禁闭期间,细胞会受到突然而严重的机械应力。这可能会对细胞造成损害,如果不仔细进行该过程,实验者经常会遇到细胞破裂。此外,如果限制高度太小,所有细胞都将遭受核信封破损或不可逆转的损坏。为了减轻这些影响,请更慢地降低上盖玻片和/或增加盖玻片之间的间距。
技术的局限性和克服它们的建议
该技术的一个明显局限性是激光穿透到组织的深部,这导致像差和不稳定的捕获。因此,穿透深度的下限取决于样品的清晰度、可采用的像差校正73 和施加的激光功率。应该考虑到,较高的激光功率会导致微球附近样品的热激发。然而,由1064 nm波长激光光斑产生的样品加热被最小化,以避免对我们的生物样品产生合理的热相关应力74。
另一个限制是可以测量的最大力。尽管直接光动量检测可以实现远远超出光学陷阱40,41的线性响应状态的力测量,但最大施加的力约为几百皮牛顿。这受到激光功率和软生物材料的间接损伤阈值以及折射率差异的限制,折射率差异通常不大于0.1或0.344。已经提出了几种提高力检测限的方法,例如,使用结构光75,抗反射涂层微球76,高折射率粒子77 或高掺杂量子点78。
OT可用于通过BFP干涉测量的纳米级位置测量,使得陷阱内磁珠的位置为Δx = β Sx,其中Sx是传感器的电压信号,β[μm/V]可以按照不同的协议进行动态校准35,54。对于光学力传感器,可以证明电压-力不变转换因子α[pN/V]与β和陷阱刚度k [pN/μm]直接相关,通过α = kβ 37)在磁珠位移太小而无法从光学成像中检测到的实验中,该策略可用于通过小位置检测来补充力测量。一个例子是将这里介绍的实验例程应用于非常僵硬的原子核,对于这些原子核,在合理的激光功率(200-500 mW)下,力不足以诱导足够大的压痕值。在这种情况下,需要使磁珠与原子核接触,并且在测量之前必须校准捕获刚度(步骤8.6)。原子核的缩进d作为力的函数可以间接地确定为:
d = xtrap - F/k
其中 xtrap 是陷阱位置。与不变光动量因子 α[pN/V]不同,在每次实验之前需要校准因子β[μm/V],因为它取决于许多确定捕获动力学的局部变量,例如粒径、光学阱斑尺寸和相对折射率。
披露声明
作者没有什么可透露的。
致谢
MK通过国家计划(PGC2018-097882-A-I00),FEDER(EQC2018-005048-P),Severo Ochoa研发卓越中心计划(CEX2019-000910-S;RYC-2016-21062),来自Fundació Privada Cellex,Fundació Mir-Puig,以及通过CERCA和研究计划(2017 SGR 1012)从加泰罗尼亚政府获得的资金,以及通过ERC(MechanoSystems)和HFSP(CDA00023 / 2018)提供资金。V.R.感谢西班牙科学与创新部对EMBL合作伙伴关系,EXCELENCIA Severo Ochoa中心,MINECO的国家计划(BFU2017-86296-P,PID2020-117011GB-I00)和加泰罗尼亚政府(CERCA)的支持。V.V.感谢ICFOstepstone博士计划的支持,该计划由欧盟的Horizon 2020研究和创新计划资助,该计划由Marie Skłodowska-Curie资助协议665884。我们感谢阿尔诺·法雷对手稿的批判性阅读;Maria Marsal帮助24 hpf胚胎的成像和安装;Senda Jiménez-Delgado支持斑马鱼微量注射。
材料
| Name | Company | Catalog Number | Comments |
| #1.5 22 mm cover glasses | Ted Pella | 260148 | |
| #1.5 22x60 mm Coverglasses | Ted Pella | 260152 | |
| #1.5H glass bottom dishes | Willco | GWST-5040 | |
| 10-um beads | Supelco | 72986 | |
| 1-mm glass capillaries | Harvard Apparatus | 30-0020 GC100F-15 | |
| 1-um polystyrene microbeads | Sigma | 89904 | |
| 1-um red-fluorescent beads | ThermoFisher | F8816 | |
| Agar | ThermoFisher | 16500500 | |
| Aqcuisition cameras sCMOS | Andor | Sona-4BV11-UNI | |
| Auxiliary camera (Figure 3, AUX) | Blackfly, FLIR | BFS-U3-200S6M-C | |
| Calbryte 520 | AAT Bioquest | 520 AM | |
| Centrifuge | Eppendorf | 5453000011 | |
| Concanavalin A | Sigma | C5275 | |
| DMEM | Sigma | D2906 | |
| DNA-Hoechst | ThermoFisher | 33342 | |
| Double scotch tape | Biesse Adesivi | ||
| E3 | 5 mM NaCl. 0.17 mM KCl. 0.33 mM CaCl2. 0.33 mM MgSO4 | ||
| Eclipse Ti2 | Nikon | ||
| Forceps | Fine Science Tools | 11252-20 | |
| GPI-GFP | |||
| H2A-mCh | |||
| Image acquisition software | Fusion-Andor | ||
| Immersion Oil | Cargille | Type B: 16484 | |
| IR protection googles | Thorlabs | LG1 | |
| Lap2b-eGFP | |||
| Micro loader pipette | Eppendorf | GELoader | |
| Microinjector | World Precision Instruments | SYS-PV820 | |
| MicroManager 2.0 | |||
| Micromiter slide | ID5243 GXMGRAT-5 5mm/100 divisions | ||
| Mineral oil | Sigma | M3616 | |
| Motorized stage | ASI | ||
| Needle puller | Sutter instrument Co. | Model P-97 | |
| Optical tweezers platform | Impetux Optics | Sensocell | |
| OTs software (LightAce) | Impetux Optics | ||
| PDMS | Sigma | Sylgard 184 | |
| PDMS Curing agent | Sigma | Sylgard 184 | |
| Post processing software (Matlab) | Mathworks | ||
| RNAse free water | Thermofisher | AM9937 | |
| Short-pass dichroic mirror (Figure 3, IR-F) | Semrock | FF01-950/SP-25 | |
| Spin-coater | Specialty Coating Systems | Spincoat G3P-8 | |
| Spinning-disk confocal microscope | Andor | DragonFly 502 | |
| Stereomicroscope | Leica M80 | ||
| Triangular microinjection mold | Adaptive Science Tools | TU1 | |
| Universal oven | Memmert | UNB 200 | |
| Water immersion objective | Nikon | MRD07602 |
参考文献
- Chan, C. J., Heisenberg, C. P., Hiiragi, T. Coordination of Morphogenesis and Cell-Fate Specification in Development. Current Biology. 27 (18), 1024-1035 (2017).
- Heller, E., Fuchs, E. Tissue patterning and cellular mechanics. Journal of Cell Biology. 211 (2), 219-231 (2015).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Petridou, N. I., Spiró, Z., Heisenberg, C. P. Multiscale force sensing in development. Nature Cell Biology. 19 (6), 581-588 (2017).
- Krieg, M., et al. Tensile forces govern germ-layer organization in zebrafish. Nature Cell Biology. 10 (4), 429-436 (2008).
- Ruprecht, V., et al. Cortical contractility triggers a stochastic switch to fast amoeboid cell motility. Cell. 160 (4), 673-685 (2015).
- Shellard, A., Mayor, R. Supracellular migration - Beyond collective cell migration. Journal of Cell Science. 132 (8), (2019).
- Mongera, A., et al. A fluid-to-solid jamming transition underlies vertebrate body axis elongation. Nature. 561 (7723), 401-405 (2018).
- Atia, L., et al. Geometric constraints during epithelial jamming. Nature Physics. 14 (6), 613-620 (2018).
- Turlier, H., Maître, J. -. L. Mechanics of tissue compaction. Seminars in Cell & Developmental Biology. 47-48, 110-117 (2015).
- Ladoux, B., Mège, R. M. Mechanobiology of collective cell behaviours. Nature Reviews Molecular Cell Biology. 18 (12), 743-757 (2017).
- Venturini, V., et al. The nucleus measures shape changes for cellular proprioception to control dynamic cell behavior. Science. 370 (6514), (2020).
- Charras, G., Sahai, E. Physical influences of the extracellular environment on cell migration. Nature Reviews Molecular Cell Biology. 15 (12), 813-824 (2014).
- Kirby, T. J., Lammerding, J. Emerging views of the nucleus as a cellular mechanosensor. Nature Cell Biology. 20 (4), 373-381 (2018).
- Lee, H. P., et al. The nuclear piston activates mechanosensitive ion channels to generate cell migration paths in confining microenvironments. Science Advances. 7 (2), (2021).
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Current Opinion in Cell Biology. 23 (1), 55-64 (2011).
- Versaevel, M., Riaz, M., Grevesse, T., Gabriele, S. Cell confinement: Putting the squeeze on the nucleus. Soft Matter. 9 (29), 6665-6676 (2013).
- Zuela-Sopilniak, N., et al. Measuring nucleus mechanics within a living multicellular organism: Physical decoupling and attenuated recovery rate are physiological protective mechanisms of the cell nucleus under high mechanical load. Molecular Biology of the Cell. 31 (17), 1943-1950 (2020).
- Kim, D. H., Wirtz, D. Cytoskeletal tension induces the polarized architecture of the nucleus. Biomaterials. 48, 161-172 (2015).
- Lomakin, A. J., et al. The nucleus acts as a ruler tailoring cell responses to spatial constraints. Science. 370 (6514), (2020).
- Hampoelz, B., et al. Microtubule-induced nuclear envelope fluctuations control chromatin dynamics in Drosophila embryos. Development. 138 (16), 3377-3386 (2011).
- Heo, S. J., et al. Differentiation alters stem cell nuclear architecture, mechanics, and mechano-sensitivity. eLife. 5, 1-21 (2016).
- Cosgrove, B. D., et al. Nuclear envelope wrinkling predicts mesenchymal progenitor cell mechano-response in 2D and 3D microenvironments. Biomaterials. 270, 120662 (2021).
- Liu, H., et al. In situ mechanical characterization of the cell nucleus by atomic force microscopy. ACS Nano. 8 (4), 3821-3828 (2014).
- Hobson, C. M., et al. Correlating nuclear morphology and external force with combined atomic force microscopy and light sheet imaging separates roles of chromatin and lamin A/C in nuclear mechanics. Molecular Biology of the Cell. 31 (16), 1788-1801 (2020).
- Pajerowski, J. D., Dahl, K. N., Zhong, F. L., Sammak, P. J., Discher, D. E. Physical plasticity of the nucleus in stem cell differentiation. Proceedings of the National Academy of Sciences of the United States of America. 104 (40), 15619-15624 (2007).
- Rowat, A. C., Lammerding, J., Ipsen, J. H. Mechanical properties of the cell nucleus and the effect of emerin deficiency. Biophysical Journal. 91 (12), 4649-4664 (2006).
- Davidson, P. M., et al. High-throughput microfluidic micropipette aspiration device to probe time-scale dependent nuclear mechanics in intact cells. Lab on a Chip. 19 (21), 3652-3663 (2019).
- Lombardi, M., Zwerger, M., Lammerding, J. Biophysical assays to probe the mechanical properties of the interphase cell nucleus: Substrate strain application and microneedle manipulation. Journal of Visualized Experiments: JoVE. (55), (2011).
- Luo, T., Mohan, K., Iglesias, P. A., Robinson, D. N. Molecular mechanisms of cellular mechanosensing. Nature Materials. 12 (11), 1064-1071 (2013).
- Dahl, K. N., Engler, A. J., Pajerowski, J. D., Discher, D. E. Power-law rheology of isolated nuclei with deformation mapping of nuclear substructures. Biophysical Journal. 89 (4), 2855-2864 (2005).
- Guilluy, C., et al. Isolated nuclei adapt to force and reveal a mechanotransduction pathway in the nucleus. Nature Cell Biology. 16 (4), 376-381 (2014).
- Bustamante, C. J., Wang, M. D. Optical tweezers in single-molecule biophysics. Nature Reviews Methods Primers. , 1-29 (2021).
- Svoboda, K., Block, S. M. Force and velocity measured for single kinesin molecules. Cell. 77 (5), 773-784 (1994).
- Berg-Sørensen, K., Flyvbjerg, H. Power spectrum analysis for optical tweezers. Review of Scientific Instruments. 75 (3), 594-612 (2004).
- Smith, S. B., Cui, Y., Bustamante, C. Optical-trap force transducer that operates by direct measurement of light momentum. Methods in Enzymology. 361 (1994), 134-162 (2003).
- Farré, A., Montes-Usategui, M. A force detection technique for single-beam optical traps based on direct measurement of light momentum changes. Optics Express. 18 (11), 11955 (2010).
- Català, F., Marsà, F., Montes-Usategui, M., Farré, A., Martín-Badosa, E. Extending calibration-free force measurements to optically-trapped rod-shaped samples. Scientific Reports. 7, 1-10 (2017).
- Bui, A. A. M., et al. Calibration of force detection for arbitrarily shaped particles in optical tweezers. Scientific Reports. 8 (1), 1-12 (2018).
- Farré, A., Marsà, F., Montes-Usategui, M. Beyond the hookean spring model: Direct measurement of optical forces through light momentum changes. Methods in Molecular Biology. 1486, (2017).
- Farré, A., Marsà, F., Montes-Usategui, M. Optimized back-focal-plane interferometry directly measures forces of optically trapped particles. Optics Express. 20 (11), 12270 (2012).
- Jun, Y., Tripathy, S. K., Narayanareddy, B. R. J., Mattson-Hoss, M. K., Gross, S. P. Calibration of optical tweezers for in vivo force measurements: How do different approaches compare. Biophysical Journal. 107 (6), 1474-1484 (2014).
- Mas, J., Farré, A., Sancho-Parramon, J., Martín-Badosa, E., Montes-Usategui, M. Force measurements with optical tweezers inside living cells. Optical Trapping and Optical Micromanipulation XI. 9164, (2014).
- Schürmann, M., Scholze, J., Müller, P., Guck, J., Chan, C. J. Cell nuclei have lower refractive index and mass density than cytoplasm. Journal of Biophotonics. 9 (10), 1068-1076 (2016).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments: JoVE. (25), (2009).
- Westerfield, M. . The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish. (Danio rerio), 5th Edition. , (2007).
- Schubert, R., et al. Assay for characterizing the recovery of vertebrate cells for adhesion measurements by single-cell force spectroscopy. FEBS Letters. 588 (19), 3639-3648 (2014).
- Koschwanez, J. H., Carlson, R. H., Meldrum, D. R. Thin PDMS films using long spin times or tert-butyl alcohol as a solvent. PLoS One. 4 (2), 2-6 (2009).
- Das, R., et al. Mechanical stretch inhibition sensitizes proprioceptors to compressive stresses. bioRxiv. , (2021).
- Chardès, C., Clement, R., Blanc, O., Lenne, P. F. Probing cell mechanics with bead-free optical tweezers in the drosophila embryo. Journal of Visualized Experiments: JoVE. (141), (2018).
- Staunton, J. R., Blehm, B., Devine, A., Tanner, K. In situ calibration of position detection in an optical trap for active microrheology in viscous materials. Optics Express. 25 (3), 1746 (2017).
- Bola, R., Treptow, D., Marzoa, A., Montes-Usategui, M., Martin-Badosa, E. Acousto-holographic optical tweezers. Optics Letters. 45 (10), 2938-2941 (2020).
- Thalhammer, G., Obmascher, L., Ritsch-Marte, M. Direct measurement of axial optical forces. Optics Express. 23 (5), 6112 (2015).
- Vermeulen, K. C., et al. Calibrating bead displacements in optical tweezers using acousto-optic deflectors. Review of Scientific Instruments. 77 (1), 1-6 (2006).
- Dzementsei, A., Barooji, Y. F., Ober, E. A., Oddershede, L. B. Foregut organ progenitors and their niche display distinct viscoelastic properties in vivo during early morphogenesis stages. bioRxiv. , 1-35 (2021).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nature Reviews Physics. , (2018).
- A-Hassan, E., et al. Relative microelastic mapping of living cells by atomic force microscopy. Biophysical Journal. 74 (3), 1564-1578 (1998).
- Khalilgharibi, N., et al. Stress relaxation in epithelial monolayers is controlled by the actomyosin cortex. Nature Physics. 15, (2019).
- Crick, S. L., Yin, F. C. Assessing micromechanical properties of cells with atomic force microscopy: importance of the contact point. Biomechanics and Modeling in Mechanobiology. 6 (3), 199-210 (2007).
- Hurst, S., Vos, B. E., Betz, T. Intracellular softening and fluidification reveals a mechanical switch of cytoskeletal material contributions during division. bioRxiv. , 425761 (2021).
- Kaplan, J. L., Bonfanti, A., Kabla, A. RHEOS.jl - A Julia package for rheology data analysis. arXiv. 4, 1-5 (2020).
- Bonfanti, A., Kaplan, J. L., Charras, G., Kabla, A. Fractional viscoelastic models for power-law materials. Soft Matter. 16 (26), 6002-6020 (2020).
- Rivas-Barbosa, R., Escobedo-Sánchez, M. A., Tassieri, M., Laurati, M. i-Rheo: determining the linear viscoelastic moduli of colloidal dispersions from step-stress measurements. Physical Chemistry Chemical Physics: PCCP. 22 (7), 3839-3848 (2020).
- Tassieri, M., et al. i-Rheo: Measuring the materials' linear viscoelastic properties "in a step". Journal of Rheology. 60 (4), 649-660 (2016).
- Zhong, M. C., Wei, X. B., Zhou, J. H., Wang, Z. Q., Li, Y. M. Trapping red blood cells in living animals using optical tweezers. Nature Communications. 4, 1767-1768 (2013).
- Harlepp, S., Thalmann, F., Follain, G., Goetz, J. G. Hemodynamic forces can be accurately measured in vivo with optical tweezers. Molecular Biology of the Cell. 28 (23), 3252-3260 (2017).
- Bayoudh, S., Mehta, M., Rubinsztein-Dunlop, H., Heckenberg, N. R., Critchley, C. Micromanipulation of chloroplasts using optical tweezers. Journal of Microscopy. 203 (2), 214-222 (2001).
- Favre-Bulle, I. A., Stilgoe, A. B., Rubinsztein-Dunlop, H., Scott, E. K. Optical trapping of otoliths drives vestibular behaviours in larval zebrafish. Nature Communications. 8 (1), 630 (2017).
- Bambardekar, K., Clément, R., Blanc, O., Chardès, C., Lenne, P. F. Direct laser manipulation reveals the mechanics of cell contacts in vivo. Proceedings of the National Academy of Sciences of the United States of America. 112 (5), 1416-1421 (2015).
- Ferro, V., Chuai, M., McGloin, D., Weijer, C. J. Measurement of junctional tension in epithelial cells at the onset of primitive streak formation in the chick embryo via non-destructive optical manipulation. Development (Cambridge). 147 (3), (2020).
- Hörner, F., et al. Holographic optical tweezers-based in vivo manipulations in zebrafish embryos. Journal of Biophotonics. 10 (11), 1492-1501 (2017).
- Zhong, M. -. C., Wang, Z. -. Q., Li, Y. -. M. Aberration compensation for optical trapping of cells within living mice. Applied Optics. 56 (7), 1972 (2017).
- Català, F., Marsà, F., Montes-Usategui, M., Farré, A., Martín-Badosa, E. Influence of experimental parameters on the laser heating of an optical trap. Scientific Reports. 7 (1), 1-9 (2017).
- Taylor, M. A., Waleed, M., Stilgoe, A. B., Rubinsztein-Dunlop, H., Bowen, W. P. Enhanced optical trapping via structured scattering. Nature Photonics. 9 (10), 669-673 (2015).
- Bormuth, V., et al. Optical trapping of coated microspheres. Optics Express. 16 (18), 13831-13844 (2008).
- Sudhakar, S., et al. Germanium nanospheres for ultraresolution picotensiometry of kinesin motors. Science. 371 (6530), (2021).
- Shan, X., et al. Optical tweezers beyond refractive index mismatch using highly doped upconversion nanoparticles. Nature Nanotechnology. 16 (5), 531-537 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。