Method Article
用于疫苗开发的无细胞规模生产和对来自 穆里达鲁姆衣原 体的重组主要外膜蛋白的佐剂添加
* 这些作者具有相同的贡献
摘要
该协议描述了使用商业的,无细胞的蛋白质表达试剂盒来产生纳米盘中支持的膜蛋白,该膜蛋白可用作亚单位疫苗中的抗原。
摘要
亚单位疫苗在安全性、稳定性和标准生产方面比更传统的灭活或减毒全细胞衍生疫苗具有优势。为了获得有效的基于蛋白质的亚单位疫苗,蛋白质抗原通常需要采用天然样构象。这对于膜结合蛋白的病原体表面抗原尤其重要。无细胞方法已成功用于通过纳米脂蛋白颗粒(NLP)的共翻译(通常称为纳米盘)来生产正确折叠的功能膜蛋白。
该策略可用于在脂质结合环境中生产由膜蛋白组成的亚单位疫苗。然而,无细胞蛋白质的生产通常仅限于小规模(<1 mL)。小规模生产中产生的蛋白质量通常足以进行生化和生物物理研究。然而,无细胞过程需要扩大、优化和仔细测试,以获得足够的蛋白质用于动物模型中的疫苗研究。疫苗生产中涉及的其他过程,如纯化、佐剂添加和冻干,需要并行优化。本文报告了表达、纯化和配制膜结合蛋白亚单位疫苗的放大方案的发展。
放大无细胞反应需要使用多种质粒表达载体、脂质选择和佐剂添加来优化质粒浓度和比例,以高水平生产配方纳米脂蛋白颗粒。本文通过表达衣原体主要外膜蛋白(MOMP)来演示该方法,但可以广泛用于其他膜蛋白抗原。抗原有效性可以通过免疫研究在 体内评估 ,以测量抗体的产生,如此处所示。
引言
用于蛋白质无细胞表达的原核或真核裂解物可作为商业产品随时获得,用于合成感兴趣的蛋白质(有关完整综述,请参阅 1)。这些表达系统具有各种规模,并利用来自各种生物体的裂解物,包括 大肠杆菌、烟草植物和哺乳动物培养物。与传统的重组蛋白生产方法相比,无细胞裂解物具有多种优势,包括易于使用和稳定、快速的蛋白质生产。虽然这些方法主要用于生产可溶性蛋白质,但该小组开创了一种用于表达膜蛋白的方法。
这种新方法通过包括编码两种表达蛋白质产物(载脂蛋白和感兴趣的膜蛋白)的DNA对现有的无细胞表达系统进行了微小的修改。表达的载脂蛋白(ApoA1或ApoE4的衍生物)与添加到无细胞裂解物中的脂质相互作用,自发组装(~20nm)NLP。当与感兴趣的膜蛋白共翻译时,NLP和膜蛋白形成可溶性纳米颗粒复合物,其中膜蛋白嵌入NLP脂质双层内。因此,膜蛋白更容易用于下游应用,因为它包含在可溶的离散颗粒中。该方法可以在NLP双层2 内产生功能性寡聚蛋白复合物,并且可以产生亚单位疫苗的抗原成分,随后将其与亲脂性佐剂混合以形成具有共定位抗原和适合 体内 评估的佐剂的纳米颗粒疫苗。
当前的方法是从先前发布的协议3修改而来的。关键修饰集中在无细胞反应的放大和随后蛋白质-NLP 复合物的纯化上。进一步的修饰包括加入称为端粒体的两亲性聚合物,其首先与脂质混合,然后再加入到无细胞反应中。质粒在端胶质和脂质存在下的共同翻译产生端胶质素NLP(tNLP)。端胶质的添加还有助于调节所得tNLP纳米颗粒的大小和单分散性4。该方案专门针对大规模疫苗研究进行了优化,以产生膜结合的亚单位抗原蛋白,衣原体MOMP 5,6。该方法产生与tNLP相关的重组MOMP,以形成高度可溶的MOMP-tNLP复合物,保留MONP寡聚化。典型的 3 mL 放大生产可产生 >1.5 mg 纯化的 MOMP。无细胞产生的MOMP-tNLP适合快速添加佐剂进行体内免疫原性测试。
研究方案
所有动物研究均在加州大学欧文分校根据机构动物护理和使用委员会制定的指导方针在公共卫生服务(PHS)保证的设施中进行。
1. 玻璃器皿制备
注意:用于生产动物疫苗级配方的所有材料均不含内毒素。
- 为了破坏污染的内毒素,烘烤清洁的玻璃器皿,这些玻璃器皿将在180°C的烤箱中保持缓冲液4小时。
2. 缓冲液制备
- 制备表 1中列出的250 mLNi亲和纯化缓冲液。将它们在4°C下储存长达6个月。
3. 反应制备
- 称取 20 mg 1,2-二肉豆蔻酰-sn-甘油-3-磷酸胆碱 (DMPC) 放入无内毒素的 1.5 mL 离心管中。将其溶解在 1 mL 无内毒素水中,在 6 A 下探头超声处理至少四次,持续 1 分钟,中间暂停 1 分钟,直至澄清。通过在22°C下以13,000× g 离心2分钟,从探针中除去任何污染物金属,然后将溶解的脂质转移到新的1.5mL无内毒素管中。
- 称出 1 mg PEG5k-CA8 端胶质放入 1.5 mL 无内毒素管中。溶于无内毒素水中,浓度为20毫克/毫升。涡旋直至完全溶解并稀释至 2 mg/mL。
- 在新的无内毒素管中,将 210 μL 20 mg/mL DMPC 溶液与 210 μL 2 mg/mL 端胶质溶液混合。
4. 用于亚单位疫苗制剂的 MOMP-tNLP 的无细胞生产
- 使用从先前发布的方案修改的无细胞方法制备 MOMP-tNLP5。
- 在建立无细胞反应前两小时,打开原核无细胞蛋白表达试剂盒并解冻其中一个复溶缓冲液。解冻后,加入一片不含EDTA的蛋白酶抑制剂混合物,使其完全溶解。
- 使用设计用于运行 5 x 1 mL 反应的试剂盒遵循此方案。
注意:典型的放大生产量为 3 x 1 mL。- 对于每 1 mL 反应,向 大肠杆菌 裂解物瓶中加入 525 μL 复溶缓冲液,然后轻轻滚动以溶解。将 250 μL 复溶缓冲液加入含有反应添加剂(例如 ATP、GTP)的瓶中,轻轻滚动溶解。
- 向反应进料瓶中加入 8.1 mL 复溶缓冲液,用橡胶塞盖上盖子(注意不要接触橡胶塞的内部),然后轻轻倒置/滚动以溶解。
- 将 3 mL 复溶缓冲液加入氨基酸混合物瓶中,用橡胶塞盖上盖子,然后轻轻倒置/滚动以溶解。
注意:注意不要触摸橡胶塞的内部,因为这会导致污染。 - 将 1.8 mL 复溶缓冲液加入蛋氨酸瓶中,轻轻滚动溶解,然后储存在冰上直至使用。
- 制备反应溶液。
- 向 大肠杆菌 裂解物瓶中加入 225 μL 重构反应混合物、270 μL 不含蛋氨酸的重组氨基酸混合物和 30 μL 重组蛋氨酸。此外,加入 400 μL DMPC/端胶质体混合物、15 μg MOMP 质粒和 0.6 μg Δ49ApoA1 质粒。滚动/轻轻摇晃以混合。
注意:确保两个质粒均由相同的质粒骨架构建。不要涡旋。 - 取 20 μL 总溶液,放在 1.5 mL 管中,用于表达 GFP 的对照反应(见下文)。
- 向 大肠杆菌 裂解物瓶中加入 225 μL 重构反应混合物、270 μL 不含蛋氨酸的重组氨基酸混合物和 30 μL 重组蛋氨酸。此外,加入 400 μL DMPC/端胶质体混合物、15 μg MOMP 质粒和 0.6 μg Δ49ApoA1 质粒。滚动/轻轻摇晃以混合。
- 准备饲料溶液。向饲料混合物瓶中加入 2.65 mL 不含蛋氨酸的重组氨基酸混合物和 300 μL 重组蛋氨酸。滚动/轻轻摇晃以溶解。
注意:此时,未使用的复溶缓冲液和蛋氨酸可以返回冰箱储存。 - 将 1 mL 的反应溶液转移到无细胞反应试剂盒中提供的内反应室中,并在填充时密封。将 10 mL 的进料溶液转移到反应容器的外室并密封。
注意:不要把腔室装得太满!内部反应室和内部进料室顶部的气泡会对反应产生不利影响。任何剩余的反应溶液都可以放入 1.5 mL 管中,并让其与主容器一起混合。 - 向先前等分的20 μL反应混合物中加入0.5 μLGFP对照质粒(0.5 mg/mL)。
注意:许多试剂盒随附对照质粒,用于质量控制目的。大多数具有T7启动子和 大肠杆菌 核糖体结合位点(RBS)的表达GFP的质粒也可以用作对照质粒。 - 将反应物置于300rpm,30°C的振荡器中长达18小时。为了验证反应是否成功,在孵育15分钟后,使用紫外光源检查由于对照GFP(图1A)的合成而产生的荧光。
注意:这些条件,特别是温度,可能需要针对其他膜蛋白的表达进行优化。
5. 单核糖核素纯化
- 使用固定化镍亲和色谱法使用 Δ49ApoA1 蛋白上的 His-tag 从无细胞反应混合物中纯化 MOMP-tNLP 纳米颗粒复合物。
- 将 1 mL 50% His-Tag 纯化树脂浆液转移到一次性 10 mL 色谱柱中,并用 3 mL 结合缓冲液进行平衡。
- 让缓冲液沥干,盖上出口,并向树脂中加入 250 μL 结合缓冲液。
- 在将无细胞反应添加到色谱柱之前,保存20 μL以供以后通过SDS-PAGE进行分析。将无细胞反应与平衡树脂混合,并将其在实验室摇臂上于4°C孵育1小时。
- 打开色谱柱的盖子,用500 μL额外的结合缓冲液洗涤瓶盖,然后将该液体添加到色谱柱的其余部分。
- 从色谱柱中收集液体流出物,以便以后通过SDS-PAGE进行分析。
- 用含有20 mM咪唑的1 mL洗涤缓冲液洗涤色谱柱6次并收集馏分。注意不要让树脂在两次洗涤之间变干。在第二次洗涤时,使用 1 mL 移液器上下移液剧烈搅拌树脂。
- 在六个 300 μL 洗脱缓冲液 1(含有 250 mM 咪唑)中洗脱 MOMP-tNLP,然后用 300 μL 洗脱缓冲液 2(含有 500 mM 咪唑)进行最后一次洗脱。在第二次洗脱时,使用 1 mL 移液器上下移液剧烈搅拌树脂。
第6章 SDS-PAGE的分析
注意:所有洗脱级分都应通过SDS-PAGE进行分析,以筛选目标蛋白质的数量和纯度。
- 总裂解物和流通液各上样 1 μL,然后对所有收集的洗涤液和洗脱级分上样 5 μL。
- 将洗脱的 MOMP–tNLP、洗涤液、流通液和总裂解液的等分试样与 4x SDS-PAGE 上样缓冲液混合。除非另有说明,否则用10倍样品还原剂混合并热变性样品。
- 使用1.0 mm,4至12%,Bis-Tris SDS-PAGE凝胶和1x MES-SDS电泳缓冲液以及适当的分子量标准品通过凝胶电泳分析馏分。在200 V下运行凝胶35分钟。
- 按照制造商的说明对凝胶进行染色。
- 从凝胶盒中取出凝胶,并将其放入 60 mL 凝胶染色剂中。将凝胶在凝胶染色剂中微波30秒,轻轻摇动容器30秒以均匀分布热量。将染色剂中的凝胶微波至80-85°C再加热30秒,然后将凝胶放在轨道振荡器上摇动5分钟。
- 第三次微波凝胶30秒,然后返回轨道摇床再摇动23分钟。
- 将凝胶转移到干净的容器中,并在100mL洗涤溶液(10%甲醇,7%乙酸)中洗涤30分钟。
注意:这是一个关键步骤,因为必须避免加热洗涤溶液。否则可能会导致背景染色和最终凝胶图像的不规则。 - 洗涤后,用超纯水冲洗凝胶两次,每次5分钟。
- 使用凝胶成像仪在600 nm处对凝胶进行成像(图2)。如果有用于比较的蛋白质标准品,请使用SDS-PAGE量化纳米颗粒溶液中单个蛋白质的量。
注意:在本例中,重组表达的MONP的连续稀释液通过SDS-PAGE解析,并使用仪器软件定量条带的密度。 - 使用 MOMP 波段的密度生成标准曲线。在同一SDS-PAGE凝胶上分离MOMP-tNLP样品,并使用MONP标准曲线计算颗粒的MONP成分 (图3)。
7. 蛋白质和点印迹和储存
- 对于蛋白质免疫印迹,通过SDS-PAGE分离样品,并使用商业干转系统转移凝胶,该系统根据制造商的方案进行标准设置。
- 转印完成后从堆栈中取出印迹膜,并将每个印迹在含有0.2%吐温20和0.5 mg/mL MAb40或0.2 mg/mL MAbHIS抗His标签的合适封闭缓冲液中孵育过夜,靶向来自Δ49ApoA1蛋白的His标签。
注意:用于印迹的抗体稀释度对于MAb40为1:1,000,对于MAbHIS抗体为1:500–1,000。 - 用PBS-T(1x PBS,0.2%吐温20,pH 7.4)洗涤每个印迹3次5分钟。
- 将印迹在含有与荧光团(例如IRDye)偶联的二抗的封闭缓冲液中以1:10,000稀释度孵育1小时。
- 用PBS-T重新洗涤印迹3次5分钟。使用荧光成像仪在最后一次洗涤后对印迹进行成像。
- 转印完成后从堆栈中取出印迹膜,并将每个印迹在含有0.2%吐温20和0.5 mg/mL MAb40或0.2 mg/mL MAbHIS抗His标签的合适封闭缓冲液中孵育过夜,靶向来自Δ49ApoA1蛋白的His标签。
- 对于斑点印迹,使用点印迹仪印迹3μg纯化的MOMP-tNLP和空tNLP。使用上述蛋白质印迹的相同方法封闭和显影印迹。
8. 内毒素评估
- 使用基于鲎变形细胞裂解物 (LAL) 测定的内毒素检测系统量化内毒素水平。使用1 M Tris盐酸盐溶液和无内毒素水制备无内毒素25 mM Tris,pH 7.4,样品缓冲液。
注意:通常,需要使用此样品缓冲液稀释样品,并调整稀释度以找到适合单个样品的范围。在这里,MOMP-tNLP 样品在样品缓冲液中稀释 500 倍,并以 0.05 EU/mL 灵敏度将 25 μL 加载到设备盒的每个孔中。下面描述的小鼠研究中使用的MOMP-tNLP和空tNLP的内毒素水平在0.4至12EU/μg蛋白质之间,具体取决于样品。
9. 冻干
- 冻干并储存MOMP-tNLP纳米颗粒,以便在-20°C下长期(长达数年)使用。 为了制备用于冻干的tNLP和MOMP-tNLP悬浮液,请在冷冻和冻干过程中加入海藻糖作为保护剂。
注意:该过程已针对各种tNLP制剂7,8进行了广泛验证。 - 将MOMP-tNLP溶液的当前体积除以9,以获得达到0.1M海藻糖终浓度所需的无菌,无内毒素去离子水中的1M海藻糖体积。记下最终体积,并根据需要等分到无内毒素的 15 mL 或 50 mL 聚丙烯管中。
- 将混合溶液冷冻在干冰上,并使用冻干机冻干过夜。将干燥的制剂储存在-20°C直至需要。
- 使用无内毒素水重建冻干的tNLP。轻轻滚动,直到冻干蛋糕完全溶解并重新水化。要去除海藻糖,请使用 3.5 kDa 截止透析膜对溶液进行 PBS 透析。
10. 佐剂添加
注意:这些和其他类似的基于NLP的亚单位疫苗制剂可以很容易地加入亲脂性佐剂,如CpG-ODN1826和FSL-1。CpG-ODN1826是一种修饰的B类CpG寡核苷酸(5'-tccatgacgttcctgacgtt-3'),具有完整的硫代磷酸骨架,具有5'胆固醇部分(5'-chol-C6)。CpG-ODN1826与tNLP的偶联是由tNLP的胆固醇部分和磷脂双层之间的疏水相互作用介导的,并且已经得到证明和很好的表征,如先前报道的9,10。
- 在掺入这些配方之前,通过反相色谱纯化胆固醇修饰的CpG,以去除污染的内毒素以及任何未修饰的CpG分子。
- 从供应商处收到后,将冻干的CpG材料在无内毒素水中再水化,并使用由10 mM三乙基乙酸铵(TEAA)(流动相A)和乙腈(流动相B)组成的分离梯度在制备型C4 RP-HPLC色谱柱上纯化。
注: 表 2 中提供了更多详细信息。 - 汇集并冻干含有胆固醇修饰的CpG的馏分。为确保完全去除残留的TEAA,请用15 mL无内毒素水复溶CpG并重新冻干三次。
- 最终冻干后,在无内毒素水(>20 mg / mL最终CpG浓度)中复溶CpG,等分试样,并将其储存在-80°C直至需要。除配方外,将 CpG 稀释至 1–2.5 mg/mL 的浓度。
注意:FSL-1 可作为疫苗级冻干粉末提供。使用浓度为1mg / mL的无菌和无内毒素水进行复溶。疫苗肌肉内(i.m.)给药,每剂含有10μgMONP总体积为50μL。
- 从供应商处收到后,将冻干的CpG材料在无内毒素水中再水化,并使用由10 mM三乙基乙酸铵(TEAA)(流动相A)和乙腈(流动相B)组成的分离梯度在制备型C4 RP-HPLC色谱柱上纯化。
- 为了达到所需的制剂剂量,将纳米颗粒透析到PBS中,并在添加佐剂之前使用离心真空浓缩器将其浓缩。这样做时要小心,以防止样品完全干燥——离心过程中每 20-30 分钟检查一次样品体积。
- 在无菌条件下将佐剂添加到生物安全柜中。为了评估掺入的成功,请通过分析体积排阻色谱(SEC)分析最终配方及其组分。
注意:对于这些制备,在PBS缓冲液中使用SEC色谱柱(流速为0.5 mL / m),并使用紫外-可见二极管阵列检测器检测洗脱。通过将佐剂颗粒的吸收与214和280nm处的未佐剂颗粒的吸收进行比较来评估掺入。 - 在动物使用前将佐剂MOMP-tNLP和空tNLP储存在4°C下长达14天。为了全面评估新tNLP配方的稳定性,SEC定期分析存储的tNLP。
注意:稳定性因配方而异。
11. 血清检测
- 获得雌性3周龄小鼠(BALB / c,n = 6)。
- 在每个后肢肌内(im)用10μgMOMP形式用5μgCpG和1μgFSL-1佐剂佐剂的MOMP-tNLP形式(im)接种小鼠。
- 接种疫苗后,观察小鼠,直到它们能够保持胸骨卧位。
- 初次接种(初配)四周后,用 10 μg MOMP 以 MOMP-tNLP 的形式第二次(加强)接种动物,佐剂为 5 μg CpG 和 1 μg FSL-1(每次注射的总体积 = 50 mL)。
- 在初次接种疫苗后第 56 天,收集血液以评估抗体滴度。首先通过注射甲苯噻嗪(0.3mg / 20g体重)和氯胺酮(3.0mg / 20g体重)的溶液来麻醉小鼠。捏住前腿和后腿,确保不会发生抽搐。在眼睛周围涂抹凡士林,以防止麻醉期间眼睛干燥。
- 使用微血细胞比容毛细管,穿刺眶后丛。在微量离心管中收集 100 mL 血液。
- 采血后,观察小鼠,直到它们从麻醉中恢复并可以保持胸骨卧位。
- 让血液在室温下凝结30分钟,然后以2,000 ×g 旋转10分钟。收集血清并在-80°C冷冻。
- 此时,用 穆里达鲁衣原体 挑战动物或对它们实施安乐死。通过首先腹膜注射甲苯噻嗪(0.3mg / 20g体重)和氯胺酮(3.0mg / 20g体重)的溶液,然后颈椎脱位,对小鼠实施安乐死。
- 如上所述,使用蛋白质印迹技术检测 MOMP 特异性血清抗体。汇集来自所有免疫小鼠的小鼠血清,并使用混合血清代替1:5,000稀释的一抗。
结果
从1 mL无细胞反应中纯化MOMP-tNLP的Ni亲和纯化的SDS-PAGE图如图 1B所示。该反应导致MOMP和Δ49ApoA1蛋白的高表达水平。先前的结果表明,在DMPC和端胶质存在下,Δ49ApoA1的无细胞表达导致端胶质纳米脂蛋白颗粒(tNLP)的形成4。MOMP与Δ49ApoA1的共洗脱表明MONP与tNLP相关,因为His标签仅存在于tNLP支架Δ49ApoA1上,而不存在于MOMP上。MONP是一种高度不溶性的蛋白质,只能通过与tNLPs络合来洗脱,tNLP已被证明可以促进膜蛋白的溶解。
按照制造商的蛋白质定量说明,合并含有MOMP-tNLP的洗脱级分,并使用基于荧光的定量设备或通过280nm吸光度测量浓度的装置测定总蛋白质浓度。为了允许MOMP疫苗的精确剂量,确定纯化复合物中MONP的浓度也很重要。我们开发了一种基于凝胶密度测定法的MONP定量方法(图2),其中使用已知浓度的纯化重组MONP作为标准品。通过建立标准曲线并将其与MOMP-tNLP样品进行比较,可以准确定量MONP浓度。纯化样品中MONP浓度的测定能够估计各种规模的无细胞反应中MONP的产率,这对于规划适合下游研究的反应设置非常重要(表3)。
MOMP需要形成低聚物以引发强大的免疫反应11。为了测试MOMP的低聚状态,在存在和不存在热量和还原剂二硫苏糖醇(DTT,50mM, 图3A)的情况下分析MOMP-tNLP。当样品未经过热处理和DTT处理时,通过SDS-PAGE鉴定了MONP的高阶低聚物。相比之下,在DTT存在下用热处理的样品在凝胶上主要显示两个不同的条带,对应于MOMP和Δ49ApoA1(分别约为40 kDa和22 kDa)。这些结果与MOMP低聚物形成的凝胶条带模式非常相似,这对其有效性至关重要。
使用MAb40(一种针对MONP蛋白可变结构域上的线性表位的抗体)进行的进一步蛋白质印迹分析显示出类似的条带模式,证实了MOMP蛋白在其非变性状态下形成的低聚物(图3B)。影响MOMP低聚物形成的一个重要因素是无细胞反应设置过程中MOMP质粒和Δ49ApoA1质粒之间的比率。 表4 列出了质粒的比例和由此产生的MOMP插入tNLP的速率。先前的研究表明,衣原体MOMP和其他外膜蛋白可能主要以三聚体形式存在12。为了在无细胞反应中最大化三聚体的形成,希望每个NLP的插入速率接近三个MOMP蛋白,这对应于~25:1的MOMP与Δ49ApoA1质粒比。
斑点印迹测定被用作检测MOMP和tNLP存在的更简化的方法。MAb40抗体用于检测总MOMP。靶向tNLP的Δ49ApoA1支架上的His标签的MAbHIS抗体用于评估tNLP的存在。MAb40和MAbHIS抗体的共信号传导表明MOMP-tNLP形成。对照反应产生空的tNLP,仅显示来自MAbHIS的阳性信号(图3C)。为了测试在无细胞反应中产生的MOMP-tNLP的免疫原性,我们用CpG + FSL-1佐剂MOMP-tNLP,并在如上所述的初免增强方案中肌内注射(i.m.)到小鼠中。从免疫小鼠收集血清,并使用蛋白质印迹测定法测量MOMP特异性IgG抗体(图4)。注射佐剂MOMP-tNLP小鼠血清显示强MOMP结合,表明MOMP-tNLP可以在 体内引发免疫反应。
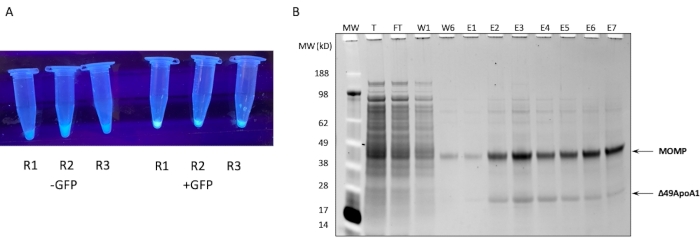
图1:MOMP-tNLP的表达和纯化。 (A)含有成功表达GFP的无细胞反应的小等分试样的管的图像,与没有GFP质粒的裂解物(左)相比,控制了在紫外光源下的发光(右)。(B)在SDS-PAGE之后用SYPRO Ruby染色的蛋白质凝胶显示了MOMP-tNLP的纯化曲线。MONP以40 kDa的速度迁移,49ApoA1以22 kDa的速度迁移。缩写:MOMP = 衣原体主要外膜蛋白;tNLP = 端胶质纳米脂蛋白颗粒;MOMP-tNLP = MOMP-tNLP 复合体;GFP = 绿色荧光蛋白编码质粒;MW = 分子量标记;T = 总游离裂解物;FT = 流通;R1-R3 = 无细胞反应等分试样;W1, W6 = 洗涤 1 和 6;E1-E7 = 洗脱 1 到 7;Δ49ApoA1 = His标记的小鼠ApoA1衍生物。 请点击此处查看此图的大图。

图2:MOMP-tNLP样品中MONP 的定量。 (A)用SYPRO Ruby染色的SDS-PAGE凝胶用于MONP的定量。将已知浓度的重组MOMP上样到凝胶上以获得标准曲线。每个泳道含有 0.1 μg、0.5 μg、1.0 μg、2.0 μg 和 4.0 μg MOMP。正在定量的MOMP-tNLP样品上样在同一块凝胶上。(B)使用密度测定法生成MONP浓度标准曲线。建立了归一化带密度与MONP量相关的方程。该方程用于计算未知样品中的MONP含量。缩写:MOMP = 衣原体主要外膜蛋白;tNLP = 端胶质纳米脂蛋白颗粒;MOMP-tNLP = MOMP-tNLP 复合体;SDS-PAGE = 十二烷基硫酸钠聚丙烯酰胺凝胶电泳。 请点击此处查看此图的大图。
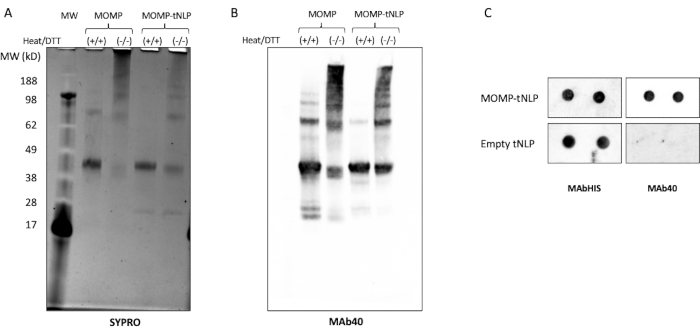
图3:无细胞产生的MOMP-tNLP允许MONP形成高阶结构。 (A)MOMP-tNLP的SDS-PAGE凝胶,有和没有经过热处理和还原剂DTT,用SYPRO Ruby染色。随着热量和DTT的出现, MONP主要表现为~40 kDa的单体带, 因为热量和还原剂分解了大部分高阶MOMP结构.在没有热量和DTT的情况下,存在高阶带,表明MOMP低聚物构象。(B)单独使用MOMP-tNLP和MONP的蛋白质印迹,未经处理并用热和DTT处理。转移后,用MAb40(1:1,000稀释度)探测膜。观察到类似于SYPRO Ruby染色凝胶的条带图案,证实较高分子量的条带确实是MOMP低聚物。(C)用MAb40和MAbHIS探测的MOMP-tNLP和空tNLP样品(一式两份)的点印迹。缩写:MOMP = 衣原体主要外膜蛋白;tNLP = 端胶质纳米脂蛋白颗粒;MOMP-tNLP = MOMP-tNLP 复合体;SDS-PAGE = 十二烷基硫酸钠聚丙烯酰胺凝胶电泳;DTT = 二硫苏糖醇。 请点击此处查看此图的大图。
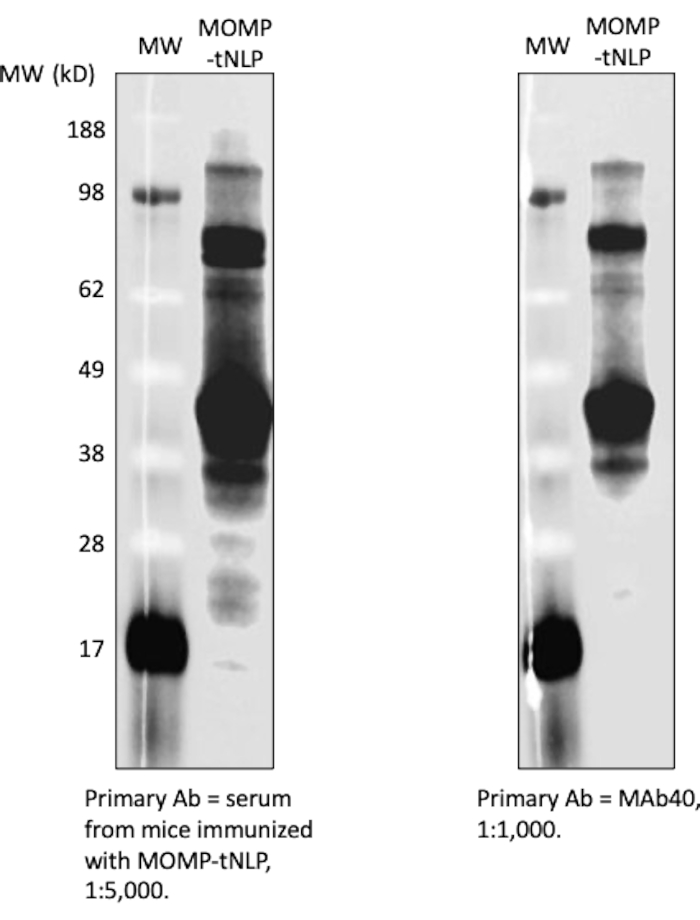
图 4:无细胞产生的 MOMP-tNLP 具有高度免疫原性。 来自免疫小鼠的血清显示出强烈的抗MOMP IgG信号。用CpG + FSL-1佐剂的MOMP-tNLP用于小鼠免疫。收集来自六只免疫小鼠的血清,汇集并用于探测MOMP-tNLP。血清能够在蛋白质印迹测定中与MOMP结合,并显示出强烈的IgG信号(左)。使用MAb40作为一抗的蛋白质印迹(右)显示相似的条带,表明血清含有MOMP特异性IgG。缩写:MOMP = 衣原体主要外膜蛋白;tNLP = 端胶质纳米脂蛋白颗粒;MOMP-tNLP = MOMP-tNLP 复合体;CpG = 胆固醇修饰的 CpG 佐剂;FSL-1 =亲脂性佐剂。 请点击此处查看此图的大图。
| 缓冲区名称 | NaH2PO4 | 氯化钠 | 咪唑 | 酸碱度 |
| 结合缓冲液 | 50 毫米 | 300 毫米 | 10 毫米 | 8.0 |
| 洗涤缓冲液 | 50 毫米 | 300 毫米 | 20 毫米 | 8.0 |
| 洗脱缓冲液 1 | 50 毫米 | 300 毫米 | 250 毫米 | 8.0 |
| 洗脱缓冲液 2 | 50 毫米 | 300 毫米 | 500 毫米 | 8.0 |
表 1: 镍亲和纯化所需的缓冲液列表,详细说明每种组分的浓度和pH值。
| 运行 | 50 分钟 |
| 流量 | 6.0 毫升/分钟 |
| 渐变类型 | 二元的 |
| 缓冲液 A | 10 mM 茶在 H20 |
| 缓冲液 B | 中新网 |
| 梯度 | % 缓冲液 B |
| 0 分钟 | 25% |
| 30 分 | 60% |
| 30.5 分钟 | 100% |
| 40 分 | 100% |
| 40.5 分钟 | 25% |
| 50 分钟 | 25% |
表 2: 反相HPLC纯化胆固醇修饰的CpG的条件缩写:TEAA=三乙基乙酸铵;MeCN = 乙腈。
| 游离裂解物 (mL) | DMPC 脂质(毫克) | 特洛登德里默(毫克) | MOMP 质粒(微克) | 纯化的 MOMP 产率(毫克) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
表 3: 用于不同规模的无细胞反应的脂质、端粒和质粒的数量以及相应的产量。缩写:MOMP = 衣原体主要外膜蛋白;DMPC = 1,2-二肉豆蔻酰基-sn-甘油-3-磷酸胆碱。
| 质粒起始比率,MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| 蛋白质产生量的比例,MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| 每个 tNLP 的 MOMP 插入估计数量 | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
表 4: 无细胞反应中的质粒比率和由此产生的MONP插入速率。缩写:MOMP = 衣原体主要外膜蛋白;tNLP = 端胶质纳米脂蛋白颗粒;Δ49ApoA1 = His标记的小鼠ApoA1衍生物。
讨论
衣原体是最常见的性传播感染,影响男性和女性。尽管衣原体的疫苗研究跨越了几十年,但可以扩展到大规模生产的安全有效的疫苗仍然难以捉摸13。衣原体 MOMP 被认为是作为保护性疫苗抗原的主要候选药物;然而,MONP具有高度疏水性,容易出现不正确的折叠14,15。进一步的研究表明,MOMP存在于对其免疫原性至关重要的寡聚状态11。这里详细介绍了一种经过验证的无细胞共表达方法,该方法可产生在tNLP纳米颗粒内形成的低聚MOMP,作为疫苗,每3 mL裂解物的纯化MOMP产量约为1.5mg。这种经过充分整理的程序可以进一步扩大工业生产的规模,从而增加其作为生产疫苗的有用方法的前景。
我们之前已经发表了关于使用无细胞表达产生嵌入NLP 3,16中的膜蛋白以及表达到端胶质稳定盘中的文章。然而,后一种技术产生的膜蛋白颗粒具有更大的异质性和更低的溶解度。4此外,与MOMP-tNLP颗粒相比,MOMP-端胶质颗粒的免疫原性尚不清楚6。
该程序可以调整为扩大细菌膜蛋白的表达,细菌膜蛋白是有希望的候选抗原用于亚单位疫苗。该过程不仅产生可溶的细菌膜蛋白,而且整个纳米颗粒结构适合使用各种亲脂性疫苗佐剂进一步修饰,包括但不限于与胆固醇部分或FSL-1偶联的CpG。从细菌中表达其他候选抗原是可行的,但可能需要探索表达温度、脂质选择和表达系统类型等参数以获得最佳产量。
此外,质粒的选择和比例在这一过程中至关重要。所使用的两种质粒应由相同的骨架构建。如果插入片段的长度大致相同,则比率可以基于添加的质粒的质量数,如此处所述。然而,基于摩尔的比率将产生更可重复的结果,特别是在缩放反应时。在筛网级反应(< 0.5 mL)中效果良好的比值可能不适用于较大的反应,可能需要进一步优化。非膜蛋白仍然可以使用无细胞试剂盒表达,但可能不需要脂质纳米颗粒(共表达)来产生可溶性产物。此外,虽然该协议描述了与CpG和FSL-1的佐剂,但该系统适用于与其他亲脂性佐剂配制或根据需要与可溶性佐剂混合。
在建立无细胞表达反应时,必须避免污染,因为这会影响产量。反应的任何添加剂,包括质粒本身,都应该是高纯度的。此外,表达的蛋白质应仅与无内毒素污染的材料和溶液接触。候选制剂中的内毒素污染会导致免疫学测定结果不一致和虚假,并且在足够数量的情况下可能是有害的。虽然此处未描述,但如果在后续分析步骤(例如通过SDS-PAGE)中观察到许多污染物,则可能需要在镍亲和色谱后进行额外的纯化。这可以通过SEC实现,尽管条件可能需要逐个配方进行优化。
披露声明
作者声明,他们没有已知的相互竞争的经济利益或个人关系,这些利益或个人关系似乎会影响本文中报告的工作。
致谢
这项工作得到了国家过敏和传染病研究所的公共卫生服务拨款R21 AI20925和U19 AI144184的支持。这项工作由劳伦斯利弗莫尔国家实验室在美国能源部的主持下根据合同DE-AC52-07NA27344[LLNL-JRNL-822525,LLNL-VIDEO-832788]进行。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
参考文献
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。