Method Article
使用瞬时表达系统高效、可扩展地生产哺乳动物细胞中的全长人类亨廷顿蛋白变异
摘要
我们提供可扩展的方案,涵盖HEK293细胞中全长人亨廷顿蛋白变体的构建体设计、瞬时转染以及表达和纯化。
摘要
全长亨廷顿蛋白(FL HTT)是一种大(aa 1-3,144),普遍表达的含聚谷氨酰胺(polyQ)的蛋白质,质量约为350 kDa。虽然FL HTT的细胞功能尚不完全清楚,但polyQ束的突变扩增超过~36次重复与亨廷顿病(HD)有关,polyQ长度大致与发病年龄相关。为了更好地了解结构对突变HTT(mHTT)功能的影响,需要大量的蛋白质。使用多西环素诱导的稳定细胞系表达在哺乳动物细胞中实现FL HTT的亚毫克生产。然而,稳定细胞系的蛋白质生产存在局限性,可以通过瞬时转染方法克服这些局限性。
本文提出了一种通过使用聚乙烯亚胺(PEI)瞬时转染从密码子优化质粒中低毫克量生产FL HTT及其变体的稳健方法。该方法可扩展(>10 mg),并始终如一地产生1-2 mg/L的高度纯化的FL HTT细胞培养物。与之前的报告一致,发现FL HTT的纯化溶液状态具有高度动态性;该蛋白具有形成二聚体和高阶低聚物的倾向。减缓低聚物形成的关键是在体积排阻色谱中快速从二聚体和高阶低聚级分中分离单体级分。
采用多角度光散射排阻色谱(SEC-MALS)分析纯化HTT的二聚体和高阶低聚物含量。FL HTT聚Q长度(Q23、Q48和Q73)与低聚物含量之间没有相关性。外显子1缺失的构建体(aa 91-3,144)显示出与FL HTT(aa 1-3,144)相当的寡聚化倾向。本文介绍了通过SEC/MALS折射率(RI)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、蛋白质印迹、非变性PAGE和蓝色非变性PAGE的生产、纯化和表征方法。
引言
亨廷顿病(HD)是一种罕见的神经退行性疾病,主要特征是不稳和不自主的运动,以及认知和精神改变,如人格改变和冷漠1,2。HD与位于亨廷顿基因(HTT)外显子1的CAG重复道扩增至35次以上有关,CAG重复序列数越多与疾病发病较早相关3,4。HTT的转化产物亨廷顿蛋白(HTT)与神经元活力和大脑发育有关5,6,7,8,9。
据报道,HTT 是一种支架蛋白,可参与广泛的细胞过程、囊泡转运、细胞分裂、纤毛生成和自噬10,11。然而,HD的分子发病机制尚不完全清楚,并且缺乏介导polyQ扩增mHTT病理影响的关键蛋白质相互作用物的鉴定。一些研究表明,mHTT的毒性功能由扩增的HTT蛋白的寡聚化倾向驱动,因为HTT聚集体已在HD患者和该疾病的动物模型中的神经元和神经胶质细胞中鉴定出12,13,14,15,16,17.为了推动对FL HTT和mHTT变体的功能和结构的研究,并为研究人员提供用于检测开发的高质量蛋白质标准品,需要稳定且可扩展的均质重组蛋白供应。
由于其大小(aa 1-3,144,编号基于polyQ长度Q23),蛋白水解不稳定性和聚集倾向,FL HTT已被证明难以表达和分离为可溶性蛋白质。此前,HTT的外显子1区(aa 2-90)已经使用各种标签大规模表达和纯化,这些标签可以增加蛋白质在大肠杆菌18,19,20中的溶解度。FL HTT首先使用杆状病毒21,22在昆虫细胞表达系统中表达和纯化,并报道了化学交联FL Q23-HTT和Q78-HTT的低分辨率30 Å电子显微镜(EM)结构23。当使用稳定的细胞系或腺病毒表达系统在人类细胞中实现具有天然翻译后修饰(PTM)的FL Q17,Q46和Q128-HTT的生产时,HTT结构的研究进一步推进了24。这些研究表明,虽然纯化的HTT主要以单体状态存在,但它也倾向于形成高阶低聚物和聚集体。
具有高度扩增的polyQ区域的FL Q128-HTT的分析超速离心比具有非扩增polyQ区域的蛋白质提供更多的低聚和聚集级分24。使用稳定的细胞系,已经成功地调整了一种策略,通过与相互作用伙伴HAP40共表达来稳定FL HTT。使用纯化的蛋白质复合物 (PDB:6EZ8)25,以平均 4 Å 分辨率解析了 FL HTT 和 HAP40 复合物的冷冻电镜结构。这种共表达策略已成功适应杆状病毒系统,并且已经从昆虫细胞中表达和纯化了一系列具有不同polyQ长度的高质量HTT变体26。从那时起,具有可变polyQ长度和HAP40和更高分辨率结构的HTT复合物的更多冷冻电镜结构被解析并沉积在蛋白质数据库27,28(PDB:7DXK,7DXH,6X9O)中。
我们使用聚乙烯亚胺(PEI)优化了HEK293细胞中的转染和表达方法,用于FL HTT的快速瞬时表达。作为原理验证,首先纯化含有23种谷氨酰胺(FL Q23-HTT)的FL HTT变体,并使用前面描述的纯化方法的修改进行表征24。这种瞬时转染方法方便、高效且可扩展;它可以生产纯化的HTT,产量为1-2 mg/L,与报道的稳定细胞系法相当24.由于蛋白质是在人细胞系中产生的,因此当进行质谱蛋白质组学分析时,产生的HTT更有可能具有天然人PTM。生产了FL HTT的FL Q48-HTT,FL Q73-HTT和外显子1缺失(ΔExon1-HTT)变体的毫克量,表明瞬时表达方法在快速生产HTT的替代变体时特别有用,而无需依赖建立稳定的生产细胞系所需的耗时工作。
以下协议举例说明了这些作者实验室用于细胞培养、转染、蛋白质纯化和纯化后蛋白质表征的标准方法,以从 2 L 细胞培养物中产生 FL Q23-HTT。该方案可以扩展到更大的培养物,也可以适应纯化其他HTT变体。使用相同方案在实验室中成功进行了多达 10 L 的 FL HTT 细胞培养以及 HTT 和 HTT 同系物的各种位点或截短突变。纯化的FL HTT含有高比例的单体以及二聚体和高阶低聚物。在产生的变体(Q23、Q48、Q73 和已删除的外显子 1)中观察到相同的聚集体曲线。由于如果不采取适当的护理,可能会发生聚集,因此进行了配方和冻融稳定性研究,以确定蛋白质处理的最佳条件。还描述了诸如Blue Native PAGE和SEC/MALS-RI之类的方法,以分析HTT低聚物含量,作为质量控制过程的一部分。为了使HD研究界受益,本研究中描述的质粒和HTT蛋白也存放在Coriell Institute(www.coriell.org/1/CHDI)的HD社区存储库中。
研究方案
1. FLAG标记 HTT 哺乳动物表达结构的设计与生产
- 从国家生物技术信息中心(https://www.ncbi.nlm.nih.gov/)检索全长人HTT蛋白序列(P42858)。
注意:研究人员在为HTT突变体设计结构时需要熟悉HTT的领域组织并保持HTT核心3D结构。 - 请求基因合成服务,根据P42858的序列对人类细胞表达进行密码子优化。将polyQ数从Q16更改为所需的Q长度(这里选择Q23作为第一个构建体)并合成全长 HTT 基因。
注意:在本研究中,合成的密码子优化全长Q23-HTT构建体作为pUC18质粒的插入片段交付。 - 可选:添加功能以促进不同Q长度的克隆和构建体中的纯化。
注意:将烟草蚀刻病毒(TEV)切割位点和FLAG纯化标签(AAAENLYFQGDYKDDDDK)添加到构建体的C端。在构建体中设计了两个HindIII位点以包含polyQ区域(通过引入HindIII位点不会改变翻译的蛋白质序列)。这允许研究人员通过限制性内切酶消化和连接来改变HTT的Q长度,而无需重新合成完整的 HTT 基因。
2. 将合成的HTT构建体克隆到pcDNA3.1中。
- 在37°C下分别使用2μLNheI和PmeI消化5μgpUC18-Q23-HTT和5μgpcDNA 3.12小时。
- 运行 0.5% w/v 琼脂糖凝胶,并使用琼脂糖凝胶提取试剂盒纯化 Q23-HTT 片段和消化的 pcDNA3.1 载体。使用可测量微升样品的紫外光谱仪通过OD280定量纯化DNA的浓度。
注意:通常观察到OD260/280 ,范围从1.8到2.0。合成的FL HTT作为插入片段提供,两端为pUC18质粒中的NheI和PmeI。如果 HTT 的合成方式不同,请使用其他限制性内切酶。 - 在反应中使用10ng消化的pcDNA3.1载体。使用 T4 DNA 连接酶在室温下以 1:1 (HTT:pcDNA3.1) 摩尔比连接纯化的 DNA 5 分钟,在室温下进行 10 μL 反应 5 分钟。
- 使用连接酶制造商指定的方案将连接产物转化为感受态 大肠杆菌 细胞(参见 材料表)。
- 拾取 6 个单个菌落,并在 37 °C 下在补充有 100 μg/mL 羧苄青霉素的 4-6 mL LB 中进行过夜培养。
- 从每个过夜培养物中分配 1 mL。加入甘油至25%v / v,并将甘油原液保存在-80°C。 根据用户手册中指定的步骤,使用小型制备试剂盒纯化剩余的过夜培养物。
- 使用跨越质粒转录区域的测序引物对所有质粒进行测序。选择一个具有正确顺序的甘油原液作为主甘油原液,并丢弃其余的。
- 可选:请求基因合成服务,以合成跨越 pcDNA3.1-Q23-HTT 质粒中两个 HindIII 位点的不同 Q 长度(Q48、Q73 和外显子 1)的 DNA。使用HindIII消化pcDNA3.1-Q23-HTT和新合成的DNA,并按照步骤2.2-2.7将它们与T4连接酶连接,以在pcDNA3.1质粒中制备具有不同polyQ长度的FL HTT。
注意:本研究中使用的质粒构建体也可直接从Coriell Institute(www.coriell.org/1/CHDI)的HD社区存储库获得;请参阅材料表。
3. 用于大规模转染的GIGA制备无内毒素质粒DNA
- 用羧苄青霉素(100μg/ mL)在LB琼脂平板上划线pcDNA3.1-Q23-HTT-TEV-FLAG的细菌甘油原液。将板在37°C孵育16-24小时,直到出现单个菌落。
- 拿起单个菌落,在配制用于羧苄青霉素(100μg/ mL)质粒扩增的富培养基中接种5mL起始培养物,并在37°C下生长8小时。
- 选择无内毒素的GIGA质粒纯化试剂盒。按照质粒GIGA试剂盒手册中概述的步骤纯化pcDNA3.1-Q23-HTT-TEV-FLAG质粒。
- 使用基于鲎变形细胞裂解物 (LAL) 的内毒素定量试剂盒测量质粒内毒素水平。按照制造商手册中指定的步骤进行操作。
注意:高质量、低内毒素水平的质粒纯化对于获得良好的转染效率至关重要。使用该协议,每L细菌培养物可以在质粒浓度>4mg / mL下获得20-40mg质粒(超螺旋形式>80%)。正确纯化的质粒的内毒素水平应<30 EU/mg,通常观察到OD260/280 的范围为1.8至2.0。
4. 聚乙烯亚胺(PEI)大规模转染2 L HEK293细胞
- 搅拌将 1 g PEI 25K 加入 1 L 无内毒素水中。使用 100 mM HCl 将 pH 值调节至 2.0,搅拌直至所有 PEI 25K 溶解。使用100mM NaOH溶液将pH调节至7.0,并通过0.2μm过滤器过滤。分装并在-20°C下储存长达一年。
注意:PEI的等分试样可以在4°C下保存长达两周,但解冻后切勿重新冷冻。 - 在加有青霉素 - 链霉素(青霉素终浓度为5U / mL,链霉素终浓度为5μg/ mL)的生长培养基(参见 材料表)中在37°C,90rpm,5%CO2 的加湿摇床培养箱中繁殖HEK293细胞18-24小时。在转染前一天,使用5 L锥形瓶中的生长培养基将细胞以~1.2×106 个细胞/ mL的密度稀释至2L。
- 继续在37°C,90rpm,5%CO2 下培养细胞18-24小时。使用能够按照用户手册测量细胞密度和活力的自动细胞计数器测量细胞参数。
注意:细胞密度应加倍,活力应为>95%。转染前的细胞密度应约为2.0 × 10 6-2.4 ×10 6 个细胞/mL。必要时在转染前将细胞稀释至所需密度。 - 计算转染所需的质粒和PEI量;使用1 mg质粒和3 mgPEI转染每升细胞培养物。分配2 L转染所需的2 mg质粒和6 mgPEI。
- 将质粒和PEI分别稀释到等于细胞培养物总体积1/ 20的磷酸盐缓冲盐水中(2L转染每个100mL),并在室温下孵育5分钟。通过轻轻旋转混合稀释的质粒和PEI,并将混合物在室温下孵育30分钟。
注意:孵育后混合物会显得略微浑浊。 - 将混合物加入细胞培养物中,轻轻旋转以混合它们。
- 在37°C,5%CO2,90rpm下培养细胞24小时。
- 加入2M丁酸钠溶液至终浓度为2mM。向培养物中加入 1:1000 (v/v) 抗结块剂和 1:1000 (v/v) 消泡剂。
- 将烧瓶移至32°C,90rpm,5%CO2的加湿振荡培养箱中,并继续生长48小时。
- 按照用户手册使用自动细胞计数器测量细胞参数,包括细胞密度和活力。
- 在微量离心管中转移2.0×106 细胞(体积= 2.0×106 /细胞密度)。在离心机中以2,000 × g 沉淀细胞1分钟,以便在第5节中进行蛋白质印迹。
- 通过以2,000× g 离心30分钟来收获细胞,并在纯化前将细胞沉淀储存在-80°C。
5. 对HEK293细胞裂解物进行SDS-PAGE和蛋白质印迹,以估计HTT表达水平
- 从HEK293细胞培养物的大规模转染中取先前冷冻的106 个细胞(步骤4.11)的2.0×等分试样。加入 250 μL 补充有 50 μg/mL 洋地黄皂苷、5 mM EDTA 和 1x 蛋白酶抑制剂混合物的 Tris 缓冲盐水 (TBS),并使用移液器多次吸液重新悬浮细胞沉淀。
- 使用微型旋转器在4°C下轻轻旋转试管30分钟以裂解细胞。通过以17,000× g 离心5分钟来沉淀不溶性材料。
- 向上清液中加入1/3体积的 4x还原十二烷基硫酸锂(LDS)上样缓冲液,并在70°C下加热10分钟。
- 将 5-20 μL 细胞裂解物加载到预制的 3-8% Tris-乙酸酯 PAGE 凝胶上。使用凝胶兼容的1x Tris-乙酸酯SDS电泳缓冲液,以150 V的恒压模式运行凝胶60分钟。
注意:三乙酸酯SDS-PAGE用于FL HTT分析,因为它对分子量高于300 kDa的蛋白质产生比其他类型的SDS-PAGE更高的分辨率。本研究中使用的蛋白质也可直接从科里尔研究所(www.coriell.org/1/CHDI)的HD社区存储库获得;请参阅材料表。 - 要进行蛋白质印迹,请使用转印缓冲液平衡的厚转印纸、甲醇活化的聚偏二氟乙烯(PVDF)膜和SDS-PAGE凝胶组装转印三明治。根据制造商的用户手册,使用半干式蛋白质印迹仪将蛋白质转移到PVDF膜上。
注意:通常,对于10cm x 10cm膜,在135 mA下20-30分钟就足够了。 - 拆卸转移三明治并在补充有 5% w/v 脱脂牛奶的 TBST(20 mM Tris pH 7.4、150 mM NaCl 和 0.1% v/v 吐温-20)中封闭膜。
- 在室温下将膜与 15 mL 一抗一起在摇臂上孵育 1 小时(抗 FLAG 抗体单克隆抗体为 1:2,500 稀释度,所有其他一抗为 1:2,000)。
注意:本研究中使用的一抗是抗FLAG M2,MAB5492,MAB5490,MAB2166,MAB3E10,MAB4E10,MAB2168,MAB8A4(见 材料表)。 - 使用 30-50 mL TBST 洗涤膜 3 x 5 分钟。
- 在含有 5% w/v 奶粉的 15 mL TBST 中,将膜与荧光染料偶联的山羊抗小鼠 IgG 二抗一起在摇杆上孵育。
- 使用二抗特异性波长在荧光成像仪上可视化蛋白质印迹条带。根据用户手册,使用成像仪随附的软件定量波段信号。
注意:可以使用纯化的HTT作为标准品进行定量蛋白质免疫印迹。HTT 的线性标准范围是特定于仪器的,在该实验室中使用抗 FLAG 抗体建立了每泳道 25 ng 至 250 ng HTT。HTT的蛋白质印迹应无降解;通常观察到总HTT表达水平为2-4 pg/细胞。有关如何进行定量蛋白质印迹的详细信息,请参阅先前发布的方案32 。
6. 使用抗FLAG柱和SEC快速蛋白液相色谱(FPLC)纯化HTT
- 防旗净化
- 估计纯化所需的FLAG树脂量(通常,12 mL抗FLAG M2亲和树脂用于纯化2-4 L转染细胞培养物)。使用缓冲液A,使用FPLC以4 mL / min的流速将12-25 mL抗FLAG树脂包装到空柱上(参见 材料表)(表1)。调整柱塞的高度,使柱塞末端与树脂床之间没有间隙。
- 使用每 1 g 细胞沉淀 10 mL 裂解缓冲液的比例,将细胞沉淀解冻并悬浮在冷裂解缓冲液中(表 1)。
- 将细胞悬液以 10,000 psi 通过高剪切均质器一次。通过在配备兼容的固定角度转子的离心机中以 20,000 × g 离心 1 小时澄清裂解物。
- 对FPLC进行编程(请参阅 研究 中使用的软件的材料表)并运行以下序列。
- 通过样品泵加载澄清的裂解物。
- 用4柱体积(CV)的缓冲液A洗涤(表1)。
- 用4份CV缓冲液B洗涤(表1)。
- 用8份CV缓冲液C洗涤(表1)。
- 用3份CV缓冲液D洗涤(表1)。
- 用3 CV洗脱缓冲液洗涤(表1)。
- 使用 SDS-PAGE 分析 10 μL 峰级分。收集峰级分并合并所需纯度。保存 ~50 μL 的合并洗脱液用于 SDS-PAGE 分析。
注意:通常会出现单个峰,峰中洗脱的所有馏分都含有~90%纯HTT。 - 使用5个CV的再生缓冲液(表1)再生抗FLAG色谱柱,并使用5个CV的缓冲液A重新平衡色谱柱。
注意:防FLAG树脂最多可重复使用五次,或直到相对产量/升降至第一次纯化的50%。
- 使用 SEC 色谱柱进行尺寸排阻柱 (SEC) 纯化
- 使用2 × CV的SEC缓冲液预平衡SEC色谱柱,分离分子量(MW)>500 kDa的蛋白质(参见所用色谱柱的材料 表 )(表1)。
- 通过 50 mL 超级环直接加载抗 FLAG 洗脱液(来自步骤 6.1.5)。每次进样运行 1.2 × CV 的 SEC 缓冲液。在4°C下运行SEC分离过夜。
注意:本研究中选择的SEC色谱柱上最多可以加载5 mL或15 mL蛋白质样品。对FPLC进行编程,以便可以自动执行多次进样。示例方法脚本也作为补充文件 1 和 补充文件 2 包含在内。 - 将洗脱曲线与标准HTT洗脱曲线进行比较,以区分单体、二聚体和高阶低聚峰。根据SEC色谱柱的洗脱曲线汇集单体HTT馏分。如果需要,分别汇集高阶低聚和二聚体HTT级分。
- 使用100kDa离心浓缩器在4°C下浓缩混合的HTT蛋白。 通过将 OD280 值除以各自的消光系数来计算蛋白质浓度(用于计算的 Q23-HTT、Q48-HTT、Q73-HTT 和 ΔExon1-HTT 的理论消光系数分别为 0.776、0.769、0.762 和 0.798 (mg/mL)-1 cm-1)。将高温热处理浓度维持≤ 1.0 毫克/毫升。
注意:必须监控浓缩过程,因为过度集中会导致聚集。 - 将纯化的HTT蛋白分装在冷冻安全的微量离心管中,体积<100μL。 使用液氮快速冷冻等分试样并将其储存在-80°C。
7. 分析高效液相色谱 SEC-MALS-DRI 分析高温灭菌多分散性
- 在与紫外检测器、多角度光散射检测器和微分折射率(dRI)检测器耦合的高效液相色谱(HPLC)系统上,在4°C下进行所有分析SEC-MALS。
- 在将 UHPLC 色谱柱连接到系统之前,用过滤的 (0.1 μm) HPLC 级水吹扫泵和检测器。
- 将 UHPLC 色谱柱(有关所用色谱柱,请参见 材料表 )连接到系统。用过滤(0.1 μm)水和SEC-MALS缓冲液(表1)平衡色谱柱,直到所有检测器信号达到基线。
- 以 0.3 mL/min 的流速每次进样 2 μL 6 mg/mL 牛血清白蛋白 (BSA) 15 分钟,并检查数据质量。根据BSA曲线执行归一化、峰对准和谱带展宽校正,并为以下HTT样品运行创建模板。
- 使用浮子在室温水浴中快速解冻一瓶FL Q23-HTT样品。通过0.1μm自旋过滤器过滤HTT。注入 2-4 μL HTT 样品,并在 4 °C 下以 0.3 mL/min 的流速运行 15 分钟。
- 使用随附的软件分析色谱和光散射数据(参见 材料表)。使用 dRI 检测器作为浓度检测器,并使用 0.185 作为 HTT 的折射率增量 (dn/dc)。生成Zimm图以确定每个峰33,34的重均分子量。
注意:使用程序SEDFIT软件35 和HTT的伯爵氨基酸序列作为输入,HTT的折射率增量计算为0.185。
注意:HTT单体MW由SEC-MALS在~370 kDa±30 kDa下测定。纯化的HTT通常具有60%至75%的单体含量(在该实验室中)。低单体含量可能表明在处理时需要更加小心以防止聚集。
8. 蓝色原生PAGE分析HTT多分散性
- 通过将 50 mL 20x 蓝色天然 PAGE 电泳缓冲液(参见材料表)与 950 mL H 2 O 混合来制备 1 L 阳极缓冲液。 通过将 100 mL 20x 蓝色非变 PAGE 电泳缓冲液和 100 mL 蓝色天然 PAGE 阴极添加剂 (20x) 与 1,800 mL H 2 O 混合来制备2L 深蓝色阴极缓冲液。 使用前将缓冲液冷却至 4 °C。
- 使用浮子在室温水浴中快速解冻一瓶FL Q23-HTT样品。使用前将解冻的蛋白质放在冰上。
- 混合 5 μg FL Q23-HTT (~1 mg/mL)、1 μL 0.5% G250 添加剂、2.5 μL 4x Blue Native PAGE 样品缓冲液和水,使最终体积达到 10 μL。
- 将混合的FL Q23-HTT样品上样到3-12%预制的Bis-Tris凝胶上。在与标准品相同的凝胶中上样7.5 μL未染色的蛋白质标准品。
- 用深蓝色阴极缓冲液填充水箱的正面,用阳极缓冲液填充水箱的背面。
注意:加载样品后填充缓冲液,以便在加载样品时轻松可视化。 - 在冷藏室中以150 V运行凝胶120分钟。
- 用脱色溶液(表1)对凝胶进行脱色,直到观察到条带;将凝胶转移到水中。在成像工作站上可视化并记录凝胶。
注意:Blue Native PAGE最初设计用于分析膜蛋白。该实验室将其作为估计HTT单体含量的替代方法进行了调整。它与HTT的疏水区域结合,并防止其在缺乏洗涤剂的缓冲条件下形成聚集体。不使用考马斯蓝G250的传统天然PAGE会导致HTT形成可溶性低聚物和聚集体,这可能是由于HTT中存在许多疏水口袋。
9. SDS PAGE,然后考马斯或银染以分析HTT纯度
- 向纯化的FL Q23-HTT中加入4x LDS样品缓冲液和10x还原试剂,使上样缓冲液和还原试剂的最终浓度为1x。
- 在70°C的干燥加热块上加热样品10分钟。
- 每孔最多加载1μg蛋白质到3-8%Tris乙酸凝胶上,并使用Tris-乙酸酯SDS电泳缓冲液在150V下运行1小时。
注意:本研究中使用的蛋白质也可直接从Coriell Institute(www.coriell.org/1/CHDI)的HD社区存储库获得;请参阅材料表。 - 考马斯染色
- 用H2O洗涤凝胶5分钟。
- 通过将凝胶在30 mL染色溶液中摇动15分钟,将凝胶染色在考马斯染色溶液(表1)中。
- 通过将凝胶在 50 mL H2O 中摇动 5 分钟进行脱色。 重复两次。在成像站上可视化并记录库马西染色的凝胶。
- 使用商业银染套件进行银染。
- SDS-PAGE后,使用固定溶液(表1)固定凝胶1小时至室温下过夜。
- 根据试剂盒的说明进行染色、清洗和显影。
- 一旦条带达到所需强度,立即停止显影步骤。
- 在配备可见光源的凝胶记录系统中记录凝胶。
注意:以>95%纯化的HTT可以通过考马斯和银染色与该方案进行检测。有关如何进行定量蛋白质分析的详细信息,请参阅先前发布的方案32 。
结果
瞬时表达载体(pcDNA3.1-Q23-HTT-TEV-FLAG,图1A)被设计用于在哺乳动物细胞中快速生产FL Q23-HTT(aa 1-3,144,基于Q23编号)。该构建体具有旨在通过盒式克隆快速生成各种HTT突变构建体的功能,以最少的色谱步骤促进HTT蛋白纯化至高质量和均一性,并可以选择生产未标记的FL HTT。功能列表包括 1。HTT 外显子 1 中围绕 CAG 重复序列的 HindIII 限制性酶切位点可用于通过限制性内切酶消化和连接产生具有不同长度的 polyQ 拉伸的 FL HTT 突变体;2. FL HTT的C端用具有TEV蛋白酶识别位点的FLAG表位标记,用于高纯度FL HTT的一步亲和纯化,并使用TEV蛋白酶切割选择性生成无标签FL HTT蛋白;3. 密码子优化的FL HTT序列用于人类细胞密码子在HEK293细胞中的高水平表达。pcDNA 3.1(+)载体用作构建体的骨架,以利用哺乳动物细胞系中CMV启动子的高转录活化活性。
以pcDNA3.1-Q23-HTT-TEV-FLAG为起始模板,通过合成跨越两个HindIII限制性内切酶位点的具有适当Q长度的DNA片段并交换模板中的相同区域来生产Q48和Q73 FL HTT构建体。FL HTT (aa 91-3,144) 的 ΔExon1 突变体(图 1B)是使用指向模板中跨越外显子 1 区域的缺失残基的引物产生的。使用PEI转染pcDNA3.1-Q23-HTT-TEV-FLAG的HEK293细胞在5%CO2下的5L摇瓶中生长。典型的大规模纯化使用含有6.0×10 9-3.0×10 10细胞的2-10 L细胞沉淀。在进行纯化之前,使用纯化的重组FLAG标记HTT作为标准品,抗FLAG抗体作为第一抗体,通过定量蛋白质印迹估计每次转染的HTT表达水平。使用HTT表达水平估计为≥2 pg HTT/细胞的沉淀进行纯化。
FL HTT的纯化包括一个两步色谱柱过程,首先使用抗FLAG亲和纯化,然后在具有合适HTT分离范围的凝胶过滤柱上使用SEC(图2A;示例参见 材料表 )。完成这两个步骤后,通过SDS-PAGE测定,样品纯度为>95%,考马斯蓝和基于分析SEC-MALS的单体含量为>65%。由于长时间和温度的延长都会对最终HTT单体含量产生负面影响,因此在两个纯化步骤中都使用了FPLC,以最大限度地减少处理并获得一致的样品质量。反FLAG纯化过程中的主要污染物是通过质谱法确定的伴侣Hsp70(图2B,泳道2)。这与Hsp70与FL HTT在人细胞系24中稳定表达的发现一致,表明Hsp70可能是FL HTT在 体内的常用稳定剂。
在抗FLAG亲和纯化步骤中,可以通过用氯化镁和ATP广泛洗涤来消除Hsp70污染(图2B,泳道1)。去除Hsp70后,FL HTT容易形成高阶低聚物24 ,必须保持在1 mg/mL≤浓度。SEC之前的浓缩步骤通常会导致显著的聚集。因此,最佳做法是将来自反FLAG纯化的峰级分直接上样到体积排阻柱上,而无需浓缩。SEC后,将样品浓缩至≤1 mg/mL,以获得单体FL HTT的最大回收率。使用纯化的FL HTT作为定量标准品,通过考马斯蓝或定量蛋白质印迹法估计从每个纯化步骤中回收的HTT量(表2)。通过所述方法生产的纯化FL HTT蛋白的典型产量约为细胞培养物的1 mg/L,但由于批次间的差异性,或者如果抗FLAG纯化树脂多次重复使用,则可能远低于该产量(表3)。
FL HTT 的过表达可导致蛋白片段化22。通过此处描述的方法产生的FL Q23-HTT通过SDS PAGE解析为具有350 kDa正确分子量的单条带,通过考马斯G250或银染色(图2C)。通过蛋白质印迹,FL Q23-HTT与N端,C端和几个中间结构域的抗表位抗体反应,未观察到额外的片段相关条带,表明分离蛋白质时没有明显的可检测截断(图3A)。FL HTT polyQ 长度变体 Q23、Q48 和 Q73 在蛋白质印迹中反应如预期,显示 polyQ 定向 mAb MW1 的信号逐渐增强,与 Q 长度增加相关:Q23-HTT < Q48-HTT < Q73-HTT(图 3B)。当用靶向N末端外显子1的抗体MW1和MAB549探测时,没有观察到ΔExon1-HTT(aa 91-3,144)的信号(图3B)。
采用SEC-MALS分析纯化的HTT蛋白的聚集状态和分子量。通过UV、MARS和dRI检测器监测的分析SEC分析样品。从SEC-MALS获得的绝对摩尔质量不依赖于分子33,34的形状;因此,SEC-MALS提供了单体和低聚级分在良好分离时的MW的无偏估计。在测试的HPLC色谱柱中,SEC色谱柱(参见 材料表)在HTT单体和二聚体之间显示出足够的分离度,因此可以区分摩尔质量(图4)。通过dRI检测测定蛋白质浓度。根据 SEDFIT 软件35 计算,FL HTT 的折射率增量 (dn/dc) 为 0.1853 mL/g。ΔExon1 HTT (91-3,144)、FL Q23、Q48 和 Q73 HTT (1-3,144) 也观察到类似的SEC分析洗脱模式,每个模式都包含一个主单体峰,具有少量二聚体和低聚峰(表4)。单体形式的计算分子量大于理论分子量。这可能是由高阶低聚峰的重叠物质和弱dRI信号引起的误差引起的,因为HTT蛋白保持在低浓度以避免形成高阶低聚物。通过整合几批纯化的FL HTT变体的UV峰,未观察到polyQ长度与聚集体分布之间存在明显的相关性(表4)。
除分析SEC外,还执行了传统的非变性PAGE以确定其是否可以用作表征FL HTT低聚状态的补充方法。使用不含去垢剂的天然缓冲液通过3-8%Tris-乙酸酯凝胶分离高阶低聚物。来自SEC的纯化FL HTT显示出对应于寡聚态的多个条带(图5A)。最低条带位于天然标记480 kDa和720 kDa之间,与先前报道的从昆虫细胞中纯化的FL HTT的结果相似22。然而,当使用传统的天然PAGE时,HTT单体并不是最丰富的条带,并且结果与分析SEC-MALS确定的聚集体分布不相关。FL HTT36,37,38中存在的几个疏水性贴片,特别是HAP40和FL HTT25之间的疏水界面,可能有助于在凝胶内迁移过程中形成高阶低聚物。这是因为已知疏水区域在没有洗涤剂或稳定的蛋白质 - 蛋白质相互作用的情况下相互相互作用。与HTT的疏水特性一致,FL HTT在SEC纯化步骤中在没有CHAPS的情况下形成越来越多的高阶低聚级分。
蓝色天然PAGE被广泛用于研究膜蛋白和含有疏水贴片39的大蛋白复合物,与传统的天然PAGE进行了比较。纯化的HTT在Blue Native PAGE上显示出三个主要条带,估计MW为643、927和1070 kDa(图5B),可能分别代表HTT的单体、二聚体和三聚体物种。单体条带仍然是Blue Native PAGE中丰度最高的条带,与相同样品的分析SEC谱图相对应。Blue Native PAGE高估HTT单体的MW可能是由于HTT独特的空心球形结构或疏水区域导致相对于相应分子量标记11,23,25的迁移较慢。总体而言,FL Q23-HTT、FL Q48-HTT、FL Q73-HTT 和 ΔExon1-HTT 具有相似的蓝色天然 PAGE 谱,由于分子量差异,蛋白质条带迁移仅略有差异。
作为对纯化蛋白质质量的额外检查,可以通过用TEV蛋白酶处理从FL HTT中去除C端FLAG标签。蛋白水解切割后,使用四种抗体通过蛋白质印迹分析样品,以确认FLAG标签去除并检测HTT降解。抗FLAG M2和三种亨廷顿特异性抗体的免疫反应性,这些抗体具有HTT的N末端,中间结构域和C末端的表位,显示出成功的FLAG标签去除,并且没有HTT特异性降解产物(补充图S1)。
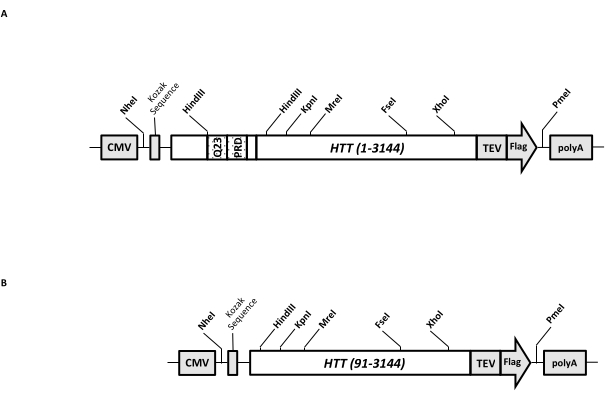
图 1:全长 HTT 表达的构造。 (A)全长Q23 HTT 被密码子优化并克隆到pcDNA3.1(+)质粒中。HTT的3'端用Flag表位和TEV蛋白酶切割位点标记,以产生无标签HTT蛋白。聚谷氨酰胺拉伸和富含脯氨酸的结构域与侧翼HindIII限制性核酸内切酶位点进行工程设计,以使用盒式克隆( 即 Q48和Q73)插入额外的CAG重复序列,以产生具有不同polyQ长度的HTT变体。(B)以pcDNA3.1-Q23-HTT为模板,对ΔExon1构建体进行PCR诱变。HTT的残基91-3,144保留在ΔExon1构建体中用于表达。缩写:HTT = 亨廷顿蛋白;巨细胞病毒=巨细胞病毒;Q23 = 聚谷氨酰胺拉伸;PRD = 富含脯氨酸的结构域;TEV = 烟草蚀刻病毒切割位点。 请点击此处查看此图的大图。
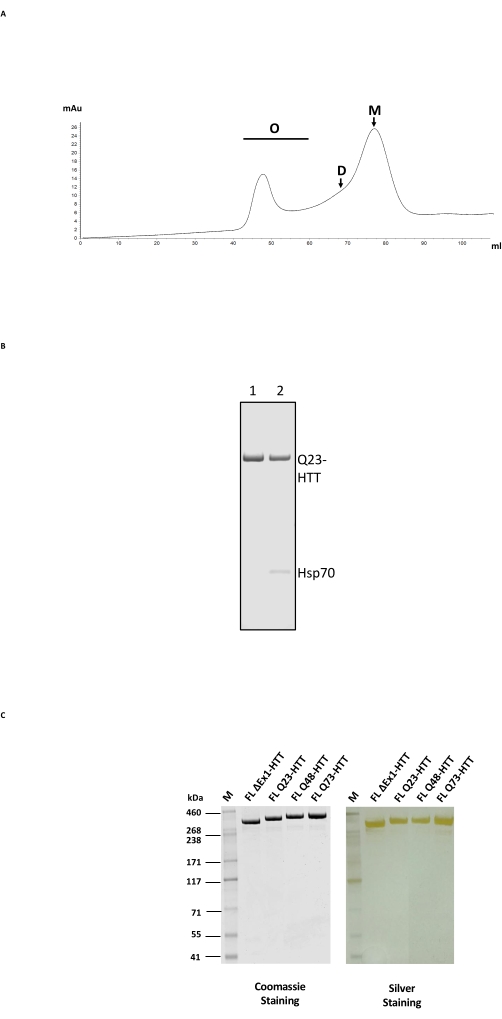
图2:HTT的大规模纯化 。 (A)FPLC色谱柱上抗Flag纯化的全长Q23-HTT的SEC曲线。标记了Q23-HTT的高阶低聚物、二聚体和单体峰。收集含有单体的馏分作为最终HTT样品。(B) 使用ATP/镁洗涤步骤(泳道1)或不进行ATP/镁洗涤的纯化Q23-HTT的SDS-PAGE导致Hsp70共洗脱(泳道2)。(C)用考马斯蓝G-250或银染染色的SDS-PAGE上的最终纯化全长HTT变体。缩写:FL = 全长;HTT = 亨廷顿蛋白;SEC = 体积排阻色谱;FPLC = 快速蛋白液相色谱;O = 低聚物;D = 二聚体;M = 单体;SDS-PAGE = 十二烷基硫酸钠聚丙烯酰胺凝胶电泳;Hsp70 = 热休克蛋白 70。 请点击此处查看此图的大图。
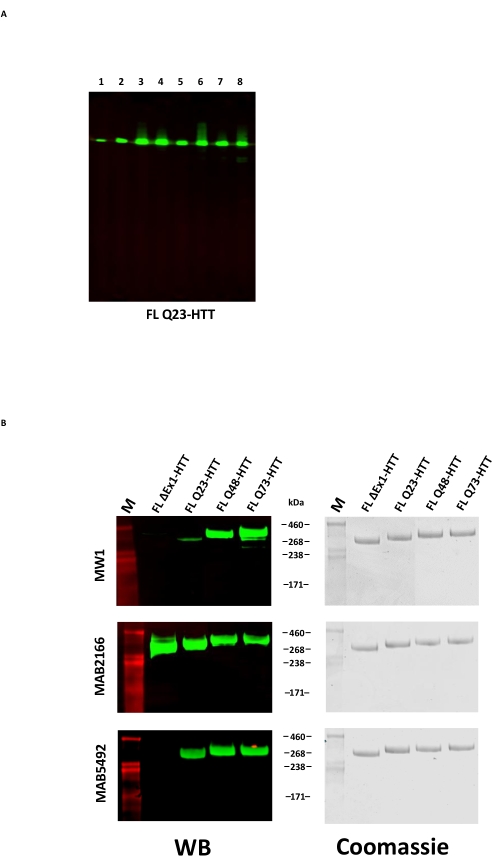
图3:纯化的HTT变体的蛋白质印迹分析 。 (A)纯化的FL Q23-HTT在SDS-PAGE上运行并转移到PVDF膜上。一抗和相互作用的表位是泳道1,α-FLAG M2,FLAG标签;车道 2, MAB5492, HTT aa.1-82;3 车道,MAB5490,HTT aa 115-129;4 车道,MAB2166,HTT aa 181-810;车道 5, MAB3E10, HTT aa 1,171-1,177;6 号车道,MAB4E10,HTT aa 1,844-2,131;7 车道,MAB2168,HTT aa 2,146-2,541;8 号车道,MAB8A4,HTT aa 2,703-2,911。(B)在SDS-PAGE上运行1μg纯化的FL HTT变体并转移到PVDF(左),并运行重复的SDS凝胶并用考马斯蓝染色(右)。一抗和相互作用的表位是第 1 行、MW1、扩增的 PolyQ 重复序列;第 2 行,MAB2166,HTT aa 181-810;第 3 行,MAB5492,HTT aa 1-82。缩写:FLL Q23-HTT = 含有 23 个谷氨酰胺残基的全长亨廷顿蛋白;SDS-PAGE = 十二烷基硫酸钠聚丙烯酰胺凝胶电泳;WB = 蛋白质印迹;M = 标记;PVDF = 聚偏二氟乙烯。 请点击此处查看此图的大图。
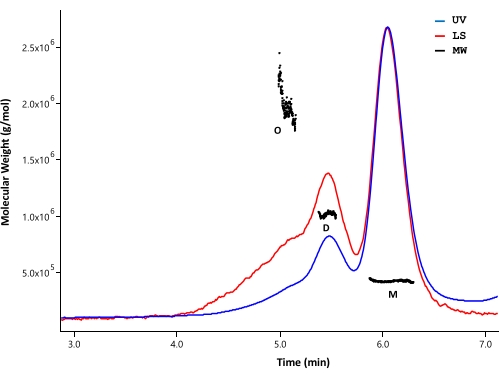
图 4:全长 HTT 的 SEC-MALS 分析。 纯化的全长Q23-HTT在UPLC色谱柱上洗脱。标明了预测单体、二聚体和低聚物的峰位置。计算单体、二聚体和三聚体峰的分子量,如 表5所示。Q48、Q73 和 ΔExon1 HTT 的洗脱曲线相似,每次纯化中的单体、二聚体和低聚物含量各不相同。缩写:SEC-MALS = 多角度光散射的体积排阻色谱;紫外线 = 紫外线;LS = 光散射;分子量 = 分子量;Q23-HTT = 含有23个谷氨酰胺残基的亨廷顿蛋白;M = 单体;D = 二聚体;O = 低聚物。 请点击此处查看此图的大图。
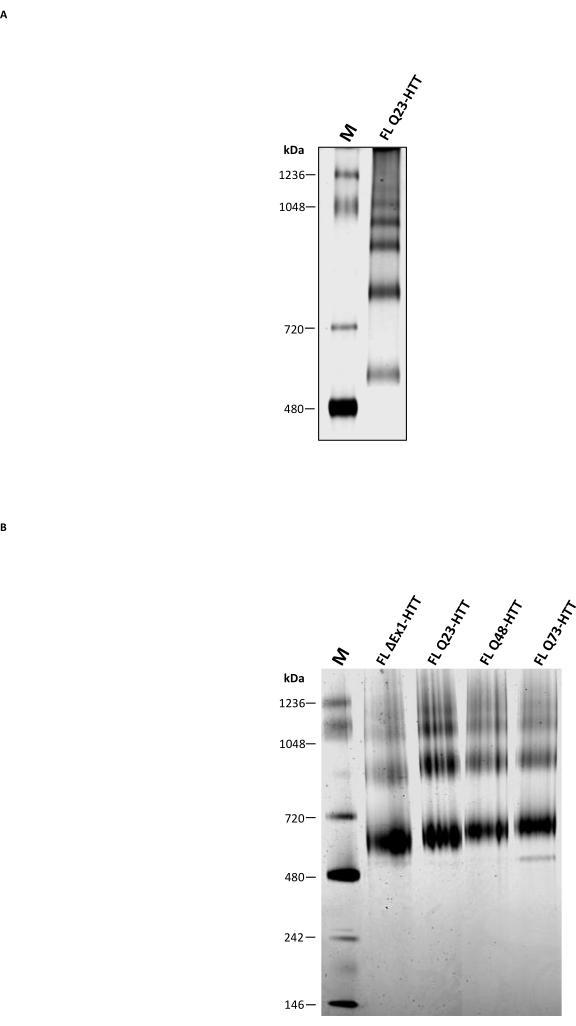
图 5:使用透明非变性 PAGE 或蓝色非变性 PAGE 凝胶表征纯化的 HTT。 SEC的天然标记物和表观单体Q23-HTT在非变性PAGE系统(A)和蓝色天然PAGE系统(B)中的3-8%乙酸三酯凝胶上分离。缩写:FL = 全长;Q23-HTT = 含有23个谷氨酰胺残基的亨廷顿蛋白;PAGE = 聚丙烯酰胺凝胶电泳;M = 标记。 请点击此处查看此图的大图。
| 步 | 名字 | 组成 | ||
| 6.1.1 | 缓冲液 A | 50 mM Tris,500 mM NaCl,5% v/v 甘油,5 mM EDTA,0.01% v/v 吐温-20,pH 8.0。 | ||
| 6.1.2 | 裂解缓冲液 | 50 mM Tris、500 mM 氯化钠、5% v/v 甘油、5 mM EDTA 和 1x 蛋白酶抑制剂混合物 | ||
| 6.1.4.2 | 缓冲液 A | 50 mM Tris,500 mM NaCl,5% v/v 甘油,5 mM EDTA,0.01% v/v 吐温-20,pH 8.0。 | ||
| 6.1.4.3 | 缓冲液 B | 50毫米三分;500 毫米氯化钾;5毫米氯化镁2;5% v/v 甘油;0.01% v/v 吐温-20, pH 8.0 | ||
| 6.1.4.4 | 缓冲液 C | 20毫米三分;200 毫米氯化钾;5毫米氯化镁2;5毫米丙胺;0.01% v/v 吐温-20;5% v/v 甘油, pH 8.0 | ||
| 6.1.4.5 | 缓冲液 D | 50毫米三分;500毫米氯化钠;5% v/v 甘油;5毫米乙二胺四乙酸;0.5% w/v CHAPS, pH 8.0 | ||
| 6.1.4.6 | 洗脱缓冲液 | 50毫米三分;500毫米氯化钠;5% v/v 甘油;0.5% w/v CHAPS;0.2 毫克/毫升 DYKDDDDK 肽,pH 8.0 | ||
| 6.1.6 | 再生缓冲液 | 0.1 M 甘氨酸盐酸盐,pH 3.5;0.01% v/v 吐温-20 | ||
| 6.2.1 | 证券交易委员会缓冲器 | 50 毫米三氯化钠, 500 毫米氯化钠, 5% v/v 甘油, 0.5% w/v CHAPS, 1 mM TCEP | ||
| 7.3 | SEC-MALS 缓冲液 | 50 毫米HEPES,pH 7.2,500 毫米氯化钠,5% v/v 甘油,0.5% w/v CHAPS | ||
| 8.7 | 脱色液 | 40% V/V 甲醇和 7% V/V 乙酸 | ||
| 9.4.2 | 考马斯染色液 | 0.01% w /v 考马斯 G250, 50% v/v/ 甲醇, 10% v/v 乙酸 | ||
| 9.5.1 | 固定解决方案 | 50% v/v 甲醇、10% v/v 乙酸、50 μL 甲醛/100 mL 溶液 | ||
表1:缓冲液和溶液的组成
| 步骤 | 高温激素浓度(毫克/毫升) | 总体积(毫升) | 高温激素含量(毫克) | 每节电池的高温超导率(皮克/细胞) | % 产率 |
| 液 | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| 反旗 | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| 秒 | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
表 2:用 pcDNA3.1-Q23-HTT-TEV-Flag 转染的 2 L HEK293 沉淀的 HTT 产量。 缩写:FL Q23-HTT = 含有 23 个谷氨酰胺残基的全长亨廷顿蛋白;TEV = 烟草蚀刻病毒切割位点;SEC = 体积排阻色谱。
| 高温超导样品 | 高温超热发电产量(毫克/升) | 平均纯度(%) | ||
| 支生局 | A280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N=3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N=3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N=3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
表 3:四种 FL HTT 变体纯化的蛋白质产量及其最终纯度汇总。 缩写:FLL HTT = 全长亨廷顿蛋白。
| 高温超导样品 | 一个 | D | M |
| FL Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| FL Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| FL Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
表4:纯化中FL HTT变体的代表性聚集体、二聚体和单体含量汇总。 缩写:FL HTT = 全长亨廷顿蛋白;A = 聚合;D = 二聚体;M = 单体;SEC = 体积排阻色谱。
补充图S1:TEV蛋白酶消化后的蛋白质印迹分析。 纯化的FL Q23-HTT和FL Q48-HTT在SDS-PAGE上运行,转移到PVDF膜上,并在TEV酶解后通过蛋白质印迹进行分析。使用的一抗是抗Flag M2(Flag标签),MAB5492(HTT aa 1-82),MAB3E10(HTT aa 997-1,276)和MAB2168(HTT aa 2,146-2,541)。泳道 1,蛋白质标准品;车道 2, Q23-HTT-TEV 标志;车道 3, Q48-HTT-TEV 标志;泳道4,Q23-HTT-TEV-Flag用TEV蛋白酶在1:5下处理,在4°C下过夜;泳道5,Q48-HTT-TEV-Flag用TEV蛋白酶以1:5处理,在4°C下过夜。 缩写:FL HTT = 全长亨廷顿蛋白;SDS-PAGE = 十二烷基硫酸钠聚丙烯酰胺凝胶电泳;TEV = 烟草蚀刻病毒;PVDF = 聚偏二氟乙烯。 请点击此处下载此文件。
补充图S2:经受冻融循环的FL HTT变体的SEC-MALS分析。 将纯化的Q23-HTT(A)和Q48-HTT(B)在-80°C下冷冻并在室温下解冻多达6次。然后采用SEC-MALS分析了第一次冻融循环和第六次冻融循环后的Q23-HTT和Q48-HTT。重复冻融循环后,通过光散射观察到单体分数略有降低,二聚体和高阶低聚物组分增加。指示预测单体、二聚体和高阶低聚物的峰位置。缩写:FL HTT = 全长亨廷顿蛋白;O = 低聚物;D = 二聚体;M = 单体;SEC-MALS = 具有多角度光散射的体积排阻色谱。 请点击此处下载此文件。
补充图S3:经受冻融循环的FL HTT变体的SDS页面。 将纯化的Q23-HTT(泳道2-7)和Q48-HTT(泳道9-14)在-80°C下冷冻并在室温下解冻多达6次。Q23-HTT和Q48-HTT的等分试样在每个冻融循环后储存,然后通过SDS PAGE进行分析。未观察到骨料或降解产物增加;通过条带密度测定法,样品被认为是稳定的,纯度为>95%。缩写:FL HTT = 全长亨廷顿蛋白;SDS-PAGE = 十二烷基硫酸钠聚丙烯酰胺凝胶电泳。请点击此处下载此文件。
补充文件 1:FPLC 15 mL 防标志 HTT 脚本。 缩写 = FPLC = 快速蛋白液相色谱;HTT = 亨廷顿蛋白。 请点击此处下载此文件。
补充文件 2:FPLC SEC_MALS HTT 脚本。 缩写:SEC-MALS = 多角度光散射的体积排阻色谱;FPLC = 快速蛋白液相色谱;HTT = 亨廷顿蛋白。 请点击此处下载此文件。
讨论
我们在这里描述了一种瞬时转染、表达和纯化方法,以产生具有合适纯度和均匀性的多种 FL HTT 蛋白构建体,用作免疫测定和 MS 测定开发的标准品、蛋白质印迹分析和结构功能研究的对照。这种瞬时表达方法具有可扩展性和多功能性,与使用前面描述的稳定细胞系或基于病毒的方法相比,用户能够更有效地生成低毫克量的FL HTT变体21,22,23,24。通常,一旦质粒构建完成,使用瞬时表达方法在不到一周的时间内,可以从2 L规模的蛋白质生产中产生2-5mg高度纯化的FL HTT,典型产量为每升细胞培养物1-2.5mg FL HTT。
这里描述的瞬时表达方法克服了稳定细胞系表达中的许多障碍,例如建立细胞系需要很长时间以及储存和维持稳定细胞系的困难。与市场上的其他转染试剂相比,PEI也相对便宜,使得大规模转染在经济上是可行的。该方案也存在局限性:转染效率在很大程度上取决于质粒的质量、最佳细胞生长以及PEI的储存和制备情况。操作人员需要特别小心,并在这些关键步骤中执行质量控制,以避免蛋白质产量急剧下降。该方案中使用的抗FLAG树脂也相对昂贵,并且在多次纯化和再生后显示出FL HTT的捕获减少。一些研究人员可能会发现切换到不同的标签以允许亲和树脂更稳健地再生更实用。
测试各种细胞系和表达条件以优化FL HTT表达水平。选择HEK293细胞进行FL HTT的表达,因为该方法具有蛋白质的高表达率和悬浮培养形式的易于处理,因此适用于在摇床或生物反应器中进行大规模表达。在较低的培养温度(如32°C)下可以获得更高的FL HTT蛋白表达水平,而不是使用37°C的常规温度。 较低的温度可能会减缓蛋白质合成并促进FL HTT40的正确折叠。然而,这种现象并非特定于FL HTT或测试的细胞系。降低的转染后温度已广泛应用于CHO细胞的药物蛋白表达。虽然其机制尚不完全清楚,但人们认为低温会阻止G1期的细胞周期,并将细胞能量转移到蛋白质生产上41。
从哺乳动物细胞纯化的全长HTT与伴侣Hsp7024共洗脱,Mg-ATP洗涤步骤可以去除Hsp70蛋白。有趣的是,在从昆虫细胞表达系统21,22,23纯化的FL HTT中未观察到共洗脱的Hsp70。这可能反映了 FL HTT 的 PTM 或热休克蛋白对哺乳动物和昆虫细胞中 FL HTT 过表达的反应的差异。一旦重组蛋白被剥离出Hsp70,就需要使用非离子去垢剂(如CHAPS或DDM)来稳定FL HTT的单体形式。
使用Blue Native PAGE和SEC-MALS分析FL HTT变体的寡聚化状态。当通过Blue Native PAGE或SEC-MALS分析时,存在一小部分二聚体和高阶低聚HTT。值得注意的是,由FL HTT形成的高阶低聚物似乎与polyQ长度无关,甚至Exon1缺失突变体也显示出类似的低聚物 - 二聚体 - 单体比率。这些结构中低聚物含量的实际变化可能是由于每个批次的生产和处理的微小差异。与HTT外显子140,41形成的聚集体和原纤维相比,FL HTT的高阶低聚物仍然可溶,可以通过SEC和Native PAGE进行分析。
纯化的单体FL HTT仅相对稳定。在 4 °C 下长时间储存、在室温下短孵育或浓度> 1 mg/mL 都会将单体 FL HTT 转化为二聚体和高阶低聚形式,即使在这些条件下没有观察到可见沉淀。如前所述,纯化的单体FL HTT在-80°C下保持≤1 mg/mL在储存缓冲液(50 mM Tris,pH 8.0,500 mM NaCl,5% v/v甘油,0.5% w/v CHAPS和5 mM DTT)中保持相对稳定24。以这种方式制备和储存的FL HTT的多达6个冻融循环不会导致蛋白质的可见沉淀,尽管SEC-MALS观察到轻微转变为更高的低聚状态(补充图S2)。SDS PAGE在反复冻融循环后也对样品进行了分析。没有观察到可见的沉淀物;SDS-PAGE未见聚集体或其他降解产物(补充图S3)。纯化的FL HTT的长期稳定性仍在研究中。在没有确凿的长期数据的情况下,我们建议将纯化的FL HTT在-80°C下储存不超过6个月。
HD研究界对高质量的重组FL HTT蛋白变体及其生产方法的需求量很大。这些蛋白质可用作免疫测定和MS分析标准品,用于结构研究以及开发新型FL HTT特异性测定。这里描述的大规模瞬时表达方法始终如一地产生纯度为>95%的毫克级FL HTT变体,为HTT研究提供了必不可少的工具。生产数十毫克高度纯化的FL HTT polyQ变体和其他突变体以支持HD研究已成为常规。
披露声明
作者声明与本文内容没有利益冲突。
致谢
我们感谢纽约州立大学布法罗分校药物科学系对HTT进行MS分析。这项工作是与CHDI基金会的合作成果。我们特别感谢伊丽莎白·多尔蒂;伊格纳西奥·穆尼奥斯-桑胡安;道格拉斯·麦克唐纳,CHDI基金会;以及库里亚的罗里·柯蒂斯(Rory Curtis),感谢他们在准备这份手稿期间的宝贵投入。我们也感谢Michele Luche,Mithra Mahmoudi和Stephanie Fox对这项研究的支持。
材料
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
参考文献
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846 (2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184 (2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055 (2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54 (2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。