Method Article
脊髓切除 术在非洲爪 蟾蝌蚪
摘要
非洲爪蟾 蝌蚪脊髓横断术是一种相关的损伤方法,通过在胸腔水平上完全切断脊髓的横向切口来研究脊髓损伤和再生。
摘要
脊髓损伤(SCI)是一种永久性疾病,影响中枢神经系统(CNS)运动和感觉神经,导致损伤部位下方瘫痪。迄今为止,SCI尚无功能恢复疗法,并且对于SCI后发生的许多复合物和动态事件缺乏明确性。许多非哺乳动物生物可以在严重SCI后再生,例如硬骨鱼,乌洛德莱两栖动物和无性两栖动物的幼虫阶段,包括 非洲爪蟾 蝌蚪。这些是真正的模式生物,用于研究和理解对SCI的反应以及成功再生过程背后的机制。这种类型的研究可以导致确定SCI治疗干预的潜在靶点。本文介绍如何进行 非洲爪蟾 蝌蚪脊髓横断,包括饲养、手术、术后护理和功能测试评估。这种损伤方法可以通过研究SCI后和脊髓再生过程中的细胞,分子和遗传机制以及组织学和功能进化来阐明脊髓再生的不同步骤。
引言
脊髓损伤 (SCI) 是一种每年影响全球约 250,000-500,000 人的疾病1。除了这种高患病率外,SCI还影响感觉和运动神经,在损伤部位下方产生麻痹,并使一些内脏器官与中枢神经系统的控制断开。脊髓是中枢神经系统的一部分,无法再生,并且由于痛苦的复杂性和对所有相关过程的缺乏完全理解,仍然没有有效的治疗方法允许功能恢复。
非哺乳动物生物,如硬骨鱼、乌贼两栖动物和两栖动物的幼虫阶段,在严重SCI2,3,4后可以再生脊髓,是研究控制成功再生事件的过程和了解哺乳动物再生失败的优秀模式生物。这种理解非常有趣,因为它可以为SCI开发新的治疗靶点和可能的治疗方法提供原创见解。
阿努兰蛙,非洲爪蟾,是研究SCI的优秀模式生物。它在蝌蚪阶段具有出色的再生能力,在蝌蚪阶段逐渐丧失,允许在再生和非再生阶段进行实验3,5。用于研究非洲爪蟾蝌蚪SCI的既定损伤方法包括尾部截肢,其中整个尾巴被移除,包括肌肉,赭骨和脊髓等组织6。这种方法有助于理解再生过程的一般机制4,7,8,9,10。
由于尾部截肢除脊髓外还涉及多个组织,这与人类SCI后发生的情况不同,因此SCI的研究需要更相关的损伤范式。我们依靠过去使用的研究11生成损伤范式的全面描述5,12,13,14和SCI12,13,14,15,16,17,18研究的不同方法.脊髓横切后,可以分离脊髓的尾部进行RNA和蛋白质表达以及高通量分析14,19,20,21。此外,在脊髓切除术之前或之后,药物和小分子的颅内注射以及cDNA,RNA或吗啉的电穿孔允许研究这些分子在预防或治疗SCI或SCI和脊髓再生后发生的特定事件中的作用13,14.此外,可以使用生化,分子,组织学和功能方法在损伤后的不同时间研究损伤进化和再生过程12,13,14,17,19,20,21,22,23。
最后,上述所有技术都可以用于非再生阶段,突出了使用 非洲爪蟾 作为模型生物研究SCI的最重要优势之一,即对同一物种的再生和非再生机制进行比较研究13,19,20,21,22。本文提出了 一种非洲爪蟾 蝌蚪脊髓横断的方案,从再生Nieuwkoop和Faber(NF)50期蝌蚪的分期和选择开始。接下来是描述脊髓手术产生假和截肢动物的程序,术后护理,最后通过测量游离蝌蚪游泳距离来分析功能恢复。
研究方案
该协议提供了足够的信息来成功进行脊髓切除。值得注意的是,这些技术在别处发表了出色的详细协议14,可以补充这里介绍的协议。所有动物程序均已获得智利天主教大学生物科学学院生物伦理学和生物安全委员会的批准。
1. 青蛙的自然交配
- 交配前三到五天,皮下注射50单位的人绒毛膜促性腺激素(hCG)预注射雄性和雌性青蛙。使用"铁爪"技术来约束青蛙;由于青蛙很滑,如有必要,请使用网包围青蛙。将26 G x 1/2"针头的尖端向后插入外侧线,将其背部推至皮肤和肌肉之间的1厘米深度。
- 在交配之前,向雄性注射300个单位,向雌性注射700个单位的hCG。
- 为了发生交配,将雄性和雌性置于2升0.1x Barth溶液中,在4°C下冷却溶液15分钟后立即将雄性和雌性置于2L中,以类似于春季条件,并在18°C下过夜。
- 16小时后,在塑料巴斯德移液器的帮助下小心地收集胚胎,切断尖端,并将它们放入直径为10厘米的培养皿中。通过在蒸馏水(pH 7.8;确保溶液覆盖胚胎)中用25mL 2%半胱氨酸孵育胚胎5分钟并轻微搅拌来去除胚胎果冻涂层。用蒸馏水洗涤3次,用0.1x Barth溶液洗涤3次(8.9mM NaCl;102μM KCl;238.1μM NaHCO3;1mM 4-(2-羟乙基)-1-哌嗪乙烷磺酸(HEPES);81.14μM MgSO4;33.88μM Ca(NO3)2;40.81μM CaCl2,pH 7.6)。
- 选择具有褐色和对称分裂的卵裂球的健康胚胎。将胚胎放入直径10厘米的培养皿中,用50 mL的0.1x Barth溶液以每培养皿不超过100个胚胎的密度。
2. 畜牧业
- 在第一周,将胚胎保持在18°C,直到它们离开卵泡囊。在此期间,每天更换Barth溶液,并去除白色的死亡胚胎和蝌蚪,呈现任何可见的解剖学改变或蝌蚪没有任何游泳运动。
- 第一周后,将蝌蚪转移到塑料罐中的无氯水中,密度为每升10只动物。在20-21°C下以12小时光照/ 12小时黑暗循环培养蝌蚪,每个水箱中都有氧结石给水充气,每天喂食一次,每只动物0.5毫克。每周补充一次水,每天检查是否有积聚的废物和死亡动物24。
3. 分期
- 受精后三到四周,将动物放在培养皿中;然后,逐个检查前肢和后肢的形态和外观。如有必要,通过将动物置于培养皿中,将50 mL的0.02%甲磺酸三卡因放入0.1x Barth溶液中来麻醉动物,以便更好地操作。不超过2分钟后,将动物置于0.1x Barth溶液中,以从麻醉中恢复。
- 寻找50期动物的以下解剖学特征25:刚刚出现的前肢并且是球形的(图1);后肢突出且呈球形(图1)。
注意:从阶段49到51的动物可用于该过程(图1);有关阶段的更多信息,请参阅Nieuwkoop和Faber的非洲爪蟾普通表25。
4.手术:脊髓切除和假手术动物
- 将50期蝌蚪置于培养皿中,在0.1x Barth溶液中麻醉50期蝌蚪,其中50 mL为0.02%甲磺酸三卡因2分钟。
- 在汤匙和镊子的帮助下,将蝌蚪背部朝上放在玻璃培养皿上半部分的湿纱布上。
- 使用显微切割弹簧剪刀在胸部中部进行皮肤和背侧肌肉的切口(图2A,B)。
- 对于对照假动物,确保切口尺寸仅为〜0.2毫米(图2C);不损伤脊髓(图2D,D')。
- 对于截面动物,进行约0.2毫米的第二次切口(图2C)以完全横切脊髓(图2E,E')。
5. 术后护理
- 手术后,将蝌蚪转移到含有0.5升0.1x Barth溶液和1x青霉素 - 链霉素的罐中,每个罐的密度为10-12只动物。在单独的水箱中维护截面并控制假动物。
注意:蝌蚪将在几分钟内从麻醉中恢复过来。 - 将蝌蚪保持在20-21°C的温度下枸气。
- 每隔一天用抗生素更换Barth溶液,直到实验结束。
- 手术后一天开始喂养动物,每天一次。
- 消灭死去的动物。
6. 游泳试验
- 从内部获得一个带有LED照明的盒子,上面覆盖着透明的聚苯乙烯片,允许光线通过。
- 在 LED 盒上安装摄像头。
- 将一个直径为15厘米的培养皿放在盒子的顶部,里面装满了100毫升0.1x Barth溶液。
- 换剖后一天,将蝌蚪放入培养皿中,放置5分钟的适应期。
- 适应后,使用引用的软件(参见 材料表)开始视频跟踪自由游泳行为5分钟。
- 视频完成后,将蝌蚪移回其水箱。
- 在横断后5天、10天、15天和20天重复视频跟踪(图3)。
7. 生物伦理学考虑
注:假手术和横断后动物的死亡率分别为13%和30%。此外,每组至少需要15-20只动物进行统计分析。因此,从23个假动物和26个截面动物开始。
- 用0.02%甲磺酸三卡因麻醉动物2分钟,以确保手术前减少神经元和运动活动以及疼痛。
- 手术后,检查动物是否从麻醉中恢复。此外,每天喂养和检查动物。
- 完成游泳测定后,用过量的甲磺酸三卡因(在30mM碳酸氢钠溶液中制备的1%甲磺酸三卡因)处死动物。
结果
本文中描述的方案允许研究 非洲爪蟾的脊髓再生。特定药物治疗的效果和特定基因表达对脊髓再生的贡献可以通过测量它们对游泳恢复的影响来评估。总游泳距离与受伤后的天数绘制,以比较特定时间点或指定时间段内的对照和治疗动物。运动功能随时间的恢复如图 3所示,显示了横断后5天、10天、15天和20天的游泳距离。在转染后5天,动物在5分钟内平均游动0.7米,显示出游泳能力降低。该容量随着天数的增加而增加,在转染后10天和15天后分别观察到平均2.1和3.1 m / 5 min,并且在转染后20天观察到游泳能力完全恢复,平均为5.7 m / 5 min。
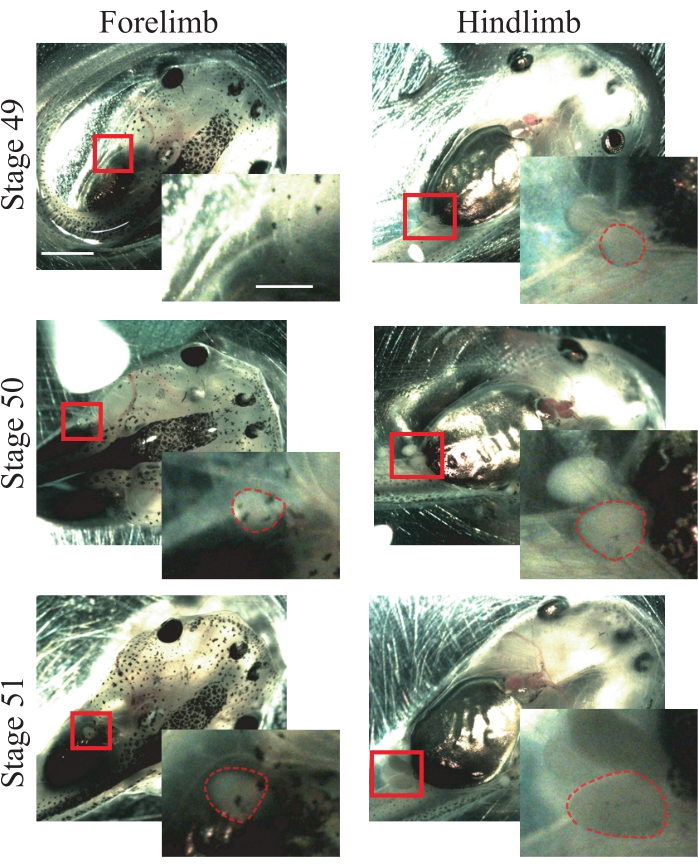
图1:非洲爪蟾蝌蚪分期。 阶段49-51的代表性图像,显示前肢和后肢供动物分期参考。比例尺 = 2 毫米。每个图像的右下角显示了盒装区域的放大倍率。比例尺 = 1 毫米。在第49阶段,没有观察到前肢,而后肢只是出现,显示出球形。第50阶段呈现刚刚出现的前肢,显示球形和后肢突出的球形。在第51阶段,前肢呈现突出的球形,后肢呈突出的细长形状。虚线轮廓显示前肢和后肢。 请点击此处查看此图的放大版本。
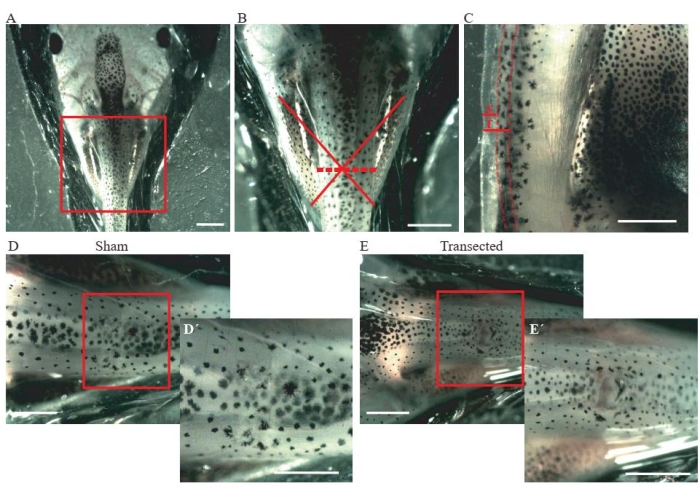
图2:脊髓横断(A)代表性图像显示动物的正确位置,背侧朝上,用于进行手术。比例尺 = 2 mm.(B) A 的放大倍率显示损伤的位置和程度。红十字显示了损伤部位在脊髓胸层的确切位置,虚线显示了损伤的程度。比例尺 = 1 mm. (C) 显示脊髓胸腔水平侧视图的代表性图像。显示假切口和横断的延伸。虚线描绘了脊髓的极限。比例尺 = 1 mm. (D) 代表性图像,显示脊髓完好无损的假动物。比例尺 = 1 mm.(E)代表性图像,显示脊髓中断的截断动物。比例尺 = 1 毫米。框内区域的放大倍率显示在每个图像(D'和E')的右下角。比例尺 = 1 mm. 缩写: S = 假切口;T = 横断面。请点击此处查看此图的放大版本。
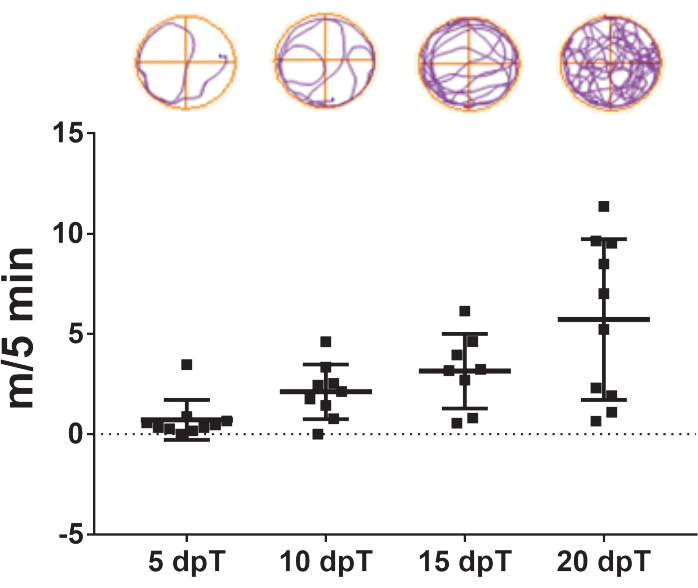
图3:游泳功能随时间推移的恢复情况。 在截面后5天、10天、15天和20天内,截面动物所覆盖的游泳距离的代表性点阵图。游泳轨迹的样本显示在顶部。数据显示为来自10个蝌蚪的平均±SEM。缩写:dpT = 切除后天数;SEM = 均值的标准误差。 请点击此处查看此图的放大版本。
讨论
本文中描述的方案是执行 SCI 和评估功能恢复的极好方法。为了可重复性,必须种植健康的蝌蚪并选择大小相似的动物。缺乏适当的喂养会产生营养压力,导致再生能力差26;因此,应特别注意蝌蚪喂养。当蝌蚪在3-4周后达到50阶段时,它们可以在更高的温度下饲养以加速生长过程,18-25°C是最佳的27。水质很重要,因为动物对水条件和化学产品很敏感。最佳水条件包括使用碳过滤的无氯水,其参数如下:pH值(6.5-7.5),氯化物(<0.02 mg / L),水电导率(1.0 mS / cm ±0.1单位),铜(<0.3 mg / L);碳酸盐硬度(KH:5-10 dKH);一般硬度(生长激素:6-16分高);硝酸盐(NO3:<20毫克/升);和亚硝酸盐(NO2:<0.1毫克/升)14,27,28。此外,为避免污染,塑料罐应每周清洁一次,用于饲养动物,或在手术后每隔一天用无氯水和海绵彻底清洗;必须避免使用洗涤剂。
为了提高术后存活率,蝌蚪不得长时间(不超过2分钟)暴露于麻醉中。此外,建议一次麻醉一个蝌蚪。由于动物需要保持水分,因此在手术前后始终将动物浸泡在溶液中,并在开始手术前用勺子将溶液倒在蝌蚪的顶部。确保损伤范围足够广泛,可以覆盖整个脊髓,但不要太广泛,因为它会导致功能恢复不良或死亡。如果横截面受损,动物将被弯曲,功能恢复将受到影响。如果损伤超出尾部,死亡概率增加14。在游泳测定过程中,如果软件用蓝色阴影识别出每只动物,则记录被认为是正确的;否则,应重复录制。在录制过程中,重要的是要避免移动和空气或光线变化,以防止录制错误。
关于脊髓损伤和再生背后的细胞和分子机制,仍然存在许多悬而未决的问题。这项工作中描述的方案可用于研究不同细胞事件,基因表达和治疗对功能恢复的贡献,通过测量游泳能力来确定。此外,许多其他技术可以应用于手术动物。可以分离脊髓以进行蛋白质和/或mRNA提取14 ,以研究损伤和治疗后的蛋白质和基因表达谱19,20。该手术也是研究脊髓细胞反应22 和脊髓损伤后神经干祖细胞行为的基础12,13,22 。还使用本文描述的脊髓损伤范式研究了参与脊髓再生的信号级联反应23。总之,这里描述的方案是研究脊髓损伤和再生的极好模型,并已被用于许多有助于有关该主题的现有知识的研究。
披露声明
作者没有利益冲突要声明。
致谢
这项工作由以下研究资助资助:PG Slater:FONDECYT N° 3190820;J. Larraín: FONDECYT N° 1180429, CARE Chile UC-Centro de Envejecimiento y Regeneración (PFB 12/2007).
材料
| Name | Company | Catalog Number | Comments |
| Air pump | Regent CALM | RC-006 | For oxygen diffuser stones function |
| ANY-maze software | Stoelting | Swimming behavior test | |
| Ca(NO3)2·4H2O | Sigma-Aldrich | 237124 | |
| CaCl2·2H2O | Sigma-Aldrich | 223506 | |
| Camera | Stoelting | 60528 | Swimming behavior test |
| Computer | Swimming behavior test (minimum recommended specifications: PC, Windows 7, Intel Core i3, 2 GB RAM, 10-GB drive disk, 1 available USB port, 1,366 × 768 monitor) | ||
| Cysteine | Sigma-Aldrich | C7352 | |
| Dissecting stereomicroscope | Nikon | SMZ745T | Surgery / staging |
| Glass Petri dishes | 100 x 20 mm | ||
| HEPES | Gibco | 11344-041 | |
| Human chorionic gonadotropin | It can be found in different formats in the pharmacy | ||
| KCl | Merck Millipore | 104936 | |
| LED light box | custom made | wood box: 55-cm length, 34-cm width, 9-cm height, LED lights, transparent polystyrene sheet) | |
| MgSO4·7H2O | Merck Millipore | 105886 | |
| Microdissection scissors for transection | Fine Science Tools | 15003-08 | Spring Scissors for surgery |
| MS-222 | Sigma-Aldrich | E10521 | Anesthetic; tricaine mesylate |
| NaCl | Merck Millipore | 106404 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| Nasco Frog Brittle for Tadpole Xenopus | Nasco | SB09480(LM)MX | Food for Xenopus tadpoles stage 44 to 60 |
| Oxygen diffuser stones | Pentair | AA1 | Mantainance of animals |
| Pair of forceps | Fine Science Tools | Dumont n° 5 SF forceps | For surgery |
| Penicillin | Sigma-Aldrich | P7794 | |
| pH meter | |||
| Plastic Pasteur pipette | Sigma-Aldrich | Z331740 | For collecting embryos after mating |
| Plastic Petri dishes | Sigma-Aldrich | P5981 | 150 x 15 mm |
| Plastic tank/box with lid | 4.5 liter capacity; 20 cm × 17 cm × 15 cm or similar | ||
| Sterilized gauze | |||
| Streptomycin | Sigma-Aldrich | S1277 | |
| Tablespoon | |||
| Xenopus laevis specialized strains and lines | National Xenopus Resource European Xenopus Resource Centre Xenopus laevis Research Resource Centre | http://www.mbl.edu/xenopus https://xenopusresource.org/ https://www.urmc.rochester.edu/microbiology-immunology/xenopus-laevis.aspx | |
| Xenopus laevis wild type | Xenopus 1 Xenopus Express | https://xenopus1.com http://www.xenopus.com |
参考文献
- International perspectives on spinal cord injury. World Health Organization Available from: https://www.who.int/publications/I/item/international-perspectives-on-spinal-cord-injury (2013)
- Quiroz, J. F. D., Echeverri, K. Spinal cord regeneration: Where fish, frogs and salamanders lead the way, can we follow. Biochemical Journal. 451 (3), 353-364 (2013).
- Lee-Liu, D., Méndez-Olivos, E. E., Muñoz, R., Larraín, J. The African clawed frog Xenopus laevis: A model organism to study regeneration of the central nervous system. Neuroscience Letters. 652, 82-93 (2017).
- Phipps, L. S., Marshall, L., Dorey, K., Amaya, E. Model systems for regeneration: Xenopus. Development. 147 (6), (2020).
- Lee-Liu, D., Edwards-Faret, G., Tapia, V. S., Larraín, J. Spinal cord regeneration: Lessons for mammals from non-mammalian vertebrates. Genesis. 51 (8), 529-544 (2013).
- Beck, C. W., Christen, B., Slack, J. M. W. Molecular pathways needed for regeneration of spinal cord and muscle in a vertebrate. Developmental Cell. 5 (3), 429-439 (2003).
- Love, N. R., et al. Genome-wide analysis of gene expression during Xenopus tropicalis tadpole tail regeneration. BMC Developmental Biology. 11, 70 (2011).
- Love, N. R., et al. Amputation-induced reactive oxygen species are required for successful Xenopus tadpole tail regeneration. Nature Cell Biology. 15 (2), 222-228 (2013).
- Gargiolo, C., Slack, J. M. W. Cell lineage tracing during Xenopus tail regeneration. Development. 131 (11), 2669-2679 (2004).
- Lin, G., Chen, Y., Slack, J. M. W. Regeneration of neural crest derivatives in the Xenopus tadpole tail. BMC Developmental Biology. 7, 56 (2007).
- Filoni, S., Bosco, L., Cioni, C. Reconstitution of the spinal cord after ablation in larval Xenopus laevistle. Acta Embryologiae et Morphologiae Experimentalis. 5 (2), 109-129 (1984).
- Gaete, M., et al. Spinal cord regeneration in Xenopus tadpoles proceeds through activation of Sox2-positive cells. Neural Development. 7, 13 (2012).
- Muñoz, R., et al. Regeneration of Xenopus laevis spinal cord requires Sox2/3 expressing cells. Developmental Biology. 408 (2), 229-243 (2015).
- Edwards-Faret, G., et al. Spinal cord regeneration in Xenopus laevis. Nature Protocols. 12 (2), 372-389 (2017).
- Méndez-Olivos, E. E., Larraín, J. Cell transplantation as a method to investigate spinal cord regeneration in regenerative and nonregenerative xenopus stages. Cold Spring Harbor Protocols. 2018 (12), 943-947 (2018).
- Méndez-Olivos, E. E., Muñoz, R., Larraín, J. Spinal cord cells from pre-metamorphic stages differentiate into neurons and promote axon growth and regeneration after transplantation into the injured spinal cord of non-regenerative Xenopus laevis froglets. Frontiers in Cellular Neuroscience. 11, 398 (2017).
- de Vidts, S., Méndez-Olivos, E., Palacios, M., Larraın, J., Mery, D. Characterization of spinal cord damage based on automatic video analysis of froglet swimming. Biology Open. 8 (12), 2-11 (2019).
- Slater, P. G., Palacios, M., Larraín, J. Xenopus, a model to study wound healing and regeneration: Experimental approaches. Cold Spring Harbor Protocols. 2021 (8), 100966 (2021).
- Lee-Liu, D., et al. Genome-wide expression profile of the response to spinal cord injury in Xenopus laevis reveals extensive differences between regenerative and non-regenerative stages. Neural Development. 9, 12 (2014).
- Lee-Liu, D., Sun, L., Dovichi, N. J., Larraín, J. Quantitative proteomics after spinal cord injury (SCI) in a regenerative and a nonregenerative stage in the frog Xenopus laevis. Molecular and Cellular Proteomics. 17 (4), 592-606 (2018).
- Peñailillo, J., et al. Analysis of the early response to spinal cord injury identi fi ed a key role for mTORC1 signaling in the activation of neural stem progenitor cells. NPJ Regenerative Medicine. 6 (1), 68 (2021).
- Edwards-Faret, G., et al. Cellular response to spinal cord injury in regenerative and non-regenerative stages in Xenopus laevis. Neural Development. 16 (1), 2 (2021).
- Tapia, V. S., Herrera-Rojas, M., Larrain, J. JAK-STAT pathway activation in response to spinal cord injury in regenerative and non-regenerative stages of Xenopus laevis. Regeneration. 4 (1), 21-35 (2017).
- Ishibashi, S., Amaya, E. How to grow Xenopus laevis tadpole stages to adult. Cold Spring Harbor Protocols. 2021 (3), (2021).
- Nieuwkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin).: A systematical and chronological survey of the development from the fertilized egg till the end of metamorphosis. , (1994).
- Williams, M. C., Patel, J. H., Kakebeen, A. D., Wills, A. E. Nutrient availability contributes to a graded refractory period for regeneration in Xenopus tropicalis. Developmental Biology. 473, 59-70 (2021).
- Vleminckx, K. . Xenopus: Methods and protocols. , (2018).
- Sive, H. L., Grainger, R. M., Harland, R. M. . Early development of Xenopus laevis: A laboratory manual. , (2000).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。