Method Article
使用2光子显微镜量化慢性单侧输尿管梗阻对肾小球过程的影响
摘要
在这里,我们提出了一种在慕尼黑Wistar Fromter大鼠中使用2光子显微镜的协议,以量化长期输尿管阻塞对肾小球动力学和功能的影响。
摘要
将新的显微镜方法应用于合适的动物疾病模型以探索肾脏的动态生理学仍然是一个挑战。具有表面肾小球的大鼠提供了使用活体2光子显微镜研究生理和病理生理过程的独特机会。肾小球毛细血管血流的定量以及药物、通透性和炎症引起的血管收缩和扩张只是可以研究的一些过程。此外,转基因大鼠,即用荧光染料和其他分子生物标志物方法标记的足细胞,提供了更高的分辨率,可以直接监测和量化蛋白质 - 蛋白质相互作用以及特定分子改变的影响。
在四周后缺乏表面肾小球的小鼠中,数周的单侧输尿管梗阻(UUO)已被用于诱导表面肾小球。由于该诱导模型不允许进行基线研究,因此我们量化了UUO对慕尼黑Wistar Frömter(MWF)大鼠UUO模型中肾小球过程的影响,这些大鼠在生理条件下具有表面肾小球。五周或更长时间的UUO模型诱导了大体肾形态,肾小管周围和肾小球微脉管系统以及肾小管上皮的结构和功能的显着改变。肾小球和肾小管周围红细胞(RBC)流量显著减少(p < 0.01),可能是由于肾小球和肾小管周围毛细血管内白细胞(WBC)的粘附显著增加。白蛋白的肾小球筛分系数从未处理的MWF的0.015±0.002增加到5周龄UUO MWF大鼠的0.045±0.05。UUO治疗12周导致白蛋白表面肾小球密度和肾小球筛分系数(GSC)进一步增加。通过肾小球过滤的荧光白蛋白未被近端小管重吸收。这些数据表明,使用UUO诱导表面肾小球限制了研究和解释正常肾小球过程和疾病改变的能力。
引言
了解肾小球过程,尤其是足细胞生物学,一直是50多年来的目标。慕尼黑Wistar大鼠表面肾小球在这些研究中发挥了核心作用,包括微穿刺研究,以了解生理和病理过程的许多方面1,2,3。由于光毒性的影响,显微镜在活体内研究肾小球成分的使用受到限制,直到2光子显微镜的出现,最大限度地减少了这种毒性暴露并增加了穿透深度1,2。随着计算机硬件和软件的快速发展,这允许在单一环境中进行数小时的三维(3D)和四维(时间)研究1,4,5。
肾小球毛细血管血流的定量、药物反应中的血管收缩和扩张、通透性以及电荷对通透性和炎症的影响只是已经研究的一些肾小球过程。此外,近端小管的 S1 段是可识别的,并且可以量化 S1 和 S2 肾小管上皮的行为差异1,4。对小鼠的研究,特别是随着小鼠转基因设施的普遍可用性,导致了对肾小球疾病过程分子生物学的理解的快速进展。在敲除研究中,单个蛋白质是导致肾小球功能障碍的原因,特别是在蛋白尿6,7,8方面。然而,小鼠模型用于肾小球成像研究的使用受到限制,因为在研究的众多菌株中,肾小球在表面以下超过100μm9。
这导致研究人员开发和利用小鼠模型,从而产生可以研究的表面肾小球。最常见的模型是使用完整的UUO10,11,12。在延长的UUO期结束时,小鼠肾脏中有许多表面肾小球可以并且已经进行了研究13,14。在这些小鼠研究中,没有基线或对照研究来确定延长UUO对肾小球生物学的影响。由于这是一种严重且长期的损伤模型,导致快速纤维化和皮质破坏10,11,12,我们假设会对肾小球过程和功能产生影响。为了回答这个问题,使用具有表面肾小球的Munich Wistar Fromter(MWF)大鼠来研究对照/基线参数,并将基线结果与UUO五周后MWF大鼠的肾小球研究进行比较。我们还研究了在UUO后没有表面肾小球的Sprague Dawley(SD)大鼠。研究结果表明,MWF和SD大鼠5周的UUO确实增加了表面肾小球的数量。然而,这些是异常的肾小球,肾小球血流、炎症以及大分子通透性和大小有明显变化。
研究方案
所有实验均遵循实验动物护理和使用指南,并得到印第安纳大学医学院动物护理和使用委员会的批准。
1. 准备慕尼黑Wistar Frömter或SD大鼠进行UUO手术
- 使用异氟烷麻醉大鼠(5%诱导,1.5-2.5%维持),然后用碘或氯己定磨砂膏和酒精以圆周运动对手术区域进行几次剃须,洗涤和消毒。根据机构 IACUC 指南,使用长效/缓释镇痛药进行疼痛管理。
- 使用手术刀沿中线切开;找到左肾并将其从周围的腹膜器官中解放出来。
- 仔细定位肾蒂,包括肾动脉、肾静脉和输尿管。将输尿管与其他结构分开,采取预防措施不要损坏脆弱的结构。
- 使用细镊子,小心地在输尿管周围缠绕 3-0 缝合并将其系好,小心不要撕裂它。在第一个结的两侧重复此过程几毫米,以打第二个结并确保完全阻塞。
- 手术完成后,小心地关闭连续的肌肉层。在闭合最后一层之前,在完全闭合之前,将 2 mL 温热的无菌 0.9% 盐水加入腹部。用手术钉关闭外皮。
- 使用长效/缓释镇痛药进行疼痛管理,并根据IACUC机构指南密切观察恢复情况。此后定期监测,并在第五周结束时准备影像学检查。
2. 德州红鼠血清白蛋白(TR-RSA)的合成
- 称出 100 mg 大鼠血清白蛋白,并将其溶解在 6.67 mL pH 8.4 的 0.1 M 碳酸氢钠缓冲液中,浸泡在 50 mL 锥形管中。
- 在一瓶 5 mg 德克萨斯红-X-琥珀酰亚胺酯中,加入 100 μL 二甲基甲酰胺(DMF,高质量)并涡旋直至所有染料溶解。
- 将大鼠血清白蛋白溶液放在低/中设置的涡旋器上,使溶液体积在开管顶部下方旋转。
- 在管子涡旋时加入溶解的染料。
- 取50mL锥形管,用箔纸包裹,将管放在任何摇臂或滚筒上,并在室温(RT)下缓慢搅拌1小时。
- 在带有搅拌棒的 5 L 桶中,在温和搅拌下,润湿合适的 50 kDa 截止透析器的膜(带有夹子的膜、封闭的膜管或透析盒都是合适的)。
- 将TR-RSA溶液装入膜系统中,并将其连接到通常包含在系统中的浮选附件上。将装有0.9%盐溶液/ TR-RSA的5L容器在4°C(在冷藏室中)下在搅拌板上轻轻搅拌过夜。在接下来的36小时内至少更换透析溶液三次。
- 膜的膨胀将增加现在透明的TR-RSA溶液的体积。将原来的100毫克除以体积以获得近似浓度:染料:蛋白质的比例将为1:1。分装成合适的体积并冻干以长期储存。
3. 倒置显微镜上2光子活体成像的准备
- 取下 50 mm 盖玻片底盘(盖玻片直径为 40 mm)的盖子,并将 8 片高压灭菌器胶带放在边缘旁边的内底部。制作一个金字塔形的空窗,每边使用 4 块,让外部肾脏紧贴在这个空间中,同时保持与高压灭菌器胶带的外围接触,从而有助于最大限度地减少运动。根据大鼠的大小调整间距,以确保与肾脏的最佳接触。
- 在 50 毫米盖玻片底盘的每一侧放置 1 个导热垫。确保加热垫覆盖舞台。
- 使用0.75倍变焦和1.5倍变焦的40倍水浸物镜分别生成30倍和60倍图像,从而获得较低和较高放大倍率的图像。如有必要,使用带有长段PE-200管的1 mL注射器向物镜加水,该注射器可以向下到达物镜顶部,以防止水滴顺管向下排汗。
- 使用2%的激光透射率,将蓝色,绿色和红色检测器设置为预定水平,以确保研究之间图像的一致性。在参考激光器上将激发波长设置为800nm(参见 材料表),这将有效地激发本研究中使用的所有荧光团。
- 使用外部(非去扫描)探测器使用光电倍增管(PMT)(420-490 nm,增益950)收集蓝色发射。
- 使用 Hyd 检测器捕获绿色排放(500-550 nm,增益 100)。
- 使用 Hyd 检测器捕获红色发射(590-660 nm,增益 200)。
- 调整PMT(蓝色发射)中的偏移量,使组织空白区域中只有几个像素的值为零。
注意:用于绿色和红色排放的 HyD 探测器具有自动偏移调整功能;只能设置增益。 - 将位深度设置为 12 位,以使图像在黑白之间具有 4,096 强度的刻度。
注意:有必要设置探测器的下限(以PMT为单位的偏移量)以不排除这些值,以确保收集Bowman空间内的低强度发射。如果灵敏度设置太低,视觉警告标记将指示这一点;这些值的强度值为零。
- 将约6mg德克萨斯红-X-Rat血清白蛋白稀释至总体积为1mL,将溶液装入1mL注射器中,并在步骤9.1中输注Hoechst 33342后,在步骤4.1中置于留置静脉导管上。
4. 活体2光子成像的手术准备
- 将预麻醉大鼠侧放留留静脉通路(股骨或颈动脉),剃光的左胁面朝上并笔直地放在桌子上。确保前爪相互接触,后爪也应如此。
- 轻轻触诊肋骨下方的左胁,感受肾脏以确定腹部的自然位置。如果需要,使用永久性记号笔沿着剃须区域画一条线,将肾脏中心以鼻子到尾巴的方向一分为二。
- 用一对带齿的镊子,抓住皮肤并将其向上提起,以方便用一对止血器捏住永久性标记线,以压碎下面的脉管系统并防止用一把手术剪刀切开时出血。对薄的外层肌肉层重复此操作,以尽量减少出血。
- 为了对薄的内腹部肌肉层进行最终切口,请重新触诊肾脏以估计大小和位置。用一对镊子小心地抬起内肌层,并用大约是肾脏估计大小的 1 /3 的止血器压碎一条将肾脏上方皮肤一分为二的线。
- 用镊子保持对肌肉层的抓地力,做最后的切口。
注意:最好做一个较小的切口并根据需要扩大,而不是让它太大,这将需要用缝合线部分闭合。 - 轻轻抓住肾脏周围的脂肪。使用双手,每只手拿着镊子,通过使用手交接技术来握住肾脏下极的脂肪,向下工作。
- 用一只手牢牢抓住肾脏下极的脂肪,轻轻拉动脂肪,如果需要,非常轻轻地通过切口挤压肾脏。如果肾脏不容易通过,请扩大切口。
5. 定位大鼠进行成像
- 小心地将暴露的肾脏放在培养皿的边缘,稍微旋转,使肾脏的腹部接触盖玻片,背侧背对边缘。
- 为了进一步减少运动,取两个无菌的2 x 2纱布垫,用盐水润湿它们,并将它们包装在肾脏的背侧,加强肾脏腹部与边缘的接触。
- 使用双通道罗丹明/FITC立方体在落射荧光照明下通过显微镜目镜观察。如果检测到运动,请对位置进行细微调整并仔细调整纱布,确保它不会推到肾脏下方。为了进一步减少运动,将老鼠稍微翻过来,使胸部离盘子更远。
6. 用于定量分析的图像采集
- 使用落射荧光照明扫描肾脏表面(步骤5.3),并使用与电动载物台控制器关联的软件标记肾小球位置(现代系统的功能)。
- 对于2光子照明下的每个颜色通道,取每个标记肾小球上部的浅3D体积,该体积将用作背景图像。在成像软件的 显示 选项中使用伪调色板,以更好地可视化肾小球毛细血管袢的背景荧光的微弱强度。
- 使用浅表血管作为焦点,缓慢注入荧光白蛋白,留出时间观察由于全身分布而导致的荧光的上升和下降。注入足够的 TR-RSA,使肾小管周围脉管系统和毛细血管袢的强度略低于饱和度。
注意:当肾脏灌注正常时,在输注物质和其在血液中出现之间通常有 5 秒的延迟。 - 等待大约10分钟,然后从步骤6.2中获取所有标记和成像肾小球的3D体积(1μm间隔)。
注意:西蒙森的慕尼黑Wistar大鼠表面肾小球较少。然而,由于MW大鼠的Frömter品系具有更多的表面肾小球,因此通常可以成像多达10个肾小球。 - 在研究结束时通过过量的异氟醚对大鼠实施安乐死。进行双重气胸胸合术以确保安乐死。
7. 计算肾小球通透性
- 使用与显微镜系统关联的图像查看软件,将图像导出为12位原始图像进行处理和分析。
- 加载背景 3D 体积和包含循环荧光白蛋白的原始 3D 体积。在 3D 体积中找到焦平面,肾小球中具有最亮的浅表毛细血管环,并且有足够的空间到周围 Bowman 囊的边缘。
- 使用视觉地标,找到在背景体积中找到的相同焦平面。在毛细管环中选择一个区域,并在Bowman空间内选择一个区域,注意每个区域的平均强度值。使用这些强度值作为背景值。
- 在含白蛋白的图像中勾勒出鲍曼空间内的一个区域(至少 20 x 20 像素的区域),并注意强度读数(选择不与毛细管环或鲍曼胶囊相邻的区域,以确保最干净地测量鲍曼的空间强度)。将绘制的区域移动到其他两个区域上,以获取鲍曼空间内平均强度的平均值。
- 选择毛细管环内最亮的血浆荧光强度并环绕该区域。使用 阈值 函数,突出显示亮值(通常位于毛细管环壁的边缘),避免循环的RBC阴影,并记录该值。
注意:由于血液中的因素会导致血浆荧光水平的低估,因此选择最亮的区域很重要。 - 在电子表格中输入值以使用公式 (1) 计算 GSC:
GSC = (1)
(1)
8. 使用线扫描功能计算表面肾小球毛细血管袢和肾血管系统中的红细胞流量
- 寻找合适的血管(毛细管环或管状血管)。由于参考图像采集软件中的 线扫描 功能(参见 材料表)要求容器垂直,因此请使用旋转功能 旋转 图像。
- 容器旋转并平放后,选择采集菜单上的 XT 功能。设置为扫描 4,000 行。将线放在要检查的容器上;确保焦平面处于要成像的段的最大直径。
- 左键单击彩色合成图像并选择 "拍摄快照" 以生成线扫描拍摄区域的参考图像。立即单击 "开始 "按钮以捕获容器的线扫描。
- 要确定RBC流速,请将线扫描导入图像处理软件(参见材料表)。打开测量下拉菜单下的显示区域统计数据对话框。选择单线绘制工具并绘制与 RBC 阴影斜率匹配的线。请注意宽度和高度值。
注意:为宽度获得的像素值将对应于距离;高度像素对应于时间。 - 使用以下公式(等式(2))计算速度。
以μm/s为单位的红细胞流速 =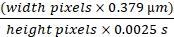 (2)
(2)
注意:这对应于使用参考显微镜在60倍放大倍率和400 Hz扫描速率下的采集参数(参见 材料表)。- 至少进行五次计算并平均它们以报告每个行扫描的速度。
注意:这些参数将取决于显微镜系统的像素尺寸和采集速度。
- 至少进行五次计算并平均它们以报告每个行扫描的速度。
9.计算肾小球毛细血管袢中的白细胞闭塞
- 通过留置静脉通路施用 Hoechst 33342 核染色(~8 μg/kg 大鼠重量),以识别滞留在毛细血管袢中的 WBC。
注意:由于光子散射和血红蛋白吸收,可用深度将受到限制,特别是对于较短波长的蓝色发射。 - 将肾小球置于成像区域的中心,并从肾小球表面开始获取 3D 数据集,并在至少 30 至 35 μm 处结束数据。在 Z 方向上使用 1 μm 的步长。
- 通过将蓝色赫斯特通道与德克萨斯红白蛋白通道进行比较来识别白细胞;寻找毛细管环中红色染料的排除和相应的核染色,以阳性识别白细胞。 如果白细胞在 3 个光学切片上显示为静态,则将白细胞定义为"粘附"。将值报告为从肾小球顶部开始的发生/10个光学切片,以1μm的间隔拍摄。
10. 评估表面肾小球中鲁洛形态的存在
- 按照步骤 9.3 的相同说明获取 3D 数据集。寻找Rouleaux形成,表现为红细胞堆叠成包,当它们沿着毛细管环移动时抵抗解离。使用红色荧光团,由于较长波长的红色发射的光子散射较少,因此在更深的深度更好地可视化结构。将值报告为从肾小球顶部开始的发生/25个光学切片,以1μm的间隔拍摄。
11.肾小球的分离
- 使用标准筛分技术从新鲜肾脏中分离三组肾小球,使大鼠肾小球纯度接近90%15。
- 将肾皮质放入冷磷酸盐缓冲盐水(PBS)中,并使用多把细剪刀或剃须刀片切碎。
- 将切碎的组织加入 100 μm 无菌细胞过滤器中,并使用 5 mL 注射器柱塞和 50-100 mL 冷 PBS 轻轻推动其通过。
注意:当肾小球通过时,大多数小管被保留。 - 将富集的肾小球部分放在70μm过滤器上,并用冷PBS广泛洗涤。用 100-200 mL 冷 PBS 清洗过滤器,以去除大部分剩余的小管。
- 使用1-2mL冷PBS从过滤器中收集肾小球,离心(10,000× g,2分钟,4°C)并在液氮中快速冷冻直至RNA分离。
注意:通过相差显微镜测定的肾小球纯度为>90%,来自2个肾脏的产量约为10mg。
12. 肾小球RNA分离
- 通过加入 400 μL 试剂并使用 200 μL 移液管吸头分解沉淀,然后短暂涡旋并在RT 16 下孵育 5 分钟,使用 RNA 分离试剂匀浆冷冻的肾小球沉淀。
- 加入 40 μL 1-溴-3-氯丙烷 (BCP),涡旋 15 秒,并在室温下保持 15 分钟。
- 以12,000 ×g离心,15分钟,4°C。 除去水层,用等体积的70%乙醇稀释下层,然后将其直接加载到离心柱上(参见 材料表)。
- 洗涤后,每次洗涤包括将相应的溶液添加到色谱柱中,然后在12,000 x g ,15 s,26 °C [总共3次,前2次用500 μL RPE(专有的乙醇温和洗涤缓冲液以去除痕量盐,用500 μL 80%EtOH进行第三次洗涤],通过加入15 μL H2洗脱RNAO 和离心机,至于洗涤。检查RNA的浓度和纯度,并将RNA样品运输到核心设施进行纳米弦分析17,18。
注意:总RNA产量约为1-2μg。在这里,24个样品含有200 ng的RNA,浓度为30 ng / μL。
13. 纳米弦分析
注意:纳米弦技术基于利用颜色编码探针对的目标分子的数字检测和直接分子条形码。捕获探头在其 3' 端携带生物素部分,报告器探头在其 5' 端携带信号。
- 将Nanostring基因探针对和CodeSets运送到密歇根州立大学的基因组核心设施,并按照NanoString的指示使用。
注意:颜色代码有六个位置,每个位置可以是四种颜色之一,从而实现了多种标签,每个标签都可以在数据收集期间单独解析和识别。 - 使用专有的Nanostring nCounter数字分析仪获取基因组核心设施工作人员收集的数据,该分析仪使用显微镜物镜和CCD相机收集视野,并制表并显示条形码计数。
- 将原始数据导入Nanostring的nSolver软件进行分析。规范化使用默认设置规范化的数据,并按照手册中所述在组之间比较数据。
注意:目的是监测先前显示的基因变化在皮质组织中的改变来自UUO模型19,肾脏疾病17,20,21,22,23,24,25,26。在每个肾小球组(CONT,SHAM和UUO)中总共分析了126个基因,包括推荐的阳性和阴性对照。
结果
使用标准筛分技术分离三组肾小球,导致大鼠肾小球纯度接近90%15。第一个肾小球组来自SD大鼠的左肾,接受左肾输尿管钳夹5周,UUO(5雄性,3雌性)。从同只大鼠CONT(5只雄性,3只雌性)的对侧对照肾中分离出第二肾小球组。第三组肾小球从接受SHAM手术的SD大鼠中分离出来,5周后左肾用于肾小球分离,SHAM(雄性4只,雌性4只)。
形态改变
阻塞肾脏的外部化用于成像显示肾脏严重肿大,约为正常大小的四倍,通过充满液体的肾脏内部可见薄上皮。通过20倍物镜,使用落射荧光照明和FITC/罗丹明双通道立方体,最明显的变化是肾小管上皮变薄和管腔沿整个管长均匀塌陷。组织学已经得到了很好的描述,并且在UUO10,11,12的一周内很严重。MWF和SD大鼠表面可见的肾小球数量在单侧输尿管梗阻五周后增加。图 1A 显示了用于创建 UUO 模型的方法。右肾未被触及,为大鼠提供足够的肾小球滤过率。使用20倍物镜(363μm x 363 μm)计算每个视野的肾小球数量,并在图1B的图表中显示。MWF大鼠表面肾小球数量从未治疗大鼠的1.08±0.11/田增加到五周UUO组的2.97±0.65/场。SD大鼠在UUO5周后从没有表面肾小球到2.02±0.37 /田。
注射TR-RSA(红色),10 kDa级联蓝色葡聚糖(10 kDa-CB)和Hoechst 33342以标记细胞核(青色)后,对这些大鼠进行活体2光子图像。这些显示了正常的MWF大鼠(图1C),UUO五周后的MWF大鼠(图1D)和UUO五周后的SD大鼠(图1E)。这些图像突出了肾小管上皮中发生的戏剧性变化。近端小管溶酶体通常是未经处理的MWF和SD大鼠中的小点状橙色积累,成为填充大部分收缩管状细胞的大型奇异液泡结构。如TR-RSA白蛋白所述,脉管系统呈拉直,在许多血管中,没有流动的红细胞,仅显示流动血浆。肾脏的固定显示,皮层已经变薄成厚度不超过一毫米的纤维皮肤。这些观察结果与使用该模型3,10,11,12的早期文献一致。
肾血管动力学和肾小球通透性的改变
与未治疗的大鼠相比,五周UUO MWF和SD组的肾血流量显着减少(图2)。假手术MWF大鼠的管状红细胞流速为885±25μm/s。五周UUO MWF和SD大鼠的肾小管周围红细胞流量分别降至250 ± 100 μm/s和200 ± 125 μm/s。这些值是通过收集管周血管的线扫描来计算RBC速度的。 图 2D 显示了这些数据的图表。
与未治疗的MWF相比,五周UUO MWF和SD大鼠肾小球毛细血管袢内的红细胞速度显着降低(图3)。在许多情况下,发现肾小球具有完全没有流动红细胞的毛细血管环。 毛细管环RBC流速分别为1,405±425μm / s,250±220μm/s±和190±200μm / s或未经处理的MWF,五周UUO MWF和五周UUO SD大鼠(图3D)。在为期五周的UUO组的毛细血管环内,红细胞的缓慢流动揭示了粘附性WBC的存在,要么减缓流动,要么阻塞血流,只有血浆流从部分或全部梗阻下游可见。为了量化这一观察结果,对在3D体积中发现的贴壁白细胞的数量进行计数,然后归一化为每10μm的3D体积深度发生数。粘附白细胞的结构可以使用Hoechst 33342的青色核染料荧光进行识别。不幸的是,蓝光发射光的更大光子散射限制了白细胞的可靠识别,通过它们的细胞核到从顶部开始的上10个光学切片,以肾小球体积的1μm步长进行。未经处理的MWF大鼠从顶部开始具有少于0.125±0.05个WBC / 10个光学切片,以1μm步长体积拍摄,而该数量分别增加到1.5±0.5和3.25±0.7在5周UUO MWF和5周UUO SD大鼠中(图3E)。
另一个血管改变也可能是5周UUO组中红细胞流量减少的原因,是Rouleaux形成的规则出现(以"堆叠硬币"配置粘附的分组红细胞,见 图3F的插图)。Rouleaux形成流动较慢,可由粘附的WBC阻止。未经治疗的WMF大鼠在其肾小球毛细血管中几乎没有Rouleaux形成,以1μm步长从顶部开始每25个光学切片仅发生0.05±0.05次。从顶部开始,为期五周的UUO MWF和SD大鼠每25个光学切片的Rouleaux形成显着增加2.27±0.46和1.46±0.73,分别以1μm步长(图3F)。
除了UUO可见肾小球红细胞流速降低外,还观察到白蛋白通透性增加。肾小球之间的白蛋白通透性异质性更大。偶尔,鲍曼空间内的白蛋白积累足够强烈,可以清楚地看到(图4B,星号)。白蛋白的肾小球筛分系数从未处理MWF的0.015±0.002增加到5周UUO MWF的0.045±0.05和5周UUO SD大鼠的0.052±0.075。
近端小管功能改变
有趣的是,在UUO之后的近端小管细胞中无法检测到过滤后的白蛋白。S1片段通常内吞大量白蛋白27,28,29,30,如此处所示,在未经处理的MWF大鼠的生理条件下(图5A)。在UUO治疗5周后的MWF或SD PT中看不到同样的摄取(图5B,C)。TR-RSA 输注后 45 至 60 分钟对肾小球周围近端小管成像,对白蛋白的存在 (1) 或不存在 (0) 进行评分。重要的是要注意,在生理条件下,S1 段热切地结合和内化白蛋白,几乎没有白蛋白到达远端小管或集合管。因此,后近端小管段可能不含白蛋白是有道理的,导致白蛋白摄取的分数阳性小于 1.0。图5D显示了近端小管白蛋白摄取评分结果的图表。未经处理的MWF近端小管分数摄取值为0.556±0.126。五周UUO MWF和SD大鼠的数值均显着降低,分别为0.049±0.126和0.00±0.00。
研究也在12周的UUO MWF大鼠中完成(表1)。十二周的UUO是小鼠研究诱导表面肾小球的标准时间。对3只UUO雄性大鼠进行成像,这些大鼠的肾小球密度进一步增加到每20倍视野6.16±1.83个肾小球。红细胞流速为293±67μm/s,白细胞粘附率为1.47±1.12,均与5周UUO数据相似。与5周UUO大鼠相比,白蛋白的GSC也增加到0.109±0.04。
慢性UUO诱导的肾小球mRNA改变
表2 显示了所有基因(探针)及其分组表达和标准偏差值。注意,根据先前肾脏疾病改变的记录选择基因进行分析,包括方案第13节注释中所述的UUO。图6是数据的热 图 ,突出显示了与对照组或假肾小球相比,UUO肾小球中大多数基因表达的显着变化。
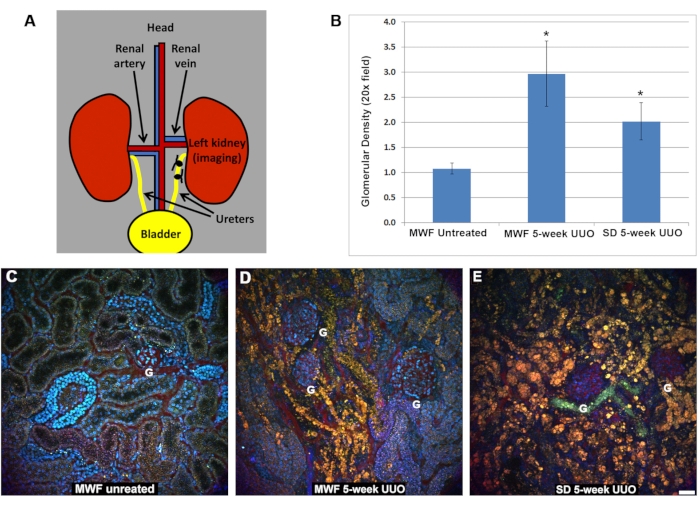
图1:MWF大鼠5周UUO后SD大鼠表面肾小球数量增加和表面肾小球诱导增加 。 (A)左肾输尿管在用手术缝合线用两条系带闭塞之前小心地从肾动脉和静脉中释放的手术图。(B)一张图表,表明MWF大鼠在UUO之前和之后五周存在的表面肾小球数量增加,以及SD大鼠的表面肾小球数量,SD大鼠通常没有表面肾小球。MWF大鼠表面肾小球数量从未治疗大鼠的1.08±0.11/田增加到5周UUO组的2.97±0.65/场。SD大鼠从没有表面肾小球到2.02±0.37 /田。三维重建图像显示未经治疗的MWF(C),5周UUO后的MWF(D)和5周UUO后的SD(E)的肾脏表面。注意大的橙色液泡结构的出现,这些结构已从小的单个溶酶体合并成大的异常体。SD大鼠的5周UUO没有导致类似于 C 和 D部分可见的正常肾小管上皮的区域。脉管系统在某些区域似乎变直,并且在许多区域有部分闭塞,允许血浆流动,但不能流动红细胞。(每组n = 3只雄性大鼠)比例尺 = 40 μm。误差线表示标准偏差。缩写:UUO = 单侧输尿管梗阻;SD = 斯普拉格-道利;MWF = 慕尼黑 Wistar Frömter;G = 肾小球;红细胞=红细胞。 请点击此处查看此图的大图。
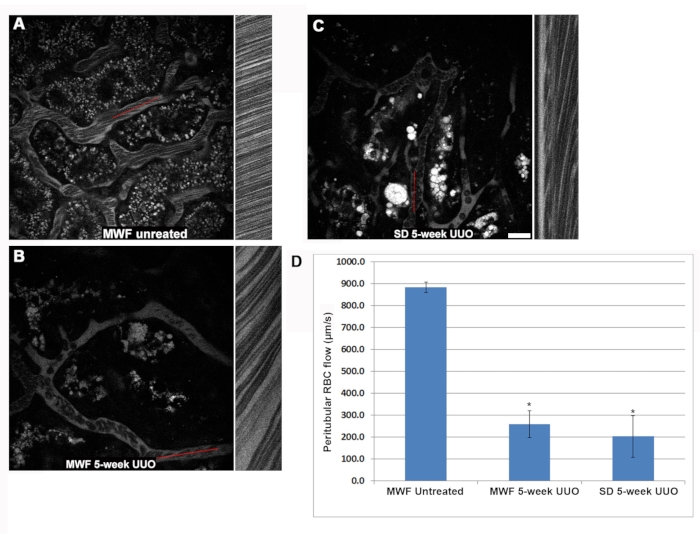
图 2:5 周 UUO 后浅肾小管周围脉管系统内的红细胞流量减少。在肾小管周围血管中收集线扫描以确定以μm / s为单位的RBC流速。简而言之,A、B和C中显示的红色参考线代表一个小区域,其中重复扫描相同的像素宽区域,并将图像堆叠成一列以可视化由流动的红细胞引起的失真,红细胞的行进速度比显微镜可以获取的要快。与参考图相邻的列是线扫描,RBC 失真的斜率用于计算速度(x 轴 = 距离,y 轴 = 时间)。在这里,逐渐变陡的斜率对应于较慢的RBC速度,因为它们在线扫描区域中保持更长的时间。请注意,与MWF(B)和SD(C)大鼠的五周UUO图像相比,未经治疗的MWF大鼠(A)的红细胞外观的差异。三个大鼠组的红细胞流速如D所示。未经处理的MWF中的管状红细胞周流量平均为885 ± μm / s。在MWF和SD大鼠中,这些值在UUO后五周显着下降至250 ± 100 μm / s和200 ± 125 μm / s。比例尺= 20μm,n = 每组3只雄性大鼠。误差线表示标准偏差。缩写:UUO = 单侧输尿管梗阻;SD = 斯普拉格-道利;MWF = 慕尼黑 Wistar Frömter;红细胞=红细胞;白细胞=白细胞。请点击此处查看此图的大图。
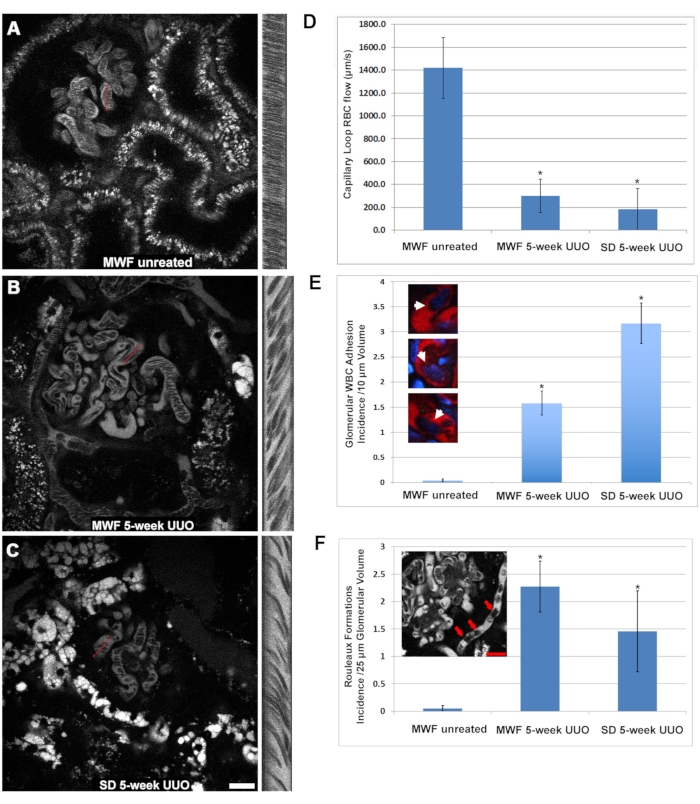
图 3:肾小球毛细血管袢红细胞流量显着减少,并通过 5 周 UUO 诱导 WBC 粘附激活。 用于确定肾小管周围红细胞血流的相同线扫描方法用于研究肾小球毛细血管血流的改变。图 A、 B和 C 显示了与 图2 类似的布局,分别关注假手术MWF、五周UUO MWF和五周UUO SD中的肾小球。(D)一张图表显示假手术MWF大鼠毛细管环中的生理高RBC流速,平均为1,405±425μm/s±425,分别降低到250 ±220 μm / s和190 ± 200 μm / s对于5周UUO MWF和5周UUO SD大鼠。当检查肾小球毛细血管袢时,粘附的白细胞在通过肾小球聚焦时很容易看到。取单个肾小球的三维光学切片,并使用相距1μm的前10个光学切片来测量贴壁白细胞的数量。 未经治疗的MWF大鼠在其体积中几乎没有可见的WBC,平均小于0.125±0.05个WBC / 10个光学切片,以1μm的步长拍摄。在5周的UUO MWF和SD大鼠中,这些数字分别以1μm步长增加到1.5±0.5和3.25±0.7个WBC / 10个光学切片。这些结果显示在图 E的图表中,彩色插入物显示白细胞阻塞毛细血管环。Rouleaux结构(箭头,插图在 F中)显示为红细胞以"堆叠硬币"结构紧密结合在一起,即使在血流湍流中也在很大程度上保留了其捆绑的分组。这些病理结构在肾小球内更深的地方很容易辨别。假手术MWF大鼠基本上没有这些结构,从顶部开始只有0.05±0.05次发生25个光学切片,以1μm的肾小球体积步长拍摄。相比之下,MWF和SD大鼠的5周UUO在Rouleaux形成中显着增加,分别以1μm步长从顶部发生2.27±0.46和1.46±0.73/25光学切片。比例尺= 20μm,n = 每组3只雄性大鼠。误差线表示标准偏差。缩写:UUO = 单侧输尿管梗阻;SD = 斯普拉格-道利;MWF = 慕尼黑 Wistar Frömter;红细胞=红细胞;白细胞=白细胞。 请点击此处查看此图的大图。
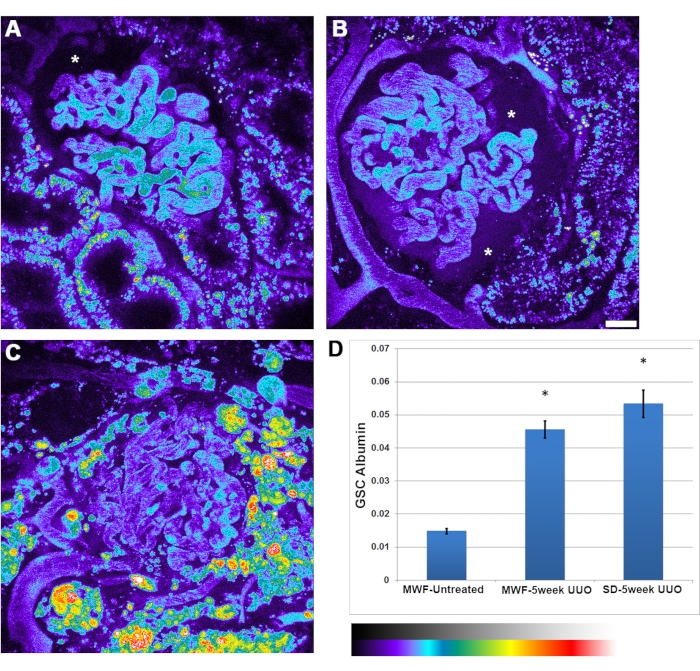
图 4:5 周 UUO 后肾小球毛细血管白蛋白通透性显着增加。 图 A, B和 C 分别显示了未处理的MWF,5周UUO MWF和5周UUO SD大鼠中大鼠血清白蛋白通道的3D体积的假彩色图像。这些图像以伪调色板呈现,以突出在Bowman空间中看到的可观数量的过滤白蛋白,特别是在 面板B (星号)中。(A)鲍曼空间(星号)显示了在未经治疗的MWF大鼠中通常可见的正常白蛋白水平,肉眼无法辨别。在输注白蛋白之前拍摄肾小球图像,以从白蛋白给药后拍摄的背景荧光值中减去背景荧光值。(D)未处理MWF大鼠白蛋白肾小球筛分系数的图表,其值为0.015±0.002。该值在5周的UUO MWF大鼠中显着增加到0.045±0.05,在5周的UUO SD大鼠中显着增加到0.052±0.075。该参数是鲍曼空间的荧光强度除以等离子体值的比率值,没有相关的测量单位。比例尺= 20μm,n = 每组3只雄性大鼠。伪彩色强度标度位于面板 D下方。误差线表示标准偏差。缩写:UUO = 单侧输尿管梗阻;SD = 斯普拉格-道利;MWF = 慕尼黑 Wistar Frömter;红细胞=红细胞;白细胞=白细胞。 请点击此处查看此图的大图。
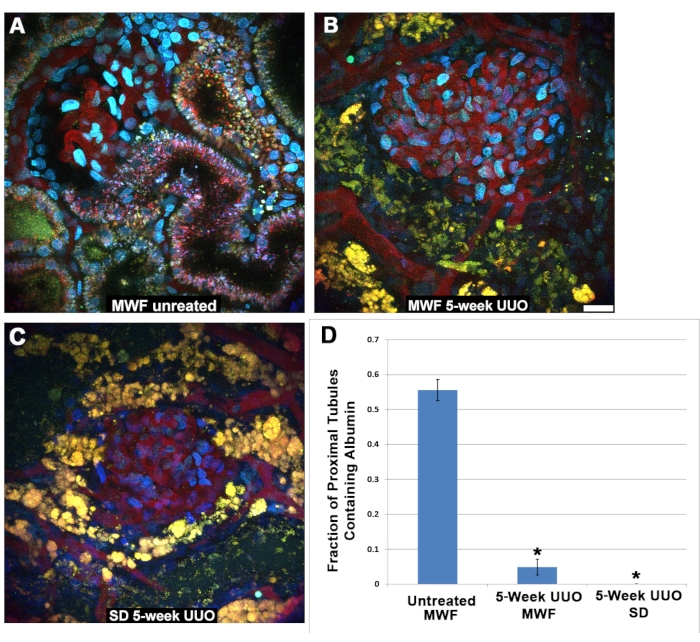
图 5:5 周 UUO 后近端小管功能下降。 (A)在输注TR-RSA和Cascade Blue 葡聚糖后40分钟拍摄的来自正常慕尼黑Wistar Frömter大鼠的浅表肾小球和S1段的图像。TR-RSA的内化可以在S1段和近端小管中看到。与此形成鲜明对比的是,接受5周UUO的MWF大鼠(B)和SD大鼠(C)显示出严重改变的近端小管,TR-RSA的摄取很少或没有吸收。通常很小的点状自发荧光溶酶体(A)变得大且呈空泡状黄橙色结构,通常管腔完全塌陷,这在三维数据集中找不到。(C)通常没有任何形式的自发荧光的远端小管现在含有自发荧光积聚。在输注后 45-60 分钟拍摄的类似图像中,对肾小球周围的近端小管进行评分,以摄入白蛋白,显示假手术的 MWF 组与两个 5 周的 UUO 组之间存在显着差异。未经治疗的MWF大鼠近端小管分数摄取值为0.556±0.126。五周UUO MWF和SD大鼠的数值均显着降低,分别为0.049±0.126和0.00±0.00。比例尺= 20μm,n = 每组3只雄性大鼠。误差线表示标准偏差。缩写:UUO = 单侧输尿管梗阻;SD = 斯普拉格-道利;MWF = 慕尼黑 Wistar Frömter;红细胞=红细胞;白细胞=白细胞;TR-RSA = 德克萨斯红鼠血清白蛋白。请点击此处查看此图的大图。
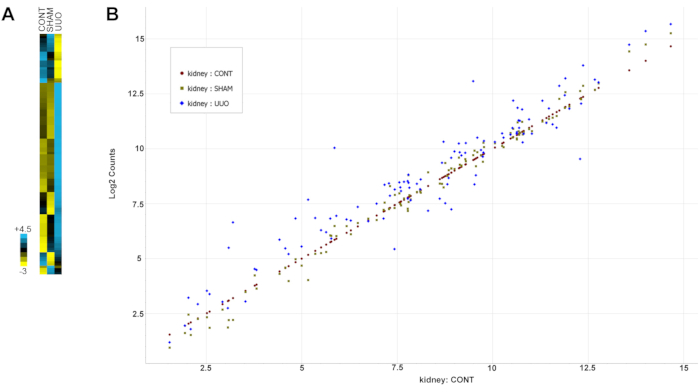
图6:UUO的基因表达改变 。 (A)数据的热图。(B)散点图中所有数据的归一化基因变化。绘制对照肾中基因表达从低到高表达的曲线图,并将SHAM和UUO肾脏的基因与对照表达水平进行比较。接近对照基因对角线值的基因数据点表示两组的表达水平相似,而高于或低于对角线的数据点分别表示更高或更低的表达水平。请注意,与UUO基因相比,SHAM基因聚集更接近对照对角线表达,UUO基因的可变性更大。缩写:UUO = 单侧输尿管梗阻。 请点击此处查看此图的大图。
表 1:UUO 5 至 12 周的损伤进展。 每个时间点3只雄性MWF大鼠和3只SD雄性大鼠的5周和12周UUO成像参数比较。五周数据与前几周数据相同。注意肾小球密度和白蛋白GSC增加伴持续UUO。缩写:UUO = 单侧输尿管梗阻;SD = 斯普拉格-道利;MWF = 慕尼黑 Wistar Frömter;GSC = 肾小球筛分系数。 请按此下载此表格。
表2:UUO和对照大鼠肾小球炎症标志物的分析。 基因探针对和CodeSets是按照NanoString的指示设计和使用的。分析了100多个基因,以及Nanostring指定的阳性和阴性对照。所有基因(探针)及其分组表达和SD值显示在表中。图 6A 是数据的热图,而 图6B 显示了散点图中所有数据的基因变化。注意对照和SHAM之间的相似性以及UUO中大多数基因的不同变化。缩写:UUO = 单侧输尿管梗阻;SD = 标准偏差。 请按此下载此表格。
讨论
肾小球生理学的研究已经看到了许多不同的方法,最显着的是使用微穿刺、孤立性肾小球灌注和显微镜检查。慕尼黑Wistar大鼠,Fromter和Simonsen菌株中表面肾小球的可用性允许 体内 动力学研究。对于采用该技术的研究人员来说,一个重要的注意事项是需要设置采集参数以保持研究之间的图像一致,以便组织中的自发荧光保持一致。利用双通道荧光素/罗丹明落射荧光立方体并将增益设置调整为绿色和红色发射通道,以在计算机屏幕上模拟通过目镜看到的内容,将确保即使在不同的显微镜系统之间,自发荧光的颜色特征也一致。
Fromter菌株已被广泛使用,因为它的总肾小球数量减少,~75%正常,男性在12周龄左右自发发生高血压,伴有进行性蛋白尿和随后的局灶性肾小球硬化症,最终死于肾衰竭12。使用这些大鼠和添加2光子显微镜,其光毒性降低,穿透深度提高,并且能够同时观察多个荧光探针,为新发现铺平了道路1,4,5。随着计算机硬件和软件的发展,定量数据现在是所有2光子实验室的标准。已经开发了多种定量技术,并将其应用于生理和疾病条件下的肾小球、近端小管、血管和间质过程1,4,5,27,28,29,30。
转基因小鼠生成设施为肾脏生理学和病理学研究增加了一个新的维度,将其与2光子显微镜相结合以进一步描述特定基因产物在肾脏结构和功能中的重要性只是时间问题。然而,除了非常年轻的小鼠外,小鼠肾小球距离肾脏表面超过100μm9。双光子显微镜最好在20至50μm的深度作为分辨率进行,此后由于发射光的光散射和与血红蛋白相互作用的吸收,荧光强度迅速降低。因此,有必要诱导表面肾小球。常用的方法是延长单侧梗阻模型,持续 12 周。由于这些模型不允许基线测定,因此不可能将UUO的影响与正在研究的过程分开。
使用MWF大鼠,可以将基线肾小球功能与UUO之后的功能进行比较。已知该UUO模型可诱导炎症和快速纤维化,并已用于研究CKD和纤维化10,11,12。正如预期的那样,MWF和SD大鼠的表面肾小球都有所增加。此外,MWF和SD大鼠在UUO后获得的定量结果非常具有可比性。之前曾报道过将UUO后的显微数据与微穿刺数据进行比较的血流量减少3。众所周知,肾小管和间质组织学有明显改变,PT大多无功能,如此处所述,缺乏白蛋白内吞作用。图2和图3中的研究表明,肾小球和肾小管周围毛细血管的红细胞流速显着降低,白细胞粘附增强。流量减少可能是由于白细胞粘附和轮盘形成造成的毛细血管阻塞。
为了进一步评估炎症,我们量化了白蛋白通透性,并显示它增加了十倍。此外,分离的肾小球显示,在各种肾脏疾病状态下,许多先前已知在肾脏炎症中增加的基因的mRNA表达增加17,19,20,21,22,23,24,25,26.肾小球表面密度和白蛋白通透性的增加是渐进的,如12周的UUO数据所示。目前的数据是第一个直接表明肾小球在UUO模型中经历显着的结构损伤,炎症和分子变化的数据。结果与早期的全肾组织研究一致,该研究分析了UUO后的绵羊肾活检,发现多个炎症标志物升高19。目前的结果表明,肾小球内存在明显的炎症,以前只知道皮质组织。
目前的数据与早期的小鼠研究不同,在小鼠中,在肾病后12周和正常肾小球31之间,粘附分子表达,补体沉积和中性粒细胞浸润没有变化。此外,Hickey实验室使用12周的UUO模型来研究小鼠肾小球的免疫反应。他们发现四周龄小鼠肾小球和梗阻后肾小球之间的中性粒细胞浸润没有差异32,33。这些后来的研究是在阻塞肾的骨盆排出尿液后进行的。我们没有这样做,因为我们想确定UUO对肾小球功能的影响,因为它在 体内, 而不是人为地去除引起阻塞的液体。最后,在小鼠中使用UUO被表面下大于100μm的成像肾小球所取代。虽然可能,但在分辨率和强度方面存在权衡,当分辨率和强度超过50μm34时,两者都会显着降低。
如果将现有文献中关于组织学变化、肾小球形成、炎症、纤维化、血流动力学的数据拼凑在一起,所呈现的结果并不奇怪10,11,12。所提供的数据,包括白细胞粘附、鲁洛形成、肾小球分子炎症标志物和白蛋白通透性增加,进一步表明该 UUO 模型中即使在五周时仍在进行的广泛炎症,并且在十二周时也存在。显然,慢性UUO不是一种生理状态,使用UUO诱导表面肾小球代表了一种损伤模型。MWF大鼠在生理条件下具有表面肾小球,可以在损伤发生时进行纵向研究。产生转基因大鼠是可能的,许多研究人员正在用生物传感器制造它们来提出具体问题。特别是,威斯康星医学院现在有一个MWF大鼠的殖民地,并制造了转基因大鼠,目的是在生理和病理条件下研究肾小球过程。这些MWF大鼠为研究正常,患病和基因改变的大鼠的肾小球过程提供了很好的机会。
披露声明
作者没有利益冲突。
致谢
这项工作得到了国家糖尿病,消化和肾脏疾病研究所拨款RO1DK091623和P30DK079312(至B.A.M.)的支持。我们感谢密歇根州立大学研究技术支持设施(RTSF)基因组学核心设施的工作人员进行纳米弦分析。
材料
| Name | Company | Catalog Number | Comments |
| 70 µm sterile cell strainer | Corning | #421751 | |
| 100 µm sterile cell strainer | Corning | #421752 | |
| CA Micro scissors Model 1C300 | Electron Microscopy Sciences | Cat# 72930 | |
| Electric heating pad | Sunbeam | Kroger | |
| Handling Forceps | Electron Microscopy Sciences | Cat# 72962 | |
| Kelly Hemostatic Forceps (straight) | Electron Microscopy Sciences | Cat#72930 | |
| Leica Dive SP-8 Multi-Photon Inverted Microscope | Leica Microsystems | Note: Version 7.1r1 | |
| MaiTai DeepSee titanium-sapphire laser | Spectra-Physics | NA | |
| Mayo Dissecting Scissors | Electron Microscopy Sciences | Cat# 78180-1C3 | |
| Metamorph Image processing Software | Molecular Dynamics | Cat# 78266-04 | |
| Microsoft Excel | Microsoft Corportation | 2007 version | |
| Quant-iT RNA Assay Kit | Invitrogen/ThermoFisher | Q33140 | |
| Reptitherm Undertank Heater | Zoomed | Amazon | |
| RNeasy MinElute Cleanup Kit (Spin columns) | Qiagen | 74204 | |
| RPE buffer | Qiagen | 1018013 | |
| Strate-Line Autoclave Tape | Fisher Scientific | Cat# 11-889-1 | |
| TRI Reagent | Sigma | T9424 | |
| Willco-dish Coverslip Bottom Dishes (50 mm/40 mm coverslip) | Electron Microscopy Sciences | Cat# 70665-07 |
参考文献
- Dunn, K. W., Molitoris, B. A., Dagher, P. C. The Indiana O'Brien center for advanced renal microscopic analysis. American Journal of Physiology-Renal Physiology. 320 (5), 671-682 (2021).
- Dunn, K. W., et al. Functional studies of the kidney of living animals using multicolor two-photon microscopy. American Journal of Physiology-Cell Physiology. 283 (3), 905-916 (2002).
- Eisenbach, G., Liew, J., Boylan, J., Manz, N., Muir, P. Effect of angiotensin on the filtration of protein in the rat kidney: a micropuncture study. Kidney International. 8 (2), 80-87 (1975).
- Sandoval, R. M., Molitoris, B. A. Intravital multiphoton microscopy as a tool for studying renal physiology and pathophysiology. Methods. 128, 20-32 (2017).
- Sandoval, R. M., Molitoris, B. A., Palygin, O. Fluorescent imaging and microscopy for dynamic processes in rats. Methods in Molecular Biology. 2018, 151-175 (2019).
- Huber, T., et al. Molecular basis of the functional podocin-nephrin complex: mutations in the NPHS2 gene disrupt nephrin targeting to lipid raft microdomains. Human Molecular Genetics. 12 (24), 3397-3405 (2003).
- Kawachi, H., Koike, H., Kurihara, H., Sakai, T., Shimizu, F. Cloning of rat homologue of podocin: expression in proteinuric states and in developing glomeruli. Journal of the American Society of Nephrology JASN. 14 (1), 46-56 (2003).
- Roselli, S., et al. Early glomerular filtration defect and severe renal disease in podocin-deficient mice. Molecular and Cellular Biology. 24 (2), 550-560 (2004).
- Schießl, I., Bardehle, S., Castrop, H. Superficial nephrons in BALB/c and C57BL/6 mice facilitate in vivo multiphoton microscopy of the kidney. PloS One. 8 (1), 52499 (2013).
- Chevalier, R., Forbes, M., Thornhill, B. Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy. Kidney International. 75 (11), 1145-1152 (2009).
- Forbes, M., Thornhill, B., Chevalier, R. Proximal tubular injury and rapid formation of atubular glomeruli in mice with unilateral ureteral obstruction: a new look at an old model. American Journal of Physiology. Renal physiology. 301 (1), 110-117 (2011).
- Yang, H. -. C., Zuo, Y., Fogo, A. B. Models of chronic kidney disease. Drug Discovery Today. Disease Models. 7 (1-2), 13-19 (2010).
- Hackl, M. J., et al. Tracking the fate of glomerular epithelial cells in vivo using serial multiphoton imaging in new mouse models with fluorescent lineage tags. Nature Medicine. 19 (12), 1661-1666 (2013).
- Kitching, A., Kuligowski, M., Hickey, M. In vivo imaging of leukocyte recruitment to glomeruli in mice using intravital microscopy. Methods in Molecular Biology. 466, 109-117 (2009).
- Savin, V. J., Terreros, D. A. Filtration in single isolated mammalian glomeruli. Kidney International. 20 (2), 188-197 (1981).
- Chomczynski, P., Sacchi, N. The single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction: twenty-something years on. Nature Protocols. 1 (2), 581-585 (2006).
- El Karoui, K., et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2. Nature Communications. 7, 10330 (2016).
- VA, M., et al. Multiplexed measurements of gene signatures in different analytes using the Nanostring nCounter Assay System. BMC Research Notes. 2, 80 (2009).
- Springer, A., et al. A combined transcriptome and bioinformatics approach to unilateral ureteral obstructive uropathy in the fetal sheep model. The Journal of Urology. 187 (2), 751-756 (2012).
- Braun, F., Becker, J., Brinkkoetter, P. Live or let die: Is there any cell death in podocytes. Seminars in Nephrology. 36 (3), 208-219 (2016).
- Kim, W. The role of angiopoietin-1 in kidney disease. Electrolyte & Blood Pressure E & BP. 6 (1), 22-26 (2008).
- Liu, F., Zhuang, S. Role of receptor tyrosine kinase signaling in renal fibrosis. International Journal of Molecular Sciences. 17 (5), 972 (2016).
- Martini, S., et al. Integrative biology identifies shared transcriptional networks in CKD. Journal of the American Society of Nephrology: JASN. 25 (11), 2559-2572 (2014).
- Mühlberger, I., et al. Integrative bioinformatics analysis of proteins associated with the cardiorenal syndrome. International Journal of Nephrology. 2011, 809378 (2010).
- Satirapoj, B., et al. Periostin: novel tissue and urinary biomarker of progressive renal injury induces a coordinated mesenchymal phenotype in tubular cells. Nephrology, Dialysis, Transplantation. 27 (7), 2702-2711 (2012).
- Fengxin, Z., et al. Numb contributes to renal fibrosis by promoting tubular epithelial cell cycle arrest at G2/M. Oncotarget. 7 (18), 25604-25619 (2016).
- Sandoval, R. M., Molitoris, B. A. Quantifying glomerular permeability of fluorescent macromolecules using 2-photon microscopy in Munich Wistar rats. Journal of Visualized Experiments: JoVE. (74), e50052 (2013).
- Russo, L. M., et al. Impaired tubular uptake explains albuminuria in early diabetic nephropathy. Journal of the American Society of Nephrology: JASN. 20 (3), 489-494 (2009).
- Russo, L. M., et al. The normal kidney filters nephrotic levels of albumin retrieved by proximal tubule cells: retrieval is disrupted in nephrotic states. Kidney International. 71 (6), 504-513 (2007).
- Sandoval, R. M., Wang, E., Molitoris, B. A. Finding the bottom and using it: Offsets and sensitivity in the detection of low intensity values in vivo with 2-photon microscopy. Intravital. 2 (1), 23674 (2014).
- Kuligowski, M. P., Kitching, A. R., Hickey, M. J. Leukocyte recruitment to the inflamed glomerulus: a critical role for platelet-derived P-selectin in the absence of rolling. Journal of Immunology. 176 (11), 6991-6999 (2006).
- Devi, S., et al. Multiphoton imaging reveals a new leukocyte recruitment paradigm in the glomerulus. Nature Medicine. 19 (1), 107-112 (2013).
- Finsterbusch, M., et al. Patrolling monocytes promote intravascular neutrophil activation and glomerular injury in the acutely inflamed glomerulus. Proceedings of the National Academy of Sciences of the United States of America. 113 (35), 5172-5181 (2016).
- Shroff, U. N., Gyarmati, G., Izuhara, A., Deepak, S., Peti-Peterdi, J. A new view of macula densa cell protein synthesis. American Journal of Physiology. Renal Physiology. 321 (6), 689-704 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。