需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过TIRF显微镜 在体外 同时可视化交联和单微管的动力学
摘要
在这里,提出了基于TIRF显微镜 的体外 重建测定,以同时量化和比较两个微管群体的动力学。描述了一种同时观察多个微管相关蛋白在交联微管束和单个微管上的集体活性的方法。
摘要
微管是αβ-微管蛋白异源二聚体的聚合物,在细胞中组织成不同的结构。基于微管的架构和网络通常包含动态属性不同的微管阵列子集。例如,在分裂细胞中,稳定的交联微管束与动态非交联微管紧密共存。基于TIRF显微镜 的体外 重建研究能够同时可视化这些不同微管阵列的动力学。在该测定中,成像室与表面固定的微管组装在一起,这些微管要么以单丝形式存在,要么组织成交联束。微管蛋白、核苷酸和蛋白质调节剂的引入允许直接可视化相关蛋白质以及单个和交联微管的动态特性。此外,可以实时监测动态单个微管组织成束时发生的变化。这里描述的方法允许系统地评估单个蛋白质的活性和定位,以及在相同的实验条件下蛋白质调节剂对两个不同微管子集的协同作用,从而提供其他方法无法获得的机制见解。
引言
微管是生物聚合物,形成对多种细胞过程至关重要的结构支架,从细胞内转运和细胞器定位到细胞分裂和伸长。为了执行这些不同的功能,单个微管被组织成微米大小的阵列,例如有丝分裂纺锤体,睫状轴突,神经元束,相间阵列和植物皮质阵列。在这些结构中发现的无处不在的建筑图案是一束沿其长度交联的微管1。几种基于微管的结构的一个有趣的特征是捆绑的微管和非交联的单个微管在紧密的空间接近中共存。这些微管亚群可以显示出彼此截然不同的聚合动力学,这取决于其正常功能的需要2,3,4,5。例如,在有丝分裂纺锤体内,稳定的交联束和动态单个微管存在于细胞中心的微米级区域内6。因此,研究如何指定共存微管群的动态特性是理解基于微管的结构的组装和功能的核心。
微管是动态聚合物,在聚合和解聚阶段之间循环,在称为灾难和救援的事件中在两个阶段之间切换7。细胞微管的动力学由无数的微管相关蛋白(MAPs)调节,这些蛋白调节微管聚合和解聚的速率以及灾难和救援事件的频率。由于光学显微镜中空间分辨率的限制,研究MAPs在细胞空间近端阵列上的活性具有挑战性,特别是在高微管密度的区域。此外,同一细胞区域中存在多个MAP阻碍了细胞生物学研究的解释。与全内反射荧光(TIRF)显微镜一起进行的 体外 重建测定规避了检查MAPs特定子集调节近端细胞微管阵列动力学的机制的挑战。在这里,在受控条件下,在一个或多个重组MAPs存在下检查 体外 组装的微管的动力学8,9,10。 然而,传统的重构测定通常在单个微管或一种类型的阵列上进行,从而排除了共存群体的可视化。
在这里,我们提出了体外 重建测定,可以在相同的溶液条件下同时可视化两个微管群体11。我们描述了一种同时观察多个MAP在单个微管和由有丝分裂纺锤体相关蛋白PRC1交联的微管束上的集体活性的方法。蛋白 PRC1 优先在反平行微管之间的重叠处结合,使它们交联9。简而言之,该协议包括以下步骤:(i)制备储备溶液和试剂,(ii)用于创建显微镜实验成像室的盖玻片的清洁和表面处理,(iii)制备稳定的微管"种子",在实验过程中从中开始聚合,(iv)TIRF显微镜设置的规范以可视化微管动力学,(v)微管种子的固定和交联微管束的产生 在成像室中,并且(vi)在添加可溶性微管蛋白,MAP和核苷酸后,通过TIRF显微镜可视化成像室中的微管动力学。这些测定能够对MAP定位及其对两个微管群体动态的影响进行定性评估和定量检查。此外,它们有助于在广泛的实验条件下评估多个MAP对这些微管群体的协同作用。
研究方案
1. 制备试剂
- 制备缓冲液和试剂,如 表1 和 表2所述。在实验过程中,除非另有说明,否则请将所有溶液保持在冰上。
| 溶液 | 组件 | 建议存储持续时间 | 笔记 | ||
| 5X BRB80 | 400 mM K-PIPES, 5 mM MgCl2, 5 mM EGTA, pH 6.8, KOH, 过滤器灭菌 | 长达 2 年 | 储存于 4 °C | ||
| 1X BRB80 | 80 mM K-PIPES, 1 mM MgCl2, 1 mM EGTA, pH 6.8 | 长达 2 年 | 储存于 4 °C | ||
| BRB80-DTT | 1X BRB80, 1 mM DTT | 长达 2 天 | |||
| 检测缓冲液 | 80 mM K-PIPES, 3 mM MgCl2, 1 mM EGTA, pH 6.8, 5% 蔗糖 (OR 1X BRB80, 5% 蔗糖, 2 mM MgCl2) | 长达 1 年 | 储存于 4 °C | ||
| 主缓冲区 (MB) | 检测缓冲液,5mM TCEP | 1 周 | 在实验当天准备;分成两管:室温下MB-温暖,MB-冷在冰上;如果使用荧光染料,则包括 1 mM DTT | ||
| 含甲基纤维素的主缓冲液 (MBMC) | 1X BRB80, 0.8% 甲基纤维素, 5 mM TCEP, 5 mM 氯化镁2 | 1 周 | 在实验当天准备;如果使用荧光染料,则包括 1 mM DTT | ||
| 蛋白质稀释缓冲液 (DB) | MB, 1 毫克/毫升牛血清白蛋白 (BSA), 1 μM ATP | 1 天,冰上 | 在实验当天准备;如果使用荧光染料,则包括 1 mM DTT | ||
| 除氧混合物 | MB, 389微克/毫升过氧化氢酶, 4.44毫克/毫升葡萄糖氧化酶, 15.9米M 2-巯基乙醇(BME) | 1 天,冰上 | 在实验当天准备 | ||
| 除氧最终 (OSF) | MB, 350 微克/毫升过氧化氢酶, 4 毫克/毫升葡萄糖氧化酶, 14.3 米M 二甲基苯甲醚, 15 毫克/毫升葡萄糖 | 30分钟内用完 | 使用前立即通过将1μL葡萄糖加入9μLOSM中制备 | ||
表 1:此协议中使用的缓冲区及其组件的列表。 请参阅"建议的存储持续时间"列,以获取有关可以提前多长时间准备每个缓冲区的指导。
| 试剂 | 储存浓度 | 储存溶剂 | 储存温度 | 工作集中 | 最终浓度 | 建议存储持续时间 | 笔记 | |||||||||
| 纽曲维丁(NA) | 5毫克/毫升 | 1X BRB80 | -80°摄氏度 | 0.2毫克/毫升 | 0.2毫克/毫升 | 长达 1 年 | 用于通过生物素 - 中性粒细胞 - 生物素连接固定微管;以小等分试样储存 | |||||||||
| 河童酪蛋白 (KC) | 5毫克/毫升 | 1X BRB80 | -80°摄氏度 | 0.5毫克/毫升 | 0.5毫克/毫升 | 长达 2 年 | 用于阻挡成像室表面;存放在小等分试样中;在实验当天,在室温下留出少量 | |||||||||
| 牛血清白蛋白 | 50毫克/毫升 | 1X BRB80 | -20°摄氏度 | 1毫克/毫升(在DB中) | 不适用 | 长达 2 年 | 以小等分试样储存 | |||||||||
| 过氧化氢酶 | 3.5毫克/毫升 | 1X BRB80 | -80°摄氏度 | 350 微克/毫升(在 OSF 中) | 35微克/毫升 | 长达 2 年 | 除氧混合物的组分;以小等分试样储存 | |||||||||
| 葡糖氧化酶 | 40毫克/毫升 | 1X BRB80 | -80°摄氏度 | 4毫克/毫升(在OSF中) | 0.4毫克/毫升 | 长达 2 年 | 除氧混合物的组分;以小等分试样储存 | |||||||||
| 微管蛋白 | 冻 | 不适用 | 4°摄氏度 | 10毫克/毫升 | 2.12毫克/毫升(微管蛋白混合物) | 长达 1 年 | 一旦微管蛋白进入溶液,请保持低温以避免聚合。 | |||||||||
| 三磷酸腺苷 (ATP) | 100 平方米 | 超纯水 | -20°摄氏度 | 10 毫米 | 1 毫米 | 6 个月 | 在过滤灭菌水中制备溶液,将pH调节至~7.0,并在小等分试样中冷冻。 | |||||||||
| 三磷酸鸟苷 | 100 平方米 | 超纯水 | -20°摄氏度 | 10 毫米 | 1.29 mM(在微管蛋白混合物中) | 6 个月 | 在过滤灭菌水中制备溶液,将pH调节至~7.0,并在小等分试样中冷冻。 | |||||||||
| 鸟苷-5'-三磷酸α,β甲基烯 | 10 毫米 | 超纯水 | -20°摄氏度 | 10 微米 | 0.5 微米 | 6 个月 | ||||||||||
| 二硫代甲状腺素醇 (DTT) | 2 . | 无菌水 | -20°摄氏度 | 1 毫米 | 不适用 | 长达 2 年 | ||||||||||
| 三(2-羧乙基)膦 | 0.5 米 | 过滤灭菌水 | 室温 | 5 毫米 | 不适用 | 长达 2 年 | ||||||||||
| 甲基纤维素 | 1% | 无菌水 | 室温 | 0.8% (以 MBMC 为单位) | 0.21%(微管蛋白混合物) | 长达 1 年 | 通过缓慢地将其添加到接近沸腾的水中来溶解甲基纤维素。在连续搅拌的同时冷却。 | |||||||||
| β-巯基乙醇 | 143 毫米 | 无菌水 | 室温 | 14.3 mM (在 OSF 中) | 1.43 毫米M | 长达 5 年 | 143 mM是1:100稀释的库存BME | |||||||||
| 葡萄糖 | 150毫克/毫升 | 1X BRB80 | -80°摄氏度 | 15毫克/毫升(在OSF中) | 1.5毫克/毫升 | 长达 2 年 | 使用前立即添加到 OSM | |||||||||
| (±)-6-羟基-2,5,7,8-四甲基铬烷-2-羧酸 | 10米 | 1X BRB80 | -80°摄氏度 | 10 毫米 | 1 毫米 | 长达 1 年 | 不能完全溶解。加入一些NaOH,搅拌约4小时,过滤灭菌后使用 | |||||||||
| mPEG-琥珀酰亚胺戊酸酯, MW 5,000 | 粉 | 不适用 | -20°摄氏度 | 333毫克/毫升 (在0.1M碳酸氢钠中) | 324毫克/毫升 (在0.1M碳酸氢钠中) | 6 个月 | 准备〜34mg等分试样,用确切重量的粉末标记每个管。将氮气输送到固体上,用副膜密封管,并在-20°C下储存在装有干燥剂的容器中。 | |||||||||
| 生物素-PEG-SVA, MW 5,000 | 粉 | 不适用 | -20°摄氏度 | 111毫克/毫升 (在0.1M碳酸氢钠中) | 3.24毫克/毫升(在0.1米碳酸氢钠中) | 6 个月 | 准备〜3mg等分试样,用确切重量的粉末标记每个管。将氮气输送到固体上,用副膜密封管,并在-20°C下储存在装有干燥剂的容器中。 | |||||||||
表2:该方案中使用的试剂列表。 包括推荐的储存条件和浓度,实验期间使用的储备溶液的工作浓度以及成像室中的最终浓度。最右边的列中提供了其他注释。
2. 准备生物素-PEG载玻片
注意:尽可能在实验开始前准备成像室,并且不超过提前2周。
- 清洁盖玻片
- 将相等数量的24 x 60 mm和18 x 18 mm #1.5盖玻片(图1F)分别放置在载玻片染色罐和玻片清洗架中(图1A,B)。将装有 18 x 18 mm 盖玻片的玻片清洗架放入 100 mL 烧杯中。
- 在超纯水(电阻率为18.2 MΩ-cm)中冲洗所有盖玻片5-6次,并在每次冲洗后用连接到真空管的移液器吸头除去多余的液体(图1C)。
- 用超纯水填充装有盖玻片的烧杯和玻片染色罐,用石蜡膜密封,并超声处理10分钟。
- 将两个 150 mL 烧杯装满 200 度乙醇。使用镊子,将每个盖玻片浸入一个装满乙醇的烧杯中,然后浸入另一个烧杯中。
- 使用镊子将盖玻片转移到载玻片干燥架(图1D),在氮气流下干燥,并在37°C下孵育直至完全干燥(约15分钟)。
- 将干燥的盖玻片放在等离子清洗剂内的一层中。形成真空密封,然后将等离子清洗机的射频(RF)电平设置为~8 MHz。
- 一旦产生血浆,将盖玻片留在血浆清洗剂中5分钟。关闭等离子清洗机并缓慢释放真空。
- 释放真空密封后,翻转盖玻片,对盖玻片的另一侧重复等离子清洗5分钟。
- 等离子清洗的替代方案:代替步骤2.1.2-2.1.3,将盖玻片放入2%洗涤剂(在超纯水)的温溶液中超声处理10分钟。然后,用超纯水彻底清洗盖玻片,并在超纯水中超声处理2-3次(每次10分钟)。接下来,在乙醇中洗涤并按照步骤2.1.4-2.1.5干燥。跳过步骤 2.1.6-2.1.8。
- 生物素-聚乙二醇处理
- 使用前立即将400μL3-氨基丙基三乙氧基硅烷溶解在40mL丙酮中。使用镊子将等离子清洗的盖玻片移入玻片清洗架和玻片染色罐中。将盖玻片浸没在3-氨基丙基三乙氧基硅烷溶液中并孵育5分钟12,13。
- 用超纯水清洗所有盖玻片5-6次。
- 将盖玻片转移到载玻片干燥架上,在氮气流下干燥,并在37°C下孵育直至完全干燥(〜20分钟)。
- 将干燥的盖玻片放在精致的工作湿巾上,并在一个角上标记每个盖玻片,例如,每个18 x 18 mm盖玻片上的"p"和每个24 x 60 mm盖玻片上的"b"(见 图2)。
- 在实验当天,通过将0.84mg NaHCO3溶解在10mL超纯水中来制备新鲜的0.1M碳酸氢钠溶液。
- 使用前立即将mPEG-琥珀酰亚胺戊酸酯(PEG-SVA)和生物素-PEG-SVA等分试样带到室温。参见 表2中关于聚乙二醇(PEG)等分试样的制备说明。
注意:快速工作,因为琥珀酰亚胺基戊酸(SVA)部分的水解半衰期约为30分钟。 - 将102μL0.1M NaHCO3加入34mgPEG-SVA中,在台式微量离心机中以2,656×g离心20秒旋转,然后通过上下移液混合。通过上下移液将3mg生物素-PEG-SVA溶解在27μL0.1M NaHCO3中。根据试管上注明的PEG的确切重量调整稀释体积(见表2)。
- 通过组合75μLPEG-SVA溶液和2.25μL生物素-PEG-SVA溶液,制备100:1 w / wPEG:PEG混合物,用于20个盖玻片,100μL和3μL用于30个盖玻片,或125μL和3.75μL用于40个盖玻片。
- 通过将湿纸巾放在空的10μL吸头盒底部的吸头架下方来构建水合室(图1E)。这将防止PEG溶液的蒸发。
- 将6μL100:1 PEG-SVA:生物素-PEG混合物移液到标记侧的一个24 x 60 mm盖玻片的中心。将另一个24 x 60 mm的盖玻片放在第一个盖玻片的顶部,使对形成X形,侧面标记为"b"相对。将对放在补水室中的空吸头架上,然后重复剩余的24 x 60 mm盖玻片。
- 将6μLPEG-SVA移液到标记侧的一个18 x 18 mm盖玻片的中心。将另一个 18 x 18 mm 的盖玻片放在第一个盖玻片的顶部,两侧标记为"p"。将这对鞋放在补水室中的空吸头架上,然后重复剩余的18 x 18 mm盖玻片。
- 关闭水合室,孵育3小时或过夜。
- 将两对盖玻片分开,用超纯水冲洗。
- 用氮气流干燥盖玻片,并将其置于37°C培养箱中以完全干燥。
- 要构建成像室,请将三条双面胶带粘贴在标有"b"的一侧的24 x 60 mm盖玻片上。在胶带的另一侧,将一个 18 x 18 mm 的盖玻片连接到一个面,其侧面标有"p",面向较大的盖玻片。这形成了两个用于显微镜实验的流动室,处理过的表面彼此相对(图2 和 图1G)。

图 1:盖玻片处理和成像室制备设备。 (A) 用于 24 x 60 mm 盖玻片的玻片染色罐,(B) 用于 18 x 18 mm 盖玻片的玻片清洗架,(C) 真空设置,(D) 载玻片干燥架,(E) 水合室,(F) 盖玻片,(G) 成像室,(H) 载玻片支架。 请点击此处查看此图的放大版本。
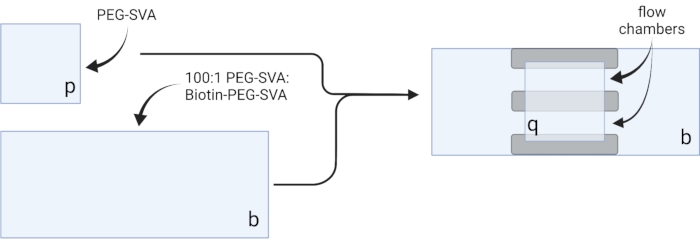
图2:使用双面胶带(灰色)和PEG / Biotin-PEG处理盖玻片制备成像室的示意图。 用 BioRender.com 创建。 请点击此处查看此图的放大版本。
3. 聚合微管
- 准备转基因种子
注意:在冷室中准备GMPCPP种子,将所有试剂,尖端和管子保持在4°C下,GMPCPP种子可以提前制备并在-80°C下储存长达1年。将固定角度的超速离心机转子(包含1 mL离心管)置于超速离心机中,并将温度设置为4°C。- 使用前立即将冻干微管蛋白(表2)重悬至~10 mg / mL,在1X BRB80中。
- 混合GMPCPP种子的组分,如 表3所述。
注意:尽可能将所有微管蛋白组分保持在冰上,以尽量减少可溶性微管蛋白的聚合。 - 在固定角度超速离心机转子中以352,700× g 在4°C下澄清混合物5分钟。
- 将上清液分离成5μL等分试样,将其快速冷冻在液氮中,并将其储存在-80°C。
- 在实验当天聚合种子
- 将1-2毫升BRB80-DTT(表1)加热至37°C。
- 将步骤3.1.4中的5μL等分试样的GMPCPP种子(-80°C)放在冰上,并立即溶解在20μL温热的BRB80-DTT中。在室温下以2,000 x g 旋转5秒,然后点击混合。
注意:初始稀释体积可能在13μL和21μL之间变化,并且根据经验为每批种子确定。如果种子无法聚合,请通过用0.5μM GMPCPP补充初始稀释缓冲液(步骤3.2.2)进行故障排除。 - 避光并在37°C下孵育30-45分钟。
注意:微管的长度取决于孵育的持续时间。对于短微管,孵育时间可以短至15分钟。对于长微管,孵育时间可长达2小时。生物素化微管往往比非生物素化微管需要更长的孵育时间。 - 将固定角度的超速离心机转子(包含500μL离心管)置于超速离心机中,并预热至30°C。
- 孵育后,向聚合的GMPCPP种子中加入50μL温热的BRB80-DTT(步骤3.2.1),并将混合物转移到500μL离心管中。用另一个50μL温热的BRB80-DTT洗涤含有GMPCPP种子的空管,上下移液,并将该缓冲液加入含有混合物的500μL离心管中。
- 在纺丝之前,标记离心管的边缘以指示沉淀的位置(沉淀太小而无法看到)。在30°C12下以244,900× g 旋转10分钟。
- 小心地移出上清液并丢弃。将沉淀重悬于100μL温热的BRB80-DTT中。点击以混合。
- 在30°C下以244,900× g 离心10分钟,将标记与转子对齐以在同一位置沉淀。
- 除去上清液并将沉淀重悬于16μL温热的BRB80-DTT中。将微管溶液转移到干净的0.6mL微量离心管中。避光并保持在室温或以上。
注意:聚合后,将微管保持在室温或室温以上。如果它们变冷,它们会解聚。在28°C孵育以增加稳定性。
- 通过TIRF显微镜检查微管
- 将4.5μLBRB80-DTT和1μL微管溶液的混合物(步骤3.2.9)移液到显微镜载玻片上。用18 x 18 mm盖玻片盖住,并用透明指甲油或凡士林,羊毛脂和石蜡(valap密封剂)的1:1:1混合物密封边缘,其在室温下是固体,在95°C时是液体。
- 将TIRF物镜放置在盖玻片下方(参见步骤4以获取推荐的显微镜设置),并在适合Bright混合物中荧光标记的微管蛋白的波长处可视化新聚合的微管(表3),以确定在即将进行的实验中使用多少稀释的微管。
| 试剂 | 光亮混合(μL) | 添加顺序 | 光亮混合物 + 生物素 (μL) | 添加顺序 |
| 荧光微管蛋白,10 毫克/毫升 | 2 | 6 | 2 | 7 |
| 生物素微管蛋白,10毫克/毫升 | 0 | 不适用 | 2 | 6 |
| 未标记微管蛋白,10毫克/毫升 | 20 | 5 | 18 | 5 |
| 通用玻璃钢,10 mM | 30 | 4 | 30 | 4 |
| 断续器, 0.2 米 | 0.7 | 3 | 0.7 | 3 |
| 5X BRB80 | 26.4 | 2 | 26.4 | 2 |
| 无菌水 | 52.9 | 1 | 52.9 | 1 |
| 总体积(μL) | 132 | 132 |
表3:GMPCPP种子混合物。 GMPCPP微管种子的组分,包括体积和添加顺序。准备5μL等分试样,并在-80°C下储存长达1年。
4. 显微镜设置
- 温度:将显微镜温度设置为28°C以查看动态微管。
- 滤光片:使用滤光片立方体和发射滤光片的最佳组合,具体取决于要成像的荧光通道。要在同一实验中可视化 488 nm、560 nm 和 647 nm 波长,请使用 405/488/560/647 nm 激光四频带集,以及指定波长的发射滤光片。
- 对齐激光器:确保实验中使用的激光束对齐。根据经验确定实验的激光强度,使得所有荧光蛋白都可以以尽可能高的信噪比成像,但在实验的时间过程中不会经历显着的光漂白。
- 物镜:使用透镜纸用70%乙醇清洁100倍物镜。在成像之前,向物镜中加入一滴显微镜浸没油。
- 设置成像序列
- 对于647nm荧光团标记的生物素化微管,560nm氟基团标记的非生物素化微管和可溶性微管蛋白以及感兴趣的GFP标记的蛋白质的实验,成像20分钟。每 10 秒对 560 nm 和 488 nm 通道进行成像,每 30 秒对 647 nm 通道进行成像。
- 为了在添加可溶性微管蛋白和MAP之前捕获束的参考图像,请设置一个序列,每个序列具有560 nm和647 nm波长的一个图像。
5. 生成表面固定的微管束
注意:对于以下步骤,通过将移液到一个开口侧,同时将滤纸放在另一侧,将所有溶液流入流室。保护成像室免受光线照射,以减少荧光标记蛋白质的光漂白。将准备好的成像室粘在载玻片支架上(图1G,H)。按照 表 4 中的步骤操作,这些步骤对应于协议 steps 5.2-6.4。
- 按 表5 制备可溶性微管蛋白混合物,并保持在冰上。
注意:可溶性微管蛋白必须始终放在冰上以防止聚合。大约每2小时或当微管不再聚合时,准备一次新鲜的可溶性微管混合物。 - 为了 通过 生物素 - 中性粒细胞 - 生物素连接固定微管,首先在Neutravidin(NA)溶液中流动,直到腔室充满(〜7.5μL)并孵育5分钟。
- 用10μL MB冷水清洗。
- 在7.5μL封闭蛋白κ-酪蛋白(KC)中流动并孵育2分钟。
- 用10μLMB温热洗涤,以准备引入微管的腔室。
- 将生物素化微管的储备(根据步骤3.3.2中的观察结果)稀释在1X BRB80-DTT中,并将1μL稀释液加入9μLMB-温热中。将混合物流入腔室并孵育10分钟。使用更高浓度的微管获得更多的束。
- 用10μLMB温热冲洗掉未固定的微管。
- 将7.5μL温KC流入腔室并孵育2分钟。
- 在孵育过程中,在温暖的KC中制备2nM交联蛋白PRC1溶液,将10μL该溶液流入流动室并孵育5分钟。
注意:重组 PRC1 从细菌细胞中表达和纯化,如前所述13。 - 为了制作束,将10μL非生物素化微管流入腔室并孵育10分钟,PRC1将交联非生物素化和固定化生物素化微管15,16 (图3)。
注意:参见步骤6.1,用于在孵育期间制备测定混合物。 - 用10μLMB温热洗涤腔室两次。从这一点开始,附着的微管稳定约20分钟。
| 步 | 试剂 | 体积(μL) | 孵育时间(分钟) |
| 1 | 纽曲维丁 | 7.5 | 5 |
| 2 | MB-冷 | 10 | - |
| 3 | κ-酪蛋白 | 7.5 | 2 |
| 4 | MB-热 | 10 | - |
| 5 | 生物素化微管(在MB温热中稀释) | 10 | 10 |
| 6 | MB-热 | 10 | - |
| 7 | 温水 κ-酪蛋白 | 7.5 | 2 |
| 8 | 2 nM PRC1 稀释于 κ-酪蛋白 | 10 | 5 |
| 9 | 非生物素化微管 | 10 | 10 |
| 10 | MB-温暖 x 2 | 10 | - |
| 11 | 检测混合物 | 10 | - |
| 附着的种子此时稳定约20分钟 | |||
表4:测定步骤。 添加到成像室的试剂列表,指示洗涤(-)或孵育时间。
| 试剂 | 体积(μL) |
| 回收微管蛋白,10毫克/毫升 | 10 |
| MB-冷 | 10.3 |
| 断续器 | 13.7 |
| BRB80-DTT | 3.4 |
| GTP, 10 mM | 6.7 |
| ATP, 10 mM (如果使用驱动蛋白) | 6.7 |
| 荧光标记的微管蛋白, 10毫克/毫升 | 1 (在冷 BRB80-DTT 中重悬冻干标记的微管蛋白) |
表5:可溶性微管蛋白混合物组分。 在实验开始时混合并保持在冰上。
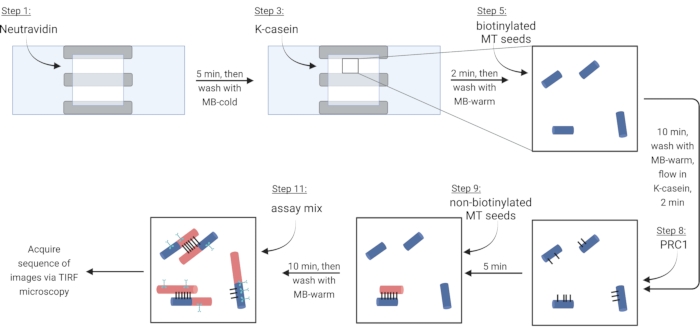
图3:添加测定组分以制作和成像荧光标记的束和单个微管的示意图。 生物素化种子以蓝色、非生物素化种子和可溶性微管蛋白红色显示,PRC1以黑色显示,感兴趣的蛋白质以青色显示。图中的步骤编号与 表 4 中的步骤编号相对应。对应于步骤9的面板显示了预先形成的束(左下角);步骤 11 显示了新形成的捆绑包(左上角)。用 BioRender.com 创建。 请点击此处查看此图的放大版本。
6. 图像微管动力学
- 在步骤5.10的10分钟孵育时间内,根据表6制备含有目标蛋白质,可溶性微管蛋白,核苷酸,氧清除剂14和抗氧化剂的10μL测定混合物。将混合物放在冰上。
- 将准备好的成像室装入100x TIRF物镜上,贴在载玻片支架上。使用 560 nm 和 647 nm 通道查找包含单个微管和束的最佳数量和密度的视场。
注意:如果生物素化和非生物素化微管都使用相同的荧光团标记,则荧光强度的线扫描分析可以区分单个微管和束。 - 确定视野后,拍摄参考图像。
- 小心地在测定混合物中流动,而不会干扰成像室。
- 用valap密封剂密封腔室的开口端。
- 按照步骤 4.5.1 中所述启动映像序列。
| 试剂 | 体积(μL) |
| 可溶性微管蛋白混合物 | 4 |
| OSF | 1 |
| Trolox(如果使用用易于光漂白的荧光团标记的微管) | 1 |
| ATP, 10 mM (如果使用驱动蛋白) | 1 |
| PRC1(或首选交联剂) | 1 |
| 感兴趣的蛋白质 | X |
| MB-冷 | 2-X |
表6:测定混合组分。 混合,流入成像室,并在30分钟内对微管动力学进行成像。
结果
上述实验使用647nm荧光团标记的生物素化微管,560nm氟团标记的非生物素化微管和560nm氟团标记的可溶性微管混合物进行。微管通过交联蛋白PRC1(GFP标记)交联。在产生表面固定束和单个微管(步骤5.11)后,将成像室安装在TIRF 100X 1.49 NA油物镜上,并在560nm和647nm荧光通道中观察。通过它们在647 nm通道中的荧光信号鉴定单个微管。在两个通道中具有荧光信号的微管被鉴定为预先形成的束(
讨论
这里描述的实验显着扩展了常规微管重构测定的范围和复杂性,传统上在单个微管或一种类型的阵列上进行。目前的测定提供了一种同时定量和比较两个群体(即单个微管和交联束)上的调节MAP活性的方法。此外,该测定允许检查两种类型的束:那些在动力学开始之前从稳定的种子预先形成的束,以及那些在两个生长端彼此相遇并交联时新形成的束(图3)。此外,除了传统?...
披露声明
作者声明没有竞争利益。
致谢
这项工作得到了NIH(编号1DP2GM126894-01)的资助,以及皮尤慈善信托基金和史密斯家庭基金会对R.S.的资助。作者感谢蒋硕博士对方案开发和优化的贡献。
材料
| Name | Company | Catalog Number | Comments |
| (±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (Trolox) | Sigma Aldrich | 238813 | |
| 1,4-piperazinediethanesulfonic acid (PIPES) | Sigma Aldrich | P6757 | |
| 18x18 mm #1.5 coverslips | Electron Microscopy Sciences | 63787 | |
| 2-Mercaptoethanol (BME) | Sigma Aldrich | M-6250 | |
| 24x60 mm #1.5 coverslips | Electron Microscopy Sciences | 63793 | |
| 405/488/560/647 nm Laser Quad Band | Chroma | TRF89901-NK | |
| Acetone | Sigma Aldrich | 320110 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sigma Aldrich | A7699-5G | |
| Avidin, NeutrAvidin® Biotin-binding Protein (Molecular Probes®) | Thermo Fischer Scientific | A2666 | |
| Bath sonicator: Branson 2800 Cleaner | Branson | CPX2800H | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 11 x 34 mm | Beckman-Coulter | 343778 | |
| Beckman Coulter Polycarbonate Thickwall Tubes, 8 x 34 mm | Beckman-Coulter | 343776 | |
| Biotin-PEG-SVA, MW 5,000 | Laysan Bio | #Biotin-PEG-SVA-5000 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | 2905 | |
| Catalase | Sigma Aldrich | C40 | |
| Corning LSE Mini Microcentrifuge, AC100-240V | Corning | 6670 | |
| Delicate Task Wipes | Kimtech | 34120 | |
| Dithiothreitol (DTT) | GoldBio | DTT10 | |
| Emission filter | Chroma | ET610/75m | |
| Ethanol (200-proof) | Decon Labs | 2705 | |
| Ethylene glycol tetraacetic acid (EGTA) | Sigma Aldrich | 3777 | |
| Glucose Oxidase | Sigma Aldrich | G2133 | |
| GMPCPP | Jena Bioscience | NU-405 | |
| Guanosine 5'-triphosphate sodium salt hydrate (GTP) | Sigma Aldrich | G8877 | |
| Hellmanex III detergent | Sigma Aldrich | Z805939 | |
| Immersion oil, Type A | Fisher Scientific | 77010 | |
| Kappa-casein | Sigma Aldrich | C0406 | |
| Lanolin | Fisher Scientific | S25376 | |
| Lens Cleaning Tissue | ThorLabs | MC-5 | |
| Magnesium Chloride (MgCl2) | Sigma Aldrich | M9272 | |
| Methylcellulose | Sigma Aldrich | M0512 | |
| Microfuge 16 Benchtop Centrifuge | Beckman-Coulter | A46474 | |
| Microscope Slides, Diamond White Glass, 25 x 75mm, 90° Ground Edges, WHITE Frosted | Globe Scientific | 1380-50W | |
| mPEG-Succinimidyl Valerate, MW 5,000 | Laysan Bio | #NH2-PEG-VA-5K | |
| Optima™ Max-XP Tabletop Ultracentrifuge | Beckman-Coulter | 393315 | |
| Paraffin | Fisher Scientific | P31-500 | |
| PELCO Reverse (self-closing), Fine Tweezers | Ted Pella | 5377-NM | |
| Petrolatum, White | Fisher Scientific | 18-605-050 | |
| Plasma Cleaner, 115V | Harrick Plasma | PDC-001 | |
| Potassium Hydroxide (KOH) | Sigma Aldrich | 221473 | |
| Sodium bicarbonate | Sigma Aldrich | S6014 | |
| Sucrose | Sigma Aldrich | S7903 | |
| Thermal-Lok 1-Position Dry Heat Bath | USA Scientific | 2510-1101 | |
| Thermal-Lok Block for 1.5 and 2.0 mL Tubes | USA Scientific | 2520-0000 | |
| Thermo Scientific™ Pierce™ Bond-Breaker™ TCEP Solution, Neutral pH; 500mM | Thermo Fischer Scientific | PI-77720 | |
| TIRF 100X NA 1.49 Oil Objective | Nikon | CFI Apochromat TIRF 100XC Oil | |
| TIRF microscope | Nikon | Eclipse Ti | |
| TLA 120.1 rotor | Beckman-Coulter | 362224 | |
| TLA 120.2 rotor | Beckman-Coulter | 357656 | |
| Tubulin protein (>99% pure): porcine brain | Cytoskeleton | T240 | |
| Tubulin Protein (Biotin): Porcine Brain | Cytoskeleton | T333P | |
| Tubulin protein (fluorescent HiLyte 647): porcine brain | Cytoskeleton | TL670M | |
| Tubulin protein (X-rhodamine): bovine brain | Cytoskeleton | TL620M | |
| VECTABOND® Reagent, Tissue Section Adhesion | Vector Biolabs | SP-1800-7 | |
| VWR® Personal-Sized Incubator, 120V, 50/60Hz, 0.6A | VWR | 97025-630 |
参考文献
- Subramanian, R., Kapoor, T. M. Building complexity: insights into self-organized assembly of microtubule-based architectures. Developmental Cell. 23 (5), 874-885 (2012).
- Baas, P. W., Rao, A. N., Matamoros, A. J., Leo, L. Stability properties of neuronal microtubules. Cytoskeleton (Hoboken). 73 (9), 442-460 (2016).
- Bitan, A., Rosenbaum, I., Abdu, U. Stable and dynamic microtubules coordinately determine and maintain Drosophila bristle shape. Development. 139 (11), 1987-1996 (2012).
- Foe, V. E., von Dassow, G. Stable and dynamic microtubules coordinately shape the myosin activation zone during cytokinetic furrow formation. The Journal of Cell Biology. 183 (3), 457-470 (2008).
- Pous, C., et al. Functional specialization of stable and dynamic microtubules in protein traffic in WIF-B cells. The Journal of Cell Biology. 142 (1), 153-165 (1998).
- Uehara, R., Goshima, G. Functional central spindle assembly requires de novo microtubule generation in the interchromosomal region during anaphase. The Journal of Cell Biology. 191 (2), 259-267 (2010).
- Mitchison, T., Kirschner, M. Dynamic instability of microtubule growth. Nature. 312 (5991), 237-242 (1984).
- Bieling, P., et al. Reconstitution of a microtubule plus-end tracking system in vitro. Nature. 450 (7172), 1100-1105 (2007).
- Bieling, P., Telley, I. A., Surrey, T. A minimal midzone protein module controls formation and length of antiparallel microtubule overlaps. Cell. 142 (3), 420-432 (2010).
- Shimamoto, Y., Forth, S., Kapoor, T. M. Measuring pushing and braking forces generated by ensembles of Kinesin-5 crosslinking two microtubules. Developmental Cell. 34 (6), 669-681 (2015).
- Mani, N., Jiang, S., Neary, A. E., Wijeratne, S. S., Subramanian, R. Differential regulation of single microtubules and bundles by a three-protein module. Nature Chemical Biology. 17 (9), 964-974 (2021).
- Hyman, A. A., Salser, S., Drechsel, D., Unwin, N., Mitchison, T. J. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue, GMPCPP. Molecular Biology of the Cell. 3 (10), 1155-1167 (1992).
- Subramanian, R., et al. Insights into antiparallel microtubule crosslinking by PRC1, a conserved nonmotor microtubule binding protein. Cell. 142 (3), 433-443 (2010).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Wijeratne, S., Subramanian, R. Geometry of antiparallel microtubule bundles regulates relative sliding and stalling by PRC1 and Kif4A. eLife. 7, 32595 (2018).
- Mani, N., Wijeratne, S. S., Subramanian, R. Micron-scale geometrical features of microtubules as regulators of microtubule organization. eLife. 10, 63880 (2021).
- Freal, A., et al. Feedback-driven assembly of the axon initial segment. Neuron. 104 (2), 305-321 (2019).
- Ledbetter, M., Porter, K. A "microtubule" in plant cell fine structure. The Journal of Cell Biology. 19 (1), 239-250 (1963).
- Wijeratne, S. S., Marchan, M. F., Tresback, J. S., Subramanian, R. Atomic force microscopy reveals distinct protofilament-scale structural dynamics in depolymerizing microtubule arrays. Proceedings of the National Academy of Sciences of the United States of America. , 119 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。