需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于同步光遗传学调制和电神经记录的光驱阵列
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种光学系统的制备方法,该系统具有用于光传输的光纤和用于神经记录的电极阵列。表达通道视紫红质-2的转基因小鼠的 体内 实验表明,该系统在同时进行光遗传学刺激和电生理记录方面具有可行性。
摘要
在过去十年中,光遗传学由于其独特的选择性神经调节或监测能力,已成为研究神经信号的重要工具。由于特定类型的神经元细胞可以被基因修饰以表达视蛋白,因此光遗传学能够对选定的神经元进行光学刺激或抑制。光遗传学的光学系统已经取得了一些技术进步。最近,有人提出将用于光传递的光波导与电生理记录相结合,以同时监测对光遗传学刺激或抑制的神经反应。在这项研究中,开发了一种植入式光驱阵列(2x2光纤),并嵌入了多通道电极。
使用发光二极管(LED)作为光源,并集成了微细结构微透镜阵列,以在光纤尖端提供足够的光功率。光驱阵列系统包括一次性部分和可重复使用部分。一次性部件具有光纤和电极,而可重复使用部分具有用于光控制和神经信号处理的LED和电子电路。除了光驱植入手术、光遗传学刺激和电生理神经记录的程序外,在随附的视频中还介绍了植入式光驱阵列系统的新颖设计。 体内 实验的结果成功地显示了由小鼠海马兴奋神经元的光刺激引起的时间锁定神经尖峰。
引言
记录和控制神经活动对于理解大脑在神经网络中和细胞水平上的功能至关重要。传统的电生理记录方法包括使用微量移液管的膜片钳1、2、3、4和使用微肺电极5、6、7、8的细胞外记录。作为一种神经调节方法,电刺激经常被用来通过神经元细胞的直接或间接去极化来直接刺激局灶性大脑区域。然而,电学方法无法区分用于记录或刺激的神经元细胞类型,因为电流向各个方向扩散。
作为一项新兴技术,光遗传学开创了一个新的时代,了解神经系统是如何工作的9,10,11,12,13,14,15,16。光遗传学技术的本质是利用光来控制转基因细胞表达的光敏视蛋白的活性。因此,光遗传学能够在复杂的神经回路14,17中对遗传选择的细胞进行复杂的调节或监测。光遗传学方法的广泛使用需要同时进行神经记录以直接确认光神经调节。因此,具有光控制和记录功能的集成设备将非常有价值16,18,19,20,21,22,23,24,25。
传统的、基于激光的光遗传学刺激存在局限性,这需要笨重且昂贵的光传输系统26、27、28、29、30。因此,一些研究小组采用基于μLED的硅探针来最小化光传输系统的尺寸31,32,33,34。然而,由于LED的能量转换效率低,与μLED直接接触存在热脑损伤的风险。光波导,如光纤,SU-8和氮氧化硅(SiON),已被应用以避免热损伤30,35,36,37,38,39。然而,这种策略也存在一个缺点,因为它在光源和波导之间的耦合效率低。
微透镜阵列先前被引入以增强LED和光纤40之间的光耦合效率。基于微机电系统(MEMS)技术开发了一种光驱系统,用于微米级40的光学刺激和电记录。LED和光纤之间的微透镜阵列将光效率提高了3.13 dB。如图 1所示,2x2光纤阵列在4x4微透镜阵列上对齐,LED位于微透镜阵列下方。安装2x2光纤而不是4x4以减少脑损伤。钨电极阵列位于光棒阵列附近,使用硅通过孔进行电生理记录(图1B)。
该系统由顶部一次性部件和可拆卸底部部件组成。顶部一次性部分,包括光纤阵列,微透镜阵列和钨电极阵列,旨在永久植入大脑 进行体内 实验。底部包括一个LED光源和一个外部电源线,该电源线易于拆卸和重复用于另一个动物实验。可拆卸的塑料盖可在拆卸部件时保护一次性部件。
通过在Ca 2 +/钙调蛋白依赖性蛋白激酶II阳性神经元(CaMKIIα::ChR2小鼠)中植入表达通道视紫红质-2(ChR2)的转基因小鼠的大脑中来验证该系统的可行性。记录电极用于记录神经元光学刺激期间单个神经元的神经活动。
研究方案
动物护理和外科手术由梨花女子大学机构动物护理和使用委员会(IACUC)批准(编号:20-029)。
1. 光驱阵列的制备(图1 和 图2)
- 将光纤与微透镜阵列连接。
- 去除光纤的钝化涂层,并使用精密光纤切割器将其切割成5毫米长的碎片。
- 将光纤浸入透明UV树脂中,并将光纤放在微透镜阵列上。
- 使用紫外灯固化树脂。
- 使用环氧树脂将微透镜阵列连接到3D打印外壳。
- 对齐全氟烷氧基 (PFA) 涂层钨丝。
- 将 4 条 30 mm 长的 PFA 钨丝和 1 根银线焊接到 5 针 1.27 mm 间距母连接器上。使用银丝作为参比电极。
- 将 1.27 mm 间距母连接器连接到头台前置放大器。
- 小心地将钨丝穿过硅通过孔(图1B),以帮助钨电极的精细对准。
- 将对齐的钨丝切割成比光纤长度短 1 mm 的钨丝。
- 使用环氧树脂将连接器连接到3D打印外壳。
- 发光二极管放置
- 将 LED 放在 3D 打印外壳中。
- 将 LED 连接到产生脉宽调制 (PWM) 的驱动电路。
注:PWM脉冲由微控制器产生。 - 给定 LED 驱动电路引起的噪声,请确保记录电极与 LED 驱动电路相距 50 mm。
- 使用光电二极管测量光纤尖端末端的光强度。
- 将钨电极和光纤浸入酒精中15分钟。然后将系统浸入无菌D.I水中,并用环氧乙烷气体灭菌。
2. 植入手术(图3 和 图4)
注意:手术过程中必须遵循无菌技术。
- 制备转基因动物,这些动物经过基因改造,可在特定类型的神经元细胞中表达光敏视蛋白。
注意:本研究使用了一只2个月大的雄性转基因小鼠,在Ca 2+/钙调蛋白依赖性蛋白激酶II阳性神经元(CaMKIIα::ChR2小鼠)中表达通道视紫红质-2(ChR2)41。 - 通过腹膜内给药用氯胺酮 - 甲苯噻嗪混合物 - 氯胺酮(100mg / kg)和甲苯噻嗪(10mg / kg)的混合物麻醉小鼠。
- 通过监测胡须运动和对爪子捏合的反应,每30分钟检查一次麻醉动物。
- 如果需要额外的麻醉,以初始剂量的一半注射氯胺酮 - 赛拉嗪鸡尾酒。
- 剃除头部皮肤,并将麻醉的鼠标放在立体定向框架中。
注意:进行手术皮肤准备和悬垂动物。皮肤准备包括脱毛,然后用抗菌剂清洁皮肤。- 将头部置于立体定向框架内,并将耳杆插入耳道。
- 通过反复松动和收紧耳杆以实现精确定位,将鼠标头居中置于立体定向框架中。
- 放置门牙杆,使上门牙钩在前内边缘。
- 调整门牙杆以设置门牙杆的高度,并将鼻夹紧到鼻子上。
- 提前打开嵌入立体定向框架中的热加热垫,以在整个外科手术过程中将体温保持在37°C。
- 将热探针放入小鼠直肠进行恒温调节。
注意:必须通过轻轻抓住和晃动鼻子来检查耳杆的位置。如果鼻子可以横向移动超过约4毫米,则必须重新调整耳杆。
- 用凡士林遮住眼睛(见 材料表)以防止干燥。
- 将1%利多卡因注射到头皮中。用镊子抬起头部皮肤,确保注射空间,并将利多卡因注射到头皮下。
- 使用手术刀和细剪刀进行矢状面切口。用微扣握住切口的皮肤,以扩大手术区域的视野。
注意:切口长度为<1厘米,高于顶骨间骨的颧骨和尾缘。 - 用棉签去除骨膜。如果有出血,用牛烧灼颅骨以密封血管。
- 用生理盐水清洁颅骨,并使用机械臂标记开颅部位:海马前后 (AP) −1.8 至 −2.8 mm、内侧 (ML) 0.5-2.5 mm 和背腹 (DV) −1 至 −2 mm。
注意:考虑到小鼠头骨的厚度,从暴露的大脑区域插入-1.2至-2.2毫米的光驱阵列。给定海马途径,CA3的锥体细胞将其轴突发送到CA1。因此,光纤比记录电极长1毫米,因此将光纤放置在CA3中,将记录电极置于CA1中。 - 在小脑上方钻一个洞,然后插入一个螺钉用于研磨。用精密螺钉将研磨螺钉放入0.5毫米深,直到它到达小脑的顶部。
注意:确保螺钉的紧密插入,螺钉将用作接地电极和支撑结构,以最大限度地提高植入的长期稳定性,因为它增加了牙科水泥粘附的三维表面。 - 钻出标记区域,并用镊子取出一块头骨。
- 将 26 G 针尖弯曲至顺时针方向 120°,并通过将针的斜面朝上插入来暴露大脑区域。注意不要损害大脑和血管。
- 用生理盐水清洁暴露的大脑,以洗掉骨尘和多余的物质。
- 将光驱阵列固定在机械臂中,并靠近暴露区域。
注意:放置设备时,从前凸再次重新计算目标区域可以提高放置的准确性。 - 缓慢插入光驱阵列并将接地螺钉连接到连接到系统42的银线。
注意:在此过程中,阵列必须紧紧固定在机械臂上,以尽量减少摆动,以防止插入过程中微运动造成的脑损伤。插入必须缓慢进行,休息10分钟,以解释插入后可能被按下的脑肿胀。建议将速度在1μm/s以下的脑组织中,以获得高质量的信噪比和可分离单个单元的数量42。 - 如果有出血,用干棉签直接按压出血器或使用烧灼。在出血完全停止之前,不要继续下一步。
- 在暴露的大脑和设备之间插入凝胶泡沫,以保护化学物质不与大脑直接接触。
注意:凝胶泡沫还有助于止血并保持大脑湿润。 - 用棉签擦拭头骨以尽可能多地去除水分,然后继续进行下一个固定步骤。
- 小心地将牙科水泥涂在颅骨上以固定设备并覆盖凝胶泡沫。在牙科水泥完全硬化之前,如果附着在牙科水泥上,则将头皮分开。用镊子拉动切开的皮肤,覆盖硬化的牙齿水泥并缝合头皮。然后,从机械手臂上释放设备。
注意:确保牙科骨水泥不会粘在皮肤上,仅覆盖颅骨区域。当皮肤生长时,它可以推开水泥,最终,设备会脱落。这将给长期 体内 实验带来关键问题。
3. 恢复和种植体护理
- 将鼠标从立体定向框架中取出。
- 使用26G针头施用卡洛芬溶液。手术前注射一次,12小时(下午手术的情况下为第二天早上)和手术后24小时,以减轻疼痛。
注意:瓶中的药物浓度为50mg / mL,并将其储存在4°C。 卡洛芬是粘稠的,需要在无菌水中稀释1:10。如果保持无菌状态,溶液可以储存长达4周。为了维持药物的有效持续时间,以12小时间隔注射卡洛芬溶液。 - 将鼠标放在加热垫上,检查它是否从麻醉中恢复良好。
注意:在动物恢复足够的意识之前,它不会无人看管。 - 手术后7-10天取下缝合线。
- 让动物恢复1周。在恢复期间监测食物和水的摄入量。给予镇痛药并检查不适或疼痛的迹象。
注意:接受过手术的动物不能与其他动物呆在一起,直到它们完全康复。- 在恢复期间,每天称量小鼠体重以检查体重变化。如果与年龄和性别匹配的对照动物相比,体重减轻了20%,则处死小鼠(见第6节)。
4. 光遗传学刺激和电生理记录
- 麻醉鼠标并将麻醉的鼠标放在立体定向框架中。
- 设置刺激参数。
- 将光脉冲配方设置为 4% 占空比和 10 Hz 频率43.在神经记录期间设置光刺激2秒(20个脉冲)。
- 使用 50 mA 电流在光纤尖端驱动 3 mW/mm2 光强度。使用光电二极管和功率计测量光功率,并将光功率除以光纤刻面面积。
- 取下塑料盖,将包含光传输系统的上部与可重复使用的LED和电路连接在一起。
- 将头台前置放大器连接到植入式 5 针连接器。
- 打开软件以记录神经信号。
- 设置软件筛选器。使用 0.1-20 kHz 的带通滤波器和 60 Hz 的陷波滤波器。将放大器采样速率设置为 20 kHz。
- 在记录之前,检查是否检测到神经尖峰信号。
注意:噪声消除很重要,因为神经信号太小。如果噪声水平太高,神经信号可能会被噪声遮挡并变得不可见。使用适当的接地和电磁波屏蔽来降低噪音。 - 信号检查后,在没有光刺激的情况下记录神经信号以进行基线记录。
- 提供LED光并同时记录神经元反应(图5 和 图6)。
注意:一旦受到刺激,下一次刺激实验必须在至少5分钟的间隔后进行,以便先前刺激引起的神经元活动不会影响下一个实验。
5. 数据分析
- 使用 MATLAB 程序加载获取的数据。
- 使用尖峰排序算法"Wave-Clus"44,45获取单个神经活动。通过幅度阈值检测每个通道中的尖峰,如方程(1)45所示。
阈值 = 5 ×中位数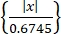 (1)
(1)
其中 x 是带通滤波信号。- 要安装"Wave-Clus",请参阅材料 表中的下载链接。
- 要打开图形用户界面 (GUI),请在 MATLAB 的命令提示符下键入 wave_clus。
- 键入 Get_spikes('filename.ext') 函数,用于准备峰值检测的文件扩展名。然后,运行 Do_clustering('filename_spikes.mat') 进行峰值排序。
- 使用特定的时间箱计算光刺激之前,期间和之后的排序尖峰。使用 0.2 s 和 2 s 时间条盒进行分析。
- 绘制每个录制通道的峰值数。
注意:计算并绘制了来自8次重复实验结果的数据的均值与均值标准误差(SEM)。
6. 安乐死
- 完成所有实验后,通过吸入二氧化碳(CO2)来牺牲小鼠。
- 无需对腔室进行预充电,将鼠标放在透明的安乐死室中,没有CO2 供应和/或泄漏。
- 打开CO2 气体,并以每分钟安乐死室空气体积的30-50%的速度置换空气。
注意:流量计必须连接到CO2 气瓶,以确保空气排量率为安乐死室体积的30-50%/分钟。 - 监测被牺牲的小鼠缺乏呼吸和改变眼睛颜色。
注意:安乐死的预期时间通常在10到15分钟内。 - 观察死亡迹象后,将小鼠从安乐死室中取出。
- 要完成安乐死程序,请通过确认呼吸和心脏骤停来验证死亡。
结果
光驱系统被成功制造,以提供足够的光功率来激活靶神经元。钨电极的精细对准是通过微加工硅通过孔实现的。当施加50 mA电流时,在光纤尖端测得的光强度为3.6 mW/mm2 。微透镜将光效提高了3.13 dB。由于微透镜阵列增强了光耦合,因此施加的电流大约是在没有微透镜阵列系统的情况下实现相同光强度所需的电流的一半。由于LED在电流更大的情况下产生更多的热量,因此采用微透镜阵列来降...
讨论
验证了该系统同时进行光遗传学刺激和电生理记录的可行性(图6)。光刺激过程中的大尖峰是与光刺激同时发生的光电伪影(图6A)。这在红色虚线矩形波形的放大视图中很明显(图6A)。如图 6A所示,从记录的波形中可以清楚地分辨出光电伪影,并清楚地识别出海马信号通路的光遗传学刺激所引起的神经?...
披露声明
作者没有利益冲突需要披露。
致谢
这项研究得到了韩国国家研究基金会(NRF)的人体增强融合技术研发计划的支持,由科学和信息通信技术部(NRF-2019M3C1B8090805)资助,并由韩国政府(MSIT)资助的韩国国家研究基金会(NRF)资助(编号:2019R1A2C1088909)。我们感谢韩国大田KAIST生物科学系的Lee Seung-Hee实验室为转基因小鼠提供了优质小鼠。
材料
| Name | Company | Catalog Number | Comments |
| 5-pin Connector | NW3 | HD127K | 1.27 mm (.050") pitch |
| Bovie | Fine Science Tools(F.S.T) | 18010-00 | High Temperature Cautery Kit |
| Data Acquisition Software | Intan Technologies, LLC | USB Interface Board software | Work with the RHD USB Interface Board |
| Dental Cement | Lang Dental Manufacturing Company, Inc. | 1223CLR | Use Jet Liquid and powder in jet denture repair package |
| Digital Manipulator Arm | Stoelting Co. | 51904/51906 | Left, Right each Digital Manipulator Arm, 3-Axes, Add-On |
| Gel Foam | Cutanplast | Standard (70*50*10 mm) | Sterile re-absorbable gelatin sponge with a haemostatic effect |
| Headstage Preamplifier | Intan Technologies, LLC | #C3314 | RHD 16-Channel Recording Headstages |
| Heating Pad | Stoelting Co. | 53800R | Stoelting Rodent Warmer X1 with Rat Heating Pad |
| LED | OSLON | GB CS8PM1.13 | λ typ. 470 nm, Viewing angle 80 °, Forward voltage 2.85 V |
| MATLAB | MathWorks, Inc. | R2019a | |
| Micro Clamp | SURGIWAY | 12-1002-04 | Straight type, Serre-fine DIEFFENBACH droite 3.5 cm |
| Optical Fiber | Thorlabs, Inc. | FT200UMT | 0.39 NA, Ø 200 µm Core Multimode Optical Fiber, High OH for 300 - 1200 nm |
| PFA-Coated Tungsten Wire | A-M System | Custom ordered | Rod type, Ø 101.6 μm (.004") |
| Photodiode | Thorlabs | S121C | |
| power meter | Thorlabs Inc. | PM100D | |
| Precision cleaver | FITEL | S326 | Fiber slicer tool |
| Prism | GraphPad | 5.01 version | |
| Scalpel | Feather™ | #20 | Scalpel blade with 100mm long Scalpel Handle |
| screw | Nasa Korea | stainless steel | diameter: 1.2 mm, length: 3 mm |
| Silver Wire | The Nilaco Corporation | AG-401265 | Ø 200 µm |
| Stereotaxic Fxrame | Stoelting Co. | 51500D | Digital new standard stereotaxic, rat and mouse |
| suture | ETHICON | W9106 | suture size: 4-0, length:75 cm, wire diameter: 4-0 |
| Vaseline | Unilever PLC | Original | 100% pure petroleum jelly |
| Wave_Clus | N/A | N/A | https://github.com/csn-le/wave_clus |
参考文献
- Wang, Y., Liu, Y. Z., Wang, S. Y., Wang, Z. In vivo whole-cell recording with high success rate in anaesthetized and awake mammalian brains. Molecular Brain. 9 (1), 86 (2016).
- Segev, A., Garcia-Oscos, F., Kourrich, S. Whole-cell patch-clamp recordings in brain slices. Journal of Visualized Experiments: JoVE. (112), e54024 (2016).
- Lee, D., Shtengel, G., Osborne, J. E., Lee, A. K. Anesthetized- and awake-patched whole-cell recordings in freely moving rats using UV-cured collar-based electrode stabilization. Nature Protocols. 9 (12), 2784-2795 (2014).
- Tao, C., Zhang, G., Xiong, Y., Zhou, Y. Functional dissection of synaptic circuits: in vivo patch-clamp recording in neuroscience. Frontiers in Neural Circuits. 9, 23 (2015).
- Henze, D. A., et al. Intracellular features predicted by extracellular recordings in the hippocampus in vivo. Journal of Neurophysiology. 84 (1), 390-400 (2000).
- Takahashi, S., Anzai, Y., Sakurai, Y. Automatic sorting for multi-neuronal activity recorded with tetrodes in the presence of overlapping spikes. Journal of Neurophysiology. 89 (4), 2245-2258 (2003).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7 (5), 446-451 (2004).
- Rossant, C., et al. Spike sorting for large, dense electrode arrays. Nature Neuroscience. 19 (4), 634-641 (2016).
- Balasubramaniam, S., et al. Wireless communications for optogenetics-based brain stimulation: present technology and future challenges. IEEE Communications Magazine. 56 (7), 218-224 (2018).
- Bedbrook, C. N., et al. Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics. Nature Methods. 16 (11), 1176-1184 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deng, W., Goldys, E. M., Farnham, M. M., Pilowsky, P. M. Optogenetics, the intersection between physics and neuroscience: light stimulation of neurons in physiological conditions. American journal of physiology. Regulatory, Integrative and Comparative Physiology. 307 (11), 1292-1302 (2014).
- Fenno, L., Yizhar, O., Deisseroth, K. The development and application of optogenetics. Annual Review Neuroscience. 34, 389-412 (2011).
- Mahmoudi, P., Veladi, H., Pakdel, F. G. Optogenetics, tools and applications in neurobiology. Journal of Medical Signals and Sensors. 7 (2), 71-79 (2017).
- Sasaki, Y., et al. Near-infrared optogenetic genome engineering based on photon-upconversion hydrogels. Angewandte Chemie International Edition in English. 58 (49), 17827-17833 (2019).
- Zhang, Y., et al. Battery-free, lightweight, injectable microsystem for in vivo wireless pharmacology and optogenetics. Proceedings of National Academy of Sciences of the United States of America. 116 (43), 21427-21437 (2019).
- Bernstein, J. G., Boyden, E. S. Optogenetic tools for analyzing the neural circuits of behavior. Trends in Cognitive Sciences. 15 (12), 592-600 (2011).
- Wang, J., et al. Integrated device for combined optical neuromodulation and electrical recording for chronic in vivo applications. Journal of Neural Engineering. 9 (1), 016001 (2012).
- Royer, S., et al. Multi-array silicon probes with integrated optical fibers: light-assisted perturbation and recording of local neural circuits in the behaving animal. European Journal of Neuroscience. 31 (12), 2279-2291 (2010).
- Zhang, J., et al. Integrated device for optical stimulation and spatiotemporal electrical recording of neural activity in light-sensitized brain tissue. Journal of Neural Engineering. 6 (5), 055007 (2009).
- Park, S. I., et al. Stretchable multichannel antennas in soft wireless optoelectronic implants for optogenetics. Proceedings of National Academy of Sciences of the United States of America. 113 (50), 8169-8177 (2016).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Research. 1511, 21-32 (2013).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. Journal of Neural Engineering. 4 (3), 143-156 (2007).
- Anikeeva, P., et al. Optetrode: a multichannel readout for optogenetic control in freely moving mice. Nature Neuroscience. 15 (1), 163-170 (2011).
- Obaid, S. N., et al. Multifunctional flexible biointerfaces for simultaneous colocalized optophysiology and electrophysiology. Advanced Functional Materials. 30 (24), 1910027 (2020).
- Wang, L., et al. An artefact-resist optrode with internal shielding structure for low-noise neural modulation. Journal of Neural Engineering. 17 (4), 046024 (2020).
- Shin, H., et al. Multifunctional multi-shank neural probe for investigating and modulating long-range neural circuits in vivo. Nature Communications. 10 (1), 3777 (2019).
- Kampasi, K., et al. Dual color optogenetic control of neural populations using low-noise, multishank optoelectrodes. Microsystem & Nanoengineering. 4, 10 (2018).
- Schwaerzle, M., Paul, O., Ruther, P. Compact silicon-based optrode with integrated laser diode chips, SU-8 waveguides and platinum electrodes for optogenetic applications. Journal of Micromechanics and Microengineering. 27 (6), 065004 (2017).
- Son, Y., et al. In vivo optical modulation of neural signals using monolithically integrated two-dimensional neural probe arrays. Scientific Reports. 5, 15466 (2015).
- Yasunaga, H., et al. Development of a neural probe integrated with high-efficiency MicroLEDs for in vivo application. Japanese Journal of Applied Physics. 60 (1), 016503 (2020).
- Kim, K., et al. Artifact-free and high-temporal-resolution in vivo opto-electrophysiology with microLED optoelectrodes. Nature Communications. 11 (1), 2063 (2020).
- Mendrela, A. E., et al. A high-resolution opto-electrophysiology system with a miniature integrated headstage. IEEE Transactions on Biomedical Circuits and Systems. 12 (5), 1065-1075 (2018).
- Scharf, R., et al. Depth-specific optogenetic control in vivo with a scalable, high-density muLED neural probe. Scientific Reports. 6, 28381 (2016).
- Oh, K., Sonsi, Y. -. A., Ha, S. Optogenetic stimulator with µLED-coupled optical fiber on flexile substrate via 3D printed mount. 2021 21st International Conference on Solid-State Sensors, Actuators and Microsystems (Transducers). , 1476-1479 (2021).
- McAlinden, N., et al. Multisite microLED optrode array for neural interfacing. Neurophotonics. 6 (3), 035010 (2019).
- Kwon, K. Y., Lee, H. M., Ghovanloo, M., Weber, A., Li, W. Design, fabrication, and packaging of an integrated, wirelessly-powered optrode array for optogenetics application. Frontiers in Systems Neuroscience. 9, 69 (2015).
- Bernstein, J. G., Allen, B. D., Guerra, A. A., Boyden, E. S. Processes for design, construction and utilisation of arrays of light-emitting diodes and light-emitting diode-coupled optical fibres for multi-site brain light delivery. Journal of Engineering. , (2015).
- Stark, E., Koos, T., Buzsaki, G. Diode probes for spatiotemporal optical control of multiple neurons in freely moving animals. Journal of Neurophysiology. 108 (1), 349-363 (2012).
- Jeon, S., et al. Implantable optrode array for optogenetic modulation and electrical neural recording. Micromachines. 12 (6), 725 (2021).
- Song, Y. H., et al. A neural circuit for auditory dominance over visual perception. Neuron. 93 (4), 940-954 (2017).
- Fiáth, R., et al. Slow insertion of silicon probes improves the quality of acute neuronal recordings. Scientific Reports. 9 (1), 111 (2019).
- Melchior, J. R., Ferris, M. J., Stuber, G. D., Riddle, D. R., Jones, S. R. Optogenetic versus electrical stimulation of dopamine terminals in the nucleus accumbens reveals local modulation of presynaptic release. Journal of Neurochemistry. 134 (5), 833-844 (2015).
- Quiroga, R. Q., Nadasdy, Z., Ben-Shaul, Y. Unsupervised spike detection and sorting with wavelets and superparamagnetic clustering. Neural Computation. 16 (8), 1661-1687 (2004).
- Chaure, F. J., Rey, H. G., Quian Quiroga, R. A novel and fully automatic spike-sorting implementation with variable number of features. Journal of Neurophysiology. 120 (4), 1859-1871 (2018).
- Casanova, F., Carney, P. R., Sarntinoranont, M. Effect of needle insertion speed on tissue injury, stress, and backflow distribution for convection-enhanced delivery in the rat brain. PLoS One. 9 (4), 94919 (2014).
- Iseri, E., Kuzum, D. Implantable optoelectronic probes for in vivo optogenetics. Journal of Neural Engineering. 14 (3), 031001 (2017).
- Arias-Gil, G., Ohl, F. W., Takagaki, K., Lippert, M. T. Measurement, modeling, and prediction of temperature rise due to optogenetic brain stimulation. Neurophotonics. 3 (4), 045007 (2016).
- Jeon, S., et al. Multi-wavelength light emitting diode-based disposable optrode array for in vivo optogenetic modulation. Journal of Biophotonics. 12 (5), 201800343 (2019).
- Korposh, S., James, S. W., Lee, S. -. W., Tatam, R. P. Tapered optical fibre sensors: current trends and future perspectives. Sensors. 19 (10), 2294 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。