需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
一种用于血管化复合同种异体移植物生物工程研究的可靠猪筋膜-皮肤皮瓣模型
摘要
本协议描述了猪筋膜 - 皮肤皮瓣模型及其在血管化复合组织研究中的潜在用途。
摘要
血管化复合同种异体移植物(VCA),如手、面部或移植,代表了破坏性皮肤缺陷的尖端治疗方法,在重建阶梯的第一步中失败了。尽管美学和功能结果有希望,但主要限制因素仍然是需要大量应用终身免疫抑制及其众所周知的医疗风险,从而阻止更广泛的适应症。因此,解除VCA中的免疫屏障对于使用最先进的手术技术打破道德规模和改善患者的生活质量至关重要。患者特异性移植物的 从头 创建是重建移植即将取得的突破。使用组织工程技术,VCA可以释放供体细胞,并通过灌注-去细胞化-再细胞化为受体定制。为了开发这些新技术,需要大规模的动物VCA模型。因此,由皮肤、脂肪、筋膜和血管组成的猪筋膜皮肤皮瓣是VCA初步研究的理想模型。然而,文献中描述的大多数VCA模型包括肌肉和骨骼。这项工作报告了一种可靠且可重复的猪大隐筋膜皮肤皮瓣收获技术,是各种研究领域,特别是血管化复合组织工程的实用工具。
引言
血管化复合同种异体移植物(VCA)彻底改变了难以修复的身体部位损失的治疗,例如手,脸和阴茎1,2,3。不幸的是,最初的长期结果4表明,终身服用高剂量免疫抑制剂可导致严重的附带疾病,包括糖尿病,感染,肿瘤形成和肾血管功能障碍5。最近,VCA专家团队不得不管理导致移植物丢失的慢性排斥反应的风险,并执行第一个面部再移植病例6,7。已经描述了不同的策略来克服VCA中免疫抑制的局限性。第一种依赖于通过在同种异体移植受体中诱导免疫混合嵌合状态来建立长期移植耐受性8,9。第二种涉及通过组织工程从头创建患者特异性移植物。
最近,生物组织的灌注脱细胞化产生了天然细胞外基质(ECM)支架,允许保存整个器官的血管网络和组织结构10。因此,用受体特异性细胞对这些ECM进行再细胞化将产生不受免疫限制的定制移植物。在VCA生物工程的研究中,多个团队已经去细胞化并获得了保留整个架构的ECM11,12,13。然而,细胞再生过程仍然具有挑战性,并且在大型动物模型中尚未成功14,15。开发这些突破性技术需要可靠且可重复的大型动物复合组织模型。猪模型代表了生物工程开发管道中的最佳选择,因为猪皮肤呈现出最接近人类皮肤的解剖学和生理特征16。在创建"定制"血管化复合组织移植物的第一步中,使用筋膜皮肤瓣(FCF)是理想的选择。事实上,FCF是一种包含皮肤,脂肪,筋膜和内皮细胞的基本VCA模型。猪肌皮肤皮瓣17和骨肌皮肤皮瓣18的描述可以在文献中找到。尽管如此,对筋膜-皮肤皮瓣收获技术缺乏关注。
因此,本研究旨在为研究人员提供猪隐形FCF采购技术的详细描述,并描述其在许多研究领域的所有特征,特别是在血管化复合组织工程中。
研究方案
所有动物都按照国家卫生研究所实验动物护理和使用指南接受人类护理。机构动物护理和使用委员会批准了实验方案(IACUC-协议#2020N000015)。所有实验均使用七只雌性约克郡猪(20-25公斤)。
1.术前护理
- 手术前12小时禁食动物以获取固体食物。
- 用4.4mg / kg特拉唑,2.2mg / kg甲苯噻嗪和0.04mg / kg(IM)硫酸阿托品镇静动物(见 材料表)。
- 将 18 G 外周静脉导管置于耳静脉中。
- 用适当的气管插管插管猪(6-15毫米可用于10-200公斤猪)并将管子连接到呼吸机。用丁丙诺啡(0.05mg / kg,IM)进行术前镇痛(见 材料表)。
2.术中监测
- 用1.5%-3%异氟醚和1.5L / min氧气流量的吸入混合物维持麻醉。
- 持续监测心率、脉搏血氧饱和度和潮气末 CO2。每5分钟评估一次血压和体温。
注意:心率的目标范围在 90-100 次/分钟之间,血氧饱和度必须高于 93%,潮气末 CO 2 范围在CO 2 的 5%-6% 之间。 - 在整个手术过程中每小时给予 5-10 mL/kg0.9% 盐水,以调节平均动脉压在 60 mmHg 和 90 mmHg 之间。
3. 双边隐形FCF采购
- 将动物置于仰卧位。剃须和擦洗腹股沟和后肢,包括手术部位的整个后肢,并以无菌方式悬垂。
- 触诊隐动脉脉搏~3指宽的内侧距髌骨并标记它。
- 识别并绘制襟翼的界限。
注意:上限是平行于其下方 3 厘米的腹股沟折痕的轴。外侧极限是从髂前上棘到髌骨内侧的轴。 - 画一个直径为10厘米的椭圆形皮瓣,以隐蒂为中心,并包含在前面描述的皮瓣限制中(步骤3.3)。
- 在皮瓣标志的椎弓根远端做一个 1.5 cm 的皮肤切口。
- 打开筋膜和钝性解剖,露出隐动脉及其两个静脉导管。进行双连字并在一束中分开。
- 用刀片切开皮瓣的剩余皮肤。
- 使用烧灼术打开皮下组织和周围的筋膜。使用双极镊子进行彻底止血(见 材料表)。
- 用 3-0 条不可吸收的缝合线将皮瓣的皮肤成分连接到下面的筋膜上,以避免无意中牵引和穿孔血管的破坏。
- 通过将筋膜从肌肉上解剖出来,将皮瓣从肌烬上释放出来。
注意:隐蒂的远端部分在腹股沟肌和筋膜之间的平面上延伸。适当的张力和谨慎的侧枝双相止血是缓解椎弓根夹层的关键因素。 - 用手术刀在腹股沟折痕处做一个12厘米的切口。进行垂直切口,将腹股沟折痕连接到皮瓣的近端。抬开连接皮肤,用烧灼术打开皮下层。
- 继续椎弓根清扫,沿着隐血管向下朝股血管方向移动。
注意:隐蒂的近端部分可以穿过肌间隔或潜入肌束肌。 - 将股骨血管骨架化,并将它们远端结扎到大隐支上,分成两束。继续从远端到近端解剖股血管,直到达到腹股沟韧带的水平。使用双极镊子烧灼或血管夹和 2-0 丝带结扎深股血管,然后切断。
注意:在切割血管之前也可以使用血管夹。 - 在对侧后肢重复步骤3.2-3.13以收获第二个隐瓣。
- 在步骤3.16之前5分钟用静脉内(IV)肝素注射液(100IU / kg)使动物肝素化。
- 尽可能在腹股沟韧带近端结扎股骨蒂(动脉和静脉),并将皮瓣与供体猪分开。
- 扩张股血管末端,并在动脉和静脉中插入 20 G 血管导管。使用3-0丝带将导管固定在血管上。
- 用10mL肝素盐水(100IU / mL)缓慢冲洗筋膜 - 皮肤皮瓣动脉,直到观察到清晰的静脉流出(图1)。
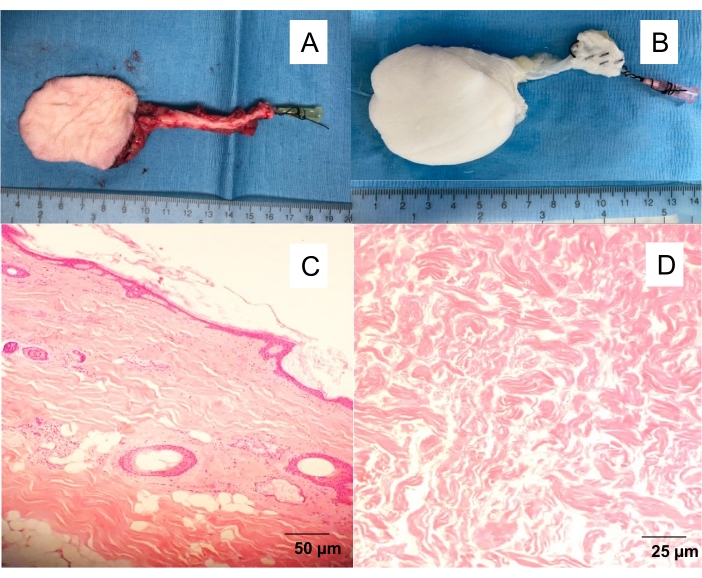
图 1:天然和去细胞化的隐性筋膜皮肤皮瓣。 (A)孤立的皮瓣,在股动脉中插入20G血管导管,允许从血液中清洗皮瓣并进行不同的实验(血管造影,灌注脱细胞)。(B)去细胞化皮瓣。灌注脱细胞在洗涤剂灌注 10 天后产生白色无细胞支架。H&E染色的(C)天然皮瓣和(D)脱细胞皮瓣的全层横截面。 请点击此处查看此图的大图。
- 用静脉注射苯巴比妥钠(100mg / kg)对动物实施安乐死。通过无心跳和呼吸运动来确认死亡。
结果
在对活体动物进行这项工作之前,确定了三个尸体标本上的隐孔体(图2)。将彩色填充溶液注入隐动脉,以遮盖来自动脉的特定血管网络。该溶液由10mL蓝色甘油剂与10mL稀释剂混合而成(见 材料表)。这生成了由隐动脉血管化的皮肤的彩色图,并允许绘制隐动脉的界限。
讨论
本文描述了一种在猪后肢上收获的可靠且可重复的筋膜皮瓣。遵循此分步手术方案将允许在不到2小时的时间内仅在一只动物上获得两个皮瓣。手术最关键的一步是肌细肌纤维内血管蒂的骨骼化,这需要熟练的外科医生进行彻底解剖。使用皮肤缝合线将皮肤固定在筋膜上是避免剪切效应破坏穿支血管和随后皮瓣皮肤血管化的关键提示。隐形FCF(长血管蒂,血管口径适中)的特性及其可靠性使其成为...
披露声明
作者没有什么可透露的。
致谢
这项工作由Shriners儿童医院拨款#85127(BEU和CLC)和#84702(AA)资助。作者要感谢"Gueules Cassées"基金会为参与该项目的研究员提供的工资支持。
材料
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
参考文献
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。