需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用压痕和磁共振弹性成像对软组织模拟明胶模型进行粘弹性表征
摘要
本文演示和总结了制作模拟软组织的明胶模型的方案,以及使用压痕和磁共振弹性成像进行相应的粘弹性表征。
摘要
表征软生物组织的生物力学特性对于了解组织力学和探索疾病、损伤和发育的生物力学相关机制非常重要。机械测试方法是组织表征最直接的方法,被认为是 体内 测量的验证。在众多 离体 力学测试技术中,压痕测试提供了一种可靠的方法,特别是对于小、难以固定和粘弹性的样品,例如脑组织。磁共振弹性成像(MRE)是一种临床上用于测量软组织生物力学特性的方法。基于使用MRE记录的横波在软组织中的传播,可以根据波动 方程估计软 组织的体内粘弹性。在这里,通过MRE和压痕测量了两种不同浓度的明胶模型的粘弹性。已经提出了模型制造、测试和模量估计的协议。
引言
大多数软生物组织似乎具有粘弹性,这对于了解它们的损伤和发育很重要1,2。此外,粘弹性是诊断纤维化和癌症等多种疾病的重要生物标志物3,4,5,6。因此,表征软组织的粘弹性至关重要。在使用的众多表征技术中,组织样品的离体机械测试和使用生物医学成像的体内弹性成像是两种广泛使用的方法。
虽然已经使用了各种机械测试技术进行软组织表征,但对样品大小和测试条件的要求并不容易满足。例如,剪切试验需要将样品牢固地固定在剪切板7之间。双轴检测更适合膜组织,并具有特定的夹紧要求8,9。压缩测试通常用于组织测试,但不能表征一个样品10中的特定位置。压痕测试对固定组织样本没有额外的要求,可用于测量许多生物组织样本,例如大脑和肝脏。此外,使用小压头,可以测试样品中的区域特性。因此,已经采用压痕测试来测试各种软组织1,3,11。
表征体内软组织的生物力学特性对于生物力学的转化研究和临床应用非常重要。超声(US)和磁共振(MR)成像等生物医学成像方式是最常用的技术。虽然美国成像相对便宜且易于进行,但它的对比度低,难以测量大脑等器官。MR弹性成像(MRE)能够对深层结构进行成像,可以测量各种软组织6,12,尤其是大脑13,14。通过施加外部振动,MRE可以在特定频率下测量软组织的粘弹性。
研究表明,在50-60赫兹时,正常大脑的剪切模量为~1.5-2.5kPa5,6,13,14,15,正常肝脏16为~2-2.5kPa。因此,具有相似生物力学特性的明胶幻影已被广泛用于模拟软组织进行测试和验证17,18,19。在该协议中,制备并测试了两种不同浓度的明胶幻影。使用定制的电磁MRE装置14和压痕装置1,3对明胶模型的粘弹性进行了表征。测试方案可用于测试许多软组织,例如大脑或肝脏。
研究方案
1. 明胶幻影制剂
- 根据 表1称取明胶,甘油和水。将明胶粉与水混合,得到明胶溶液。
注意:用于制备两个模型的各个组分的浓度如 表1所示。明胶浓度越高,幻影越硬。 - 在水浴中将明胶溶液加热至60°C。在保持温度的同时将甘油加入明胶溶液中。
注意:甘油通过提高明胶混合物的熔化温度和剪切模量17来稳定明胶混合物。 - 搅拌溶液并再次加热至60°C。将混合溶液倒入将用于MRE和压痕测试的容器中。将溶液冷却至室温,等待溶液凝固。
2. 地雷危险教育测试
- 将振动板放在明胶幻影的顶部。确保幻影和振动板之间的接触牢固(图1A)。
注意:振动板由聚酰胺制成,尺寸为 50 x 50 x 5 mm3。 - 将明胶幻影放入头部线圈中。在明胶幻影周围放海绵和沙袋,以确保幻影牢固放置。使用带有传动杆14,18 的定制电磁致动器。在磁头线圈上安装电磁致动器。将传动杆连接到振动盘(图1B)。
- 将执行器的电源线与放大器连接。将控制线与控制器连接(图1C)。
- 执行器和 MRI 扫描参数设置
- 在函数发生器中设置波形、振动频率和振幅。通过调整功率放大器来设置所需的振动幅度。
注意:此处,波形在函数发生器中设置为正弦;振动频率设置为 40 Hz 或 50 Hz,振幅设置为 1.5 Vpp。在功率放大器中,放大比设置为40%。 - 将函数生成器设置为在触发模式下工作。将触发线连接到MRI机器的外部触发端口。
- 将MRE扫描(执行器)频率设置为与函数发生器的频率相同,以便运动编码梯度与振动板的运动同步。
- 在函数发生器中设置波形、振动频率和振幅。通过调整功率放大器来设置所需的振动幅度。
- 数据测量和分析
- 遵循常规成像定位程序。使用基于 2D 梯度回波 (GRE) 的 MRE 序列对明胶模型20 进行成像。GRE-MRE成像参数设置如下:翻转角度= 30°;TR/TE = 50/31 毫秒;视场 = 300 mm;切片厚度 = 5 毫米;体素大小 = 2.34 x 2.34 mm2.
- 在一个正弦周期内测量四个时间点的相位图像。在每个时间点应用正负运动编码渐变。
- 根据采集的相位图像,通过减去正负编码相位图像来去除背景相位。使用基于可靠性排序的算法21 展开阶段。
- 通过将快速傅里叶变换应用于展开的相位图像来提取运动的主分量。使用数字带通滤波器滤除相位图像。使用 2D 直接反演 (DI) 算法估计剪切模量,以获得储能模量 G' 和损耗模量 G''13,14。
注意:带通滤波器的截止频率为 [0.04 0.08]。DI 算法的拟合窗口的大小为 11 x 11。
3. 压痕测试
- 使用圆形冲头或手术刀片将明胶幻影分别修剪成圆柱形或长方体样品。确保样品厚度在 3 到 10 毫米之间,圆柱形样品或长方体的长边直径大于 4 毫米。使用锋利的刀片修剪样品表面,使其尽可能光滑,便于压痕。
- 打开压痕测试仪的电源。使用旨在自动执行压头接触程序的压头控制程序(自定义程序;请参阅 材料表)执行以下操作。
- 单击 GUI 中的 "后退 "按钮以初始化校准过程(图 2B)。从激光传感器读取值,然后在 "基线 "框中键入该值。
注意: 在校准过程中,激光传感器和挡板之间的距离被调整到特定的预定义值。 - 将载玻片放在挡板上并记录激光传感器显示的值。接下来,将样品放在载玻片上,并将它们一起放在挡板上。从激光传感器读取该值,并在 "样本+幻灯片 "框中键入此值。
注意:激光传感器用于记录压痕的位移,但也用于在测试前测量样品厚度。 - 将步骤3.2.2中获得的两个值之间的差异作为感兴趣区域(ROI)处的样品厚度。
- 小心地将样品与下面的载玻片一起放在压头的正下方,然后单击"接触"按钮以启动压头和样品表面之间的自动 接触 。
注意:如果自动触点不令人满意,即压头深入样品或没有触点,通过在 偏移 框中键入0.05-0.1 mm范围内的值来调整压头位置,然后重复步骤1.2.1-1.2.4。 - 根据测量的样品厚度(步骤3.2.3),通过将厚度乘以压痕测试应变来估计压痕位移(即总压痕深度)(此处设置为≤8%以将压痕保持在小应变假设内)。
- 在位移(毫米)框中键入位 移值(步骤 3.2.5)。在" 停留时间" 框中将松弛时间设置为 180 秒。单击缩 进 按钮。斜坡保持过程中的位移和反作用力将自动记录并保存在指定 文件路径的文件中。
注意:文件路径可以预定义为保存测试数据的 路径 。
- 单击 GUI 中的 "后退 "按钮以初始化校准过程(图 2B)。从激光传感器读取值,然后在 "基线 "框中键入该值。
- 将缩进数据导出到电子表格。使用两项 Prony 级数
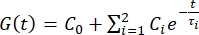 来拟合力松弛曲线1,3,11:
来拟合力松弛曲线1,3,11: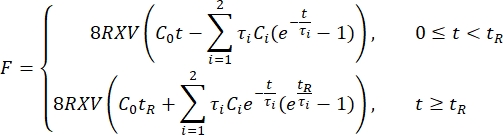
- 根据拟合参数估算瞬时剪切模量 (G 0) 和长期剪切模量 (G∞):
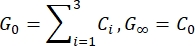
注意:在上述等式中,C 0、C i 和 τi 是 Prony 级数的模型参数,F 是压痕力,R 是压头的半径,X 是无限半空间假设的补偿因子,V 是压痕速度,t 是时间变量,t R 是斜坡时间。
结果
按照MRE协议,观察到明胶幻影中以40和50 Hz传播的清晰横波传播(图3)。通过MRE测量的粘弹性和压痕测试如图 4所示。 表2总结了每个模型每次测试时的估计G'和G"值。按照压痕方案, 表3总结了每个测试点每个模型的粘弹性。
如图4所示,对于使用MRE的测量,在40和50 Hz下测量的G'和G"值?...
讨论
明胶模型通常用作组织模拟材料,用于测试和验证算法和设备17,19,22,23,24,25,26,27。Okamoto等人(2011)提出了使用明胶模型来比较MRE和动态剪切测试的开创性研究之一(2011)1...
披露声明
作者声明没有利益冲突。
致谢
获得国家自然科学基金(31870941)、上海市自然科学基金(22ZR1429600)和上海市科学技术委员会(资助19441907700)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 24-channel head & Neck coil | United Imaging Healthcare | 100120 | Equipment |
| 3T MR Scanner | United Imaging Healthcare | uMR 790 | Equipment |
| Acquisition board | Advantech Co | PCI-1706U | Equipment |
| Computer-Windows | HP | 790-07 | Equipment |
| Electromagnetic actuator | Shanghai Jiao Tong University | Equipment | |
| Function generator | RIGOL | DG1022Z | Equipment |
| Gelatin | CARTE D’OR | Reagent | |
| Glycerol | Vance Bioenergy Sdn.Bhd | Reagent | |
| Indenter control program | custom-designed | Software; accessed via: https://github.com/aaronfeng369/FengLab_indentation_code. | |
| Laser sensor | Panasonic | HG-C1050 | Equipment |
| Load cell | Transducer Technique | GSO-10 | Equipment |
| MATLAB | Mathworks | Software | |
| Power amplifier | Yamaha | A-S201 | Equipment |
| Voice coil electric motor | SMAC Corporation | DB2583 | Equipment |
参考文献
- Qiu, S., et al. Viscoelastic characterization of injured brain tissue after controlled cortical impact (CCI) using a mouse model. Journal of Neuroscience Methods. 330, 108463 (2020).
- Garcia, K. E., et al. Dynamic patterns of cortical expansion during folding of the preterm human brain. Proceedings of the National Academy of Sciences of the United States of America. 115 (12), 3156-3161 (2018).
- Qiu, S., et al. Characterizing viscoelastic properties of breast cancer tissue in a mouse model using indentation. Journal of Biomechanics. 69, 81-89 (2018).
- Yin, Z., et al. A new method for quantification and 3D visualization of brain tumor adhesion using slip interface imaging in patients with meningiomas. European Radiology. 31 (8), 5554-5564 (2021).
- Streitberger, K. -. J., et al. How tissue fluidity influences brain tumor progression. Proceedings of the National Academy of Sciences of the United States of America. 117 (1), 128 (2020).
- Bunevicius, A., Schregel, K., Sinkus, R., Golby, A., Patz, S. REVIEW: MR elastography of brain tumors. NeuroImage: Clinical. 25, 102109 (2020).
- Namani, R., et al. Elastic characterization of transversely isotropic soft materials by dynamic shear and asymmetric indentation. Journal of Biomechanical Engineering. 134 (6), 061004 (2012).
- Potter, S., et al. A novel small-specimen planar biaxial testing system with full in-plane deformation control. Journal of Biomechanical Engineering. 140 (5), 0510011 (2018).
- Zhang, W., Feng, Y., Lee, C. -. H., Billiar, K. L., Sacks, M. S. A generalized method for the analysis of planar biaxial mechanical data using tethered testing configurations. Journal of Biomechanical Engineering. 137 (6), 064501 (2015).
- Delaine-Smith, R. M., Burney, S., Balkwill, F. R., Knight, M. M. Experimental validation of a flat punch indentation methodology calibrated against unconfined compression tests for determination of soft tissue biomechanics. Journal of the Mechanical Behavior of Biomedical Materials. 60, 401-415 (2016).
- Chen, Y., et al. Comparative analysis of indentation and magnetic resonance elastography for measuring viscoelastic properties. Acta Mechanica Sinica. 37 (3), 527-536 (2021).
- Garteiser, P., Doblas, S., Van Beers, B. E. Magnetic resonance elastography of liver and spleen: Methods and applications. NMR in Biomedicine. 31 (10), 3891 (2018).
- Arani, A., Manduca, A., Ehman, R. L., Huston Iii, J. Harnessing brain waves: a review of brain magnetic resonance elastography for clinicians and scientists entering the field. British Journal of Radiolology. 94 (1119), 20200265 (2021).
- Qiu, S., et al. An electromagnetic actuator for brain magnetic resonance elastography with high frequency accuracy. NMR in Biomedicine. 34 (12), 4592 (2021).
- Hiscox, L. V., et al. Standard-space atlas of the viscoelastic properties of the human brain. Human Brain Mapping. 41 (18), 5282-5300 (2020).
- Seyedpour, S. M., et al. Application of magnetic resonance imaging in liver biomechanics: A systematic review. Frontiers in Physiology. 12, 733393 (2021).
- Okamoto, R. J., Clayton, E. H., Bayly, P. V. Viscoelastic properties of soft gels: comparison of magnetic resonance elastography and dynamic shear testing in the shear wave regime. Physics in Medicine and Biology. 56 (19), 6379-6400 (2011).
- Feng, Y., et al. A multi-purpose electromagnetic actuator for magnetic resonance elastography. Magnetic Resonance Imaging. 51, 29-34 (2018).
- Zeng, W., et al. Nonlinear inversion MR elastography with low-frequency actuation. IEEE Transactions on Medical Imaging. 39 (5), 1775-1784 (2020).
- Wang, R., et al. Fast magnetic resonance elastography with multiphase radial encoding and harmonic motion sparsity based reconstruction. Physics in Medicine and Biology. 67 (2), (2022).
- Herraez, M. A., Burton, D. R., Lalor, M. J., Gdeisat, M. A. Fast two-dimensional phase-unwrapping algorithm based on sorting by reliability following a noncontinuous path. Applied Optics. 41 (35), 7437-7444 (2002).
- Gordon-Wylie, S. W., et al. MR elastography at 1 of gelatin phantoms using 3D or 4D acquisition. Journal of Magnetic Resonance. 296, 112-120 (2018).
- McGarry, M., et al. Uniqueness of poroelastic and viscoelastic nonlinear inversion MR elastography at low frequencies. Physics in Medicine and Biology. 64 (7), 075006 (2019).
- Zampini, M. A., Guidetti, M., Royston, T. J., Klatt, D. Measuring viscoelastic parameters in Magnetic Resonance Elastography: a comparison at high and low magnetic field intensity. Journal of the Mechanical Behavior of Biomedical Materials. 120, 104587 (2021).
- Ozkaya, E., et al. Brain-mimicking phantom for biomechanical validation of motion sensitive MR imaging techniques. Journal of the Mechanical Behavior of Biomedical Materials. 122, 104680 (2021).
- Guidetti, M., et al. Axially- and torsionally-polarized radially converging shear wave MRE in an anisotropic phantom made via Embedded Direct Ink Writing. Journal of the Mechanical Behavior of Biomedical Materials. 119, 104483 (2021).
- Badachhape, A. A., et al. The relationship of three-dimensional human skull motion to brain tissue deformation in magnetic resonance elastography studies. Journal of Biomechanical Engineering. 139 (5), 0510021 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。