Method Article
用于无细胞重建的重组隔肽复合物的纯化和质量控制
摘要
细胞骨架蛋白的体外重建是了解这些蛋白质基本功能特性的重要工具。本文描述了一种纯化和评估重组隔膜复合物质量的方案,重组隔膜复合物在细胞分裂和迁移中起核心作用。
摘要
Septins是一系列保守的真核GTP结合蛋白,可以从异寡聚复合物形成细胞骨架丝和高阶结构。它们与其他细胞骨架成分和细胞膜相互作用,参与重要的细胞功能,如迁移和细胞分裂。由于隔肽多种相互作用的复杂性,大量的隔膜素基因(人类为13个),以及隔膜素形成具有不同亚基组成的异质寡聚复合物的能力,无细胞重建是了解隔膜素生物学基础的重要策略。本文首先描述了一种使用两步亲和色谱法纯化异质低聚形式的重组隔膜的方法。然后,详细介绍了用于检查隔膜素复合物纯度和完整性的质量控制过程。该过程结合了天然和变性凝胶电泳、负染色电子显微镜和干涉散射显微镜。最后,介绍了利用负染色电镜和荧光显微镜检查隔膜络合物聚合能力的方法。这表明有可能生产含有不同亚型septin_9的高质量人隔膜六聚体和八聚体,以及 果蝇 隔膜六聚体。
引言
细胞骨架被经典地描述为由肌动蛋白丝、微管和中间丝 1 组成的三组分系统,但最近,隔肽已被公认为细胞骨架1 的第四种成分。Septins是GTP结合蛋白家族,在真核生物2中是保守的。Septins参与许多细胞功能,例如细胞分裂3,细胞粘附4,细胞运动5,形态发生6,细胞感染7以及细胞极性的建立和维持8。尽管它们具有重要作用,但对隔膜素如何参与这些过程知之甚少。
根据蛋白质序列相似性2,隔肽蛋白家族被细分为几个亚组(四个或七个,取决于分类)。不同亚科的成员可以形成回文异寡聚复合物,它们是细丝的构建块,反过来又组装成高阶结构,如束、环和网状结构 1、9、10、11、12。进一步的分子复杂性源于不同剪接变体的存在,一个例子是人类SEPT9,其中有证据表明不同剪接变体13,14,15的特定功能。此外,异质低聚物的长度取决于物种和细胞类型。例如,秀丽隐杆线虫隔膜形成四聚体16,黑腹果蝇隔膜形成六聚体17(图1A),酿酒酵母隔膜形成八聚体18,人隔膜形成六聚体和八聚体19(图1A)。来自同一亚家族的隔膜素亚型、剪接变体和翻译后修饰的隔膜在复合物中相互替换的能力以及不同大小的异质低聚物的(共同)存在使得难以描述不同异质低聚复合物的细胞功能12。
隔肽的另一个有趣的能力是它们与细胞中的许多结合伴侣相互作用的能力。隔膜素在间期和细胞分裂期间结合质膜和膜细胞器20,21,22。在分裂细胞中,隔膜素在细胞分裂过程中与苯甲素23,24,25以及肌动蛋白和肌球蛋白合作26,27。在细胞分裂的晚期,隔膜素似乎调节中体脱落转运(ESCRT)系统所需的内体分选复合物28。此外,还有证据表明隔膜蛋白位于肌动蛋白皮层和肌动蛋白应激纤维上 间期细胞29,30,31。在特定细胞类型中,隔膜素还结合和调节微管细胞骨架32,33。
所有这些特征使隔膜素成为一个非常有趣的蛋白质系统,也是一个具有挑战性的系统。大量的隔肽亚基(人类中的13个基因,不计算剪接变体2)与来自同一亚科的隔肽亚基相互替换并形成不同大小的异质低聚物的潜力相结合,使得很难通过遗传操作得出关于特定隔肽的细胞功能的结论。此外,隔肽的多种相互作用使得解释常见研究工具(例如针对细胞骨架或膜成分的药物34 )的作用成为一项艰巨的任务。
克服这种情况的一种方法是通过隔膜素的体外(无细胞)重建来补充细胞研究。体外复溶允许分离具有特定亚基组成和长度18,35,36,37的单一类型的隔肽异低聚物。然后可以在受控环境中研究该复合物,可以单独发现隔肽38,39,40的基本结构和物理化学特性,或者与所需的伴侣(例如模型生物膜11,41,42,肌动蛋白丝10,27或微管32,36)结合使用,以破译其性质相互 作用。
因此,有效纯化不同隔膜素复合物的可靠方法对于隔膜素研究至关重要。然而,即使使用相同的方案,不同的纯化也可以使蛋白质具有不同的活性/功能甚至完整性。对于酶等市售蛋白质,其功能和酶活性经过仔细验证43。对细胞骨架或结构蛋白(如隔膜素)实施仔细的质量控制可能具有挑战性,但必须使实验室之间的实验具有可比性。
本文描述了一种基于在大肠杆菌细胞中同时表达两种含有单顺反子或双顺反子构建体的载体(表1)的异质低聚体纯化高质量重组隔膜的稳健方法。该方法包括一种两步亲和色谱方法,用于捕获含有HIS 6 标记隔肽和 Strep-II 标记隔肽的隔肽异低聚物(图 1B,C)。该协议首先在 Iv 等人 10 中描述,已用于纯化果蝇隔膜六聚体11,27,35、人隔膜六聚体 10 和含有不同天然(亚型 1、3 和 5)的几种人隔肽八聚体10,32 或突变的 SEPT9 亚型 32.此外,还描述了一套评估纯化隔膜质量的技术。首先,使用变性电泳和透射电子显微镜(TEM)检查隔肽亚基的完整性和正确的化学计量。然后,通过干涉散射显微镜(iSCAT)通过天然电泳和质谱光度法检查正确分子量的异质低聚物的存在以及指示复杂不稳定性的单体或较小低聚物的存在。最后,最后一步包括使用荧光显微镜和TEM评估隔膜的聚合活性。
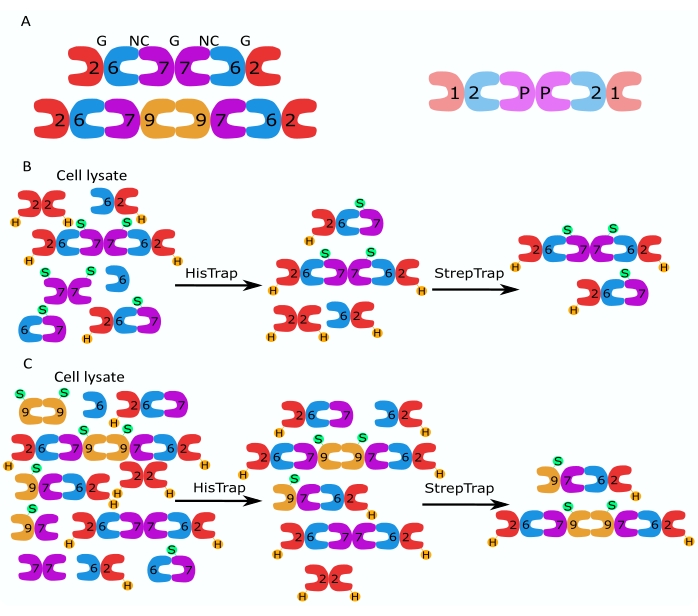
图 1:纯化策略 。 (A)存在于人(左)和 果蝇 (右)细胞中的隔膜素异寡聚物的示意图。数字表示来自指定组的隔肽亚基,P表示花生。人类SEPT9可以是其任何亚型。隔膜亚基具有不对称的形状,并且与两个不同的界面纵向相关,NC:NC和G:G界面,分别由人类六聚体顶部的NC和G表示。(乙,丙)两步色谱策略的示意图,所示为(B)人隔丁六聚体和(C)八聚体。H 表示 his-tags,而 S 表示 Strep-II 标签。 请点击此处查看此图的大图。
研究方案
1. 隔肽异质低聚物的纯化
- 细菌细胞与表达载体的共转化
- 选择一个pnEA和一个pnCS质粒44 的组合,用于表达。根据隔肽异低聚物10,35 的所需亚基组成以及是否需要荧光标记来选择组合。
注意:这里使用C末端标记的单体超级文件夹GFP(msfGFP)标记的SEPT2(用于人隔膜)或msfGFP-或单体增强GFP(mEGFP)-DSep2(用于 果蝇 隔膜)(表1)。 - 将 1 μL 每个质粒 (~1 ng/μL) 移液到 100 μL 感受态 BL21 大肠杆菌 细胞中,并在冰上孵育 20 分钟。
- 将细胞置于42°C的水浴中40秒,然后立即在冰上孵育3分钟。
- 向细胞悬液中加入0.9mL溶原肉汤(LB)培养基,让细胞在37°C下生长1小时。 将 100 μL 细胞接种在含有 100 μg/mL 氨苄青霉素和 100 μg/mL 大观霉素的温热 LB-琼脂平板上,并在 37 °C 下孵育过夜。
- 选择一个pnEA和一个pnCS质粒44 的组合,用于表达。根据隔肽异低聚物10,35 的所需亚基组成以及是否需要荧光标记来选择组合。
- 培养细菌预培养
- 用 100 mL 极好的肉汤 (TB) 或含有 100 μg/mL 氨苄青霉素和 100 μg/mL 大观霉素的 LB 培养基填充 250 mL 锥形瓶。
- 用无菌接种环从LB-琼脂平板中挑选出单个菌落,并将其转移到步骤1.2.1中的新鲜培养基中。
- 在旋转振荡器培养箱中于37°C孵育过夜或至少6小时。
注意:从该培养物中,可以通过将细菌悬浮液与甘油1:1混合并储存在-80°C来制备甘油原液。 该储备可用于步骤1.2.2。而不是新改造的殖民地。
- 细菌培养和蛋白表达诱导
- 将 100 mL 生长细菌转移到含有 50 μg/mL 氨苄青霉素和 50 μg/mL 壮观霉素的 5 L TB 或 LB 中。
- 在摇床培养箱中在37°C下培养该培养物,直到其达到在600nm波长下测量的光密度(OD),对于未标记的隔膜素,在2-3范围内,对于msfGFP / mEGFP标记的隔膜素为0.6-0.8,并通过添加终浓度为0.5mM IPTG诱导蛋白质表达。标记的隔膜素的较低OD是为了避免在其较长的表达时间内达到死亡阶段,详见下一步。
- 将表达未标记的隔肽异寡聚物的细胞在37°C孵育3小时,或在17°C下孵育表达msfGFP标记的异质低聚物过夜的细胞。
注意:选择使用更丰富的结核病培养基促进未标记复合物的短蛋白表达时间以防止蛋白质降解。对于标记的复合物,选择更长的表达时间和较低的温度,以允许msfGFP标签的正确折叠。
- 细菌裂解和裂解物澄清
注意:从纯化过程中的这一点开始,始终将含蛋白质的溶液保持在冰上或4°C,以防止蛋白水解蛋白质降解或活性损失。- 通过在4°C下以4,000× g 离心20分钟来收集培养的细胞。 弃去上清液。
- 可选地,在此步骤中快速冷冻沉淀并在-80°C下储存最多6个月。如果选择此选项,请确保在继续之前在冰上解冻颗粒。
- 将沉淀溶解在100 mL裂解缓冲液(表2)中并裂解细胞。选择以下两个选项之一
- 使用尖端超声仪使用 30% 振幅在 30 秒开和 59 秒关的 7 个周期中进行超声处理(请注意,设置取决于超声仪)。
- 通过至少 3 次传递来分解法国媒体中的单元格。
- 通过在4°C下以20,000× g 离心30分钟澄清细胞裂解物并保持上清液。建议从步骤 1.5.1 开始。在这个离心步骤中。
- 或者,取样进行变性电泳,如第 2 节所述。
- 通过在4°C下以4,000× g 离心20分钟来收集培养的细胞。 弃去上清液。
- His标记蛋白的亲和色谱
注意:此步骤使用镍柱产生含有人SEPT2或果 蝇 Sep1的复合物(图1B)。- 用隔膜缓冲液平衡预填充的镍琼脂糖高效色谱柱(表2)。
- 将澄清的上清液以1 mL/min的速度加载到色谱柱上,并用至少三柱体积的隔膜缓冲液洗涤结合的蛋白质。
- 用50%HisTrap洗脱缓冲液(表2)以1 mL/min的速度洗脱隔肽复合物,同时收集0.5 mL级分,得到250 mM的咪唑浓度。
- 选择含有隔肽复合物的级分,如用快速蛋白质液相色谱(FPLC)系统在线监测洗脱液在280nm处的光学吸光度所示,或在用微量分光光度计纯化后。
注意:咪唑吸收280nm处的光。这可能解释了为什么隔膜洗脱后蛋白峰没有恢复到零吸光度(图2A)。
- 链球菌-II标记蛋白的亲和色谱
注意:此步骤使用链球菌肌动蛋白柱产生含有人 SEPT7(六聚体)、人 SEPT9(八聚体)或 果蝇 花生的复合物(图 1B)。色谱柱基于改良的生物素-链霉亲和素系统。该蛋白用修饰的生物素(Strep-II-tag)标记,色谱柱含有工程化的链霉亲和素(Strep-Tactin)。尽管是从生物素-链霉亲和素系统改性而来的,但链球菌-塔克汀-链球菌-II-标签系统和生物素-链霉亲和素系统之间没有干扰。所述系统用于避免干扰使用生物素和链霉亲和素的复溶测定。- 用隔肽缓冲液平衡预填充的链球菌素琼脂糖高效色谱柱(表2)。以 1 mL/min 的速度加载从镍柱中回收的含隔膜的馏分,并用至少三列体积的隔膜缓冲液洗涤结合的蛋白质。
- 用 100% StrepTrap 洗脱缓冲液(表 2)以 1 mL/min 的速度洗脱隔膜络合物,同时收集 0.5 mL 级分以产生浓度为 2.5mM 的去硫菌素。
注意:StrepTrap洗脱缓冲液中的去硫菌素必须新鲜溶解。 - 选择含有隔肽复合物的级分,如用FPLC系统在线监测洗脱液在280nm处的光学吸光度所示,或在用微量分光光度计纯化后。
注意:变性电泳通常在此时使用色谱柱洗涤和隔膜组分的样品进行。列的顺序可以反转,结果难以区分,即步骤1.4之后澄清的裂解物。可进行链球菌-肌动蛋白亲和层析,然后进行镍亲和层析。
- 透析和储存
- 为了从最终储存溶液中去除脱硫菌素,将隔膜复合物以~1:300的样品缓冲液体积比与隔肽缓冲液(表2)隔膜透析,并补充有1mM DTT过夜,或至少4小时,在4°C下使用30kDa MWCO透析膜。
- 或者,使用30 kDa MWCO离心浓缩柱将隔膜浓缩至所需浓度。目标是5-7μM的浓度,通过溶液在280nm处的光学吸光度测量,并使用通过ProtParam计算的理论消光系数(表3)。
- 将蛋白质复合物等分到所需的等分试样大小,快速冷冻等分试样,并将其储存在-80°C。
注意:建议不要将蛋白质储存超过 6 个月。此外,建议定期进行质量控制实验,特别是如果蛋白质的储存时间超过推荐时间。
2. 隔膜异质低聚物纯度和完整性的质量控制
注意:异质低聚物质量控制由一组生化和成像技术组成,可用于检测溶液中存在的隔膜素复合物的质量和完整性。
- 变性电泳以检查具有正确组分的隔肽异低聚物的形成
- 将 10 μL 所选馏分与 10 μL 2x SDS 样品缓冲液混合,将其上样到预制的 4%-15% TGX 凝胶上,并用 Tris/甘氨酸/SDS 电泳缓冲液填充系统。
- 在200V下运行电泳35分钟,并对凝胶(材料表)进行染色以可视化结果。单个隔膜蛋白和隔肽异寡聚复合物的分子量见 表3。
- 测量对比度倒置图像中含有纯化隔膜的每个泳道内每个条带的相对强度。为此,请计算每个波段周围大小相等的矩形的平均强度,以及同一泳道中没有任何波段的区域上大小相等的矩形的平均强度。然后,通过将每个波段的强度除以无波段的区域的强度来规范化值。
注意: 如果强度饱和(例如,对比度反转图像上的 8 位图像的值为 255),请跳过通道。
- 通过天然电泳 进行 集成平均天然尺寸分布
- 前一天准备 800 mL 阳极缓冲液和 200 mL 浅蓝色阴极缓冲液,并将它们存放在冰箱中。要制备阳极缓冲液,用 760 mL I 型去离子水(I-水)稀释 40 mL 的 20x 电泳缓冲液。要制备浅蓝色阴极缓冲液,请用 189 mL I-水稀释 10 mL 20x 电泳缓冲液和 1 mL 20x 阴极添加剂。电泳缓冲液和阴极添加剂随附套件(材料表)。
- 将~500 ng 隔膜与所需量的样品缓冲液(本例中为 2.5 μL,由于使用了 4x 样品缓冲液;参见 材料表)和足够的 I-水混合以达到 10 μL 的体积,制备 10 μL 的样品。
- 将样品加载到凝胶上,并用冰冷的阳极和阴极缓冲液填充系统。
- 使用在低电流下不停止的电源在150V下运行电泳约115分钟,并对凝胶(材料表)染色以可视化结果。基于序列计算的单个蛋白质和复合物的分子量可以在 表3中找到。
- 通过干涉散射显微镜使用质量光度法进行单分子质量分布
- 通过在超声波清洗机中超声处理#1.5载玻片在I-水中5分钟,在异丙醇中超声处理5分钟,最后在I-水中超声处理5分钟。
- 用温和的氮气流干燥两个载玻片,并将7 μL滴0.01%聚-L-赖氨酸(PLL)溶液放在其中一个载玻片的中心。然后,将另一张载玻片的中心放在PLL落差的顶部,将两个载玻片正交定向,以便于分离。孵育30秒。
- 通过浸入装有 I-water 1x 的烧杯中并直接涂抹 I-water 2x 流来洗涤。然后,用氮气流干燥两个载玻片。这些载玻片可以在干燥条件下在室温下储存约 6 周。
注意:标记用PLL处理的载玻片侧面以正确运行实验。
- 通过浸入装有 I-water 1x 的烧杯中并直接涂抹 I-water 2x 流来洗涤。然后,用氮气流干燥两个载玻片。这些载玻片可以在干燥条件下在室温下储存约 6 周。
- 在实验之前,切割一块 2 x 2、3 x 2 或 3 x 3 垫圈(分别产生 4、6 或 9 个成像室/载玻片),并将其粘贴在载玻片的 PLL 处理部分,同时避免载玻片和垫圈接触任何脏表面。将载玻片放在轻型刮水纸上,用移液器吸头按压垫圈,使其与保护塑料仍粘在垫圈上。
- 将隔膜缓冲液(表2)加热至室温并解冻手中的蛋白质(之后将它们放在冰上)。
注意:iSCAT显示一些类似于蛋白质信号的去垢剂和小分子的信号45。DTT是这些小分子之一,这就是为什么它不用于本实验的原因。储存的隔膜中只有一丝DTT。 - 将带垫圈的载玻片放在含有19 μL隔肽缓冲液的商用质量光度法系统上,并使用自动对焦选项聚焦显微镜。按照制造商的说明检查找到的焦点是否正确。此处使用作为设置一部分的标准100倍物镜。
- 创建或加载项目文件夹以使用" 新建项目>文件"或"文件>加载项目"来存储数据。
- 将 1 μL 样品移液到 19 μL 隔膜缓冲液滴(步骤 2.3.5)上,用于聚焦和混合,同时通过不接触任何东西来最大限度地减少载玻片的移动。然后,通过单击录制 6,000 帧的视频 记录.
- 为了正确分析,记录以下样品:隔肽缓冲液,用于校准信质量比的蛋白质质量标准品(如果最近校准可用且环境条件没有变化,则可以跳过该样品),以及在不含DTT的隔肽缓冲液中稀释的250nM隔肽复合物(最终浓度为~12.5nM)。
- 使用制造商的软件分析视频以获得蛋白质质量分布。按如下方式检查高质量的数据。
- 如果不同隔膜异质低聚物大小的峰重叠太多或检测到太多事件(对于 6,000 帧视频,常规视场为 128 像素 x 34 像素,跨越 10.8 μm x 2.9 μm,>3,500 个事件),降低最终隔肽浓度并再次测量。
- 如果测量的单个分子计数不足(对于具有常规视野的6,000帧视频,至少为2,500-3,500),请增加隔肽浓度并再次测量。
- 通过负染色透射电子显微镜对隔膜复合物进行直接成像
- 将样品在隔膜缓冲液中稀释至约50nM的浓度,并制备染色溶液(I-水中的2%甲酸铀酰或乙酸铀酰)。
注意:甲酸铀酰必须新鲜制备。 - 将 4 μL 稀释的隔膜移液到发光放电的电子显微镜网格上并孵育 30 秒。
- 使用滤纸去除大部分蛋白质溶液,并用隔肽缓冲液洗涤网格2x,用I-水洗涤网格1x以除去松散吸附的隔膜。
- 用2%乙酸铀酰或甲酸铀酰溶液在I-water中染色1分钟,用滤纸吸收染色溶液,然后风干网格几分钟。
- 使用正确对齐的透射电子显微镜筛选网格以搜索增强染色区域,并在这些选定区域内收集约100张图像。
- 以至少 50,000 倍的放大倍率收集图像,以获得约 2 Å/像素的像素尺寸,散焦范围为 −1 μm 至 −2 μm。使用 200 kV 的加速电压。优选地,使用自动化程序来收集数据,这将取决于可用的采集软件。
- 使用专用软件执行 2D 图像处理
- 使用专用软件将至少 2,000 个颗粒装箱46.
- 以迭代方式执行二维对齐和分类,直到获得类而无需进一步改进。第一个对齐和分类步骤应该是无参考的,以避免分类中的任何偏差。
- 使用从第一次无参考分类中获得的平均值作为新参考进行额外一轮分类。反复重复此过程,直到没有进一步的改进。确保每个类基于 50 到 100 个拾取的颗粒,并且各个亚基清晰可见。可以使用不同的软件工具(Spider,Eman或Relion)46,47,48。
- 将样品在隔膜缓冲液中稀释至约50nM的浓度,并制备染色溶液(I-水中的2%甲酸铀酰或乙酸铀酰)。
3. 通过聚合分析控制隔肽功能质量控制
注意:功能质量控制包括一组成像技术,可用于检测聚合的隔膜素复合物。下面,未标记的隔膜被称为"深色"隔膜,用于聚合未标记的隔膜的缓冲液被称为"深色"隔膜聚合缓冲液(SPB)。
- 通过荧光显微镜进行隔膜束成像
- 制备5x fluoSPB(表2)和由90%深色隔膜素和10%msfGFP-隔膜组成的隔膜混合物,浓度比隔膜缓冲液+ 1mM DTT中的所需终浓度高6倍。该测定的典型浓度为300 nM,因此,该混合物的浓度为1,800 nM。
- 通过按该特定顺序混合I-水(足以加满最终所需体积),20%5xfluoSPB(最终稀释度为1:5),0.05μM PCD和16.67%隔膜混合物(最终稀释度为1:6)来聚合隔膜素。对于 10 μL,混合 6.23 μL I-水、2 μL 5xfluoSPB、0.1 μL PCD(储备液为 5 μM)和 1.67 μL 隔肽混合物。将该混合物在室温下孵育至少30分钟。
- 将样品加入用fluoSPB洗涤的成像室(表2)并对隔膜束进行成像。如之前的研究10,32中所述,PLL-PEG钝化流道适用于本实验。
- 通过负染色透射电子显微镜想象隔膜束
- 制备5x darkSPB(表2)和由100%深色隔膜组成的隔膜混合物,浓度比隔膜缓冲液中所需的最终浓度高6倍+ 1mM DTT。该测定的典型浓度为300 nM,因此,该混合物的浓度为1,800 nM。
- 通过按该特定顺序混合I-水(足以补充到最终所需体积),20%5xdarkSPB和16.67%隔肽混合物来聚合隔肽复合物。对于 5 μL,混合 3.16 μL I-水、1 μL 5x 暗色 SPB 和 0.83 μL 隔肽混合物。将该混合物在室温下孵育至少30分钟。
- 将 3-5 μL 样品加入发光放电的电子显微镜网格中并孵育 1 分钟。然后,用 darkSPB(表 2)用滤纸吸收液体并加入一滴 darkSPB 缓冲液来洗涤网格 2x,用 I-水洗涤 1x,用 2% 乙酸铀酰孵育 ~30 秒,吸干污渍,风干样品几分钟。
- 在 120 kV 下对隔肽束进行成像,放大倍率在 5,000 倍和 60,000 倍之间,散焦在 1-2 μm 之间。
结果
如协议中所述,生长了5 L与两种表达隔肽的质粒共转化的大 肠杆菌 细胞,并通过添加IPTG诱导隔膜素的表达。3小时后,通过离心收集细胞,重悬于裂解缓冲液中,并通过超声裂解。然后通过离心澄清裂解物,并将澄清后的溶液施加到HisTrap色谱柱上(图2A)。第一次纯化后,将含隔肽的馏分合并并施加到StrepTrap色谱柱上(图2B)。这通常产生大约 3-5 mL 的 ~1 μM 隔膜复合物。在汇集含隔肽的馏分之前,变性凝胶电泳可用于检查隔肽亚基的完整性以及形成复合物的不同隔肽亚基之间的等摩尔化学计量比。(图3A)。如果凝胶显示对应于隔膜素亚基的分子量(表3)的类似强度条带,则可以继续该方案。如果没有,建议重新启动协议。在所示的含SEPT9_i1人隔肽八聚体的示例中, 图3A 清楚地显示了对应于强度相似的SEPT9_i1、SEPT6、SEPT7和SEPT2(按从上到下的顺序)的条带;归一化强度的 99% 置信区间为 SEPT2 的 1.128 ± 0.048,SEPT6 的置信区间为 1.092 ± 0.034,9 月份为 1.108 ± 0.040,9 月份为 1.067 ± 0.029。如果 SEPT2 被标记为 msfGFP,它将非常接近 SEPT9_i1 下方。根据所使用的电泳系统和 SEPT7 的 C 端 TEV-Strep 标签的存在(这使得它比未标记的 SEPT7 迁移得更慢),SEPT7 和 SEPT6 条带有时会由于分子量相当而合并。下一步是合并馏分并用DTT对隔膜缓冲液进行透析。透析后,如果浓度太低(<2μM)或实验需要更高的浓度,则可以包括浓缩步骤,如协议中所述。浓度低于1μM通常表明隔膜的功能质量差。最终隔膜复合物浓度在 3.5 μM 和 7 μM 之间适用于大多数 体外 测定。这些浓度通常在浓缩后的体积达到0.5-1mL时获得。
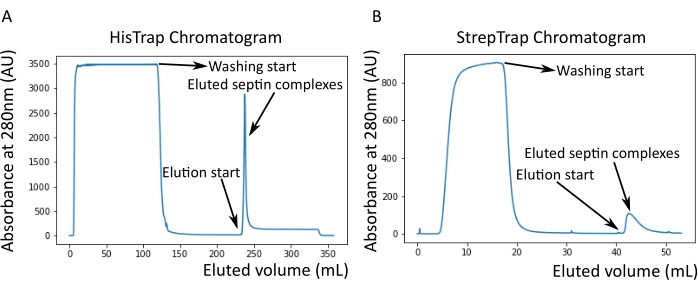
图2:对应于深色人隔肽纯化的示例色谱图octamers_9i1。 (A)HisTrap色谱柱色谱图。隔膜洗脱峰后,吸光度不会回到零,可能是由于缓冲液中存在咪唑。混合级分从洗脱峰开始到吸光度稳定在250 mL左右。(B)链球菌捕印柱色谱图。混合级分从洗脱峰开始,直到吸光度在50 mL时恢复到0左右。请点击此处查看此图的大图。
为了继续质量控制,如协议中所述,进行了天然电泳(图3B)。在凝胶中,可以观察到对应于完整杂低聚物的主条带,通常可以观察到对应于二聚体的次要条带。人类六聚体略高于242 kDa标记带,而八聚体高于480 kDa带,高于其计算的分子量。通过真核细胞提取物的蛋白质印迹分析检查这些条带的位置32。用msfGFP标记将每个SEPT2与msfGFP蛋白偶联。这导致隔肽复合物的分子量增加53.4 kDa(26.7 kDa/msGFP分子)。然而,在天然电泳凝胶上,msfGFP标记复合物的表观分子量与未标记复合物的表观分子量无法区分。
测试隔膜素复合物是否完整的补充技术是通过iSCAT显微镜进行质谱光度法。iSCAT监测落在载玻片上的分子的光散射,这些分子因对参考光的干扰而放大,通常是激光在载玻片底部的反射。然后,使用背景减法与粒子形成对比。由于这种校正,信号显示正值和负值,具体取决于粒子是落在玻璃上还是远离玻璃49。检测到的信号与蛋白质50的分子量成正比。因此,使用质量标准品进行信噪比校准可以确定样品蛋白质的质量数。 图3C 显示了含有SEPT9_i1的人隔肽八聚体的示例。大多数检测到的单个颗粒(~50%)的分子量为含有SEPT9_i1(423kDa)的完全八聚体的预期分子量(图3C)。还有一些颗粒的质量在150-300kDa之间,但没有观察到明确的峰,表明可能存在低丰度的其他隔膜素物种。同样,大多数检测到的mEGFP标记的 果蝇 六聚体的单颗粒具有完整六聚体的预期分子量(361 kDa)(图3D)。在241 kDa处的另一个清晰峰表明存在含有两种花生蛋白(一种DSep1和一种mEGFP-DSep2)的稳定四聚体。最后,人和苍蝇隔膜素复合物都显示出80 kDa左右的峰,可能是单体和二聚体的混合物,可能被痕量DTT或任何其他聚集的小分子扩增,在图45的正侧显示峰值。
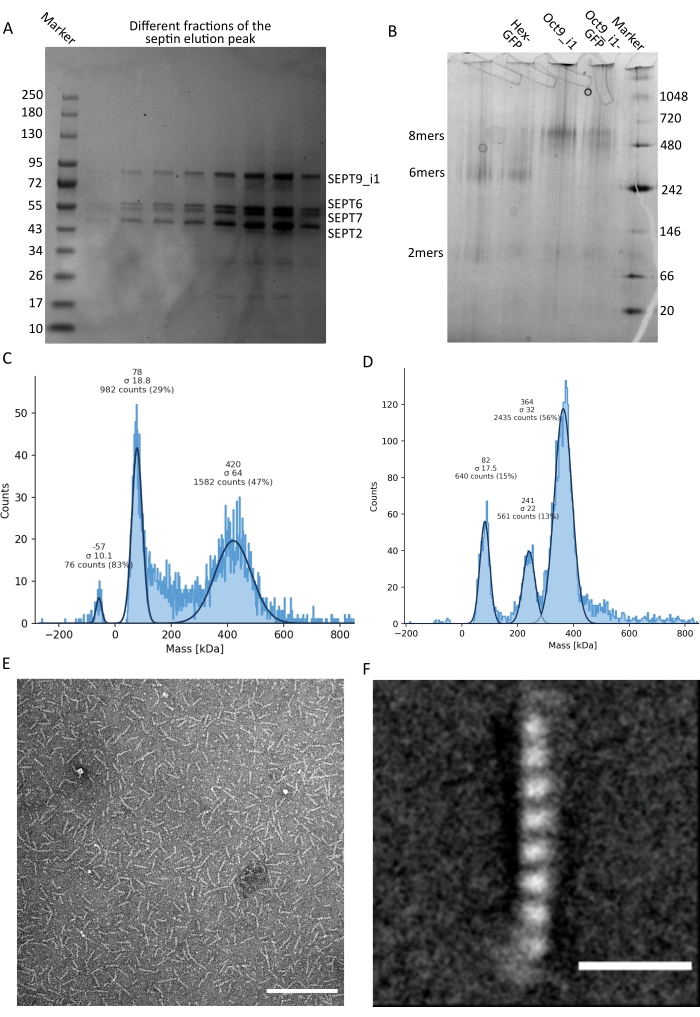
图3:低聚物质量控制结果示例 。 (A)变性凝胶的示例,显示来自深色人隔肽octamers_9i1纯化洗脱峰的不同部分。(B)不同隔膜素复合物的天然电泳示例。(中,四)在12.5nM隔膜复合物下进行质量光度测定的直方图结果的不同示例:(C)深色人隔肽octamers_9i1和(D)DSep1-msfGFP 果蝇 隔膜素六聚体。线条是高斯拟合。(E) 隔膜缓冲液中 25 nM 深色人隔肽octamers_9i1的 TEM 图像。比例尺 = 200 nm。(F)SEPT2-msfGFP人隔肽octamers_9i1类平均图像。msfGFP 标签在两端显示为模糊密度。比例尺 = 10 nm。面板(E)和(F)是生物学家公司的版权,并经许可改编自Iv等人10 。 请点击此处查看此图的大图。
鉴于非变性凝胶和iSCAT仅提供集合平均信息,因此使用单个隔肽低聚物的透射电子显微镜图像的类别平均,通过直接可视化检查复合物的完整性和纯度。在隔膜缓冲液中隔膜络合物的TEM图像中,可以观察到长度为24nm(六聚体)或32nm(八聚体)的棒。含有SEPT9_i1的人隔丁八聚体的示例如图 3E所示。当对它们进行类平均时,可以观察和计数每个亚基,如图 3F中所示,具有SEPT9_i1的msfGFP标记的人类八聚体。如果低聚物被荧光标记,则可以在棒的末端观察到对应于SEPT2-msfGFP的额外密度(图3F)。
上述技术的组合证明,具有正确化学计量比和高纯度的八聚体(或六聚体)可以使用所述方案纯化。最后,最后的质量控制检查是隔肽配合物在聚合能力方面的功能。在低盐浓度(<150mM KCl与所述缓冲液9)存在下,如果隔膜不存在其他蛋白质或带负电荷的脂质膜,则它们自组装成束9。通过将隔肽保存在具有高(300mM)KCl浓度的存储缓冲液中来防止其聚合。然后将隔肽异质低聚物在相同成分但没有KCl的缓冲液中以1:6的体积比稀释,以达到50mM的最终KCl浓度。为了进行荧光成像,该缓冲液辅以除氧系统以防止光漂白和闪烁抑制器。在TIRF显微镜中,可以在浅层TIRF场(~100nm;图 4A,B)。在共聚焦显微镜上,可以看到大簇状结构漂浮在溶液中(图4C)。最后,使用TEM,可以观察到对应于TIRF观察到的簇的小束隔膜素(图4D)和对应于共聚焦显微镜观察到的结构的大束(图4E)。图4D,E的插图显示,这两种类型的结构都由平行运行的细长细丝组成,形成末端锥形的束。荧光和TEM图像共同证明,纯化的隔肽复合物可以聚合成细丝,而细丝又自组装成束。
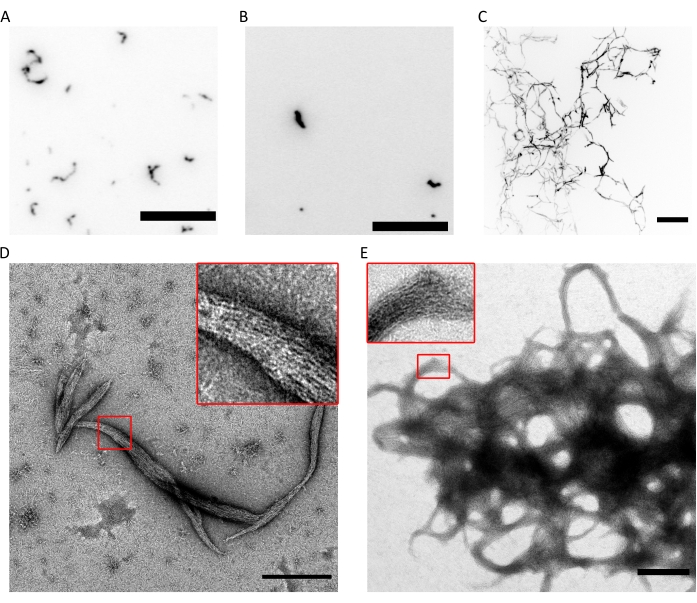
图4:聚合能力质量控制的结果示例。 (A)氟SPB中300nM人隔肽六聚体(10%msfGFP标记的六聚体)的TIRF图像。(B) 在fluoSPB中含有SEPT9_i1(10%msfGFP标记的octamers9_i1)的300 nM人隔肽八聚体的TIRF图像。(C) 在 fluoSPB 中 ~30 μm 上 Z 堆栈的共聚焦最大强度投影,间距为 0.5 μm 的 300 nM 人隔肽octamers_9i3。(A-C)比例尺 = 10 μm 和倒置灰度。(D,E)在暗SPB中(D)小束和(E)大束人隔肽octamers_9i1的示例TEM图像。插图显示了可以观察到在束内平行运行的透明细丝的区域。比例尺 = 500 nm。小组(C-E)是生物学家公司的版权,并经许可改编自Iv等人10。请点击此处查看此图的大图。
表1:质粒列表。 质粒按照该方案纯化隔肽低聚物。所有质粒均已沉积在Addgene(第一列)中。 请按此下载此表格。
表 2:缓冲区列表。 用于隔肽低聚物的纯化和质量控制的缓冲液组合物。 请按此下载此表格。
表3:分子量和消光系数。 假设隔肽亚基、不同的隔肽复合物和独特的隔肽亚基(仅MW)的线性融合,根据复合物的序列,使用ProtParam计算波长为280nm的分子量(MW)和光消光系数(ε)列表,可以用 表1中列出的质粒纯化。 请按此下载此表格。
讨论
此处描述的方法允许对预先形成的隔肽异质低聚物进行稳健的纯化和质量控制。正确应用该方法需要考虑的一些关键问题如下。在色谱分离的洗脱步骤中,重要的是使用推荐(或更低)的流速来最小化隔膜络合物的稀释。此外,为了在最终浓缩步骤中最大限度地提高蛋白质的回收率,浓缩柱的方向使溶液不会被推到过滤器上(当一侧只有一个过滤器时)。如果溶液直接进入过滤器,蛋白质会粘附得更多,从而大大降低最终产量。同样重要的是要考虑到浓缩步骤并不总是必要的。仅从色谱图中峰周围的狭窄范围内挑选馏分,通常可为许多复溶应用(通常在10-300 nM之间操作)提供足够高的原液浓度(>3,000 nM)。最后,为了通过荧光显微镜对隔膜络合物的功能进行质量控制,正确钝化显微镜载玻片的表面非常重要,因为隔膜络合物会贪婪地粘附在玻璃上。载玻片的钝化可以通过PLL-PEG功能化或通过形成中性(100%DOPC)支持的脂质双层11,32来完成。
与Iv等人10中首次描述的原始纯化方案相比,缓冲液组合物发生了变化(表2)。MgCl 2的浓度从5 mM降低到2 mM,Tris-HCl的浓度和pH值分别从50 mM降低到20 mM和从8.0降低到7.4。进行这些更改是为了使缓冲条件与人隔膜与脂质双层,肌动蛋白丝和微管的相互作用的研究兼容10,11,32。这是因为作者在F缓冲液中形成了支持的脂质双层和聚合的肌动蛋白,除了F缓冲液中存在ATP之外,其组成与暗SPB相同。与原始缓冲液相比,缓冲液的变化不会对纯化的隔膜的质量或寿命产生任何变化。
这种纯化方法仍然有几个局限性。首先,不同的纯化尝试在产量(0.5-1 mL 的 2-5 μM 隔膜复合物)和功能质量方面可能有所不同,这可以通过纯化的隔肽复合物的束形成能力来检查。这就是为什么始终如一地执行本文中描述的质量检查非常重要的原因。很好地控制细菌培养物的表达时间和光密度有助于减轻产量的差异。其次,该纯化管道无法区分三聚体和六聚体或四聚体和八聚体(图1B)。然而,质量控制实验可用于证明大多数隔膜素复合物处于长低聚物形式。如果需要更窄的低聚物尺寸分布,可以在步骤1.6之间插入体积排阻色谱。和步骤 1.7。的纯化方案。但是,此可选步骤会大大降低产量,除非严格需要,否则不建议使用。最后一个更根本的限制来自使用大肠杆菌作为重组隔膜复合物的表达系统。当然,该系统不允许在动物细胞中报道的翻译后修饰(PTM),例如磷酸化,乙酰化和苏莫酰化6,51,52,53。这些翻译后修饰可以通过在昆虫或人类细胞中实施类似的纯化策略来添加。此外,本文仅讨论了隔肽本身的重建,但细胞研究表明,调节蛋白,如来自Borg家族54,55和烯素24,25,56的蛋白质可能对隔肽的组装和功能产生实质性但知之甚少的影响,因此,最终在体外纳入很重要。 研究。据报道,纯化Borg蛋白和苯甲醛的方案为54,57。
这里报道的隔肽纯化方案提供了一种标准化的方法,以正确的亚基化学计量法纯化低聚物形式的隔膜素,与许多依赖单个隔膜亚基的早期体外研究相比,提供了重要的进展。尽管在特定情况下,一些隔膜素可以作为单个亚基2,但目前的文献强烈表明,在动物细胞中,隔膜素主要在复合物中起作用9,58。因此,使用预先形成的异质低聚物,例如本文中描述的杂低聚物和其他10,11,18,32,35,36,37,对于通过体外研究隔肽的结构和生物物理性质具有重要意义。 重建以剖析它们在细胞中的功能。此外,隔肽是具有许多相互作用伙伴的自组装蛋白质,包括膜和细胞骨架,这使得它们对自下而上的合成生物学59,60,61和蛋白质诱导的膜生物物理性质变化的研究(如曲率42,62,63)非常感兴趣。
披露声明
作者声明没有竞争或经济利益。
致谢
我们感谢塞西莉亚·德·阿格雷拉·平托、托马斯·德·加雷和卡塔琳娜·霍瑟曼在质量光度法 (iSCAT) 实验方面的帮助;Arjen Jakobi和Wiel Evers对TEM的帮助;露西亚·巴尔道夫(Lucia Baldauf)对TIRF的协助;Pascal Verdier-Pinard关于天然电泳的建议;Agata Szuba和Marjolein Vinkenoog帮助建立了果蝇隔膜素纯化工作,以及法国国家研究基础设施法国生物成像(ANR10-INBS-04)成员居里研究所的细胞和组织成像(PICT-IBiSA)。这项研究得到了荷兰科学研究组织(NWO / OCW)的资助,通过"BaSyC-构建合成细胞"引力赠款(024.003.019)和国家研究机构(ANR赠款ANR-17-CE13-0014:"SEPTIMORF";ANR-13-JSV8-0002-01: "SEPTIME";和ANR-20-CE11-0014-01:"SEPTSCORT")。
材料
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
参考文献
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。