Method Article
评估肺炎消退的实验模型
Erratum Notice
摘要
该手稿描述了小鼠肺炎感染模型的建立和损伤消退的相应表征,以及培养细菌和气管内滴注的方法。还描述了一种使用高维流式细胞术来评估免疫景观的新方法。
摘要
急性呼吸窘迫综合征 (ARDS) 可引起急性肺损伤,其特征是肺泡快速损伤和严重低氧血症。这反过来又导致高发病率和死亡率。目前,还没有临床前模型可以概括人类急性呼吸窘迫综合征的复杂性。然而,肺炎感染模型(PNA)可以复制ARDS的主要病理生理特征。在这里,我们描述了由C57BL6小鼠气管内滴注活的 肺炎链球菌 和 肺炎克雷伯菌 诱导的PNA模型。为了评估和表征该模型,在诱导损伤后,我们进行了体重和支气管肺泡灌洗 (BAL) 的连续测量,以测量肺损伤的标志物。此外,我们还收获肺进行细胞计数和分类、BAL 蛋白定量、细胞旋转、细菌菌落形成单位计数和组织学。最后,进行高维流式细胞术。我们建议将该模型作为一种工具,用于了解肺损伤早期和晚期消退阶段的免疫景观。
引言
急性呼吸窘迫综合征 (ARDS) 仍然是一种常见的致死性和致残性综合征,影响约 10% 的重症监护病房 (ICU) 患者和高达 23% 的机械通气患者,导致医院死亡率为 35%-46%1。此外,最近的 COVID-19 大流行再次强调了研究 ARDS 的重要性。COVID-19 阳性病例导致 ARDS 死亡率增加,凸显了药物治疗的局限性2.
在人类中,急性呼吸窘迫综合征的特征是低氧血症 (PaO2/FiO2 < 300) 迅速发作,并且由于肺泡-毛细血管通透性过高和肺泡炎3 导致的非静水性双侧肺水肿证据。尽管 ARDS 传统上被描述为继发于各种侮辱的急性肺损伤 (ALI) 模式,但细菌性和病毒性肺炎 (PNA) 仍然是最常见的病因之一。已经描述了三个主要的病理生理阶段,即渗出期、增殖期和纤维化阶段,而 ARDS 的两个主要主要特征是炎症失调和肺泡毛细血管破坏4。在这些过程中,炎性细胞因子(例如肿瘤坏死因子 [TNF-α]、白细胞介素 [IL-1β、IL-6、IL-8 等])、中性粒细胞和炎性巨噬细胞的流入以及富含蛋白质的液体泛滥而产生肺泡损伤。最终,这些事件导致斑片状和双侧肺泡损伤 5,6,7,8。
尽管在理解早期肺损伤和炎症方面取得了重大进展,但 PNA 消退的机制鲜为人知,应成为未来机制研究的重点。本方法论文的主要目的是为研究人员提供一种可以复制 ARDS 主要病理生理特征的传染性肺炎损伤解决模型。我们提出,该模型将有助于更好地理解肺部炎症消退和修复的生物学机制,从而作为抢救疗法的平台。
ARDS 期间发生的主要生理病理学阶段可以在 ALI 的临床前动物模型中复制,其中应包括炎症反应、组织损伤、生理功能障碍、肺泡炎和肺泡-毛细血管屏障改变的组织学证据9。诱导PNA和ALI的小鼠模型具有优势,因为它具有高可重复性、快速繁殖以及多种工具进行机制和分子研究的可用性。没有一个单一的模型可以完全概括人类 ARDS9 的所有特征。
小鼠 PNA 模型允许复制感染性 ARDS 在人类中产生的关键病理生理机制,例如快速发病、组织学中组织损伤的证据、肺泡-毛细血管屏障损伤、炎症反应的证据和生理功能障碍,同时产生适度的死亡率10 。感染模型可由病原体的局部或全身递送诱导,鼻内、气管内和静脉给药是最常见的给药途径。气管内途径允许将感染因子直接接种到肺部,从而减少气溶胶并优化输送11,12。
本文将介绍通过气管内滴注活 肺炎链球菌 (Spn) 或 肺炎克雷伯菌 (Kp) 建立 PNA 临床前小鼠模型的方法。这些模型代表了细菌性 PNA 产生的 ARDS 的良好替代物,具有几个优点,包括:人类 PNA-ARDS 的普遍原因(社区和医院获得性);高再现性;死亡率和损伤可以很容易地滴定(模拟不同程度的肺部炎症)以表现出强烈的炎症反应,导致肺泡炎和肺泡毛细血管功能障碍;肺损伤早期和晚期的评估和消退;以及 PNA-ARDS 不同阶段的治疗策略评估。
研究方案
本研究中描述的所有动物方案均由约翰霍普金斯大学医学院机构动物护理和使用委员会 (ACUC) 批准,用于动物方案MO21M160。此外,实验是按照机构、州和联邦的动物研究规定进行的。
注意:下述所有协议的复制需要在生物安全 2 级 (BSL-2) 机柜中进行,并遵循生物安全机柜下的所有机构 BSL-2 指南。
1. 从商业循环中电镀细菌储备液
注:该协议可用于培养 Spn (ATCC 49619)和 Kpn (ATCC 43816)的细菌储备液,从从提供者处获得的培养环开始(有关详细信息,请参见 材料表 )。
- 在培养箱中将5%羊血琼脂平板在37°C下加热15分钟。细胞培养箱可用于此目的。
- 在引擎盖下,从细菌接种环中取出鞘,并小心地展开,按照锯齿形图案划线进入琼脂平板。使用单独的板作为副本重复此步骤。最多可以有五块板使用相同的环进行划线。
- 将板在37°C下孵育过夜,以获得最佳细菌生长。每天传代细菌 3 天。将血琼脂平板在37°C下加热15分钟,使用一次性接种环从第一个琼脂平板中取出15至20个菌落,并将它们铺入新的预热琼脂平板中。适当地标记板。
2. 细菌生长和储存以备将来使用
- 3 天后,从带有条纹环的血琼脂平板中取出多达 30 个菌落,并将其直接放入含有 Todd Hewitt 肉汤(TH 肉汤)的 250 mL 烧瓶中。在37°C下孵育,以250rpm振荡,用5%CO2 孵育约4小时。
- 每 15 分钟取等分试样以测量 OD620nm ,直至达到 0.3,这相当于每 mL 约 3 x 108 个菌落形成单位 (CFU)。
- 立即将 1 mL 新细菌储备液分装到 2 mL 低温瓶中。将新鲜等分的小瓶在液氮中快速冷冻5分钟。将细菌的等分试样储存在-80°C冰箱中(小瓶在失去效力之前可以使用长达6-8个月)。
- 冷冻 7 天后,等分试样可用于动物研究。因此,确定细菌的新浓度。
3. 细菌解冻以进行气管内滴注
- 在振荡器中将血琼脂平板在37°C下加热10分钟。从冰箱中取出一个新的储备瓶,在37°C水浴中轻轻搅拌解冻约2分钟。避免用温水接触 O 形圈或盖子。
- 将板放在血琼脂平板上以手动计数细菌菌落。进行 1 x 10-6 稀释,并将最后一次稀释的 200 μL 放在预热的血琼脂平板中。一式两份地执行此操作。
- 将板在37°C下孵育过夜,以优化细菌的生长。第二天,应用以下公式确定新的细菌浓度:CFU/mL =(菌落数 x 稀释因子)/铺板原液体积
4.气管内滴注活菌
注意:该方案已经过优化,可气管内滴注 50 μL 的体积。细菌储备液可以储存长达 6-9 个月。为确保每个小瓶中的细菌 CFU,请确保在每次实验前将其铺板,如上所述计算细菌储备液 CFU,并使用 TH 肉汤进行后续稀释。
注意:在生物安全柜下,使用无菌手术器械执行啮齿动物生存程序。
- 通过腹膜内注射100mg / kg氯胺酮和2.5mg / kg乙酰氯酮嗪麻醉小鼠。对一次注射的小鼠数量重复上述步骤。
注意:小鼠可以暴露于异氟醚以促进动物处理。然而,能够注射腹膜内麻醉剂而不会引起动物严重困扰的有经验的处理者可以避免异氟烷暴露。注射的小鼠数量取决于外科医生的专业知识。 - 在所有小鼠都处于适当的麻醉下后,通过捏尾部确认麻醉。将麻醉的小鼠放在干净且消毒的表面上,用门牙悬挂动物,并轻轻地用胶带粘住前肢(图1A)。
注意:为确保动物健康,请为所有麻醉动物提供角膜润滑。可以使用羧甲基纤维素滴眼液,每只眼睛滴一滴。 - 剃除颈部区域,并用氯己定和 70% 酒精消毒该区域。使用手术剪刀,做一个1厘米浅的颈部中线切口,以观察气管(图1B)。一个小切口就足够了,但如果看到大量的脂肪组织,请小心地垂直解剖脂肪组织以观察气管。
注意: 通过仅吸头技术使用无菌手套和无菌器械。如果该程序在无菌条件下进行,则感染风险很小。 - 使用镊子,给每只小鼠插管。轻轻地将舌头向外拉,将 20 G 血管导管插入口腔,将导管推进气管。在气管上轻轻按压,以利于插管。
注意:由于气管位于小鼠身体的前方,因此请稍微弯曲导管的尖端,因为这将有助于获得成功插管小鼠的角度。颈部切口主要用于可视化目的;或者,操作者可以盲目插管气管。 - 插管后,将鼠标连接到呼吸器以确认插管。此程序中使用的常规呼吸机参数是 200 μL 每搏输出量和每分钟 200 次呼吸。短暂地调高和/或调低呼吸机频率,以便快速轻松地确认。
- 确认插管后,断开小鼠与呼吸器的连接,并使用 200 μL 移液管凝胶加载吸头通过血管导管小心滴注 50 μL 细菌制剂。对于对照小鼠,注射50μL无菌TH肉汤。
- 滴入细菌制剂后,再次将鼠标连接到呼吸器以帮助重新开始呼吸。将鼠标放在呼吸器上 30-60 秒。注射所有小鼠后,监测它们的呼吸。如果呼吸模式缓慢,请再次将小鼠连接到呼吸器。
- 通过在皮肤上滴一小滴胶水来闭合切口。将皮肤褶皱合拢,轻轻按压,直到胶水变干。
- 将小鼠放在加热垫上进行恢复,并密切监视它们,直到它们恢复足够的意识。一旦完全恢复,将小鼠转移回笼中。对于术后疼痛/痛苦管理,小鼠可以用丁丙诺啡治疗,剂量为0.05-0.1mg/kg皮下注射(SC)。
注意:体重减轻超过 20% 或在手术后出现严重痛苦的动物,例如嗜睡、无法获得水或食物、呼吸困难、对外部刺激的反应受损或精神警觉性降低,应实施安乐死。
5.支气管肺泡灌洗和肺采收
- 通过将小鼠置于含有5%异氟醚的密闭容器中对小鼠实施安乐死。小鼠停止呼吸后继续异氟烷暴露1分钟。进行开胸手术以确认安乐死。
注意:通过目视和身体检查确认安乐死。心脏一定停止了跳动,老鼠没有呼吸。粘膜应为白色或苍白。 - 将小鼠仰卧在干净的手术板上,并将其挂在门牙上。用70%乙醇喷洒小鼠皮肤。使用手术剪刀,在颈部浅表切口做一个小的浅切口,以观察小鼠的气管。
- 用 20 G 导管插管气管。小心地使用 1 mL 注射器在气管内添加 1 mL 无钙磷酸盐缓冲盐水 (PBS)。允许肺完全扩张,然后使用同一注射器吸出液体。重复此步骤,总共 2 mL。
- 将 BAL 转移到 2 mL 等分试样中。执行此步骤两次,最终体积为 2 mL。不要一次用超过 1 mL 的液体灌洗肺部,因为肺泡间隙破裂的风险很高。
- 用剪刀和镊子打开胸腔,露出肺、心脏和气管。小心地解剖横膈膜并取下肋骨架。确保不要挤压肺组织。
- 横断腹主动脉以允许放血。使用剪刀在右心室做一个约 2 mm 的小切口灌注肺组织,并使用 20 G 导管注射 5 mL 冷 PBS。PBS 应灌注肺部。如果进行充分的灌注,肺组织会变成白色苍白,PBS会通过腹主动脉离开血管内室。
- 小心地取出肺部并将其从气管中解剖,以进行组织学检查或进一步处理到单细胞悬浮液。
- 如果进行组织学处理,请小心地插入 20 G 导管,用福尔马林溶液(中性缓冲 10%)将肺充气至 25 cm H2O。一旦肺部被吹气,将一根长约 5 厘米的 3.0 缝合线穿过气管下方,并将其牢固地系住两次,以确保福尔马林留在肺组织中。轻轻地从其余组织中解剖出肺,并将其放入含有 10 mL 福尔马林溶液的 15 mL 锥形管中。
6.支气管肺泡灌洗处理
- 将BAL在4°C下以500× g 离心5分钟。在单独的管中取出无细胞上清液并储存在-80°C。
注:可以在 BAL 上清液中进行进一步分析,包括蛋白质定量(例如,BCA 测定13)或特定生物标志物或细胞因子的测量(ELISA 测定和使用 MSD 和 Luminex 等平台的多种测定)。 - 通过加入 100 μL 裂解缓冲液 1 分钟裂解红细胞。通过加入 1 mL PBS 中和裂解反应。将BAL在4°C下以500× g 离心5分钟,并除去上清液。
- 将细胞重悬于PBS(100-300μL;基于细胞沉淀大小)中。通过手动或自动细胞计数用0.4%台盼蓝染色剂进行细胞计数。使用剩余的沉淀进行流式细胞术染色和/或液氮冷冻保存(通过重悬于冷冻保存溶液中)进行进一步测试。
7. 单细胞悬液的肺处理
- 轻轻地将肺从其余组织中解剖出来,并将其放入含有 5 mL 冷 PBS 的 15 mL 锥形管中。从PBS中取出肺,并用纸巾擦干。
- 通过将 1 mg DNase 和 5 mg 胶原酶加入 1 mL 低葡萄糖 Dulbecco 改良的 Eagle 培养基 (DMEM) 中来制备消化混合物。将肺转移到含有 1 mL 消化混合物的 C 管中。
- 将 C 管转移到组织解离器,并按照标准化方案处理肺组织14。
- 将 10 mL 冷 PBS 加入 C 管中并适当混合。使用 50 mL 锥形管顶部的 70 μm 细胞过滤器过滤单细胞悬浮液。执行两次过滤。
- 将悬浮液在4°C下以500× g 离心5分钟。小心地倒出上清液,并在室温下加入 1 mL 裂解缓冲液 1 分钟。加入 10 mL 冷 PBS 以停止裂解反应并除去上清液。
- 将悬浮液在4°C下以500× g 离心5分钟。小心地倒出上清液并加入 10 mL 冷 PBS。
- 使用台盼蓝染色剂通过手动或自动细胞计数进行细胞计数。使用细胞沉淀进行流式细胞术染色和/或在液氮中冷冻保存以进行进一步测试。
结果
上述程序允许对细菌性肺炎诱导的小鼠肺损伤的病理生理机制进行建模。为了开始建模,C57BL / 6野生型(WT)小鼠是从杰克逊实验室获得的,并在该研究所的动物设施中繁殖。雄性 WT C57BL/6 小鼠,8 周龄,气管内接种 TH 肉汤(对照)、3 x 106 CFU 活 Spn 或 200 CFU 活 Kpn。感染后,分别监测小鼠 Spn 和 Kpn 6 天和 10 天。尽管与未感染的对照组相比,感染组的体重较低,但 Spn 组的体重恢复到基线水平,而 Kpn感染的小鼠在感染6天后恢复缓慢(图2A)。在研究期间,由于体重超过20%,没有小鼠需要接受安乐死,也没有证据表明疼痛和痛苦。
我们测量了不同时间间隔的肺损伤。感染组的BAL蛋白浓度以及BAL和肺部的总细胞计数均明显更高(图2)。在接种后第2天,第4天和第6天(图3)获得了显示两种模型中炎症过程的代表性组织学切片,显示了Kpn感染小鼠(图4)中持续肺泡炎症的证据,即使在第10天也是如此。Kpn感染的小鼠在第10天继续损伤(图2和图4),而Spn感染的小鼠在第6天解决了肺部炎症(图2和图3)。
在 Spn 模型中,在感染后第 6 天使用肺单细胞悬液通过高维流式细胞术区分免疫景观,在荧光激活细胞分选 (FACS) 中使用 18 色面板。使用 t 分布随机邻居嵌入 (t-SNE),可以观察到免疫细胞组成的总体差异,对于粒细胞(CD45+、CD11b+、CD24+、MHC-II-)、间质巨噬细胞(CD45+、CD11b+、MHC-II-、CD24-)、单核细胞(CD45+、CD11b+、MHC-II-、CD24-、CD64-)、B 细胞(CD45+、CD19+)和 T 细胞(CD45+、CD3+),包括自然杀伤细胞(CD45+、CD3+、NK1.1+)、 如图 5 所示。门控策略如图 6 所示。
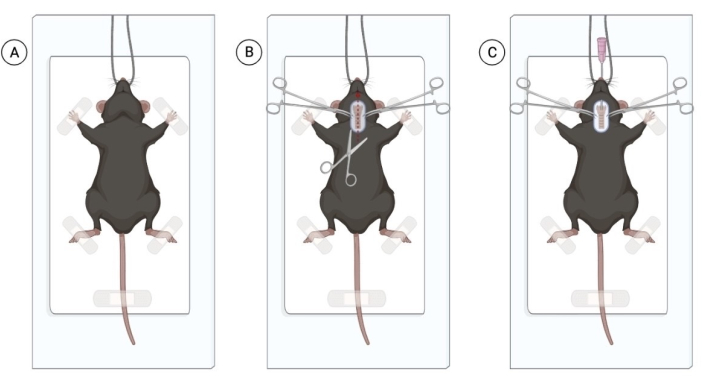
图 1:气管内滴注活细菌的外科手术。 (A) 小鼠在无菌手术区域的位置,悬挂在门牙上。(B) 切口面积和气管暴露。(C) 插入 20 G 导管的插管过程。用 Biorender.com 创建的图形。 请点击这里查看此图的较大版本.
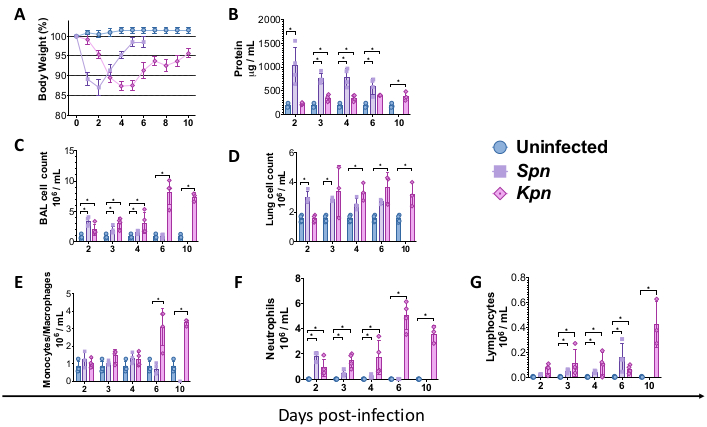
图 2:肺炎模型后的急性肺损伤 (ALI) 概况。 (A) 体重随时间的变化相对于基线,对照组与 Kpn 和 Spn (n = 4,每组)。 (B) 通过 BCA 测定法定量 BAL 总蛋白(n = 4,每组)。(C) 对照组 (n = 3)、Kpn (n = 4) 和 Spn (n = 3) 中的 BAL 总细胞计数。(D) 对照组 (n = 3)、Kpn (n = 4) 和 Spn (n = 3) 的肺总细胞计数。(E-G)通过对照组 BAL 细胞离心 (n = 3)、Kpn (n = 4) 和 Spn (n = 3) 的手动组织学计数进行 BAL 细胞鉴别。通过个体 t 检验进行统计检验,比较未感染的对照组与感染组。*P < 0.05。数据使用标准误差 (SE) 显示每个图。y 轴是所有面板感染后的天数。缩写:BAL=支气管肺泡灌洗;Spn = 肺炎链球菌;Kpn = 肺炎克雷伯菌。 请点击这里查看此图的较大版本.
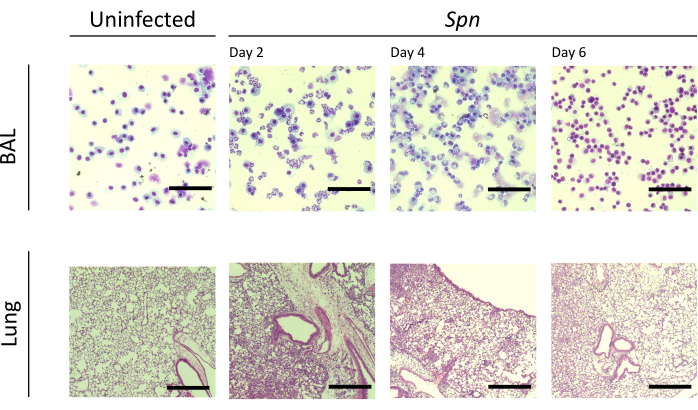
图 3:Spn 感染期间的肺部组织病理学发现。 Spn 气管内感染后以及第 2、4 和 6 天对代表性 BAL 和肺切片的组织学切片进行苏木精和伊红 (H&E) 染色。BAL 放大倍率 = 100x;肺放大倍数 = 10x。缩写:BAL=支气管肺泡灌洗;Spn = 肺炎链球菌。请点击这里查看此图的较大版本.
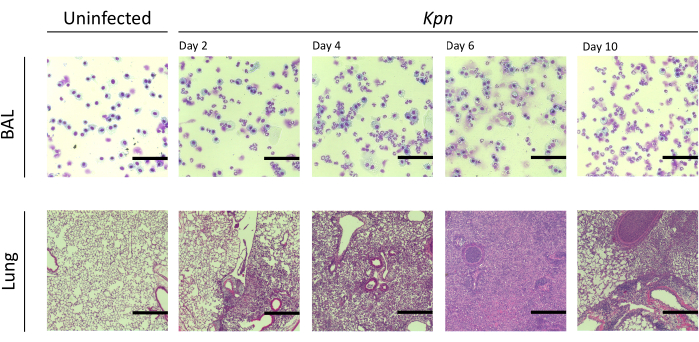
图 4:Kpn 感染期间的肺部组织病理学发现。 第 2、4、6 和 10 天 Kpn 气管内感染后代表性 BAL 和肺切片的组织学切片的苏木精和伊红 (H&E) 染色。图像显示高功率放大倍率(比例尺 = 50 μm)。缩写:BAL=支气管肺泡灌洗;Kpn = 肺炎克雷伯菌。请点击这里查看此图的较大版本.
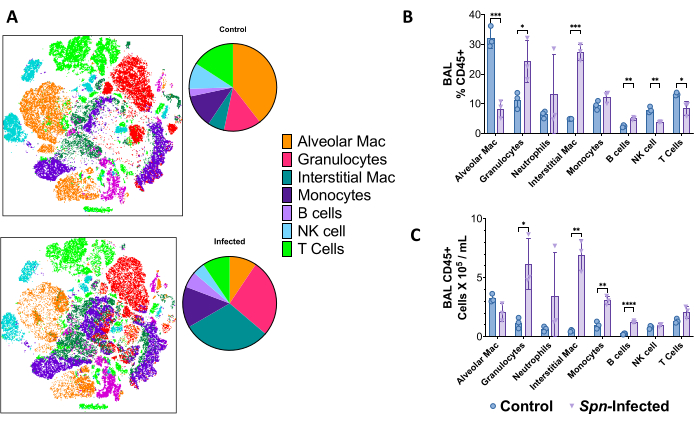
图 5:Spn 感染 6 天后通过多色流式细胞术得出的免疫细胞景观。 (A) 使用 T 分布随机邻居嵌入 (t-SNE) 来可视化未感染对照组与感染组的肺部免疫细胞群 (CD45+)。(B) 肺中总 CD45+ 细胞中免疫细胞频率的摘要。(C) 每个个体群体的总细胞计数。通过对照组和感染组之间的 t 检验进行统计比较。*P < 0.05, **P < 0.01, ***P < 0,001。数据使用标准误差 (SE) 显示每个图。缩写:BAL=支气管肺泡灌洗;Spn = 肺炎链球菌。 请点击这里查看此图的较大版本.

图 6:用于在基线和肺炎后识别肺部免疫细胞亚群的门控策略。 对 BAL 和肺细胞悬液进行多色流式细胞术染色。首先使用SSC-A和FSC-A对碎片进行门控,然后通过两种策略(SSC-W与SSC-H和FSC-W与FSC-H)对单细胞进行门控。通过使用活/死鉴别器与 SSC-A 来鉴定活细胞。随后的细胞群通过先前鉴定的标记物 15 进行鉴定。缩写:BAL=支气管肺泡灌洗。 请点击这里查看此图的较大版本.
讨论
PNA的实验小鼠模型提供了一个平台来评估ARDS损伤和消退的细胞和分子机制。可以评估的病理生理成分包括早期炎症通路、细菌清除、动态免疫景观变化、炎症消退、纤维增殖以及上皮和血管修复16。然而,在计划复制这种肺炎诱导的肺损伤模型时,必须考虑几个方面,包括年龄、性别、小鼠品系、内在宿主因素(例如免疫功能低下状态)、使用的特定病原体和细菌载量,以及执行手术的工作人员的经验。
PNA是导致急性呼吸窘迫综合征的主要原因之一。我们选择使用活 Spn 和 Kpn,它们分别是社区和医院获得性 PNA 在人类中的普遍原因17。我们建议通过滴定活细菌的剂量来优化 PNA 的细菌模型,以实现最符合研究者假设的预期死亡率和损伤解决率。我们优化了小鼠 Spn 的 3 x 106 CFU 和 Kpn 的 200 CFU 气管内细菌接种,这会导致肺泡炎症、肺泡毛细血管屏障破坏和器官功能障碍(图 2)。然而,即使使用相同的菌株和 CFU,来自不同来源的细菌批次,甚至在重复环内的细菌批次也会表现出不同程度的炎症和损伤。
因此,为了复制本手稿中提供的结果,研究人员应该从这里描述的细菌浓度开始;然而,他们可能需要增加或减少剂量以获得相似的模型图谱。因此,每一批新使用的细菌都需要优化,以适应其潜在的损伤解决效果。我们提出了一个稳健的 PNA 模型,该模型具有两种不同的分辨率结果,一种是自我消退 (Spn),另一种是慢速/非分辨率 (Kpn),可以作为研究人员评估免疫机制和测试治疗干预措施的平台,特别是在感染高峰期或之后(例如,感染后 2 天)。
年龄、性别、菌株和遗传因素会影响损伤消退模式的动力学16.例如,与男性相比,性别使女性的分辨率更快18;因此,与女性相比,细菌载量的增加会导致男性的死亡率增加和消退延迟。老化是滴定所用细菌的 CFU 时要考虑的另一个因素。当我们使用指定的Spn剂量时,衰老小鼠表现出100%的死亡率(此处未显示)。年轻小鼠最常用于肺炎球菌PNA模型(范围为6至14周),而老年小鼠(19-26个月大)表现出改变的免疫反应,并用于研究衰老在PNA11中的作用。我们必须将 CFU 降低到 300%,才能在衰老动物中实现存活(此处未显示)。本研究使用雄性 C57BL/6 小鼠(8-12 周龄),并在感染后 6 至 10 天内进行随访。菌株之间在易感性方面也存在显着差异;BALB/C 和 C57BL6/J 等近交系对感染的反应不同11,19。
气管内直接接种细菌可以更精确地将接种物(高达 99%)输送到肺部12,代表了毒性较低的血清型的替代方案,并减少了细菌的气溶胶化11。但是,可以说这是一种侵入性手术。插管可能具有挑战性,需要全身麻醉,并可能导致气管创伤,随后出现气道水肿和喘鸣。小鼠可能会产生血管迷走神经反射,导致呼吸暂停,为此需要有一个小型小鼠呼吸机,以便在需要时提供额外的呼吸机支持。执行手术的外科医生的专业知识是保证插管成功的关键因素11.在我们的研究中,由于适当的疼痛管理,不需要对小鼠实施安乐死,而且体重减轻不超过20%。未见疼痛和痛苦的迹象,如嗜睡、无法获得水或食物、呼吸困难或精神警觉性下降。将细菌直接输送到肺部的替代方法是口咽抽吸,尽管肺损伤的消退似乎发生得更快,并且一些细菌可以在胃和胃肠道中结束20。
PNA的临床前模型使研究人员能够评估免疫状况。支气管肺泡和间质室室可以评估免疫细胞的动态变化16。此外,可以在 体外 培养和刺激细胞,以确定它们特异性产生的细胞因子和趋化因子。在这里,我们专注于通过使用多色流式细胞术来探索肺和 BAL 中的免疫细胞景观。还可以进行单细胞RNA测序,以了解损伤消退不同阶段的细胞特异性转录组特征。
PNA-ARDS 模型产生全身效应,可以通过在疾病过程中测量体重来早期检测到10。虽然我们不直接测量急性呼吸窘迫综合征的全身效应,但器官功能障碍也可以通过血液化学检查来评估,以及采集不同的组织(如脾脏、肾脏和肝脏)进行组织学检查。肺炎球菌 PNA-ARDS 的全身效应先前已被使用相同细菌菌株的其他小组描述21.
在这里,描述了一个实验性PNA模型,该模型类似于人类ARDS的一些关键病理生理学发现。虽然没有理想的模型可以完全概括人类ARDS9的复杂性和异质性,但这些模型对于研究肺损伤和修复的机制具有相关性和可重复性,也可以作为识别新的潜在药理学靶点的平台,这些靶点侧重于加速肺部炎症的消退和促进肺修复。
披露声明
作者没有什么可透露的。
致谢
这项研究得到了 NIH 拨款 R01 HL131812 和 R01HL163881 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
参考文献
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。