需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
多流灌注生物反应器集成了出口分馏功能,用于动态细胞培养
摘要
本文提出了一种构建和操作低成本、多通道灌注细胞培养系统的方法,用于测量细胞过程中溶质分泌和吸收速率的动态。该系统还可以使细胞暴露于动态刺激曲线中。
摘要
某些细胞和组织功能在几分钟到几小时的动态时间尺度内运行,而传统培养系统无法很好地解决这些功能。这项工作开发了一种低成本的灌注生物反应器系统,该系统允许将培养基连续灌注到细胞培养模块中,并在下游模块中分馏以测量这种规模的动态。该系统几乎完全由市售部件构成,可以并行化以同时在常规多孔细胞培养板中进行独立实验。本视频文章演示了如何组装基础设置,该设置只需要一个多通道注射器泵和一个改进的馏分收集器即可并行灌注多达六种培养物。还提出了模块化设计的有用变体,允许受控的刺激动力学,例如溶质脉冲或药代动力学样曲线。重要的是,当溶质信号通过系统时,它们会因溶质色散而失真。此外,还描述了一种使用MATLAB用示踪剂测量灌注装置组件的停留时间分布(RTD)的方法。RTD可用于计算多室系统中的流动如何使溶质信号失真。该系统非常坚固且可重复,因此基础研究人员可以轻松采用它,而无需专门的制造设施。
引言
许多重要的生物过程发生在细胞和组织培养物中,时间尺度为几分钟到几小时1,2,3。虽然可以使用延时显微镜4,生物发光1或其他方法以自动方式观察和记录其中一些现象,但涉及收集用于化学分析的培养物上清液样品的实验通常在静态细胞培养物中手动进行。由于频繁或下班后采样时间点的不便,手动采样限制了某些研究的可行性。静态培养方法的进一步缺点包括涉及受控的瞬时暴露于化学刺激的实验。在静态培养物中,必须手动添加和去除刺激,并且刺激曲线仅限于随时间的步进变化,而培养基的变化也会添加和去除其他培养基成分,这可能会以不受控制的方式影响细胞5。流体系统可以克服这些挑战,但现有设备带来了其他挑战。微流体装置伴随着专业设备和培训的生产和使用成本过高,需要微分析方法来处理样品,并且灌注后细胞难以从装置中回收6。对于这里描述的实验类型,很少有大流体系统7,8,9,10,并且它们由内部制造的多个定制部件组成,需要多个泵或馏分收集器。此外,作者不知道除了用于悬浮培养的搅拌罐生物反应器之外,任何市售的大流体灌注细胞培养系统,这些系统对生物制造有用,尽管不是为建模和研究生理学而设计的。
作者之前报告了低成本灌注生物反应器系统的设计,该系统几乎完全由市售部件11组成。该系统的基本版本使孔板中的多种培养物能够保存在CO2 培养箱中,并连续灌注来自注射器泵的培养基,而来自培养物的流出培养基流随着时间的推移使用具有定制修改的馏分收集器自动分馏到样品中。因此,该系统能够自动取样培养基上清液,并随着时间的推移连续地将溶质输入到培养物中。该系统是大流体和模块化的,可以很容易地修改,以满足新型实验设计的需要。
这里介绍的方法的总体目标是构建,表征和使用灌注细胞培养系统,该系统能够进行实验,其中测量细胞随时间推移的物质分泌或吸收速率,和/或细胞暴露于精确的瞬态溶质信号。本视频文章介绍了如何组装碱基设置,该设置能够使用单个注射器泵和改进的馏分收集器同时灌注多达六种细胞培养物。还介绍了基础系统上的两个有用变体,它们利用额外的泵和部件来允许将细胞暴露于瞬态溶质浓度信号的实验,包括短暂的脉冲和药代动力学样曲线12, 如图1所示。
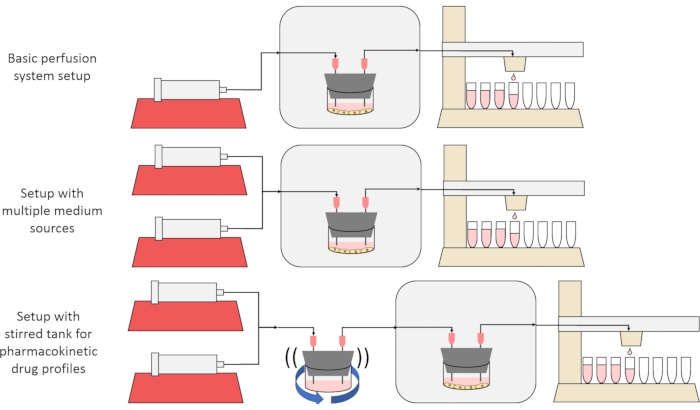
图1:灌注系统设计的三种变化 (顶部)基本灌注系统。(中)带有旋塞阀的灌注系统,用于多种介质来源。(底部)灌注系统带有搅拌罐,以模拟混合良好的分布体积。 请点击此处查看此图的大图。
由于流动中的色散和扩散,溶质信号在通过流动系统时会失真或"模糊"。这种失真可以通过使用停留时间分布(RTD)来量化13。本文介绍了如何对灌注系统的组件进行示踪剂实验(图 2),并提供 MATLAB 脚本来根据测量数据生成 RTD。关于这一分析的详细解释可以在作者之前的论文11中找到。附加的MATLAB脚本将适当的函数拟合到RTD并提取物理参数,并使用RTD执行信号卷积,以预测用户输入的溶质信号将如何通过灌注系统14传播和扭曲。
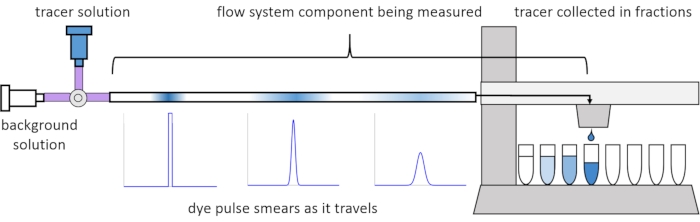
图 2:停留时间分布。 流量系统组件的RTD,例如这个长度的管道,是通过向系统输入示踪剂脉冲并测量它在退出收集的馏分时如何"涂抹"来测量的。这个数字是从埃里克森等人11修改而来的。 请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 准备孔板灌注零件
- 准备管材
- 为每个要灌注的细胞培养物切割两个长度的硅胶管(内径1.6 mm)。确保用作上游管路的片段足够长,可以从注射器泵到达培养箱内的细胞培养物,并且下游片段可以从细胞培养物到达馏分收集器的最远延伸位置。
- 在每根管子的两端都有一个独特的标签,并贴上胶带。
- 为孔板准备塞子
- 为要灌注的孔板的每个孔获得一个硅胶塞,其直径适当,以密闭密封紧贴在孔中。
- 从塞子的底部切掉多余的材料,使它们适合井中,同时在内部留出空间,供空气高于预期的液位。
- 将两根钝的18 G针穿过每个塞子,进入顶部并从底部出来,作为流经孔的入口和出口,彼此截然相反,以最大化其尖端之间的距离在井内。
- 调整堵塞井内针的高度,因为出胶针的高度将决定灌注过程中井中液位的稳定高度。
注意:如果灌注是用高于液位的出口针开始灌注的,那么液体将积聚在井中,直到液位达到针头。如果从液位以下的出口针开始灌注,液位将保持稳定,除非气泡流入井中,这将导致液体高度降低,直到它与出口针的高度相同。
- 收集其他部件
- 为每个要灌注的细胞培养物获得一个无菌注射器,该注射器足够大以包含足够的培养基用于整个灌注,外加额外量的培养基以最初填充管子。
- 对于要灌注的每种培养物,获得一个雌性到倒钩和两个公对倒钩鲁尔连接器,以及两个母头和两个公头鲁尔帽。
- 清洁和消毒部件
- 如果以前使用过部件,请用0.1 N NaOH灌注来清洁它们,然后用去离子水冲洗。
- 通过高压灭菌或其他方式,确保上面列出的所有部件的无菌性。
2. 激光切割多头分配器并将其连接到馏分收集器上
- 在计算机辅助设计程序中重新创建 图3 中的多头分配器模型,或下载提供的模型DXF文件(补充文件1)。
- 使用激光切割机从1/8英寸的丙烯酸板切割设计。
- 卸下将点胶头连接到馏分收集器移动底座上的三个螺钉。
- 将多头分配器中的三个最小孔与移动底座上的螺钉孔对齐,然后将螺钉通过孔拧回以进行连接。
- 调整三个螺钉的松紧度,使多头分配器上下倾斜,直到一排分配孔与其下方的收集管对齐。
- 小心地将300μL移液器吸头放入所需的孔中,以用作分液吸头。
注意:馏分收集器可以在不使用多头分配器的情况下使用,以灌注单细胞培养物。
3. 测量分量RTD并执行信号卷积
- 设置示踪脉冲的泵和注射器 ,如图2所示。
- 获得两个单通道或多通道注射泵。
- 选择背景解决方案来表示细胞培养实验期间将在流动系统中使用的培养基。确保背景溶液具有与介质相似的传质特性。在许多情况下,去离子水是一个合适的选择。
- 选择示踪物质来表示细胞培养实验期间感兴趣的溶质。确保示踪剂具有与目标溶质相似的传质特性,并且必须能够测量其浓度。在许多情况下,食用色素是一个合适的选择。
- 将示踪物质溶解在背景溶液中,制成示踪剂溶液。
- 用背景溶液填充一个注射器,然后将其装入一个注射泵中。用示踪剂溶液填充另一个注射器,并将其装入第二个注射器泵中。
- 使用鲁尔连接器将两个注射器连接到四路旋塞阀的三个端口中的两个。
- 将旋塞阀关闭到后台溶液中,并将示踪剂溶液泵入旋塞阀,直到它开始从打开的端口滴出。停止泵,不要进一步调整注射器。
注意:重要的是,在实验的定时部分开始之前,将注射泵的移动杆向上推到注射器柱塞上。这将允许泵启动时立即开始流动。否则,泵可能会启动,但在移动杆赶上柱塞位置之前,流量实际上不会开始。 - 关闭示踪剂溶液的旋塞阀,并将背景溶液泵入旋塞阀,直到所有残留的示踪剂溶液都从打开的端口中冲洗出来。停止泵,不要进一步调整注射器。
- 设置感兴趣的流量系统组件和馏分收集器
- 设置 RTD 分析所需的流量系统组件。确保待测部件末端有一段长度合适且柔韧性的下游管材,以便在操作期间到达馏分收集器。
- 将下游管路的末端插入多头分液器中的移液器吸头分配器中,使其紧密连接。
- 将四通旋塞阀的打开端口连接到要测量的组件的入口处。将背景溶液泵入组件,直到它像细胞培养实验期间那样完全充满,并且它开始从馏分收集器分配尖端滴出。停止泵。
- 注入示踪剂脉冲,收集分数并测量示踪剂
- 将示踪剂溶液的泵设置为所需的流速。将旋塞阀关闭到后台溶液并启动示踪剂溶液的流动。同时,启动分数收集器。
- 在短时间内继续示踪剂溶液的流动,以近似示踪剂的脉冲输入。发现10分钟的脉冲持续时间在1 mL / h的流速下对RTDs效果良好。
注意:如果示踪剂脉冲太短,则没有足够的示踪剂进入流量以进行测量。如果脉冲太长,它将不再近似于脉冲,并将改变RTD的形状。 - 在示踪剂溶液脉冲周期结束时,停止示踪剂溶液泵。快速关闭示踪剂溶液的旋塞阀,并以相同的流速启动背景溶液的流动。
- 允许背景溶液流动并收集馏分,直到所有示踪剂通过系统并进入收集的馏分。
- 停止系统并测量馏分中的示踪剂浓度。仅包括完全分配的分数。如果收集分数的中途停止收集,请不要包括该分数。
- 根据 MATLAB 中的测量数据计算停留时间分布 (RTD)
注意:关于此 MATLAB 脚本所执行的分析的书面解释可以在作者之前的出版物11 中找到,并且该理论的讨论在文献13 中随处可见。- 以 补充文件 2 中提供的example_tracer_data.xlsx电子表格的格式生成包含浓度数据的.xlsx文件。在第2行中按时间顺序从左到右以分数(任何单位)输入示踪剂的浓度值。在单元格 A5 中输入从脉冲开始到最后一个分数结束所经过的时间,并在单元格 A8 中输入示踪剂脉冲的长度(以分钟为单位)。
- 将.xlsx文件保存在 MATLAB 目录中。
- 在 MATLAB 编辑器中,从 补充文件 3 中打开RTD_From_Data.m"脚本。
- 按照脚本文件中编写的说明,将脚本" 加载数据 "部分第一行括号中括号中.xlsx文件的名称替换为新.xlsx数据文件的名称。运行脚本。
- 确保脚本成功执行RTD分析13,生成RTD的图,并返回RTD等于1的数值积分值。查找脚本保存到 MATLAB 目录的时间向量 (t) 和关联的 RTD 值向量 (Et)。
- 将模型函数拟合到 MATLAB 中的 RTD
- 从 补充文件 4 在 MATLAB 编辑器中打开Fit_RTD_Function.m"脚本。
- 从三个注释掉的模型函数中选择一个来适应RTD:轴向色散模型13,它适合圆柱管中层流RTD;CSTR型号13,适合搅拌良好的罐;和n-CSTR模型15,它大约适合较大的孔板。要适合此处未包含的其他模型,请以相同的格式将其添加到脚本中。
- 删除脚本中包含选定用于拟合的模型的部分中的注释。
- 将参数的初始猜测值更改为适合 RTD 的值。
- 运行脚本以生成覆盖在 RTD 数据上的拟合函数的图解,并打印函数的拟合参数值。如果拟合非常差或发生错误,请更改参数初始猜测并再次运行脚本。
- 在 MATLAB 中执行信号卷积
- 选择一个信号和一个 RTD 或两个 RTD 进行卷积。
- 在 MATLAB 编辑器中,从 补充文件 5 中打开Signal_Convolution.m"脚本。
- 对于要卷积的两个信号中的每一个(即,一个信号和一个RTD,或两个RTD),定义一个以所需单位划分的均匀间隔时间点的向量和这些时间的相应信号值向量。
注意:两个信号的矢量必须具有相同数量的元素和相同大小的时间步长。这就是为什么将RTD作为一个连续函数很有用,可以在任何时间间隔内对任意数量的点进行采样。 - 将两个信号输入 MATLAB 并运行脚本以获取输出信号的时间和信号向量。
4. 用孔板中的细胞建立基本的灌注系统
- 准备孔板
- 确保孔板培养物具有适合灌注实验的培养基深度。在开始灌注之前,根据需要进行任何最终的培养基更换,刺激或其他步骤。如果悬浮细胞正在灌注,请离心板以确保它们位于底部。
- 在无菌条件下,将带有针头的塞子插入孔板培养物中,并将针头拉起。塞子就位后,将针头降低到所需的灌注高度,因为出口针的高度决定了稳定的液位。
- 用雄性鲁尔帽盖住针头,并将整个孔板保持在培养箱中直至使用。
- 准备注射器和上游管路
- 在无菌条件下,为每个培养物填充一个注射器,以灌注足够的培养基,以达到所需的灌注持续时间,加上足够的额外培养基以填充上游管。
- 使用母头到倒钩型鲁尔连接器将上游管路连接到注射器。在管子的另一端,插入公头到倒钩的鲁尔连接器。
- 从注射器中分配培养基,直到上游管子完全充满培养基。
- 用雌性鲁尔帽盖住管子的开口端。
注意:此时,所有复制注射器的体积必须完全相同。如果它们的体积不相等,它们的柱塞将处于不同的位置,并且它们将无法很好地放入单个多通道注射泵中。
- 在无菌条件下,将公头到倒钩型鲁尔连接器插入下游管路的一端,并用母鲁尔帽盖住。
- 小心地将所有准备好的管子,注射器和孔板带到将用于灌注的培养箱中。
- 将注射泵和馏分收集器放置在培养箱附近的所需位置。将注射器泵放在培养箱的顶部或附近,然后将馏分收集器放在培养箱旁边,靠近端口。
- 将所有上游和下游管的封端捆绑在一起,并通过端口将它们从培养箱外部推到内部。
- 将注射器装入注射泵,并将下游管的开口端插入馏分收集器多头分配器的分液器吸头中。
- 在培养箱内,将尽可能多的上游试管拉入培养箱,以最大限度地延长管道的长度,流动介质可以通过该管从培养箱空气中接收热量和CO2。在将这些管子固定到位的同时,将下游管子从培养箱中拉出,刚好足以使它们能够到达馏分收集器上最远的延伸点,同时仍将封端保持在培养箱内。
- 对于每个堵塞的孔,快速松开该井的针头以及上游和下游管的盖子,并将它们与Luer连接器连接在一起。
- 连接所有部件后,以相对较高的速度短暂运行注射泵,以确保所有流都正常流动。
- 此时,如果需要在充满介质的下游管道中开始实验,请继续运行泵,直到全部装满。否则,请停止泵。
- 设置注射泵的流量和馏分收集的频率,并同时启动两台机器以开始实验。收集所需实验持续时间的分数。
5. 使用旋塞阀设置灌注系统,用于多种介质源
- 执行上述步骤 4.1 的所有子步骤。
- 准备两种用于灌注的培养基,将首先分配的培养基标记为1,另一种标记为培养基2。
- 对于要灌注的每种培养物,在分配期间用足够的培养基1填充一个注射器,加上足够的体积以最初填充灌注系统。在第二个注射器中加入足够的培养基2,以维持其分配过程。
- 将两个注射器连接到四向旋塞阀的三个端口中的两个。
注:可能需要一定长度的管子才能将注射器连接到旋塞阀。 - 以与上述步骤3.1.7-3.1.8类似的方式准备旋塞阀和注射器,方法是将旋塞阀关闭至介质1并将介质2分配到旋塞阀中,直到它刚开始从打开的端口滴出。
- 将旋塞阀关闭至介质 2,并将介质 1 分配到旋塞阀中,直到所有残留介质 2 从打开的端口中冲洗出来。
- 使用母头到倒钩型鲁尔连接器将上游管连接到开放式旋塞阀端口。在管子的另一端,插入公头到倒钩的鲁尔连接器。
- 从注射器中分配培养基1,直到上游管完全充满培养基。
- 继续执行上述步骤 4.3-4.11,将两个注射器都装入单独的注射器泵中,仅分配介质 1。
- 设置介质1的注射器泵流量和馏分收集的频率,并同时启动两台机器开始实验。
- 当介质源要更换时,快速停止介质1的注射泵,将旋塞阀关闭至介质1,启动介质2的注射泵。如果以后需要,请以类似的方式将源切换回介质 1。
- 收集所需实验持续时间的分数。
6. 使用搅拌罐设置灌注系统以模拟药代动力学
- 获取目标药物的药代动力学数据,并确保它由浓度峰后跟指数衰减组成。
- 将峰值设置为时间 0 并在峰值之前删除数据点后,使用 Stirred_Tank_Fit.m 脚本(补充文件 6)将搅拌罐 RTD 方程拟合到数据中。输入v(期望的灌注流速)和要作为一对向量直接放入脚本中的数据,以及t和C分别表示时间值和浓度值。运行脚本以打印参数 V,即所需的搅拌罐容积。
- 规划灌注系统的布局,包括两个注射泵和一个培养箱上游的板振荡器。
- 测量旋塞阀以外的灌注系统组件的RTD,并执行具有各种药物脉冲持续时间和浓度的RTD的信号卷积,以找到适当的药代动力学特征。在此计算中使用拟合搅拌罐 RTD 方程。
- 继续执行上述步骤 5.1-5.8。
- 使用适当尺寸的附加孔板作为搅拌罐进行设置。每个孔都可以作为一个灌注培养物的搅拌罐。用所需体积的培养基V填充孔,并用最初拉起的针头堵塞孔,然后推到孔的底部,并盖住针头。
- 将注射器装入注射泵,并将管子从注射器快速连接到搅拌罐的带盖的入口针。然后将细胞培养物上游管入口连接到搅拌罐的出口针。
- 继续执行步骤 5.9-5.10。
- 在所需的时间,切换到分配含有药物的培养基2,如步骤5.11所述。当药物输注完成时,切换回介质1。
- 继续执行步骤 5.12。
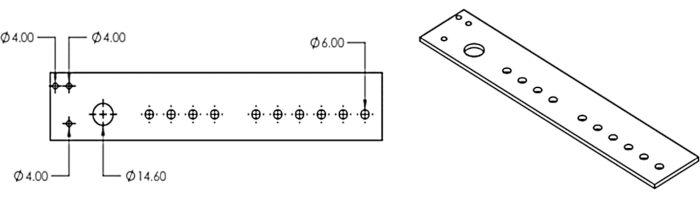
图 3:多头分配器。 设计用于激光切割多头分配器。这个数字是从埃里克森等人11修改而来的。 请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
结果
使用来自方案第5部分的多个培养基来源的灌注系统来测量由活化B细胞(NF-κB)转录因子的核因子kappa-轻链增强子驱动的报告基因的表达动力学,以响应肿瘤坏死因子α(TNF-α)的1.5 h脉冲。HEK293细胞使用含有高西亚荧光素酶(GLuc)的基因构建体的慢病毒载体稳定地转导,由含有NF-κB响应元件的称为NFKB的启动子驱动,以产生NFKB-GLuc HEK293细胞, 其通过 荧光激活细胞分选(FACS)分选以分离转?...
Access restricted. Please log in or start a trial to view this content.
讨论
这项工作描述了具有多个培养基来源的灌注细胞培养系统的组装和操作,并展示了一个具体的例子,其中测量了NF-κB驱动的基因表达响应于TNF-α瞬时脉冲的动态。对灌注系统组分的RTD进行测量和建模,并使用信号卷积来预测细胞暴露于TNF-α脉冲和TNF-α在收集的流出介质中的分布。将细胞暴露于脉冲并收集分数40小时,之后在分数中测量GLuc并与预测的TNF-α信号一起绘制,以揭示刺激 - 反应动力学。<...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明没有竞争利益。
致谢
这项研究是在拨款号的支持下进行的。R01EB012521、R01EB028782 和 T32 GM008339 来自美国国立卫生研究院。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
参考文献
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153(2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305(2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673(2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213(2021).
- Saltzman, W. M. Drug Delivery: Engineering Principles for Drug Therapy. , Oxford University Press. (2001).
- Fogler, H. S. Elements of Chemical Reaction Engineering. 4th edn. , Prentice Hall PTR. Boston. (2006).
- Conesa, J. A. Chemical Reactor Design: Mathematical Modeling and Applications. , Wiley. (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615(2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。