Method Article
开发用于心脏功能成像和光遗传学控制的 黑腹果蝇 模型
摘要
本方案描述了在心脏中表达eNpHR2.0或ReaChR视蛋白的黑色果蝇的产生,用于OCT成像和光遗传学心脏起搏。报告了果蝇OCT成像和心跳调节的详细说明,包括模拟不同发育阶段活体动物的可恢复性心骤停,心动过缓和心动过速。
摘要
使用 果蝇黑腹草r(果蝇)作为模式生物,确保了从细胞组织和基因组研究到行为研究等生物科学许多领域的重大进展。由于科学知识的积累,近年来, 果蝇 被带到人类疾病建模领域,包括心脏疾病。所介绍的工作描述了使用红光(617nm)和无侵入性程序在整个活生物体的背景下监测和操纵心脏功能的实验系统。对心脏的控制是使用光遗传学工具实现的。光遗传学结合了光敏转基因视蛋白的表达及其光学激活来调节感兴趣的生物组织。在这项工作中,使用定制的集成光学相干断层扫描(OCT)成像和光遗传学刺激系统来可视化和调节三龄幼虫和早期蛹发育阶段的 黑色素消化 道滴虫心脏的功能。UAS / GAL4双遗传系统用于表达氟视紫红质(eNpHR2.0)和红移通道视紫红质(ReaChR),特别是在苍蝇心脏中。提供了有关准备 黑色素体D. 用于实时OCT成像和光遗传学起搏的详细信息。实验室开发的集成软件处理成像数据,以创建 果蝇 心脏功能的视觉呈现和定量特征。结果验证了eNpHR2.0激活引起的心脏骤停和心动过缓以及在ReaChR激活时进行心脏起搏的可行性。
引言
2010年底,《自然方法》杂志将光遗传学选为第1年方法。使用由光调节的遗传工具(转基因视蛋白)以前所未有的精度和速度控制感兴趣的生物组织,为新的应用打开了闸门。迄今为止,大多数成就都属于神经科学。该技术作为精确控制单个神经元2 的新方法引入,并已在活生物体认知功能3领域取得了进展。从一开始,神经科学家就证明了调节整个生物体行为的能力。小鼠多巴胺能神经元中ChR2视蛋白的表达和光激活引起其激活,足以驱动行为调节4。将含有卤视紫红质NpHR2.0的神经元亚群的光遗传学抑制传递到啮齿动物大脑的癫痫病灶,导致脑电图癫痫发作减弱5。
光遗传学在心脏病学中的应用正在稳步发展6.ChR2在心肌细胞培养物和小鼠中成功表达;心脏起搏是通过蓝光闪光(在活体动物中使用植入的纤维进行的)进行的7。在斑马鱼中,ChR2被表达并用于识别起搏心脏区域;NpHR激活诱导心脏骤停8.光遗传学心脏起搏具有开发新的起搏和再同步疗法的独特潜力9.最近也有10次尝试建立自体性心律失常终止系统的尝试。
广泛的研究和新的治疗疗法的开发需要应用各种模型系统,从细胞培养到哺乳动物。脊椎动物的心脏是一个非常复杂的器官。心肌细胞(CM)占所有心脏细胞的三分之一;其他细胞包括神经元、血管平滑肌细胞和非兴奋性细胞(即内皮细胞、成纤维细胞和免疫细胞)。研究CM细胞培养限制了所获结果在人类医学应用中的转化。哺乳动物模式生物的遗传操作是有限且耗时的。较小的无脊椎动物模型具有许多优点;他们的心血管系统携带着所有必要的组织学元素。 果蝇(果 蝇)是一种简单而强大的遗传模型系统,用于研究与人类疾病相关的基因的作用,包括心脏疾病11,12,13。作为短命动物,果蝇代表了一个极好的机会来模拟年龄或疾病依赖性心脏功能的变化,这些变化可以在整个生命中追溯14,15,16,17。果蝇的心管位于其身体的背侧,距离角质层表面200μm以内,允许可见的近红外光到达心脏管。这种解剖学特征可以使用现有的光遗传学工具对 果蝇 心脏进行非侵入性光学起搏。
为了监测 果蝇 心脏,开发了一个定制的光谱域光学相干断层扫描(SD-OCT)成像系统,该系统集成了红光LED激发模块18。相对简单的果蝇心脏的形态和节律变化可以很容易地用这种非侵入性生物医学成像技术12,19,20,21进行分析。OCT具有增强的光学切片性能和微米级空间分辨率,已成功用于研究 果蝇 心脏在不同发育阶段(包括三龄幼虫和早期蛹18)的结构和功能监测。该系统还可以同时监测和刺激完整动物果 蝇的心脏状况。OCT系统的示意图如图 1所示。SD-OCT系统使用超发光二极管(SLD)作为光源(中心波长:850 nm±10 nm,FWHM:165 nm,参见 材料表)。使用10倍物镜,OCT成像系统可以在空气中实现~4.4μm的轴向分辨率,在组织中实现约3.3μm的轴向分辨率,横向分辨率为〜2.8μm,足以解析飞行心脏结构的精细细节18,22。来自参考臂和样品臂的反射光的干扰信号使用带有2048像素线阵扫描相机的光谱仪进行检测(最大线速:80 kHz,参见 材料表)。测得的系统灵敏度约为 95.1 dB。每次B模式OCT扫描都会在xz图像平面中生成一个横截面图像。在同一位置采集重复的B模式图像,以创建M模式图像,捕获跳动的心脏超过30秒18,22,23。M模式成像的帧速率约为125帧/秒,足以捕捉果蝇心跳的动态。
为了果 蝇 心脏功能的光遗传学调节,带有617 nm LED光源的照明模块与SD-OCT系统的样品臂集成在一起。刺激光聚焦在样品表面上直径约2.2 mm的光斑上,与成像聚焦点的位置相同。利用定制编写的软件来控制照明模式(光强度、脉冲宽度和占空比),调整光脉冲刺激频率,并同步LED模块照明和M模式OCT成像采集22。
最近的出版物描述了果蝇转基因系统,该系统由使用UAS / GAL4遗传系统的时空调节的ChR2,ReaChR和eNpHR2.0视蛋白组成。获得的结果表明,eNpHR2.0的红光激活和高频心脏起搏以及由ChR2的蓝光激活引起的高频心脏起搏的能力。所有所述实验中的视蛋白表达均由24B-GAL4驱动,其中视蛋白表达在广泛的组织中观察到,包括心肌细胞和周围肌肉细胞。在目前的研究中,24B-GAL4被Hand-GAL4驱动因子取代,以实现心脏特异性eNpHR2.0和ReaChR视蛋白表达。
总体而言,所提出的实验结果显示可恢复的心脏骤停和可诱发的心动过缓和心动过速。提供了详细的方案,其中包含在活体动物中创建转基因 果蝇 模型和同时进行OCT成像和光遗传学起搏实验的分步说明。
研究方案
对于本研究,eNpHR2.0转基因品系 w[*];P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2, ReaChR 转基因品系 w[*];P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO,以及含有 汉德 基因调节片段的心脏特异性GAL4驱动子 w[1118];使用了通用汽车88D05-GAL4}attP2/TM3 Sb[1] (此驱动程序库存将表示为 手动GAL4)。 y[*] w[*];P=UAS-2x玻璃纤维增强剂}AH3 被用作通用防盗报告器行。上述 果蝇 种群是从布卢明顿果蝇种群中心(BDSC,见 材料表)获得的,并在室温或标准玉米粉培养基上保持在18°C。本研究中开发的 果蝇 模型可根据要求进行协作工作。
1. 果蝇 遗传杂交和培养基制备
- 将第三条染色体平衡器 TM3 Sb[1] 更改为 TM6 Sb Tb,产生w[1118];P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM6 Sb Tb (Hand-GAL4/TM6 Sb Tb). 有关交叉方案,请参见 补充图 1 。将十字架放在带有常规玉米粉培养基的小瓶中。
注意: Tb 标记物的存在使用户能够区分含有视蛋白转基因的幼虫和蛹以及GAL4驱动者与含有视蛋白但没有驱动因子的动物25。 - 将遗传杂交保存在25°C,70%湿度的培养箱中,在特殊配方的含全反式视网膜I(ATR)培养基(参见 材料表)上,在黑暗中保存5天以进行幼虫收集,6天用于蛹收集。
- 每小瓶将五名手 GAL4/TM6 Sb Tb 处女和两到三名来自 UAS 视蛋白储备(eNpHR2.0 或 ReaChR)的男性组合在一起。分别参见图2A和图2B中eNpHR2.0和ReaChR视星的交叉图。
- 第二天,准备含有ATR的培养基小瓶。
- 根据BDSC26的说明准备半定义食品。不要加入蔗糖和葡萄糖,只加入蔗糖(5.14 g / 100 mL)。冷却至~60°C,不断搅拌。
- 制备窄小瓶,并向每个小瓶中加入50μL100 mM ATR-乙醇溶液。
- 使用血清学移液管,将苍蝇食物处理成窄的苍蝇小瓶,每瓶5毫升。以最大速度涡旋10秒。
- 插入小瓶,并用深色织物包裹,以保护它们免受光线照射。让小瓶干燥至少12小时(过夜)。
- 第二天,从步骤1.3转移稳定产卵的苍蝇。到含有ATR食物的小瓶(步骤1.4.4.)。用小瓶保护机架免受光线照射。
- 24-48小时后(取决于产卵的数量),丢弃父母以防止小瓶过度排卵。
- 收集非Tb 后代并将其用于心脏成像。
注意:图 2C显示了幼虫期和蛹期的表型差异。样品制备步骤的摘要和大致时间表如图 3所示。
2. 果蝇心脏的光遗传学控制
- 从小瓶中挑选 UAS-opsin/Hand-GAL4 幼虫/蛹(步骤1.7),放在纸巾上,然后用画笔轻轻擦去体表面的培养基。
- 准备显微镜载玻片,并在中间放置一小块双面胶带。
- 使用刷子或细镊子,轻轻地将幼虫/蛹放在胶带表面上,背侧向上并垂直于滑块的长侧。施加轻柔的压力,将幼虫/蛹附着在胶带表面。
- 将载玻片设置在成像台上,幼虫/蛹朝下。
- 通过激光控制软件打开OCT光源(见 材料表)。打开自定义编写的SD-OCT控制软件,然后单击" 预览" 窗口。
- 在 SD-OCT 软件中设置扫描参数。
注意:目标是对齐样本以对跳动的心脏进行最佳成像,因此选择X范围和Y范围覆盖心脏区域。在此步骤中,A扫描和B扫描的数量均为400。x和y方向的范围是~490μm和〜537μm,分别显示了心脏的两个正交横截面(xz和yz)。 - 使用显微操作器控制样品台,使飞行心脏成为焦点。调整焦点位置以尽量减少来自苍蝇角质层表面的光反射。考虑在幼虫/蛹表面涂抹矿物油,以尽量减少反射。
注意:油可能会损害胶带的粘合性能,从而增加动物移动的风险。 - 确保飞心可以在图像窗口中完全看到,没有任何扭曲,被组织阻挡,阴影和反射不可忽略;否则,请返回步骤 2.7。
- 设置 M 模式 OCT 图像采集的扫描参数。
注:与步骤2.7相比,A扫描次数有所减少。用于更快的帧速率,以捕获飞行心脏的跳动动态(几个Hz)。B扫描次数表示M模式成像的重复帧数,可以根据记录时间和可用系统内存进行调整。在这个实验中,128次A扫描可以允许~125帧/秒的速度,并记录4,000次重复的B扫描,提供约32秒的连续记录。 - 在没有红光刺激脉冲的情况下采集五组控制数据,以计算静息心率(RHR)。
- 在自定义OCT控制软件中设计用于起搏刺激的光脉冲。在"设置"中,添加设计的光脉冲序列,以根据不同的刺激方案控制脉冲频率、脉冲宽度、刺激持续时间和等待时间。
注意:RHR是从没有光照明的对照实验中测量的,用于计算测速和缓动实验22的光脉冲频率。 - 打开光控制器软件(参见 材料表)以产生红光脉冲。在" 模式选择 "中选择脉冲模式。双击"脉冲配置文件"设置的图,然后选择 跟随器模式。将 OFF 强度保留为 0,并在计算实际功率密度时设置 ON 强度百分比。
注:刺激光脉冲由OCT控制软件的信号根据步骤2.12中的设置触发。 - 通过单击OCT控制软件中的"获取",通过光刺激获取跳动的果蝇心脏的M模式视频。重复测量5x。
3. 图像分析
- 打开定制开发的蝇心分割软件。
- 单击 "选择文件" ,然后在显示的 GUI 中选择要分析的文件。
- 在顶部文本框中输入心脏区域的垂直和水平边界(以像素为单位)。单击" 调整大小"。使用底部的滑块,确保整个心脏区域可见,并且它填满了整个集合的整个框。如果不是,请重复此过程并调整边界。
- 单击 "预测 "以预测心脏区域。现在,程序将遍历集合中的每个切片并选择心脏区域,大约需要3分钟。
- 预测完成后,单击 心率图 。这将打开一个新窗口,显示心脏区域随时间变化的图解。确保选择了正确的峰值或谷值区域。选择 Pulse ,然后选择 HR 生成最终图形,功能参数将同时保存在.csv文件中。
结果
在心管中表达红光敏视蛋白eNpHR2.0或ReaChR的黑腹大虫动物是通过从每个UAS-视蛋白转基因系和Hand-GAL4驱动者之间的杂交中获得后代而产生的。通过对GFP表达进行成像来验证GAL4驱动器的组织特异性(图4)。以果蝇三龄幼虫和早期蛹发育阶段为研究对象,通过红光激活eNpHR2.0和ReaChR的效果。设计了由LED传递的~617nm红光脉冲,照亮了幼虫/蛹,并激活了心脏中的eNpHR2.0和ReaChR。尽管报告的NpHR的最大响应波长为~580 nm,ReaChR的最大响应波长为~600 nm,但617 nm光照可以通过增强的光能传递到表达视蛋白的心脏组织22进行更深的穿透。
安装在显微镜载玻片上,背侧朝下,在倒置显微镜设置中,幼虫/蛹被指向A7体段的LED光束照亮。车身横截面图像的示例如图5A和图6A所示。心脏在由4,000帧组成的视频记录中显示为收缩和扩张的圆形(补充视频1-6)。为了模仿不同的心脏病,设计了四种类型的光脉冲。在等待5秒后持续10秒的单脉冲产生由eNpHR2.0诱导的可恢复性心脏骤停,如图5B所示。对于以低于静息心率(RHR)的频率(由eNpHR2.0介导)的心脏起搏,使用两个起搏频率等于RHR/2和RHR/4的光脉冲序列,持续8秒,等待时间为6秒(图5C)。每个光脉冲序列的占空比为90%。这种光刺激方案导致令人联想到心动过缓的心脏病。由于ReaChR激活而增加心率的刺激模式由三个光脉冲序列组成,频率分别为RHR + 0.5 Hz,RHR + 1 Hz和RHR + 1.5 Hz,脉冲宽度为20 ms(图5D)。这种脉搏方案旨在引起心动过速心脏病。在所有实验过程中,光功率密度为7.49 mW/mm2。对于对照实验,没有设置光照。
每个实验变体被记录五次。使用FlyNet 2.0 27将苍蝇心脏的M模式视频处理成2D掩模。该软件自动分割心脏区域以产生心脏功能数据集。该程序在每一帧中提供心脏的掩模,如果需要,可以进一步手动校正,以生成跳动的心脏功能参数的准确量化,例如心率(HR),舒张末期尺寸(EDD)和收缩末期尺寸(ESD),小数缩短(FR),舒张末期面积(EDA),收缩末期面积(ESA)等。心率是通过分析心脏区域随时间变化来测量的。没有光脉冲的控制视频用于建立每只动物的基线心率(例如RHR)。
图5B 和 图6B 显示, 手>eNpHR2.0 分别在幼虫和蛹中使用红光(617nm)激活引起的10 s长的心脏骤停。当红灯亮起时, 果蝇的 心脏停止跳动,一直保持这种状态,直到光照结束。红灯熄灭后,心脏功能得以恢复。未表达视蛋白的动物("无视蛋白"对照)对红光照明没有反应(补充图2A 和 补充图3A)。对 手持>eNpHR2.0 动物进行的对照实验,其中10秒红灯照明未打开("无光"对照)显示心脏正常跳动(补充图4A 和 补充图4C)。
使用手>eNpHR2.0动物,施加频率低于RHR的红光脉冲。随着光信号的照射,心脏收缩频率降低;这种较慢的心率模仿一种类型的心律失常,心动过缓(分别为幼虫和蛹的图5C和图6C)。在"无视蛋白"(补充图2B和补充图3B)和"无光"(补充图4A和补充图4C)对照实验中未观察到较慢的心脏起搏。
可以通过以高于给定动物的RHR的频率用红光脉冲序列激活手>ReaChR视星来实现心率增加。将一系列不同刺激频率(例如,RHR + 0.5 Hz,RHR + 1 Hz,RHR + 1.5 Hz)的三个光脉冲序列应用于手>ReaChR幼虫和蛹心。获得的数据清楚地显示光脉冲后心率增加(分别为幼虫和蛹的图5D和图6D)。这些实验中证明的心脏病模仿心动过速。阴性对照实验如图2C、补充图3C和补充图4B、D所示。
总体而言,结果证明了在 黑腹角龙转基因动物模型中对不同发育阶段心律进行非侵入性和特异性光遗传学控制的可行性。
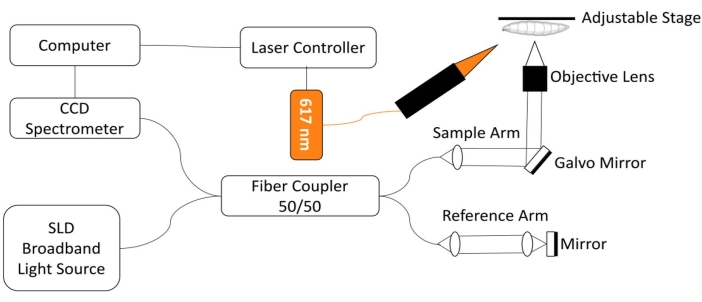
图1:OCT成像系统集成了617nm LED模块,用于 果蝇 心脏功能的光遗传学控制 。
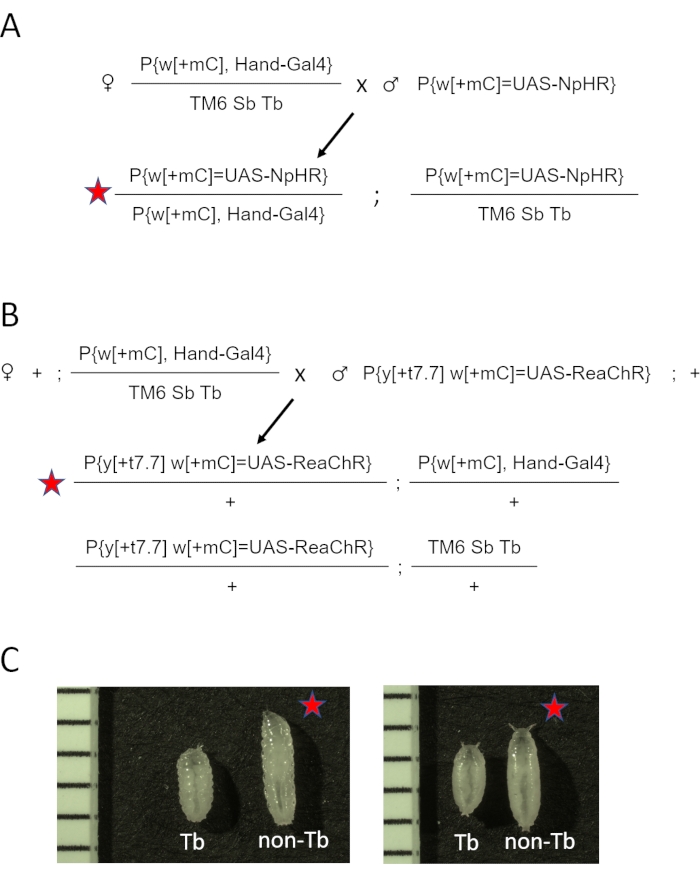
图2:生成在心脏中表达视蛋白的黑腹双歧杆菌动物。将手持 GAL4/TM6 SbTb 杂交给携带 eNpHR2.0 的雄性。收集所得的汉德-GAL4/eNpHR2.0后代(以红星标记)进行OCT成像,并根据其表型外观丢弃手GAL4/TM6 Sb Tb。(B)遗传交叉图。雌性手-GAL4/TM6 SbTb与携带雷氏环状物的雄性杂交。将得到的汉德-GAL4/ReaChR后代(以红星标记)收集用于OCT成像,并根据其表型外观丢弃手GAL4/TM6 Sb Tb。(C)手GAL4/视蛋白(红星)和手GAL4/TM6 Tb后代之间的表型差异。与正常的非Tb幼虫或蛹相比,在TM6染色体上携带Tb基因突变的动物具有"结核"体形。左图显示幼虫;右图显示了早期的蛹。图像还包括带有1毫米标记的标尺。请点击此处查看此图的大图。
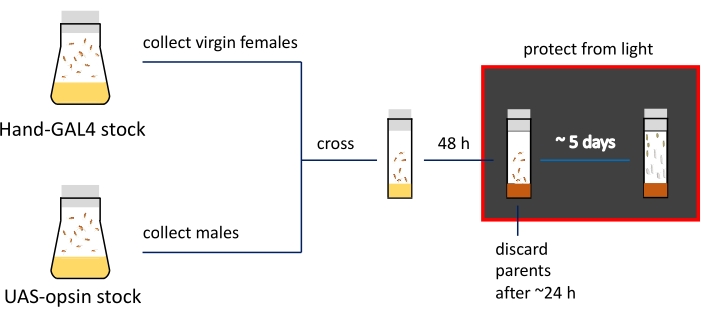
图3:成像准备程序的示意图和时间表。 父母的股票保存在苍蝇瓶中;处女雌性和雄性在装满常规食物的狭窄小瓶中交叉(用黄色表示)。主动产卵的苍蝇被转移到含有ATR的培养基(以棕色显示)小瓶中。具有发育后代的小瓶需要从这一步开始就保持在黑暗中。从小瓶壁收集三龄幼虫和早期蛹进行成像。 请点击此处查看此图的大图。
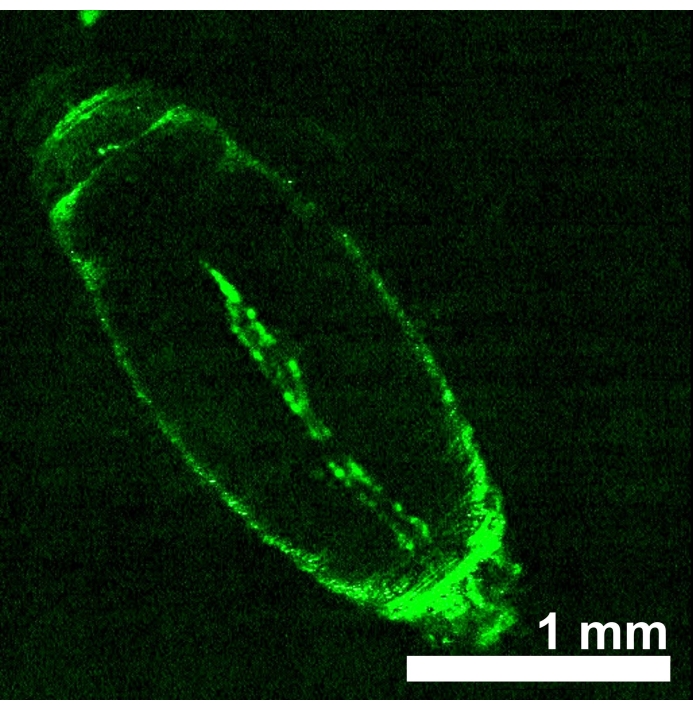
图 4:由汉德-GAL4 (BDSC 48396) 驱动的黑色素早蛹表达 UAS-GFP (BDSC 6658)。荧光模式证实了Hand-GAL4驱动器的心脏特异性。请点击此处查看此图的大图。
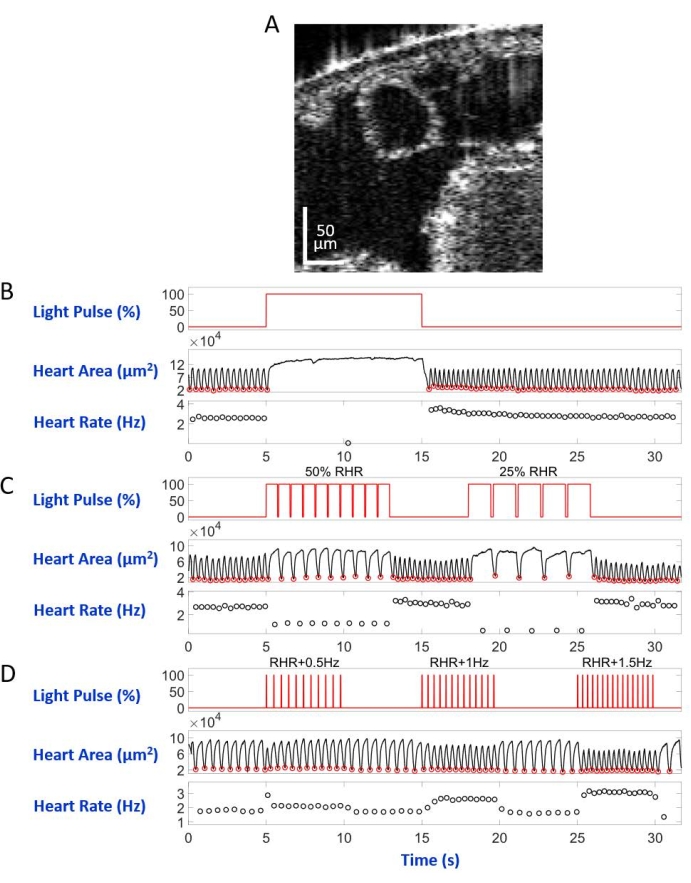
图 5: 模拟黑腹 角龙幼虫的心脏骤停、心动过缓和心动过速。 (A) OCT幼体横截面的图像。心脏在身体表面下方显示为一个圆圈。(B)可恢复性心脏骤停的图形演示。上图显示红光照明的时序(X 轴)(Y 轴,光源功率水平百分比)。中间面板表示心脏区域(Y轴,平方微米)随时间(X轴)的变化。下图显示了心率随时间(X 轴)的变化(Y 轴,赫兹)。(C)eNpHR2.0介导的可恢复性心动过缓的图形显示。上图显示红光照明的脉冲,诱发两个心动过缓期:RHR的50%和RHR的25%。心脏区域和心率变化分别显示在中间和下面板上。(D)通过激活的ReaChR来显示心脏起搏的图形。上图显示了在 RHR + 0.5 Hz、RHR + 1 Hz 和 RHR + 1.5 Hz 频率下发生的一系列 20 ms 红光脉冲。心脏收缩遵循光脉冲频率,如中下面板所示。 请点击此处查看此图的大图。
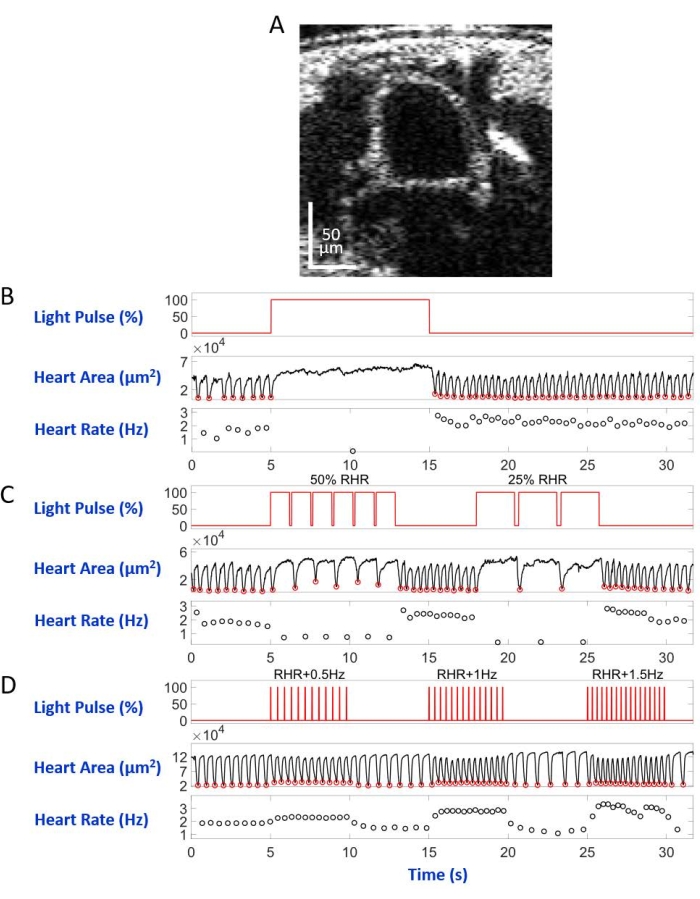
图 6:黑 腹 双歧杆菌蛹中心脏骤停、心动过缓和心动过速的模拟 (A) 蛹体横截面的 OCT 图像。心脏在身体表面下方显示为一个圆圈。(B)可恢复性心脏骤停的图形演示。上图显示红光照明的时序(X 轴)(Y 轴,光源功率水平百分比)。中间面板表示心脏区域(Y轴,平方微米)随时间(X轴)的变化。下图显示了心率随时间(X 轴)的变化(Y 轴,赫兹)。(C)eNpHR2.0介导的可恢复性心动过缓的图形显示。上图显示红光照明的脉冲,诱发两个心动过缓期:RHR的50%和RHR的25%。中下面板分别显示心脏区域和心率变化。(D)通过激活的ReaChR来显示心脏起搏的图形。上图显示了一系列 20 ms 红光脉冲,频率为 RHR + 0.5 Hz、RHR + 1 Hz 和 RHR + 1.5 Hz。心脏收缩遵循光脉冲的频率,如中下面板所示。 请点击此处查看此图的大图。
补充图1:用TM6 Sb Tb替换TM3 Sb平衡染色体的遗传杂交。 处女雌性 手-加仑4 w+/ TM3 Sb 与 核-加仑4NP3537 浴缸-GAL80ts w+/ TM6 Sb Tb 雄性杂交。选择 Hand-GAL4 w+/ TM6 Sb Tb 后代,包括处女雌性和雄性(筛查色素沉着的眼睛和结实的体型)。选定的苍蝇被自我杂交以建立稳定的种群。 请按此下载此档案。
补充图2:在对照实验中,野生型(wt)幼虫的心律在红光照射下不会改变。 (A)在wt幼虫的红光照射期间没有观察到心脏骤停。上图显示 M 模式心脏图像。红线表示照明时间。中下面板显示了32秒成像时间内的心脏区域和心率。(乙、丙)红光脉冲不会改变wt幼虫的心率。上图显示 M 模式心脏图像。红线表示照明时间。中下面板显示了32秒成像时间内的心脏区域和心率。 请按此下载此档案。
补充图3:在对照实验中,野生型(wt)蛹的心律在红光照射下不会改变。 (A)在wt幼虫的红光照射期间没有观察到心脏骤停。上图显示 M 模式心脏图像。红线表示照明时间。中下面板显示了32秒成像时间内的心脏区域和心率。(乙、丙)红光脉冲不会改变wt蛹的心率。上图显示 M 模式心脏图像。红线表示照明时间。中下面板显示32秒成像时间内的心脏区域和心率。 请按此下载此档案。
补充图4:黑色 食虫 幼虫和表达 手>eNpHR2.0 或 手>ReaChR 在没有红光照明的情况下在OCT成像期间不显示显着的HR变化。 (A) 手>ENpHR2.0 幼虫的心率。(B) 手>脉轮幼虫的 心率。(C) 手>的心率。 (D) 手>蛹的 心率。 请按此下载此档案。
补充视频1:激活的eNpHR2.0导致黑色食虫幼虫心脏骤停。请按此下载此影片。
补充视频2:激活的eNpHR2.0导致黑色素蛹的心脏骤。请按此下载此影片。
补充视频3:eNpHR2.0介导的黑色食虫幼虫可恢复性心动过缓。请按此下载此影片。
补充视频4:eNpHR2.0介导的黑腹角蛹可恢复性心动过缓。请按此下载此影片。
补充视频5:通过激活黑色腹足衣原体幼虫的ReaChR来踱步。请按此下载此影片。
补充视频6:通过激活黑腹蛹中的ReaChR来蛊动心脏起搏。请按此下载此影片。
讨论
与我们之前的报告相比,视蛋白的表达不仅在心脏中驱动,而且在周围的肌肉组织中驱动,本工作报告使用心脏特异性驱动因素 Hand-GAL4。这种用于光遗传学心脏调节的 新型Hand> 视蛋白遗传构型进一步证实了以前报道的结果,并建立了更好的 果蝇 心血管研究模型。
培养基制备对于实验的成功至关重要。视蛋白需要配体,全反式视黄醛(ATR)才能起作用28。苍蝇不能产生足够的ATR,因此ATR必须补充到苍蝇介质中。在这项研究中,先前报道的速食食品被半定义培养基29所取代。引入了含ATR的培养基的新配方,以确保ATR的均匀分布。ATR不溶于水;当乙醇基100 mM ATR储备物质添加到水基介质中时,它通过涡旋含有温暖的半定义介质的小瓶来分散。此外,先前报告的ATR浓度从eNpHR2.0的10 mM和ReaChR22 的3 mM降低到两者的1 mM最终浓度。该浓度足以确保适当的eNpHR2.0和ReaChR功能。
实验成功的一个重要组成部分是使用FlyNet 2.027改进了数据处理。该实验室继续开发该软件,以提高自动飞行心脏分割算法的计算效率和准确性。该软件产生的横截面罩用于获取 果蝇 生理数据,例如分数缩短和心壁速度。这种方法能够以最少的人工监督实现高效的数据分析,从而更快,更可靠地表征大型飞行心脏成像数据集的心脏功能。
心肌梗死仍然是死亡的主要原因,心肌缺血占所有心力衰竭病例的三分之二,心力衰竭在美国迅速成为死亡和发病的主要原因之一30。新疗法和医疗设备的开发需要在生理和生化水平上深入了解心脏疾病的机制。这些目标可以在模式生物的帮助下实现。 D.黑色气体 已成为最可靠和最高效的模型之一31,32,33,34,35。这项工作已经生成了由非侵入性光遗传学方法诱导的模拟 果蝇 心脏疾病模型。非侵入性光学心脏起搏技术的发展为开发传统电动心脏起搏装置的替代方案提供了基础。使用OCT实时观察心脏功能,使研究能够准确地表征 果蝇 模型中的相关心脏生理学,以进行高级研究,包括候选药物筛查。OCT成像的穿透深度约为1毫米,这适用于 果蝇 心脏研究,但限制了其在大型动物模型中表征心脏功能的使用。此外,将 果蝇 研究直接转化为哺乳动物模型也是一项挑战。需要开发新的光遗传学工具来提高视蛋白的灵敏度,并将其转化为各种模型系统,包括斑马鱼,小鼠,大鼠和人类心脏类器官,用于心血管研究。
披露声明
作者没有什么可透露的。
致谢
作者感谢安德烈·科马罗夫、王宇轩和朱建涛在数据分析方面的帮助,并感谢周氏实验室成员的宝贵讨论。周博士实验室的工作得到了圣路易斯华盛顿大学的启动基金,美国国立卫生研究院(NIH)的资助R01-EB025209和R01-HL156265以及Clayco基金会创新研究奖的支持。
材料
| Name | Company | Catalog Number | Comments |
| All-trans retinal | Cayman Chemicals | 18449 | |
| Bacto Peptone | Gibco | 02-10-2025 | |
| BioLED Light Source Control Module, 4-channel | Migtex Systems | BLS-SA04-US | Part of the optogenetic stimulation module |
| Broadband Light Source Module | Superlum | cBLMD-T-850-HP | Part of the SD-OCT imaging system |
| Cobra-S 800 OCT Spectrometers | Wasatch Photonics | CS800-840/180-80-OC2K-U3 | Part of the SD-OCT imaging system |
| Delicate Task Wipers | Kimberly-Clark Professtional | 34155 | tissues |
| Drosophila agar | Genesee Scientific | 66-103 | |
| Drosophila culture bottles | Genesee Scientific | 32-131 | |
| FlyNet 2.0 Software | Z-Lab | Custom software for fly heart segmentation and heart function analysis developed in the Zhou lab | |
| High-Power LED Collimator Sources | Migtex Systems | BLS-LCS-0617-03-22 | Part of the optogenetic stimulation module |
| Inactive dry yeast | Genesee Scientific | 62-106 | |
| Microscope slides | AmScope | BS-72P | |
| Narrow plugs for Drosophila culture | Genesee Scientific | 59-200 | |
| Narrow vials for Drosophila culture | Genesee Scientific | 32-116SB | |
| Permanent double-sided tape | Scotch | ||
| Plugs for Drosophila bottles | Genesee Scientific | 59-194 | |
| Propionic Acid | Sigma | P1386-1L | |
| SD-OCT control software | Z-Lab | Custom software for image acquisition and pacing control developed in the Zhou lab | |
| SD-OCT imaging and optogenetic pacing system | Z-Lab | Imaging and optogenetic pacing system developed in the Zhou lab (~$50k BOM) | |
| Sucrose | Carolina | 89-2871 | |
| w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2 | Bloomington Drosophila Stock Center (BDSC) | stock # 41752 | eNpHR2.0 transgenic line |
| w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO | Bloomington Drosophila Stock Center (BDSC) | stock # 53748 | ReaChR transgenic line |
| w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] | Bloomington Drosophila Stock Center (BDSC) | stock # 48396 | Heart specific GAL4 driver containing Hand gene regulatory fragment |
| y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 | Bloomington Drosophila Stock Center (BDSC) | stock #6658 | GFP reporter line |
| Yeast extract | Lab Scientific bioKEMIX | 978-907-4243 |
参考文献
- Nature Methods. Method of the Year 2010. Nature Methods. 8, 1(2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Tsai, H. -C. Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science. 324 (5930), 1080-1084 (2009).
- Wykes, R. C., et al. Optogenetic and potassium channel gene therapy in a rodent model of focal neocortical epilepsy. Science Translational Medicine. 4 (161), (2012).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nature Reviews Cardiology. 18 (5), 349-367 (2021).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Arrenberg, A. B., Stainier, D. Y. R., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Nussinovitch, U., Gepstein, L. Optogenetics for in vivo cardiac pacing and resynchronization therapies. Nature Biotechnology. 33 (7), 750-754 (2015).
- Nyns, E. C. A., et al. An automated hybrid bioelectronic system for autogenous restoration of sinus rhythm in atrial fibrillation. Science Translational Medicine. 11 (481), (2019).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342 (1), 1-11 (2004).
- Wolf, M. J., Amrein, H., Izatt, J. A., Choma, M. A., Reedy, M. C., Rockman, H. A. Drosophila as a model for the identification of genes causing adult human heart disease. Proceedings of the National Academy of Sciences of the United States of America. 103 (5), 1394-1399 (2006).
- Yu, L., Lee, T., Lin, N., Wolf, M. J. Affecting rhomboid-3 function causes a dilated heart in adult Drosophila. PLOS Genetics. 6 (5), 1000969(2010).
- Cooper, A. S., Rymond, K. E., Ward, M. A., Bocook, E. L., Cooper, R. L. Monitoring heart function in larval Drosophila melanogaster for physiological studies. Journal of Visualized Experiments. (33), e1596(2009).
- Zhu, Y. C., Yocom, E., Sifers, J., Uradu, H., Cooper, R. L. Modulatory effects on Drosophila larva hearts: Room temperature, acute and chronic cold stress. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology. 186 (7), 829-841 (2016).
- Zhu, Y. C., Uradu, H., Majeed, Z. R., Cooper, R. L. Optogenetic stimulation of Drosophila heart rate at different temperatures and Ca2+ concentrations. Physiological Reports. 4 (3), 12695(2016).
- Malloy, C., et al. Using optogenetics to assess neuroendocrine modulation of heart rate in Drosophila melanogaster larvae. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 203 (10), 791-806 (2017).
- Men, J., et al. Drosophila preparation and longitudinal imaging of heart function in vivo using optical coherence microscopy (OCM). Journal of Visualized Experiments. (118), e55002(2016).
- Choma, M. A., Izatt, S. D., Wessells, R. J., Bodmer, R., Izatt, J. A. In vivo imaging of the adult Drosophila melanogaster heart with real-time optical coherence tomography. Circulation. 114 (2), 35-36 (2006).
- Li, A., et al. Changes in the expression of the Alzheimer's disease-associated presenilin gene in drosophila heart leads to cardiac dysfunction. Current Alzheimer Research. 8 (3), 313-322 (2011).
- Li, A., et al. Silencing of the Drosophila ortholog of SOX5 in heart leads to cardiac dysfunction as detected by optical coherence tomography. Human Molecular Genetics. 22 (18), 3798-3806 (2013).
- Men, J., Li, A., Jerwick, J., Li, Z., Tanzi, R. E., Zhou, C. Non-invasive red-light optogenetic control of Drosophila cardiac function. Communications Biology. 3 (1), 1-10 (2020).
- Alex, A., Li, A., Tanzi, R. E., Zhou, C. Optogenetic pacing in Drosophila melanogaster. Science Advances. 1 (9), 1500639(2015).
- Stanley, C. E., Mauss, A. S., Borst, A., Cooper, R. L. The effects of chloride flux on Drosophila heart rate. Methods and Protocols. 2 (3), 73(2019).
- Lindsley, D. L., Zimm, G. G. The Genome of Drosophila melanogaster. , Elsevier. (1992).
- Bloomington Drosophila Stock Center. , Available from: https://bdsc.indiana.edu/information/recipes/germanfood.html (2022).
- Dong, Z., et al. FlyNet 2.0: Drosophila heart 3D (2D + time) segmentation in optical coherence microscopy images using a convolutional long short-term memory neural network. Biomedical Optics Express. 11 (3), 1568-1579 (2020).
- Deisseroth, K. Optogenetics. Nature Methods. 8 (1), 26-29 (2011).
- Backhaus, B., Sulkowski, E., Schlote, F. W. A semi-synthetic, general-purpose medium for Drosophila melanogaster. Drosophila Information Service. 60, 210-212 (1984).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56(2019).
- Wolf, M. J., Rockman, H. A. Drosophila, genetic screens, and cardiac function. Circulation Research. 109 (7), 794-806 (2011).
- Choma, M. A., Suter, M. J., Vakoc, B. J., Bouma, B. E., Tearney, G. J. Physiological homology between Drosophila melanogaster and vertebrate cardiovascular systems. Disease Models & Mechanisms. 4 (3), 411-420 (2011).
- Ocorr, K., Vogler, G., Bodmer, R. Methods to assess Drosophila heart development, function and aging. Methods [Supplement to Methods in Enzymology]. 68 (1), 265-272 (2014).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Rotstein, B., Paululat, A. On the morphology of the Drosophila heart. Journal of Cardiovascular Development and Disease. 3 (2), 15(2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。