需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用于动态界面共聚焦显微镜可视化的微量天体测量仪
摘要
本手稿描述了微量血压计/共聚焦显微镜的设计和操作,以便在可视化界面形态的同时测量界面张力和表面膨胀流变学。这提供了在技术和生理学中重要的界面的结构 - 属性关系的实时构建。
摘要
表面活性分子对流体 - 流体界面的吸附在自然界中无处不在。表征这些界面需要测量表面活性剂吸附速率,评估平衡表面张力作为块体表面活性剂浓度的函数,并关联表面张力如何随平衡后界面面积的变化而变化。使用荧光成像和高速共聚焦显微镜同时对界面进行可视化,可以直接评估结构 - 功能关系。在毛细管压力微量计(CPM)中,将半球形气泡固定在毛细管末端的1 mL液体储液器中。通过商业微流体流量控制器控制穿过气泡界面的毛细管压力,该控制器允许基于模型的压力、气泡曲率或基于拉普拉斯方程的气泡面积控制。与以往的Langmuir槽和吊坠落技术相比,测量和控制精度和响应时间大大提高;毛细管压力变化可以在几毫秒内应用和控制。气泡界面的动态响应通过第二个光学透镜可视化,因为气泡膨胀和收缩。气泡轮廓拟合到圆形轮廓,以确定气泡曲率半径 R,以及任何会使结果无效的圆度偏差。拉普拉斯方程用于确定界面的动态表面张力。平衡后,计算机控制的微流体泵可以施加小的压力振荡来振荡气泡半径(频率为0.001-100个周期/分钟),以确定膨胀模量系统的整体尺寸足够小,以至于微秒计适合高速共聚焦显微镜的透镜下,允许以亚微米横向分辨率定量跟踪荧光标记的化学物质。
引言
表面活性剂薄膜覆盖的空气-水界面在日常生活中无处不在。表面活性剂-水注入用于提高枯竭油田的采收率,并用作页岩气和石油的水力压裂解决方案。气液泡沫和液液乳液在许多工业和科学过程中作为润滑剂和清洁剂很常见,在食品中很常见。界面处的表面活性剂和蛋白质在包装、储存和给药过程中稳定抗体构象1,2,3,4,5,眼睛中的泪膜稳定性6,7,8 和肺力学9,10,11,12,13,14,15.
表面活性剂或表面活性剂吸附到界面及其性质的研究有着悠久的历史,具有许多不同的实验技术16,17,18,19,20,21,22,23,24,25,26,27.最近的发展是毛细管压力微量血压计(CPM),它允许在更小的长度尺度上检查高度弯曲界面上的界面性质,同时使用的材料明显少于其他常用方法9,23,24,25。共聚焦荧光显微镜(CFM)可用于研究CPM 22中气水界面或Langmuir槽20,26,27,28,29处脂质和蛋白质的形态。在这里,CPM和CFM相结合,将形态现象与动态和平衡界面性质联系起来,以发展生物和技术界面的结构 - 功能关系。
在界面表面活性剂系统中有许多重要的参数可供CPM-CFM使用。在CPM中,将直径为30-200μm的气泡固定在玻璃毛细管的尖端。在CPM的早期版本中,气泡内部和外部之间的毛细管压差 通过 水柱和振荡注射泵9,30 控制;这里描述的新版本用更高精度的计算机控制微流体泵取代了这些。表面张力(γ) 通过 拉普拉斯方程ΔP = 2γ / R确定,该方程由泵ΔP设置的界面上的压降和对气泡曲率半径R的光学分析确定。在与含有可溶性表面活性剂的散装液体接触时产生新气泡后,界面的动态表面张力可以用10 ms的时间分辨率确定。表面活性剂的吸附动力学可以用经典的Ward-Tordai方程10,31 来描述,以确定表面活性剂的基本性质,包括扩散率,表面覆盖率以及体积浓度与平衡表面张力之间的关系。一旦达到平衡的表面张力,界面面积就可以振荡以测量膨胀模量, 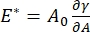 通过记录表面张力的变化,由气泡表面积的微小变化引起, A32。对于发展自己的内部结构(如缠结聚合物或蛋白质)的更复杂的界面,表面张力被更一般的表面应力4,33,
通过记录表面张力的变化,由气泡表面积的微小变化引起, A32。对于发展自己的内部结构(如缠结聚合物或蛋白质)的更复杂的界面,表面张力被更一般的表面应力4,33, 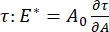 所取代。
所取代。
呼吸期间的肺稳定性可直接与在肺泡气液界面9,10处保持低表面张力和高扩张模量直接相关。所有肺内表面都衬有连续的,微米厚的上皮衬里液膜,以维持组织水合作用34。这种上皮衬里液主要是水,含有盐和各种其他蛋白质,酶,糖和肺表面活性剂。与任何弯曲的液蒸气界面一样,毛细管压力随着肺泡(或气泡)内部压力的升高而诱导。然而,如果肺内各处的表面张力恒定,拉普拉斯方程ΔP = 2γ / R表明,较小的肺泡相对于较大的肺泡具有更高的内部压力,迫使较小肺泡的气体含量流向较大,压力较低的肺泡。这被称为"拉普拉斯不稳定性"9,35。最终结果是,最小的肺泡会塌陷并充满液体,变得难以再充气,导致部分肺塌陷,其他部分会过度充气,这两者都是急性呼吸窘迫综合征(ARDS)的典型症状。然而,在功能正常的肺中,随着肺泡界面区域的空气 - 上皮流体界面在呼吸过程中扩张和收缩,表面张力动态变化。如果 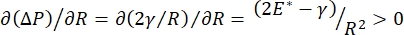 ,或
,或 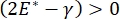 ,拉普拉斯压力随着半径的减小而减小,并随着半径的增加而增加,以消除拉普拉斯的不稳定性,从而稳定肺9。因此,
,拉普拉斯压力随着半径的减小而减小,并随着半径的增加而增加,以消除拉普拉斯的不稳定性,从而稳定肺9。因此, 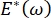 以及它如何依赖于频率、单层形态和组成,以及肺泡液组成可能对肺的稳定性至关重要。CPM-CFM还首次证明了界面曲率对表面活性剂吸附25、单层形貌22 和膨胀模量9的影响。CPM中储液槽体积小(~1 mL)允许快速引入,去除或交换液相,并最大限度地减少所需数量的昂贵蛋白质或表面活性剂10。
以及它如何依赖于频率、单层形态和组成,以及肺泡液组成可能对肺的稳定性至关重要。CPM-CFM还首次证明了界面曲率对表面活性剂吸附25、单层形貌22 和膨胀模量9的影响。CPM中储液槽体积小(~1 mL)允许快速引入,去除或交换液相,并最大限度地减少所需数量的昂贵蛋白质或表面活性剂10。
CPM-CFM图像中的对比度是由于在界面16,27处分布的荧光标记的脂质或蛋白质的一小部分。二维表面活性剂单层通常表现出横向相分离作为表面张力或表面压力的函数, 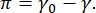 π是清洁的流体 - 流体界面γ0和表面活性剂覆盖的界面的表面张力之间的差异,π γ。在低表面压力下,脂质单层处于液体状无组织状态;这被称为液体膨胀(LE)相。随着表面压力的增加和每个脂质分子的面积减小,脂质彼此定向并且可以经历一阶相变,以长程有序液体凝结(LC)相16,20,27。LE和LC相可以在各种表面压力下共存,并且可以可视化,因为荧光标记的脂质从LC相中排除并分离到LE相。因此,当使用CFM16成像时,LE相位是明亮的,LC相位是暗的。
π是清洁的流体 - 流体界面γ0和表面活性剂覆盖的界面的表面张力之间的差异,π γ。在低表面压力下,脂质单层处于液体状无组织状态;这被称为液体膨胀(LE)相。随着表面压力的增加和每个脂质分子的面积减小,脂质彼此定向并且可以经历一阶相变,以长程有序液体凝结(LC)相16,20,27。LE和LC相可以在各种表面压力下共存,并且可以可视化,因为荧光标记的脂质从LC相中排除并分离到LE相。因此,当使用CFM16成像时,LE相位是明亮的,LC相位是暗的。
本手稿的目的是描述构建和操作组合共聚焦显微镜微量血压计所需的步骤。这将允许读者在微米级的空气/水或油/水界面上同时进行吸附研究,测量表面张力,流变行为并检查界面形态。这包括讨论如何拉动、切割和疏水所需的毛细血管,使用压力、曲率和表面积控制模式的说明,以及将不溶性表面活性剂的界面转移到微量血压计曲面界面。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 毛细管的制备
- 将毛细管放入毛细管拉拔器中,并运行所需的拉拔程序,以制造两个锥形毛细管,其尖端的外径(OD)约为1μm。
注意:拉动前毛细管的外径必须是指定适合微型血压计单元中毛细管支架的外径。毛细管的内径(ID)可以变化,但会影响拉动后毛细管的临界半径。选择拉拔程序,以便所得的锥度最初迅速减小毛细管OD和ID,然后达到所需毛细管OD和ID附近的半径,然后更慢地减小直径。这将产生更大的毛细管长度,可以对其进行评分以产生ID为30-100μm的可用毛细管。 - 在所需位置对毛细管的尖端进行评分,以获得30-100μm的ID并折断尖端。毛细管现在将在尖端具有所需半径的OD和ID(图1A)。毛细血管可以储存到步骤2。
注:毛细管的切割边缘必须为 90° 干净。切割边缘的任何缺陷都会导致气泡与毛细管的固定不良,并且表面性能测量较差。锥形毛细管尖端非常细腻。如果它们与溶液以外的任何东西(例如,小瓶壁,空气喷嘴)接触,它们将被破坏。
2. 毛细管的疏水
- 收集拉出的玻璃毛细管,酸清洗液,塑料镊子,去离子(DI)水,疏水溶液(乙醇中2%硅烷),真空泵和乙醇溶液。有关详细信息 ,请参阅材料表 。
注意:酸性清洁液具有剧毒,会引起皮肤和眼睛腐蚀/刺激,会氧化。疏水溶液是皮肤/眼睛/呼吸道刺激物。戴上护目镜、实验室外套和手套,并在通风橱中使用溶液。 - 对毛细管进行酸洗
注意:对毛细管进行酸洗可去除毛细管内的任何有机残留物,并为硅烷化反应准备玻璃表面,从而使毛细管疏水。- 用镊子将毛细管牢牢地抓住靠近其宽端的毛细管。
- 将锥形尖端浸入酸清洗液中,同时将软管从真空泵连接到毛细管的宽端。这会将溶液吸入毛细管。
注意:移液器吸头可以连接到毛细管软管的末端,以便更好地配合毛细管末端。 - 当酸性清洁溶液充满毛细管的一半时停止。
注意:从酸清洗溶液中取出毛细管尖端后,毛细管外部的溶液通常在毛细管尖端附近形成珠子。轻轻触摸毛细管到溶液小瓶的颈部以除去多余的溶液。 - 让酸清洁溶液在毛细管中保留至少30分钟,确保液体的塞子保持在毛细管的锥形端。
- 用镊子牢牢握住毛细管,并使用真空软管从毛细管的大端拉出液体,从毛细管中取出酸清洗液。
- 冲洗毛细管
- 将毛细管的锥形端浸入去离子水中,确保其浸入足够深的深度以覆盖浸没在酸清洗溶液中的任何外部。当尖端被浸没时,使用真空软管将去离子水拉过毛细管。从水中取出毛细管,并用真空软管除去剩余的水。
- 重复上述步骤至少4x。
- 再次执行步骤2.3,用乙醇代替去离子水。
- 连续抽吸,直到乙醇从毛细管内部完全蒸发。当乙醇开始蒸发时,毛细管会变得浑浊和凉爽,但在30至45秒后会清除。
- 用疏水溶液涂覆毛细管
- 将毛细管的宽端短暂浸入乙醇溶液中〜2%硅烷中。毛细管作用将导致涂层溶液在毛细管内上升。一旦毛细管内约1厘米大小的插头上升,就从溶液中取出毛细管。
- 调整毛细管的方向,使锥形尖端朝下,使涂层溶液随着重力向锥形尖端下降。
- 让涂层溶液在毛细管中保持至少3分钟。
注意:与锥形尖端内部接触的涂层溶液的插头中不得有气泡。如果存在气泡,则毛细管内部很可能在步骤2.5中没有充分干燥。要解决此问题,请根据需要重复步骤 2.4-2.6。
- 以与步骤2.3相同的方式用乙醇1x冲洗毛细管。
- 在毛细管上设置疏水涂层
- 将干净且干燥的闪烁小瓶放入设定为120°C的真空烘箱中。 将涂覆的毛细管放入小瓶中(理想情况下每个小瓶一个毛细管),宽端放在小瓶的底部。让毛细管在烘箱中停留至少6小时(优选过夜),以实现疏水性硅烷层与毛细管的永久结合。毛细血管可以储存到步骤4。
3. 样品制备和储存
- 将表面活性剂和荧光团溶液混合并储存在干净的酸洗小瓶中,以避免污染。
注意:市售脂质必须具有最高纯度,并在-20°C的使用之间储存。 旧的或受污染的脂质通常会导致结果难以重现。
4. 设置微型血压计
- 组装 CPM 单元格, 如图 2 所示。
- 将毛细管的大一侧放入CPM细胞的顶部,直到它推入细胞的下侧。
- 轻轻拧紧PEEK塞子以固定毛细管,然后将管子从微流体泵连接到毛细管的大侧。注意不要触摸锥形毛细管尖端。
- 如有必要,将储液罐交换和/或温度控制软管连接到CPM单元上的相应入口和出口(图2);否则,请插入未使用的入口和出口。
- 将CPM细胞连接到共聚焦显微镜载物台,将其与CFM物镜,CPM相机和CPM光源大致对齐(图3)。
- 在泵的推荐工作压力(此处使用的微流体泵为150 mbar)下打开流向微流体泵的气流,并确保流向毛细管的气流是开放的。
- 在压力控制模式下开始运行 CPM 虚拟接口(补充编码文件 1:微型血压计虚拟 Interface.vi),毛细管压力振荡频率和振幅设置为零(图 4-7)。图 4 显示了虚拟接口的屏幕截图。对于去离子水和毛细管半径为~35μm,~20 mbar的压力可确保没有水进入毛细管。
- 使用移液管用水填充CPM细胞。
- 使用微型血压计相机聚焦毛细管尖端。
- 使用 CFM 将重点放在毛细管尖端上。如果难以找到毛细管,请使用CPM相机找到CFM物镜。这将有助于近似CFM物镜和气泡之间的距离,从而实现正确的工作距离。
- 环空(绿色扇形投影)在气泡上居中后,手动调整焦点,以便可以清楚地看到气泡边缘(图4-3)。
注:环的位置、起始和结束角度以及环的内半径和外半径可通过视图 窗口下方的 菜单进行调整。 - 单击"重置气泡",并确保形成一个新气泡(一个人将能够听到旧气泡的弹出,并且可以从控制面板查看窗口中观察到新气泡;图 4-3)。如果气泡不弹出,请在查看窗口下方的"气泡重置"选项卡中增加"重置压力"或增加"重置延迟时间"。检查表面张力是否在73 mN/ m左右(对于盐水或水/气泡)(图4-9)。
- 通过直接进入细胞的注射器取出水(图3-13),将其清空,然后重新连接。该示例已准备好加载以运行实验。
5. 吸附研究
- 使用高压灭菌的移液器将CPM软件保持在 压力控制 模式下,用所需的样品填充细胞。确保在创建新的气泡界面时,初始表面张力约为73 mN/m。
- 确定新形成的气泡的半径并将该值输入到中心线区域控件中(图4-7),并通过单击"区域控制"选项卡将控件类型更改为区域 控制 (图4-8)。
注意:也可以使用恒压控制,但这会导致气泡半径随着界面表面张力的变化而不断变化。这种变化的区域会使表面活性剂吸附速率的分析复杂化,并导致气泡在研究过程中破裂。 - 开始录制共聚焦视频。
- 单击 重置气泡 (图4-5),然后立即单击 收集数据(图4-6)。按钮上的信号灯将变为绿色。
- 通过滑动 图4-6所示的条形,根据样品的浓度调整数据记录速率。对于较慢的吸附,请使用较慢的记录速率。如果早期需要更高的记录速率,则可以在运行过程中进行调整,但对于长时间的研究,为了减小文件大小,最好是较慢的速率。
- 实验结束后(当达到最终的表面张力平台时),通过选择正确的文件路径(图4-1)并单击"保存"按钮(图4-2)来保存文件。
- 停止并将记录也保存在CFM上。
6. 振荡/松弛研究
- 使用高压灭菌的移液器将样品填充细胞,使CPM软件保持在 压力控制 模式下。确保在创建新的气泡界面时,表面张力约为73 mN/m。
- 等到样品完全吸附到界面上。这可以在吸附研究后直接进行,而不是从新的气泡界面重新开始。
- 通过选择适当的选项卡(图4-8)并输入所需的基线值,振荡%和振荡频率(图4-7),确定振荡是压力振荡,面积振荡还是曲率振荡。
注:锯齿波、方波和三角波区域振荡也可从" 其他区域振荡 "选项卡的下拉菜单中访问。 - 开始录制共聚焦视频,然后单击CPM软件上的 "收集数据"(图4-6)。
- 开始振荡。确保记录至少七个周期以获得最佳结果。选择数据采集速率(图4-6),为每个振荡周期提供足够数量的数据点。
- 如果需要其他振荡幅度或频率,请在实验期间更改值。
- 保存结果,如步骤 5.6 和 5.7 所示。
7. 溶剂交换研究
- 使用高压灭菌的移液器将样品填充细胞,使CPM软件保持在压力控制模式。当创建新的气泡界面时,确保表面张力约为73 mN/m。
注意:吸附和/或振荡研究可以在溶剂交换研究之前进行。 - 将带有所需交换溶液瓶的入口管(图3-11)连接到蠕动泵(图3-10)。
- 在共聚焦软件中开始录制视频,然后单击CPM软件上的 "收集数据 "(图4-6)。
- 设置蠕动泵速度。这将控制流体交换的速率,并且必须根据实验的要求(即需要交换溶剂的速度)进行选择。
- 如果需要更换多种流体,请停止蠕动泵,并将入口连接到另一个交换溶液。
- 交换完成后(约20分钟),保存步骤5.6和5.7中的结果。
8. 不溶性表面活性剂吸附
注意:如果要吸附的表面活性剂不溶于储液器液体,则可以使用此方法将单层从电池的空气/水界面转移到气泡表面。许多双层形成的脂质几乎不溶于盐水溶液,当悬浮在储液槽溶液中时不会自发地吸收到气泡中。
- 使用高压灭菌的移液器将样品填充细胞,使CPM软件保持在 压力控制 模式下。当创建新的气泡界面时,确保表面张力约为73 mN/m。
- 将不溶性表面活性剂的单层沉积在细胞的空气 - 水界面上,从挥发性有机溶液中的溶液中分离出来。使用注射器,在界面处沉积小液滴,并允许溶剂蒸发,留下脂质作为薄膜。
注意:氯仿用作磷脂的溶剂,如磷脂酰胆碱和脂肪酸。铺展溶液通常为每毫升溶剂0.01-0.02mg脂质。氯仿具有急性毒性,可引起皮肤和眼睛刺激,并致癌。戴上适当的护目镜、实验室外套和手套,将溶液放入通风橱中。 - 通过气泡的中心线压力控制(图4-7)减小表面积,直到它几乎变平。这可以防止表面活性剂吸附后气泡破裂。
- 通过直接到细胞的注射器从细胞中取出储液器液体,直到空气/水界面经过毛细管的尖端。虽然可以使用注射泵,但此步骤可以通过手动使用注射器来实现。
- 将储液罐液体高度增加到其初始水平。
注意:吸头重新浸没后,由于表面活性剂现在吸附在界面上,气泡会变大。单层现在可以用于振荡或溶剂交换实验。
9. 清理
- 关闭节能灯。
- 更改为 "压力控制" 模式。
- 使用移液管从细胞中取出样品。用去离子水加载传感器,并将压力调高至~50 mbar,使气泡不断逸出毛细管并清洁毛细管尖端。重复此过程 2x。
- 通过单击左上角的红色按钮关闭安全阀并关闭CPM,关闭浅色和蓝色压力控制面板,然后关闭压力源。
- 从共聚焦显微镜载物台中取出细胞。用乙醇和去离子水冲洗细胞。从CPM细胞中取出毛细管。
10. 清洁电池
- 拆卸电池。在去离子水下冲洗时,用牙刷刷内壁。将部件浸入乙醇中并超声处理约30分钟。
- 用去离子水冲洗所有部件几次。通过用氮气吹气或在真空烤箱内干燥来干燥零件。
11. 振荡分析
- 运行 Dilatational_Rheology_Analysis.m 代码 (补充编码文件 2),选择从 CPM 虚拟界面保存的所需文件。示例数据包含在补充文件中。
- 压力与时间的关系图将如图 1所示。左键单击振荡开始的点,然后再次左键单击振荡结束的位置。如果数据包含多个振荡,请对所有振荡重复此过程。
- 左键单击所有起点和终点后,右键单击任意位置的鼠标。例如,如 补充图 1 所示,可以左键单击点 1、2、3 和 4,然后单击鼠标右键。
注意:代码将计算膨胀模量和相位角,并将结果写入原始文件位置的新.csv文件中。示例数据的结果可以在 补充编码文件 2 中给出的代码结果中看到。MATLAB 还将生成数据的多个图形表示形式,如 补充图 2 所示。
- 左键单击所有起点和终点后,右键单击任意位置的鼠标。例如,如 补充图 1 所示,可以左键单击点 1、2、3 和 4,然后单击鼠标右键。
Access restricted. Please log in or start a trial to view this content.
结果
测量误差的主要来源来自毛细管,这些毛细管在切割过程(图5A,B)或涂层过程(图5D)中具有缺陷。这两种类型的缺陷都会导致光学图像分析系统在确定气泡形状和尺寸时出现错误,从而导致表面张力值不准确。在将毛细管插入CPM之前,在将毛细管拉出并涂覆在光学显微镜下后,仔细检查每个毛细管非常重要。必须丢弃毛细管,但可以对...
Access restricted. Please log in or start a trial to view this content.
讨论
CPM/CFM组合是检查界面动力学、平衡和形态的强大工具。此协议描述了使用 CPM/CFM 获取数据所需的步骤。
图2 显示了带有毛细管、溶剂和热交换通道的电池设计。溶剂交换的入口应位于电池的底部,而出口应位于顶部,以使电池在交换过程中不会溢出。在实践中,同一蠕动泵的入口和出口流量可能略有不同。这种电池设计的一个常见问题是从电池泄漏。?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突要披露。
致谢
所有共聚焦显微镜图像均使用尼康A1RHD多光子直立共聚焦显微镜获得。我们感谢明尼苏达大学成像中心的支持人员,特别是吉列尔莫·马克斯的指导和帮助。这项工作得到了NIH格兰特HL51177的支持。SI得到了露丝·柯尔施泰因NRSA机构研究培训补助金F32 HL151128的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ - cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL - 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
参考文献
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44(2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al. Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. Ramachadran, A., et al. , chap. 7 (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., et al. Surfactant Progress. Nag, K. , New York. (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604(2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. Physical Chemistry of Surfaces, Sixth ed. , Wiley-Interscience. New York. 784(1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14(2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115(2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。