Method Article
通过清除技术对稻田进行深度荧光观察
摘要
本方案描述了一种用于稻芽的清除技术,由于组织的坚硬,厚厚或分层的性质,这些苗很难为内部结构观察做准备。这种方法有助于连续和深入的荧光观察,即使在成年水稻植物中也是如此。
摘要
最近开发的清除技术消除了折射率不匹配并减少了自动荧光材料,使得在三维(3D)中观察植物组织成为可能,同时保持其内部结构。在水稻(Oryza sativa L.)中,一种单子叶植物模型植物和全球重要的作物,已经报道了清除技术在相对容易观察的器官中,如根和叶。清除技术在芽尖分生组织(SAM)和茎中的应用也有报道,但由于清除液(CS)在这些组织中的渗透性差,因此仅在有限的程度上。这些组织中清除溶液的有限效率归因于茎中组织的自发荧光,增厚和硬化,因为血管束和表皮发育以及SAM与憎水性叶子的分层。本方案报告了在发育过程中连续和3D观察从SAM/幼穗到芽基部的基因表达的清除方法的优化。使用振动微切片机将表达荧光蛋白报告的固定组织样品修剪成切片。当达到适当的厚度时,应用CS。通过特异性靶向中央组织,CS的穿透率和均匀性增加,并且使组织透明所需的时间减少。此外,清除修剪的部分,可以从宏观角度观察整个拍摄的内部结构。该方法在难以清除的其他植物物种组织的深成像中具有潜在的应用。
引言
最近开发的清除技术使得在保持其内部结构1,2,3的同时观察植物的深层组织成为可能。在双子叶植物拟南芥中,已经使用清除技术进行了许多荧光蛋白成像研究,以消除折射率不匹配并去除自动荧光材料4,5,6。虽然在水稻(Oryza sativa L.)中已经报道了在水稻(Oryza sativa L.)中使用细胞分辨率9的清除技术,但仅限于相对较薄和柔软的器官,例如根,叶和芽顶分生组织(SAM),这些器官易于观察。
芽是构成维管植物地上部分的主要器官。在水稻中,芽由一系列垂直堆叠的"植物体"组成,包括腋芽,叶子和茎10。在芽的尖端,SAM由中心的未分化干细胞组成。植物体是由来自SAM的细胞分化形成的。在植物从营养阶段转移到生殖阶段后,水稻茎伸长,SAM分化成年轻的穗状10。这种发育变化伴随着茎和SAM /幼穗中各种基因表达的波动。为了了解细胞分化成各种组织的潜在机制,重要的是从结构上观察内部芽组织中的细胞形态和基因表达。然而,由于穿透组织的清除溶液效率低下,芽中茎(节点和节间)的深度成像提出了挑战。茎在与SAM分化后,由于横向生长而立即经历快速的体积增加。由于维管束的增厚和节点血管吻合的水平复合链接,以及水稻芽的高排斥性,水稻节点组织硬化都有助于限制CS在茎10中的渗透。
本研究旨在使用结构性深度荧光技术观察水稻笋组织中基因表达的变化。这项工作优化了水稻的清除方案,以使用共聚焦激光显微镜连续观察从SAM /幼穗到3D结构中基部的基因表达,而不是在平坦的表面上。
研究方案
1. 固定剂溶液的制备
- 将70毫升无菌水转移到玻璃瓶中,加入10克多聚甲醛(PFA)。
注意:PFA是有毒的;因此,建议戴手套。 - 加入2毫升1 N NaOH溶解PFA溶液。
- 在60°C下连续搅拌(300-500rpm)溶解PFA溶液约1小时,直到PFA溶液透明。
- 加入灭菌水,将PFA溶液的体积增加到100 mL。
注意:PFA溶液在使用前是新鲜制备的。此外,储存在4°C的PFA溶液可以使用大约2个月。 - 在取样前,立即将 25 mL 60 mM HEPES (pH 7.4)、3 mL 1 M 蔗糖和 2 mL 无菌水加入 20 mL 10% PFA 中,以制备 50 mL 固定剂溶液。
2. 清算液的制备
- 在50 mL无菌水中称取并混合7.5g脱氧胆酸钠,5g木糖醇和12.5g尿素(参见 材料表)。
注意:在一般的实验室通风室中称量脱氧胆酸钠粉末,以防止空气传播。 - 使用磁力搅拌器溶解成分(步骤2.1)以制备CS。
注:本研究使用内部制备的清除溶液(CS),但也可以使用市售的清除溶液ClearSee(见 材料表)。 - 将CS转移到50 mL锥形管中,并在黑暗中的室温(15-30°C)下储存。
注意:CS 可以存储 1 年以上。
3. 抽样
- 小心地切开根部,不要损坏植物。用水清洗植物以除去污垢。
注意:该方法研究了从三叶期(LS)到标记LS的组织观察。本研究使用水稻品种日本白(Nip)和台中65(T65)在8-10 LS。 - 用手和镊子剥掉旧的外叶。还剩下大约2-3片叶子。
- 使用滑动运动用单刃剃须刀将组织从SAM /年轻的穗部切到基部,以避免压碎细胞(图1A-C)。如果 SAM/幼穗的位置不可见,请将其切得更长。
- 由于稻笋的横截面呈椭圆形(图1D),因此用双刃剃须刀沿其长轴方向薄薄地剃掉椭圆形的一侧(图1E-F)。
注意:此步骤使固定剂溶液更容易穿透样品。水平切割表面使样品更容易粘附在振动的微切片机(参见 材料表)托盘上。 - 通过样品中白色的外观确认SAM /年轻穗的位置(图1G)。修剪掉多余的组织。
注意:样品的长度应调整到可以使用振动微切片机修剪的最大长度。如果样品太长,请将其分成几部分。
4. 样品的固定
- 将1mL固定剂溶液(在步骤1中制备)移液到1.5mL微量离心管中并立即放入样品中。
注意:确保样品量不超过固定剂溶液体积的20%。 - 将一块石蜡膜切成2.5厘米2。将石蜡膜塑造成球状,并将它们放在样品的顶部,以防止它们从固定溶液中漂浮出来。
- 将装有样品的管放入干燥器中。然后,关闭干燥器的盖子并启动真空泵以缓慢地将干燥器内部减压至-0.095 MPa。
- 在−0.095 MPa关闭干燥器后,关闭真空泵并使其在室温下静置30分钟。
注意:真空度使得样品中逐渐出现气泡。 - 稍微打开干燥器,慢慢将其返回到大气压。将干燥器的压力降低至−0.095 MPa,关闭真空泵,并使混合物在室温下静置30分钟。
- 稍微打开干燥器,慢慢将其返回到大气压。如果样品正确固定,则沉入固定溶液中。如果它没有下沉,请再次降低压力。
- 取下石蜡膜,合上盖子,并将管保持在4°C过夜。
注意:样品在固定溶液中固定至少2小时。它可以储存约1周。
5. 修剪固定样品
- 使用不起毛的湿巾从样品中除去多余的固定剂溶液。
注:过量的固定剂溶液会阻止样品正确粘附在托盘上。 - 用即时胶将样品固定在振动的微切片器托盘上。将其放在平边朝下的托盘上,在取样过程中将其剃掉。
注意:由于稻芽的结构,必须从基部向SAM/幼穗修剪。 - 根据固定样本设置修剪条件。
注意:在本研究中,修剪设置为厚,130μm;宽, 15 毫米;频率, 15%;和切割速度,32毫米。 - 使用 RVS 或 FWD 按钮以及 向上 或 向下 按钮调整样品位置。用去离子水填充托盘,直到所有样品浸入。装满托盘后,按 "开始" 按钮。将修剪后的样品放在载玻片上,滴1x PBS。
注意:每次修剪后,将样品的位置移到另一侧,因为硬样品会磨损剃须刀片。 - 在立体显微镜下检查含有目标位点的样品后,将修剪后的样品转移到具有1 mL 1x PBS的多孔板中。
注意:根据样品的大小选择孔的数量。在这项研究中,使用了12孔板。
6. 用清漆溶液处理
- 从多孔板中取出 1x PBS,然后加入新的 1x PBS。让它静置1分钟。
- 删除 1 个 PBS 并添加 CS。
注意:CS的量必须是样品体积的五倍。 - 将含有样品的多孔板放入干燥器中。然后,关闭干燥器的盖子并启动真空泵以缓慢地将干燥器内部减压至-0.09 MPa。
- 在−0.09 MPa关闭干燥器后,关闭真空泵,使其在室温下静置1小时。
- 稍微打开干燥器,慢慢将其返回到大气压。
- 将去离子水倒入井之间的间隙中以防止CS蒸发,将多孔板在室温下存放在黑暗中以进行清除。
注意:每1-2天轻轻摇动多孔板,以扩散叶绿素和其他成分。 - 当 CS 变为绿色时,请将其替换为新的溶液。
7. 用化学染料染色细胞壁
- 将钙氟白色溶液(1 mL,终浓度:澄清溶液中的1mg / mL,参见 材料表)移入多孔板中。将样品置于染料溶液中并孵育1小时。
注意:染料的体积不得超过CS体积的10%。 - 用1mLCS在另一个多孔板中洗涤染色的样品至少1小时。
8. 使用共聚焦激光显微镜观察
- 将一滴CS滴到显微镜载玻片上,并将处理过的(用CS)样品转移到载玻片上。
注意:由于处理过的样品是柔软的,因此必须用镊子小心处理。 - 用玻璃盖玻片覆盖样品,以防止CS蒸发。
注意:CS 容易沉淀。 - 在共聚焦激光显微镜下观察处理过的样品。
注意:观察后,处理后的样品可以返回CS进行进一步的观察。
结果
首先,验证了通过清理处理使成年水稻植物的坚硬和厚厚组织透明化的程度。在9-10 LS处(即穗形成阶段)使用夹子,并使用从幼穗切出的12-16毫米长的组织到芽的基部。这些样品,包括年轻的穗,被固定在固定溶液中,并在清除处理1-4周之前和之后观察(图2)。未修剪的样品在用澄清溶液处理4周甚至3个月后保持绿色,并且不会变得透明(图2A)。在剥离所有叶子的样品中,节间在用CS处理1周后变白,尽管节点保持绿色。该样品在4周后未变得透明(图2B)。在用CS治疗3个月后,只有年轻的穗变得透明。在用CS治疗1周后,除外叶和维管束外,手工修剪的样品变为白色。叶子,幼穗和节间的某些部分变得半透明,但在4周后不透明(图2C)。3个月后,只有幼穗和内叶变得透明。用振动微切片机修剪至130μm厚度的样品在CS处理1周后变为半透明,叶子变为透明。2周后,样品几乎是透明的,4周后保持不变(图2D)。3个月后,样品变得完全透明。
接下来,验证了清除处理允许在8 LS处的T65拍摄中观察基因表达的深度。使用了氮化物色- 氮化物色-三氟甲醚3-毫农绿 (UBQ普朗::NGCN,见 材料表)表达的芽。将组织样品固定在固定溶液中,然后使用振动微切片机将其修剪至130μm厚度。然后将样品置于共聚焦激光显微镜(激光:488nm / 13%,物镜:20x,针孔:0.93 AU,平均:16,检测器增益:800)下,每周在z轴方向上以10μm的间隔观察,从CS治疗0-4周。代表性结果如图 3所示。使用相同的处理对所有数字进行调整,以比较荧光强度。在没有处理的节点中,在−40μm的深度观察微弱的荧光信号(图3A)。CS处理1周后可观察到的深度为-60μm,2周后为-90μm,但在-20μm的深度下,细胞质的自体荧光在两周内均可见。自发荧光在3周后变得有些减弱,4周后不再可见。在3周时在-80μm的深度和4周时在-100μm的深度观察到荧光信号。在节间,在没有CS处理的情况下,在−60μm的深度观察荧光信号(图3B)。CS治疗1周至3周后可观察到的深度为-90μm,4周后为-100μm,但细胞质中的自身荧光在1周后-20μm的深度处是明显的。2周后不再可见自动荧光。在叶子中,在没有CS处理的情况下,在−90μm的深度观察到荧光信号(图3C)。在叶子中观察到的荧光信号比节点和节间更深。然而,荧光信号较弱。在CS处理1周后荧光信号变得清晰,并在-120μm的深度观察到。2周和3周后,在-110μm的深度观察荧光信号,4周后在-120μm的深度观察荧光信号。
最后,观察了转录因子OsMADS1511 与mOrange12 融合的表达,其调节了SAM从营养期到生殖期13的过渡。用OsMADS15-mOrange固定来自10 LS的Nip的组织样品,修剪至130μm厚度,并用CS处理2周。 图4 显示,透明溶液可以同时用于观察天然基因表达和荧光染料染色(钙氟白色)的荧光蛋白(OsMADS15-mOrange)。观察了0至−130μm深度的整个小花,并以3μm的间隔从43个z堆叠图像重建了3D图像(图4E)。

图1:采样位置和处理(A)短日条件下在8 LS处压紧幼苗。(B) 底座的放大视图。(C) 从SAM/幼穗到基部的样品切口。(D) 从 C(插图)开始的椭圆形横截面。(E)用刀片薄薄地剃掉拍摄一侧。(F) 剃须表面薄。(G)显示节间伸长率的样品。箭头指示的白色部分是节点。上淋巴结的上侧有年轻的穗状突起。比例尺: (A) 10 厘米, (B-C,E-G) 1 厘米, (深) 0.5 厘米. 请点击此处查看此图的大图。

图2:组织清除取决于样品厚度和CS处理周期. (A)具有部分芽的未修剪样品,包括年轻的穗。最大厚度:4毫米(B)所有叶子从样品上剥离以暴露幼穗。最大厚度:2.5毫米yp:幼穗,在:节间;箭头表示节点。(C) 手工修剪至1毫米厚度的样品。(D)用振动微切片机修剪至130μm厚度的样品。比例尺:5 mm ,请点击此处查看此图的大图。
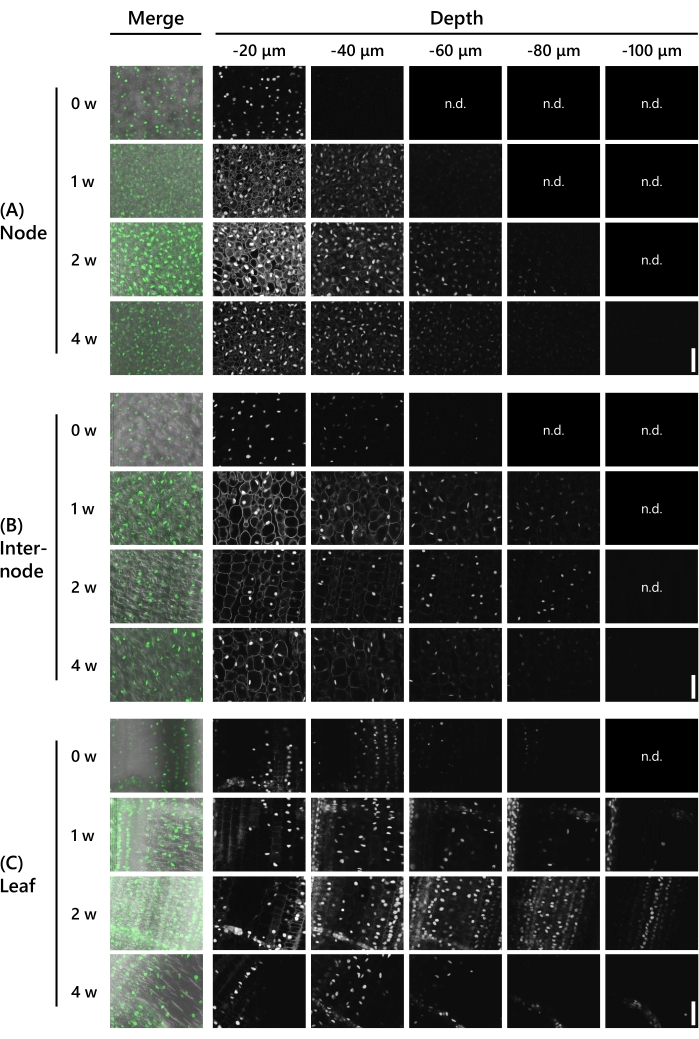
图3:荧光观察的深度取决于组织类型和CS治疗期。在 (A) 节点、(B) 节间和 (C) 叶中对 UBQpro::NGCN 进行深度成像。"合并"表示图像与微分干涉对比度(DIC)图像和所有z-堆栈图像融合。没有观察到荧光的图像被标记为"n.d"。(未检测到)。共聚焦激光显微镜的设置如下:激光:488 nm/13%,物镜:20x,针孔:0.93 AU,平均值:16,检测器增益:800,间隔:10 μm。比例尺:50 μm.请点击此处查看此图的大图。
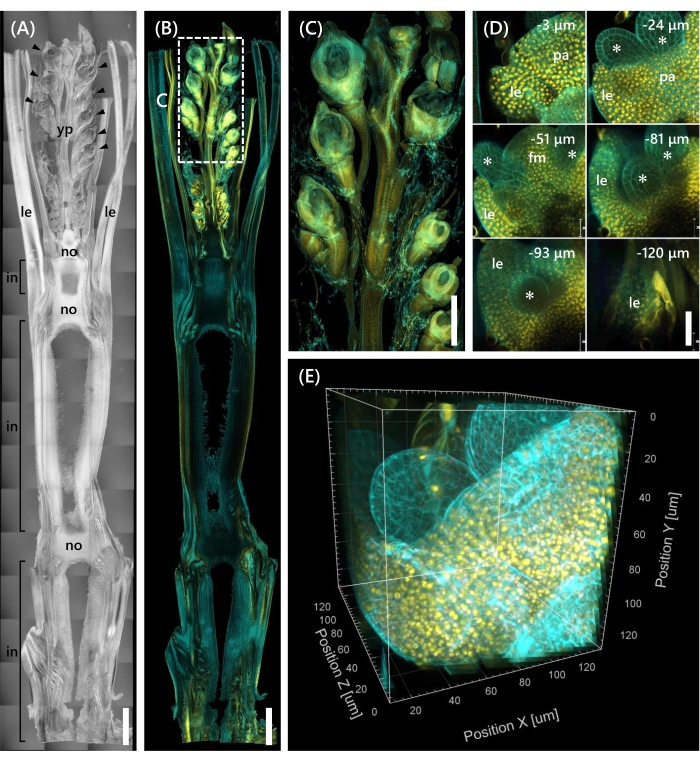
图4:对OsMADS15-m的深度荧光观察(A)10 LS处Nip的DIC图像。yp:幼穗,乐:叶,无:节点,在:节间;箭头表示小花。(B)奥斯玛德15-微量程的荧光图像。黄点表示细胞核处的OsMADS15-m奥儿的荧光蛋白。用钙氟白色溶液将细胞壁染成青色。(C)缩小了幼穗的视野。(D)小花的深度成像。pa: 古植物, le: 引理, fm: 花卉分生组织;星号表示雄蕊原基。共聚焦激光显微镜设置如下:奥斯玛德15-m欧式;激光: 555 nm/13%, 物镜: 20x, 针孔: 0.96 AU, 平均: 16, 探测器增益: 800, 间隔: 3 μm.钙氟白色;激光: 405 nm/3%, 物镜: 20x, 针孔: 0.93 AU, 平均: 16, 探测器增益: 470, 间隔: 3 μm. (E) 图的 3D 图像 (D) 由 z 堆叠图像构成。比例尺: (A-B) 1 毫米, (C) 500 微米, (D) 40 微米. 请点击此处查看此图的大图。
讨论
协议的关键步骤
该协议中的关键步骤是固定和修剪。水稻芽具有坚硬,厚或分层的组织,限制了固定溶液的渗透。为了提高固定溶液的渗透性,在取样时将组织的一侧薄薄地剃须,如图1E-F所示。此外,使用更高的压力重复真空处理两次。此外,将样品在4°C下固定过夜,而不是在4°C下通常的2小时固定。
修剪步骤的关键点是确定要制备的组织厚度,以观察荧光蛋白,同时在CS处理短时间后保留其内部结构。如图 2C所示,即使经过3个月的CS处理,1毫米厚的样品,手工修剪尽可能薄,也仅在有限数量的组织中变得透明。因此,修剪步骤对于成年水稻芽的深度荧光观察至关重要。在这项研究中,将样品修剪至130μm的厚度,如图 2D所示。130μm的厚度允许在CS处理1周后清除叶子,并在2周后清除整个样品。本研究使用了9-10 LS的成年水稻芽。来自年轻稻芽的厚而柔软的组织可以通过CS处理更快地清除。样品的厚度和CS处理的持续时间应根据要观察的3D结构的组织类型,条件和厚度进行调整。
修改和故障排除方法
CS在低温下容易析出。沉淀的CS不能保存荧光蛋白;因此,在适当的温度下储存样品时必须小心。此外,CS和固定液都没有防腐作用;因此,如果被污染,荧光蛋白将被降解。土壤生长的水稻容易真菌生长;因此,必须小心进行样品的取样和处理,以避免污染。
缓冲液中过量的荧光染料可能会发出背景荧光并干扰微观观察。例如,以前使用含有埃文斯蓝色染料的钙氟白色溶液。染色1 h并洗涤1 h后,使用555nm激光观察OsMADS15-mOrange的荧光蛋白。然而,由于来自埃文斯蓝色染料的背景荧光,无法观察到荧光蛋白。通过洗涤样品2小时,这种背景荧光几乎被消除。此外,如果样品过夜,荧光蛋白会更清晰。因此,本研究使用了纯钙氟白色溶液。在观察之前,应使用不同的激光波长检查来自荧光染料的背景荧光。
方法的局限性
如图 3所示,在CS处理2周后,在130μm厚的样品中观察到深荧光蛋白。这与 图2D中所示的结果一致,其中130μm厚的样品在CS处理2周后变得透明。然而,如图 3A所示,细胞质的自体荧光在2周后在淋巴结中仍然明显,并且在CS治疗4周后才完全去除。节点具有高细胞密度,因此需要更长的时间来去除自动荧光材料。
如图 3C所示,在未进行CS处理的叶子中观察到深荧光蛋白,但在相同深度为20μm的节点和节间亮度弱。经过1周的CS处理,荧光蛋白更亮。叶绿素在叶子中含量丰富,吸收488nm的激发光。它们还具有橙色/红色的自动荧光,这可能会干扰使用555nm激光观察荧光蛋白。经过1周的CS处理,去除叶绿素等自发荧光物质,产生高信噪比图像。
在CS治疗2周和4周后可以在组织中观察到的深度没有显着差异,尽管荧光蛋白在4周后显得较弱(图3)。通常,荧光蛋白和自动荧光的亮度会随着时间的推移而减弱,从而导致更高的信噪比。因此,通过调整微观条件和图像处理可以更清楚地观察到荧光蛋白。基于这些结果,得出结论,鉴于我们的样品条件,2周的CS处理可以促进深荧光蛋白的观察。然而,需要4周才能观察到完全排除自动荧光材料的更清晰的图像。
具有强自发荧光的结构,如血管束和多臂细胞,不能在CS中清除。为了在没有自发荧光的情况下观察这些结构,有必要使用时间门控方法12 或通过荧光光谱的光谱学获得图像。如果观察到较厚的组织,双光子显微镜可能更适合观察更深的组织。
该方法相对于现有方法和替代方法的重要性
通常,使用低温恒温器或振动切片观察水稻植物的内部结构。低温恒温器适用于制备薄切片,这使得观察更容易,但是样品的制备和设备操作非常耗时。从薄片重建原始的3D结构也很困难。振动筛操作相对容易,适合生产厚型材。然而,目标组织的厚切片只能观察切割表面,而不能观察光线无法到达的深层组织。由于这些原因,这两种方法都不适合深度荧光观察。
本研究通过结合现有方法,解决了水稻芽中深度荧光观察的挑战,例如CS的组织穿透力有限以及共聚焦显微镜下的物体分辨率差。如图 4所示,我们观察到荧光蛋白(OsMADS15-mOrange)在从幼穗到基部的成年水稻芽的深层组织中表达。 图4D 聚焦于小花,以3μm的间隔显示深荧光蛋白。在CS处理2周后观察到-130μm深度以上的组织,但在没有CS处理的相同大小和生长阶段的小花中仅观察到-27μm深度内的组织(未显示数据)。目前改进的方案不仅可以观察基因的过表达,还可以观察成年稻芽深层组织中的自然基因表达。
该方法在特定研究领域的重要性和潜在应用
该方案优化了成年水稻芽的深度荧光观察,通过修剪掉不必要的组织并增加CS的渗透性,可以有效地清除坚硬,厚或分层的组织。此外,对用于分析的样品的厚度进行了优化,以允许使用共聚焦激光显微镜进行连续和结构化的深度荧光观察,这通常无法解析厚或不透明的组织。
很难比较不同生长阶段的水稻样品,因为荧光蛋白在固定剂和PBS溶液中会随着时间的推移而降解。然而,CS中的荧光蛋白可以储存超过5个月1。CS的保质期长是水稻深度荧光观察的主要优势。
最近,已经开发了许多清除技术,使得在3D中观察深层组织成为可能,同时保留其内部结构。这些技术不断发展,并开发了新的清算解决方案。一个很好的例子是iTOMEI14,它可以有效地去除叶绿素和更亮的荧光检测。另一个例子是ClearSeeAlpha15,它可以防止在清除治疗期间组织褐变并使其看起来透明。将这些清算解决方案与本方法相结合可以允许更高效和有效的清算。
预计目前的方法将有助于通过对水稻和其他植物的深度成像来获得新的见解。
披露声明
作者没有利益冲突需要声明。
致谢
我们感谢寺田R.博士、志谷Z.博士和辻H.博士为我们提供了OsMADS15-m奥兰吉种子;栗原博士为我们提供NGCN建设;和R.沈博士编辑我们的手稿。这项工作由JSPS卡肯希(授权号JP20H05912,20H05778,20H05779)和SATREPS计划(编号:2005779)资助。日本统计局和日本国际协力事业团的摩根大通社1706)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tube | BIO-BIK | ST-0150F | |
| 12-multiwell plate | Corning | 353043 | |
| 50 mL conical tube | Corning | 352070 | |
| Calcofluor white solution | Sigma-Aldrich | 910090 | |
| ClearSee | FUJIFILM Wako Pure Chemical | 031-25151 | This can be made or purchased. |
| Confocal laser microscope | Carl Zeiss | LSM700 | |
| Desiccator | SANPLATEC | Custom made of acrylic. 30 cm (L), 30 cm (W), 14.5 cm (H) | |
| Glass coverslip (18 × 18 No.1) | MATSUNAMI | C018181 | |
| HEPES | FUJIFILM Wako Pure Chemical | 342-01375 | |
| Microscope slide (76 × 26) | MATSUNAMI | S2441 | |
| Paraffin film | Bemis | PM-996 | |
| Paraformaldehyde | FUJIFILM Wako Pure Chemical | 162-16065 | |
| Sodium deoxycholate | Tokyo Chemical Industry | C0316 | |
| Sucrose | FUJIFILM Wako Pure Chemical | 190-00013 | |
| UBQpro::NLS-sGFP-nClover3-mNeonGreen (UBQpro::NGCN) | provided by Dr. Kurihara | ||
| Urea | FUJIFILM Wako Pure Chemical | 211-01213 | |
| Vacuum pump | AS One | AS-01 | |
| Vibrating micro-slicer | DOSAKA | DTK-3000 | |
| Xylitol | FUJIFILM Wako Pure Chemical | 248-00545 |
参考文献
- Kurihara, D., Mizuta, Y., Sato, Y., Higashiyama, T. ClearSee: A rapid optical clearing reagent for whole-plant fluorescence imaging. Development. 142 (23), 4168-4179 (2015).
- Hasegawa, J., et al. Three-dimensional imaging of plant organs using a simple and rapid transparency technique. Plant and Cell Physiology. 57 (3), 462-472 (2016).
- Musielak, T. J., Slane, D., Liebig, C., Bayer, M. A versatile optical clearing protocol for deep tissue imaging of fluorescent proteins in Arabidopsis thaliana. PLoS One. 11 (8), 0161107 (2016).
- Pandey, K. B., et al. Plant roots sense soil compaction through restricted ethylene diffusion. Science. 371 (6526), 276-280 (2021).
- Ejaza, M., Bencivenga, S., Tavaresa, R., Busha, M., Sablowski, R. ARABIDOPSIS THALIANA HOMEOBOX GENE 1 controls plant architecture by locally restricting environmental responses. Proceedings of the National Academy of Sciences of the United States of America. 118 (17), (2021).
- Smetana, O., et al. High levels of auxin signalling define the stem-cell organizer of the vascular cambium. Nature. 565 (7740), 485-489 (2019).
- Chu, T. T. H., et al. Sub-cellular markers highlight intracellular dynamics of membrane proteins in response to abiotic treatments in rice. Rice. 11 (1), 23 (2018).
- Nagaki, K., Yamaji, N., Murata, M. ePro-ClearSee: A simple immunohistochemical method that does not require sectioning of plant samples. Scientific Reports. 7, 42203 (2017).
- Sato, M., Akashi, H., Sakamoto, Y., Matsunaga, S., Tsuji, H. Whole-tissue three-dimensional imaging of rice at single-cell resolution. International Journal of Molecular Sciences. 23 (1), 40 (2022).
- Matsuo, T., Hoshikawa, K. Science of the Rice Plant: Morphology. Food and Agriculture Policy Research Center. , (1993).
- Kobayashi, K., et al. Inflorescence meristem identity in rice is specified by overlapping functions of three AP1/FUL-Like MADS box genes and PAP2, a SEPALLATA MADS box gene. Plant Cell. 24 (5), 1848-1859 (2012).
- Tamaki, S., et al. FT-like proteins induce transposon silencing in the shoot apex during floral induction in rice. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 901-910 (2015).
- Kodama, Y. Time gating of chloroplast autofluorescence allows clearer fluorescence imaging In Planta. PLoS One. 11 (3), 0152484 (2016).
- Sakamoto, Y., et al. Improved clearing method contributes to deep imaging of plant organs. Communications Biology. 5 (1), 12 (2022).
- Kurihara, D., Mizuta, Y., Nagahara, S., Higashiyama, T. ClearSeeAlpha: Advanced optical clearing for whole-plant imaging. Plant and Cell Physiology. 62 (8), 1302-1310 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。