需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
蜜蜂组织中的组织学基础和细胞死亡检测
摘要
免疫组织化学方法可用于蜜蜂研究,以检测和评估成年蜜蜂中肠和下咽腺的细胞凋亡和坏死水平。
摘要
蜂巢内(护士和其他蜂巢蜜蜂)和蜂巢外(觅食者)的蜜蜂(Apis mellifera L.)暴露于气候和天气变化,各种杀虫剂,病原体和营养不良,主要通过口腔进入,主要影响成年蜜蜂的消化道。为了了解和防止这种外部和内部压力源对蜜蜂的影响,一种有用的研究方法是免疫组织化学方法。描述了准备成年蜜蜂的中肠(脑室)和下咽腺(HPG)以进行组织学分析的基本方案。描述了一种详细的方法来评估细胞损伤水平,并将坏死与作为组织再生自然过程的程序性细胞死亡(细胞凋亡)区分开来。介绍了用草酸和杀虫剂(杀虫剂和杀螨剂)处理成年蜜蜂的结果以及脑室和HPG中细胞死亡的测定。还讨论了该方法的优缺点。
引言
蜜蜂(Apis mellifera L.)是其他野生传粉媒介,也是农业植物最重要的传粉媒介。几千年来,不断变化的环境影响了蜜蜂调整其形态、生理、行为和对几种病原体和寄生虫的耐受性。因此,蜜蜂在全球范围内发展出高度多样化的物种和亚种1。这些结果与先前的发现一致,即蜜蜂的消化道结构存在遗传变异,但也表明中肠的改变是由于环境因素2,3。
蜜蜂的消化道有三个主要部分:前肠、中肠(脑室)和后肠4。脑室是消化花粉和花蜜/蜂蜜的重要器官;在后肠中,渗透控制是通过吸收水和离子2进行的。蜜蜂工人的下咽腺(HPG)位于头部,合成和分泌蜂王浆成分,以喂养育雏,蜂王和蜂群成员。它们的大小随着年龄和任务而变化,并取决于适当的营养(优质花粉)。6至18天的护士进行育雏,HPG的大小增加5,6。在觅食蜂中,HPGs退化并仅分泌对将蜂蜜中的复杂糖转化为简单糖(α-葡萄糖苷酶,亮氨酸芳基酰胺酶,转化酶)很重要的酶7。
蜜蜂暴露于几种生物和非生物应激源8,消化道可能受到几种负面兴奋剂的影响。保护生物体免受病原体侵害的第一道屏障是中肠的周养膜,它由肠粘膜组成,以防止病原体4。HPG 的发育和功能取决于饮食、年龄和菌落条件9,并受到杀虫剂、杀螨剂10 和病原体11、12、13 的影响。由于瓦罗亚控制处理和来自环境的杀虫剂,蜂巢中的杀螨剂残留会影响觅食蜂和护士蜂14,15。对蜜蜂群体的最大威胁是螨虫Varroa破坏者,既是导致蜂群损失的病毒载体16,也是宿主肥胖身体(蜜蜂的重要重要器官)的消费者,因此会影响个体的身体和群体功能17。
然而,集约化的农田栖息地可以为蜜蜂提供短期的食物供应。因此,农业环境计划应提高农业景观中蜜花的供应18.为了评估不同亚种6,19,20,21的形态或这些因素在细胞或组织水平上的亚致死作用,特别是中肠和HPG,组织学和免疫组织化学方法是实用的,并且足够准确,可用于蜜蜂的组织学研究。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 蜜蜂研究的基础组织学
- 蜜蜂组织解剖
注意:要解剖工蜂,请使用带LED光源的解剖显微镜。最有用的放大倍率是~20倍。- 操作和解剖
- 小心地用镊子取一只工蜂,并将其放在冰上(或放入-20°C的冰箱)2分钟以固定22。将蜜蜂斜着固定在培养皿上,从左到右和从右到左两次穿过胸部的最上部。
- 倒入昆虫盐水覆盖身体。将培养皿放在显微镜下,聚焦并调整。
- 准备仪器(见 材料表)。
- 中肠解剖
- 从腹部开始,在蜜蜂身体右侧中心的 tergite A5(图 1)下方插入剪刀的一个点。切到特吉特 A2。
- 保持剪刀内刃与身体侧面平行,以免损坏内脏。将剪刀向左转,剪一剪;右转并再次切割。轻轻打开腹部的左侧并固定。在另一侧重复。
- 用一只手用镊子轻轻向上拉蜜蜂胃,另一只手用剪刀在食道的最末端剪开。将胃和中肠从腹部拉开,并在直肠处切开。使用带有昆虫盐水溶液的移液管,并去除任何粪便或组织部分。
- 解剖高分子气质激素
- 按照步骤1.1.1所述将工蜂固定在冰上。切下头部并将其放在较小的板上,触角朝上。用两个销钉固定头部:一个穿过左复眼,第二个穿过右复眼。
- 在针脚内侧的第一个复眼上切开,继续切到盂唇,然后在另一侧穿过第二个复眼进行另一切口(图2)。
- 切断触角。取下面膜,切下仍附着的地方。拿起镊子,小心地去除腺体以及大脑和部分复眼。
- 操作和解剖
- 固定、脱水和石蜡包埋
注意:戴防护手套。- 将组织放入青霉素瓶中,用10%福尔马林填充3/4。保存在4°C的冰箱中。
- 24小时后,在一系列醇中脱水组织:70%,80%,90%,100%,每个1小时,100%2-丙醇1小时,100%2-丙醇12小时,最后100%2-丙醇1小时。
- 将组织放入组织盒中;标记并将它们放入玻璃室中,用2-丙醇和石蜡(1:1)在60°C的培养箱中放置24小时。
- 将组织盒移至另一个装有石蜡(I.)的腔室中24小时。用新鲜石蜡重复该过程两次(II.和III.),均为24小时。
- 最后,准备安装站并开始将组织嵌入蜡中。
- 打开每个历史盒并取下盖子。用蜡填充模具,并小心地将带有温镊子的组织放在模具中间。
- 将组织盒放在模具上,并用蜡轻轻覆盖。立即将模具放在安装站的冷表面上几秒钟,然后将其放在冷板上几分钟,直到蜡变硬并与模具和组织盒一起分离。
- 将完成的样品存放在盒子中,远离灰尘和热量。
- 在切片机上切割4μm薄片:首先,两个切片相互连接,然后一个分开。用镊子转移切片并让它们漂浮在蒸馏水(42°C)上,然后将它们收集在干净的载玻片上,将两个部分放在物镜的左侧,第三个部分放在右侧,保持明显分开。将标记的载玻片在加热设备上过夜,最后将它们存放在专用于组织学样品的盒子中。
- 脱蜡和补水
注意:戴防护手套。- 准备九个科普林罐,并将切片放入一系列清除剂(I.,II.,III.)中,每个5分钟。
- 放入2-丙醇、乙醇96%(I.,II.)、酒精90%和80%和蒸馏水各3分钟。
- 用苏木精和伊红染色
注意:戴防护手套。- 准备六个科普林罐。
- 对于苏木精和伊红(H&E)染色,将脱蜡,再水化的切片放入苏木精中5分钟,然后小心地将它们放在流动的自来水中2分钟。然后将它们放入蒸馏水中1分钟,伊红4分钟(对于伊红,不需要Coplin罐)。
- 将载玻片置于96%乙醇中1分钟,然后2-丙醇放置2分钟,最后放入清除剂中2分钟。
- 加入安装介质和盖玻片,让它们干燥。在光学显微镜下观察。
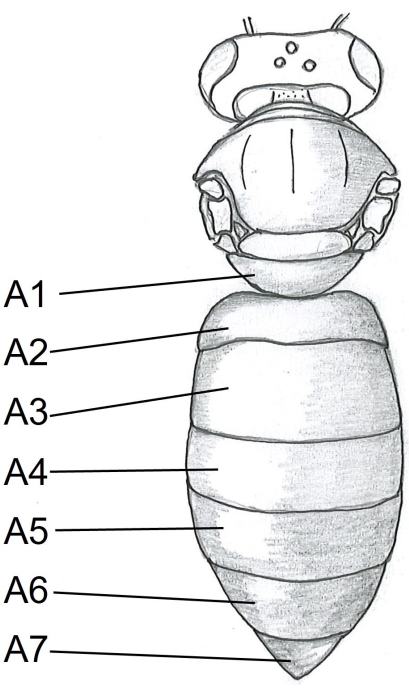
图1:蜜蜂身体的背视图。 A1-A7 三分。有关蜜蜂解剖的详细说明可以在Carreck等人24中找到。 请点击此处查看此图的大图。
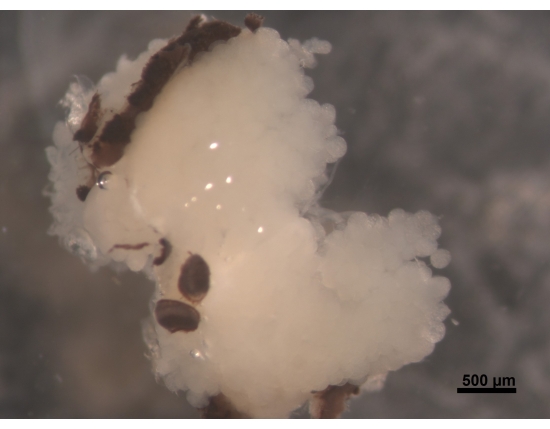
图2:HPG的背视图,复眼的一部分附着在大脑上(不可见)。 一只 5 到 6 天的年轻工蜂有丰满和乳白色的 HPG。腺泡位于大脑上,并用到达大脑后部的分支填充头部区域。在觅食的蜜蜂中,这些腺体大大缩小,只留下细线状的残骸。出于这个原因,最好将腺体与大脑一起切除,以便在进一步的手术中更容易避免失去组织。比例尺 = 500 μm。 请点击此处查看此图的大图。
2. 组织切片细胞死亡检测
- 细胞凋亡检测试剂盒(检测A)
注意:请遵循制造商的协议(请参阅 材料表)。- 准备科普林罐。
- 脱蜡和再水化后(参见步骤1.3),将载玻片浸入0.85%NaCl溶液中,然后浸入磷酸盐缓冲盐水(PBS)(5分钟)。
- 将载玻片放入4%多聚甲醛中2 x 15分钟。
- 将载玻片平放在容器中,加入 100 μL 蛋白酶 K (20 μg/mL) 溶液,然后放置 10-30 分钟。
- 将载玻片放入PBS(5分钟)。
- 将载玻片放入PBS中的4%多聚甲醛中(5分钟)。
- 将幻灯片浸入PBS中(2 x 5分钟)。
- 将载玻片平放在容器中,加入 100 μL 平衡缓冲液,静置 5-10 分钟。
- 加入 100 μL TdT 反应混合物。将纸巾放在容器内,在载玻片周围,用水润湿毛巾,然后用保鲜膜盖住。将载玻片在37°C孵育60分钟。
- 将载玻片放回染色架中,浸入2x盐水 - 柠檬酸钠(SSC)中15分钟。
- 将载玻片浸入PBS中3 x 5分钟,然后在0.3%过氧化氢中浸入3-5分钟,然后再次浸入PBS中,3 x 5分钟。
- 再次,将载玻片平放在容器中,加入 100 μL 链霉亲和素 HRP(辣根过氧化物酶),静置 30 分钟(用保鲜膜覆盖)。
- 将载玻片浸入PBS中3 x 5分钟。
- 将载玻片平放在容器中,加入 100 μL 3,3'-二氨基联苯胺 (DAB) 溶液。寻找浅棕色背景。
- 将载玻片放回架子上,在水中清洗几次(双蒸)。
- 将载玻片安装在安装介质中的玻璃盖玻片下,并平放晾干。
- 在光学显微镜下观察。
- 细胞凋亡检测试剂盒(检测 B)
注意:请遵循制造商的协议(请参阅 材料表)。- 准备科普林罐。
- 制备蛋白酶K(在PBS中稀释的20μg/ mL)。
- 脱蜡和再水化切片(步骤1.3)后,将载玻片放入PBS中5分钟。
- 将载玻片平放在容器中,加入蛋白酶K(20μg/ mL,每5cm²样品60μL)。
- 在蒸馏水中清洗载玻片2 x 2分钟。
- 在室温下在内源性过氧化物酶(3%氢过氧化物酶中)中淬灭。
- 用PBS或水冲洗载玻片2 x 5分钟。
- 将载玻片平放在容器中,并在室温下应用平衡缓冲液(75μL / 5 cm2)10秒。
- 小心地擦拭纸巾周围。
- 向每个部分加入TdT酶(末端脱氧核苷酸转移酶),并在37°C下在加湿室中孵育1小时。 将纸巾放在托盘内,在幻灯片周围,用水润湿毛巾,并用保鲜膜盖住。
- 孵育后,将标本放入架子中,并将其留在停止/洗涤缓冲液中(10分钟)。
- 将抗地高辛偶联物加热至室温。
- 在PBS中清洗载玻片(3 x 1分钟)。
- 小心地擦拭纸巾周围。
- 向切片中加入两滴抗地高辛-过氧化物酶偶联物(65μL / 5cm²),并在加湿的容器中孵育30分钟。
- 在PBS中洗涤4 x 2分钟后,制备工作强度的过氧化物酶底物,轻轻敲击多余的液体并在切片周围吸出。
- 用过氧化物酶底物(75μL / 5cm²)覆盖切片并染色5分钟。将载玻片放在显微镜下并确定最佳染色时间。
- 在蒸馏水中的染色架中清洗载玻片(3 x 1分钟)。
- 将载玻片在蒸馏水中孵育5分钟。
- 使用苏木精复染2分钟。
- 将载玻片放在流动的自来水中3分钟。
- 用蒸馏水清洗载玻片。
- 将载玻片安装在安装介质中的玻璃盖玻片下,并平放晾干。
- 在光学显微镜下观察。
- 细胞凋亡检测试剂盒(检测C)
注意:请遵循制造商的协议(请参阅 材料表)。- 准备科普林罐。
- 对组织切片进行脱蜡和再水化(见步骤1.3)。
- 用蛋白酶K孵育组织(在37°C下孵育15-30分钟)。
- 将载玻片放回架子上,在PBS中冲洗2次。
- 盖上 50 μL 的"TUNEL 反应混合物"。将湿纸巾放入容器内,用保鲜膜覆盖,并在37°C下放置60分钟。
- 用 PBS 冲洗 3 次。
- 将载玻片放入容器中并干燥组织样品周围的区域。
- 向样品中加入 50 μL 转换器-AP,并在 37 °C 下在加湿容器中孵育 30 分钟。
- 在PBS中冲洗3次。
- 加入 50-100 μL 底物溶液,在黑暗中放置 10 分钟。
注意:在光学显微镜下观察染色。 - 用PBS冲洗载玻片3次。
- 通过将切片转移到苏木精中2分钟,然后在流动的自来水中仔细冲洗5分钟来进行复染。
- 将载玻片安装在水性封片介质中的玻璃盖玻片下,并使其平放干燥。
- 在光学显微镜下观察。通过在光学显微镜下计数中肠或HPG的每个样品中的70至100个细胞来评估受影响的(阳性)细胞。
Access restricted. Please log in or start a trial to view this content.
结果
中肠细胞死亡检测
来自卢布尔雅那斯洛文尼亚农业研究所实验养蜂场的新出现的工蜂(Apis mellifera carnica)用3%草酸(OA)单独处理23。OA经常用于养蜂业,用于 瓦罗阿析构函数 控制。治疗后,将工蜂(每组三只)固定在冰上。解剖中肠并将其固定在10%福尔马林中。然后将组织在一系列酒精溶液中脱水,最后包埋在石蜡中。用切片机切成7μm薄片后,制?...
Access restricted. Please log in or start a trial to view this content.
讨论
在生物体中,细胞死亡被定义为细胞凋亡或坏死25,并可伴有自噬26。凋亡细胞和坏死细胞之间的区别在于,细胞凋亡是程序性细胞死亡的一种形式,出现在正常细胞中,而坏死是由于致命条件(例如,事故,疾病)而发生的27,28。可以使用基于TUNEL技术的检测试剂盒检测细胞凋亡(通过在细胞凋亡过程中产生的双链D...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突。
致谢
我非常感谢斯洛文尼亚研究机构的支持,批准号P4-133。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
参考文献
- Ruttner, F. Naturgeschichte der Honigbienen. , Ehrenwirth. München. (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , Dadant and Sons. 111-113 (1975).
- Snodgrass, R. E. The Anatomy of the Honey Bee. , Cornell University Press. (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. Honey bee colony health: Challenges and sustainable solutions. , Taylor & Francis Group. 302(2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, Ö Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. Mitosis and apoptosis: Matters of Life and Death. , Chapman & Hall. London. (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。