Method Article
使用双光子全息显微镜评估和操纵神经活动
摘要
我们开发了一种双光子全息显微镜,可以使用高时空分辨率可视化、评估和操纵神经活动,目的是阐明与异常神经活动相关的神经精神疾病的发病机制。
摘要
光学生物成像和光遗传学的最新进展使得能够可视化和操纵活体动物的生物现象,包括细胞活动。在神经科学领域,现在已经揭示了与大脑功能相关的详细神经活动,例如学习和记忆,并且人为地操纵这种活动来表达大脑功能已经变得可行。然而,通过双光子Ca2+ 成像对神经活动的常规评估存在时间分辨率低的问题。此外,常规光遗传学通过光纤操纵神经活动只能同时调节具有相同遗传背景的神经元的活动,难以控制单个神经元的活动。为了解决这个问题,我们最近开发了一种具有高时空分辨率的显微镜,通过将光遗传学与可以修改飞秒红外激光束的数字全息技术相结合,用于生物应用。在这里,我们描述了用于可视化,评估和操作神经活动的协议,包括样品的制备和双光子全息显微镜的操作(图1)。这些协议提供了关于神经活动的准确时空信息,这可能有助于阐明导致神经活动异常的神经精神疾病的发病机制。
引言
双光子Ca2+成像是评估神经活动的有用技术。它不仅可以用于识别正常动物的行为和记忆所需的神经活动1,2,还可以用于识别神经精神疾病小鼠模型中发生的异常神经元活动3,4。该技术已被用于阐明大脑功能的神经基础。然而,尽管它可以提供高分辨率和高质量的图像,但其时间分辨率低于电生理方法1,3。
光遗传学有助于创新神经科学家理解大脑功能的方式5。鉴于技术限制,大多数光遗传学研究都使用了低空间分辨率的激活方案,从而限制了可以相应地执行的神经活动操作类型。然而,在更精细的时空尺度上操纵神经活动可能有助于更全面地理解神经计算和神经精神疾病的发病机制。可以塑造飞秒近红外激光束的空间精确全息技术有望克服这一挑战,并开辟了以前不可能的几个新的实验类别6,7。这项技术使神经科学家能够揭示遥不可及的感觉、认知和行为神经代码的基本方面和病理学。
全息投影涉及生成所需的光模式,以选择性地访问单个细胞和功能网络。体内实验需要将光最佳地传递到活体大脑中的靶细胞。红外光深入活组织,可用于非线性双光子激发(2PE)8,9,10。因此,结合全息投影和2PE的双光子全息显微镜可用于评估和操纵神经活动以探测体内的细胞和功能网络。双光子全息显微镜的最新生物学应用阐明了视觉皮层11,12,嗅球13和海马体14中学习所需的神经活动和回路。
全球许多实验室都报告了使用其全息刺激系统15,16,17,18,19,20,21,22,23的令人兴奋的结果和改进。在这里描述的系统中,全息刺激系统可以构建为传统显微镜的附加设备。仅相位空间光调制器(SLM)是将平面波前调制为任何形状的关键器件,干涉效应用于控制焦点的强度和位置。图2显示了全息刺激和成像光路。第一条光路用于点扫描成像模式,由扫描头和图像探测器组成。第二条光路用于波长为 1040 nm 的全息刺激,由 SLM1 组成。第三条光路用于波长为920 nm的全息照明,由SLM2和图像传感器组成。全息成像模式可以通过照亮样品中的多个点来记录来自多个感兴趣区域的强度。这样,录制速度可以提高到每秒几百帧。为了实现点扫描成像或全息照明成像,920 nm激光器通过固定比例为3:7的分束器分成两条路径。所有光学元件都对准在尺寸为 600 mm × 600 mm 的光学试验板上。调制后的光通过显微体侧面的光口进入,而点扫描成像光通过显微体顶部的扫描头进入。这些光集成在物镜正上方,并在样品平面中形成焦点。此外,定制软件使常规工作流程变得简单和一致。
在本文中,提出了一个完整的协议,用于使用全息刺激或照明来测量神经活动并评估神经元之间的功能连接。为了演示目的,我们在这里描述了一种针对小鼠大脑初级躯体感觉皮层(S1HL)后肢区域的脑部手术,以及一种使用双光子全息显微镜评估和操纵神经活动的方法。实验程序分为四个部分。首先,使用牙科水泥将头板固定在小鼠的头骨上。其次,将表达jGCaMP8f或GCaMP6m-P2A-ChRmine的病毒载体立体定向注射到S1HL中。第三,校准全息刺激或照明系统。第四,在这两种蛋白质术后恢复和表达后,用双光子全息显微镜进行 体内 Ca2+ 成像,评估神经元之间的神经活动和功能连接。
研究方案
所有实验方案均由名古屋大学医学研究生院动物护理和使用委员会批准(批准号:M220295-003)。
1. 顶板植入(图1A)
- 腹膜内施用麻醉剂(74mg / kg氯胺酮和10mg / kg甲苯噻嗪的混合物)以麻醉小鼠。通过评估踏板反射经常检查鼠标的麻醉状态。
- 麻醉后,将鼠标置于立体定位仪器中。涂抹眼膏(见 材料表)以防止植入头板时角膜干燥。
- 剃除手术区域并用三轮交替使用聚维酮碘或洗必泰磨砂膏对皮肤进行消毒,然后用 70% 酒精湿巾擦拭。小心地暴露头骨并用棉签清洁。
注意:所有手术器械都应消毒,并应相应地执行所有程序。任何残留的碎片(例如,头发或干血)都会引起炎症反应。因此,应使用蘸有无菌水或70%酒精的棉签在立体镜下清除任何碎屑。 - 使用立体定向坐标 - 前部和后部 = 0.5 毫米,内侧和外侧 = 距前膛 1.5 毫米 - 找到开颅术的中心并用记号笔标记。
- 将定制的头板放在颅骨的中心。接下来,应用牙科水泥(见 材料表)将其牢固地固定在头骨上。轻轻按压,直到头板与颅骨前后牢固接触。
注意:此步骤大约需要20分钟才能完成,对于减少双光子成像期间大脑中的运动伪影至关重要。顶板的尺寸为 20 毫米× 40 毫米× 1 毫米,本垒板形状开口,一个边缘长 15 毫米,两个相邻的边长 3 毫米,其余两侧长 10 毫米。 - 将丙烯酸基牙科粘合剂树脂水泥混合在一起,如下所示:半勺粉末,三滴液体和一滴催化剂(见 材料表)。为防止干燥,请将这种混合牙科粘合剂树脂水泥与顶板一起涂在小鼠的完整颅骨表面上。
- 将鼠标放在温暖的笼子中,直到它从麻醉中恢复过来。在小鼠恢复足够的意识以维持胸骨卧位之前,不要让鼠标无人看管。
2.手术和腺相关病毒(AAV)注射(图1B)
- 在植入顶板后 1 天进行开颅手术或病毒注射,而无需从颅骨中去除牙科粘合剂树脂水泥。
注意:在此过程中腹膜内向小鼠施用麻醉(74mg / kg氯胺酮和10mg / kg甲苯噻嗪的混合物)。 - 为避免脑水肿,在手术前1小时腹膜内给予地塞米松磷酸钠(1.32mg / kg)。
- 使用蒸发器(麻醉输送系统)用1%异氟醚麻醉的头板麻醉小鼠,同时用加热垫保持体温。涂抹眼膏以防止角膜干燥。
- 在立体镜下,使用牙钻进行直径约2毫米的圆形开颅手术。为减少脑损伤,请小心操作牙钻,不断轻微移动并轻轻向下按压。
- 使用抽吸系统多次取出骨头碎片。去除骨头碎片后,使用人工脊髓液(ACSF)溶液去除并清洗残留在大脑表面的任何碎片。重复此清洁程序几次以抑制炎症反应。
注意:将ACSF溶液(140mM NaCl,2.5mM KCl,5mM HEPES,2.0mM CaCl 2和1.0mM MgCl2)在试剂溶解和过滤后在4°C下储存1个月(孔径= 0.22μm)。 - 使用压力注射系统(参见 材料表),设置适当的压力(脉冲中约10PSI,持续时间为4ms),通过尖端直径为10-20μm的玻璃毛细管(用微量移液器拉拔器制备)注入500nLAAV溶液10分钟。
- 通过检查玻璃毛细管中AAV溶液的水平是否逐渐降低来确定AAV溶液是否正在施用到大脑。
- 将玻璃毛细管再放置10分钟以防止回流。重复三次,将总共 1.5 μL AAV 溶液注入大脑。
- 为了评估和操纵第 2/3 层 (L2/3) 锥体细胞中的神经活动,将 AAV 溶液(用于 Ca 2+ 成像:AAV2/1-Syn-jGCaMP8f-WPRE 浓度为 1.28 × 10 14 个载体基因组/mL,在盐水中 1:1 稀释;对于具有光遗传学的 Ca2+ 成像:AAV2/8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1-WPRE 以 1.73 × 1014 个载体基因组/mL,在盐水中 1:1 稀释)到野生型小鼠初级躯体感觉皮层的后爪区域(S1, 中心距前臀后方0.5毫米,外侧1.5毫米,距表面150μm深度)。
注意:AAV溶液应分别在jGCaMP8f和GCaMP6m-P2A-ChRmine表达成像前2-3周和1-2周注射。 - 使用微量移液管将2%(w / v)低熔点琼脂糖施用于S1的大脑表面后,用两个盖玻片在开颅手术上放置一个玻璃窗。用UV固化粘合剂连接两个盖板玻璃(直径2.0毫米小,直径4.5毫米大;见 材料表)。
- 将盖玻片压在琼脂糖上,当它仍然是液体时;这可以防止琼脂糖中形成气泡。用牙科和粘性树脂水泥密封颅窗的边缘(图1C)。
- 将鼠标从立体定位仪器中取出并将其放回笼子中。将小鼠放在温暖的笼子里,在从麻醉中完全恢复之前不要与其他动物一起返回笼子。在生存手术期间小心保持无菌条件。
- 在手术后的前72小时内,通过观察一般行为来检查小鼠的健康状况。如果一般行为有任何异常,皮下注射抗炎和镇痛药。
3. 全息刺激或照明系统的准备(图3)
- 通过将红色荧光载玻片(铸造丙烯酸基板)的表面放置在样品平面上来校准全息刺激系统。将显微镜置于具有弱激发光的实时成像模式下,然后运行calibration_GUI.m文件。检查参数窗格,然后单击 保存 按钮。
- 点击 Z 扫描 步骤 1 窗格中的按钮。它将在所有 21 个轴向平面中自动生成三个随机点,每个平面相距 2 μm。
- 移动滑动条并检查实时图像。找到一个点看起来最小和最亮的完美平面,然后单击" 保存 "按钮。这将自动生成数字全息图的偏移球面波前。
注意:如果找不到最亮的荧光点,请更改扫描范围的最小值和最大值,然后重试。 - 单击步骤 2 窗格中的" 转到 "按钮,然后单击左侧方块上的六个点。检查实时图像。如果有六个可区分的荧光点,则在编辑框中键入它们的 x 和 y 轴,然后单击 "保存 "按钮。这将自动生成仿射变换系数,以协调全息刺激和成像系统之间的校准。
注意: 轴对编号和单击的点编号必须按顺序匹配。如果不确定,或者图像中没有斑点,请重试并生成独特的光斑图案或选择围绕视场中心(FOV)的较小范围。 - 点击 Scan 扫描 步骤 3 窗格中的按钮。它将生成 441 个数字全息图,以 21 × 21 个步骤在 FOV 上执行单点扫描。
- 首先,在列表框中更改模式时检查图像。然后,调整激光功率以获得成像设备动态范围内的光斑图像(例如,避免图像过度饱和)。
- 随后,在编辑框中调整间隔时间;间隔时间应为记录间隔时间的两倍以上。最后,将成像设备置于录制模式并单击 玩 按钮。如果播放完成,命令窗口中将显示"显示确定"字符串。停止记录并使用最大强度方法堆叠记录的连续图像。
- 单击步骤 4 窗格中的 生成 WM ,然后从上方选择堆叠图像。然后关闭calibration_GUI窗口。它将自动生成一个权重图,以补偿每个点的不平衡强度。
注:有关更详细的说明,请参阅 2;Matlab代码可以从这里下载(https://github.com/ZenKG/SLM_control)。
4. 使用具有全息照明的图像传感器进行Ca 2+ 成像(图 4)
- 将带有顶板的AAV注射小鼠放在显微镜下(图1D)。
注意:在此过程中,鼠标被限制在清醒状态,但能够逃避不舒服的刺激。 - 使用全息显微镜和锁模Ti:蓝宝石激光器(调谐至920 nm)和25倍物镜进行双光子成像(点扫描模式)(参见 材料表)。
- 打开商业成像软件(请参阅 材料表)。在实时成像模式下,调整图像检测器的电压(见 材料表)和成像激光器的功率,以优化表达jGCaMP8f的神经元的亮度。捕获表达这种蛋白质的神经元的图像。
注意:成像激光(920 nm)的强度为20-30 mW。在距皮质表面100-150μm的深度处,FOV为512μm×512μm。 - 若要使用全息照明照亮表达 jGCaMP8f 的特定神经元,请运行 SLMcontrol.m 脚本文件。单击 参考图像 并选择上面获取的图像。然后,单击 Spot 按钮,通过连续单击鼠标来选择图像中神经元上的特定像素(图4A)。如果选择完成,请按键盘上的 Enter 按钮完成选择。
注意:数字全息影像会自动计算并显示在 SLM 上。也可以通过单击列表框来重新访问此模式。SLM产生的单个光斑的空间分辨率沿横向约为1.2 μm,沿光轴约为~8.3 μm。我们使用高数值孔径(1.1)物镜来实现更局部的全息刺激。 表1 总结了以前的报告和该系统在全息刺激的空间分辨率方面。 - 要使用图像传感器以高时间分辨率检测神经活动(参见材料表),请在执行图像采集之前设置曝光时间、成像区域和合并(图 4B)(图 4C)。
注意:连续刺激一个神经元的全息照明激光(920 nm)的强度为2 mW,足以检测神经活动。例如,要实现100 Hz的成像帧速率,曝光时间为9 ms,成像区域为400 μm×400 μm,像素合并为4。 - 实验结束后,将鼠标放回其家笼。
5. 使用全息显微镜的光遗传学双光子成像(点扫描模式)(图2)
- 重复步骤 4.1 和 4.2。
- 打开商业成像软件(请参阅 材料表)。在实时成像模式下,调整图像检测器的电压(见 材料表)和成像激光器的功率,以优化表达GCaMP6m-P2A-ChRmine的神经元的亮度。捕获表达这些蛋白质的神经元的图像(图1E)。
- 重复步骤 4.4。
- 为了研究 L2/3 神经元内的功能连接,使用 SLM 生成光遗传学刺激的全息图案 (ChRmine; 1,040 nm),并将其与双光子 Ca2+ 成像相结合(GCaMP6m; 920 nm,512 × 512 像素,2 Hz 或 30 Hz,2 倍数码变焦,点扫描模式;图 4D-H)。
- 对于此协议,将成像激光的强度设置为920nm,在10-20mW处,并将FOV设置为256μm×256μm,在距皮质表面100-150μm的深度测量。将像素停留时间设置为 1.5 μs(2 Hz)或 100 ns(30 Hz)。
- 要查看单个全息刺激是否在神经元中引起钙反应,请使用 2 Hz 和 30 Hz 作为成像帧速率。设置全息刺激激光(1,040 nm)的强度,该激光以10 mW刺激单个神经元,足以诱导神经活动(图4D)。
注意:SLM产生的单个光斑的空间分辨率沿横向约为1.2μm,沿光轴约为~8.3μm。横向的可接近体积范围约为 500 μm × 500 μm 和轴向为 100 μm。我们已经通过 2 Hz 或 30 Hz 成像帧速率的 Ca2+ 成像进一步证实,不仅可以同时对一个神经元,而且可以同时对多个神经元进行全息刺激(图 4E)。
- 使用以下协议执行图像采集:在 920 nm 处同时成像Ca 2+ 响应,在 1,040 nm 处以 8 秒间隔 (0.125 Hz) 进行 10 ms 的 10 ms 的持续时间为 50 ms。在所有实验完成后,对小鼠实施安乐死。
注意:如果存在Ca2 +瞬变,则由全息刺激诱发,其峰值在刺激后1秒内出现(图4F-H)。
6. 功能连接的图像分析和评估(图4)
- 使用 ImageJ 打开在步骤 4.5 或 5.5 中保存的原始图像。要补偿焦平面位移,请使用 ImageJ 插件 TurboReg。
注意:如果使用TurboReg进行校正还不够,建议使用CaImAn (http://github.com/simonsfoundation)来校正焦平面位移。 - 要评估神经活动,请使用自动算法 (CaImAn) 确定 L2/3 中的感兴趣区域 (ROI)。在定义基线荧光强度(F0)和阈值后检测和分析Ca2+瞬变。
注意:F0是在基线成像期间获得的荧光强度的第35个百分位值。Ca2+瞬变用Δ F/F 0(Δ F = F-F0)表示,其中F是瞬时荧光信号。如果 Δ F 值从F 0 超过 2 S.D.,我们评估显著的 Ca2+ 瞬变。 - 为了定义L2 / 3神经元的功能连接,刺激目标神经元并相应地测量受刺激神经元和周围神经元中的GCaMP6m反应(图4F-H)。
结果
给出了使用此处描述的方法获得的代表性记录。 体内 使用全息显微镜的Ca2+ 成像需要2-4周才能完成从头板植入和AAV注射到数据采集。因此,为了获得稳定的结果,减少大脑中的运动伪影很重要。头板植入(步骤1.5)和颅窗的放置(步骤2.9)是这一过程中非常重要的步骤。此外,选择在单个神经元中同时表达钙指示剂和视蛋白的AAV(AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1)也很重要(步骤2.8)。
图4A 显示了使用定制的MATLAB脚本对采集的神经元图像进行全息照明的点。如果全息照明成功照亮表达jGCaMP8f的神经元,则可以使用图像传感器获得Ca2+ 迹线(图4B),如图 4C所示。
使用全息刺激评估神经元之间的功能连接(图4D),如图 4E所示。由于神经元之间的功能连接是在疼痛模型小鼠24的发病机制中改变的神经回路特性之一,因此我们描述了一种评估它的简单程序。 图4F 显示了使用GCaMP6m可视化的S1HL中L2 / 3神经元的典型图像。当一个神经元(橙色圆圈)受到全息刺激时,另一个神经元(红色圆圈)同时活跃;因此,神经元之间的功能连接数量为一(图4G)。
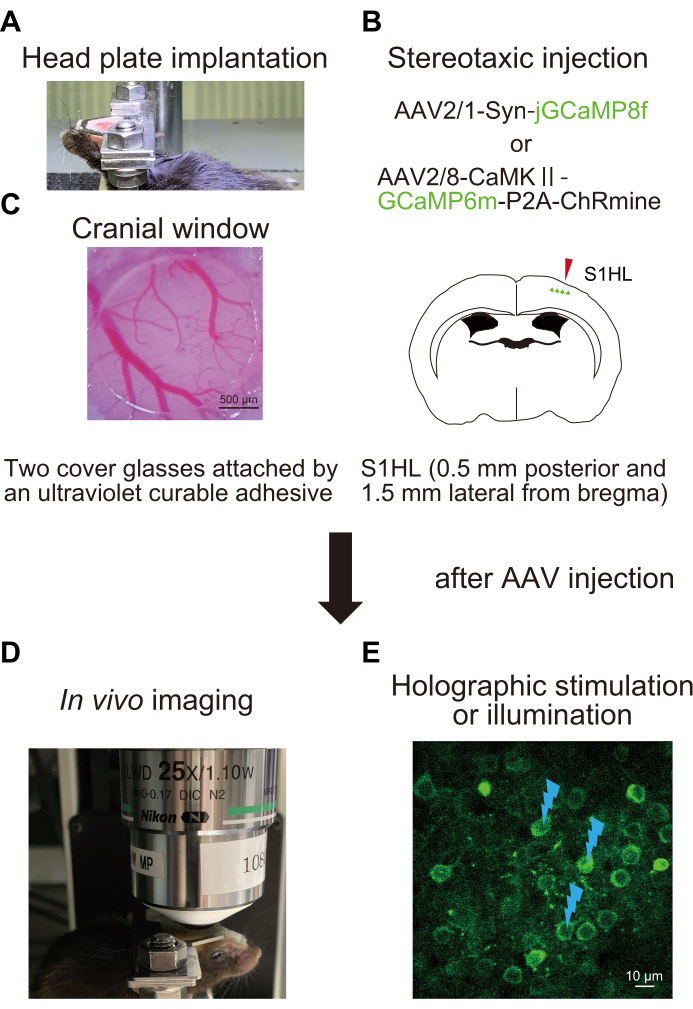
图1:实验程序的示意图。 (A)将头板固定在颅骨上。(B)将AAV立体定向注射到初级躯体感觉皮层(S1HL)的后爪区域。(C)植入颅窗。为了评估和操纵神经活动,在全息刺激(E)的清醒小鼠(D)中进行体内Ca2+成像。闪光标记表示全息刺激或照明。请点击此处查看此图的大图。
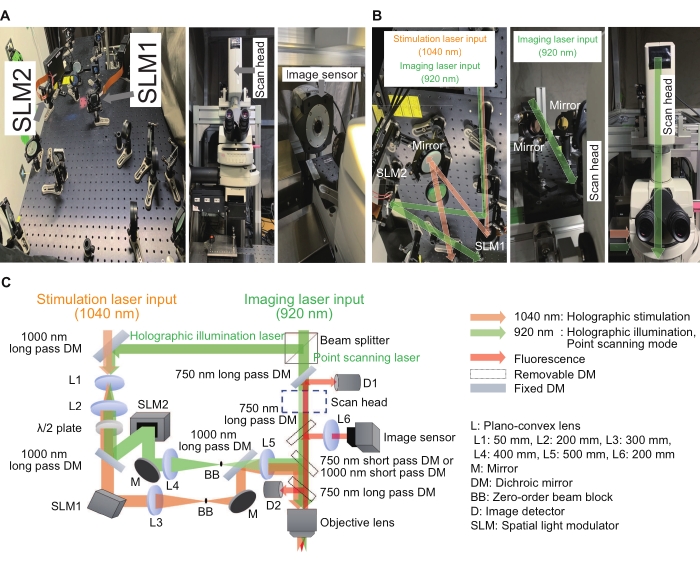
图2:用于全息显微镜的系统 。 (A)带有图像传感器(右)的显微镜(中)附近的全息刺激和照明光路(左)的图像。(B)这些是围绕各个SLM(左和右)的全息刺激和照明光路的放大图像,以及围绕扫描头(中和右)的点扫描光路。(C)刺激和成像光路的示意图。仅相位SLM用于显示数字全息图,并在各自的SLM之前和之后放置扩束镜(L1和L2的组合)和4f中继系统(L3和L4的组合用于全息刺激,L4和L5用于全息照明),以确保每个数字全息图在水浸物镜的出口瞳孔处成像, 图像大小略微填充不足。为了抑制残余零阶分量,在中间平面放置一个梁块。 请点击此处查看此图的大图。
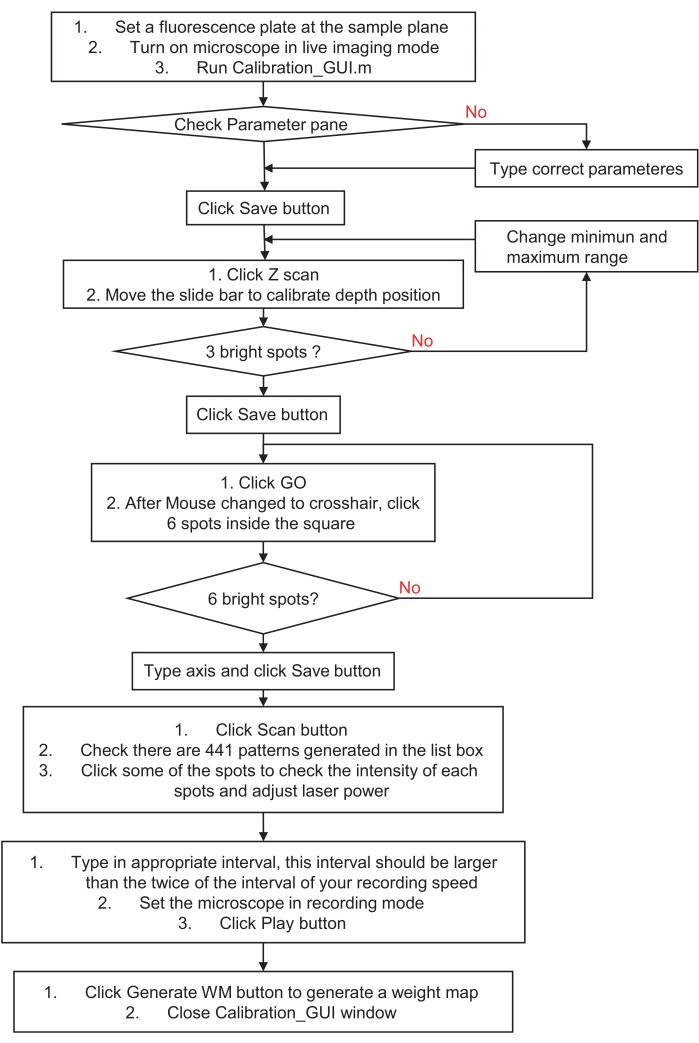
图 3:如何校准全息刺激或照明系统的流程图。此流程图描述了将全息刺激或照明系统校准到样品空间和成像系统的步骤。请访问步骤 3,全息刺激或照明系统的准备,以获取详细说明并下载示例程序。请点击此处查看此图的大图。
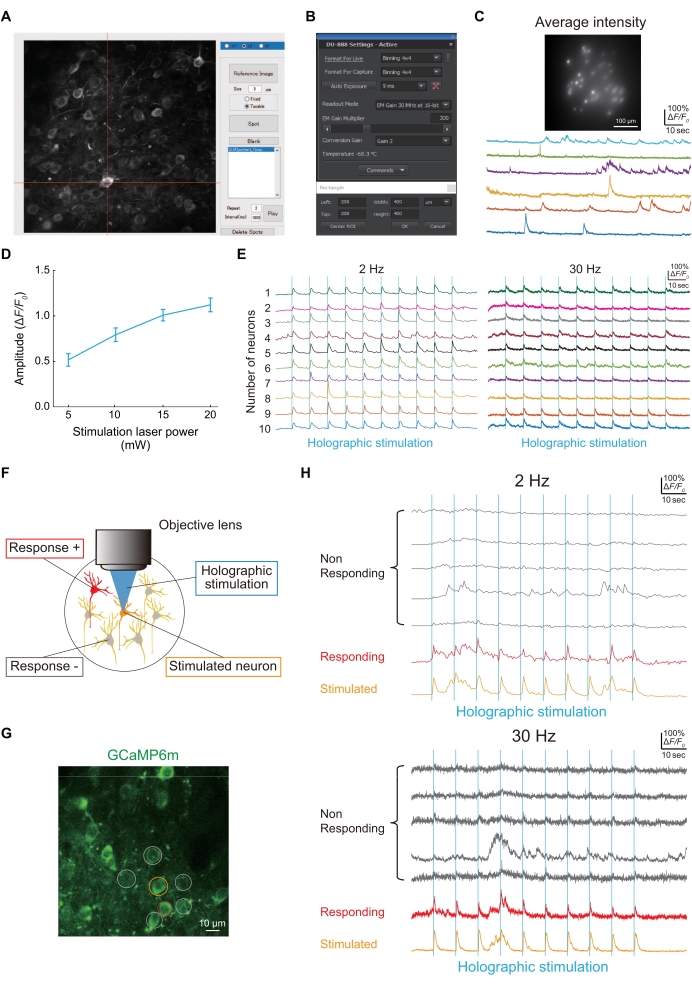
图4:使用全息显微镜成像和功能连接的代表性结果 。 (A)为了照亮表达jGCaMP8f或GCaMP6m-P2A-ChRmine的特定神经元,捕获神经元的图像,然后使用定制的MATLAB脚本在神经元上形成一个斑点。(B) 图像传感器的设置(曝光时间、成像区域和合并)。(C)在具有全息照明和图像传感器的100 Hz成像中表达jGCaMP8f的神经元的代表性图像和迹线。(D)该图显示了每种激光功率下对全息刺激(1,040nm)的神经反应(来自GCaMP6m-P2A-ChRmine在2 Hz成像帧速率下表达神经元的数据[n = 16])。误差线表示平均值的标准误差。(E) 在 2 Hz(左)和 30 Hz(右)成像帧速率下对 10 个不同神经元进行全息刺激(蓝色垂直线)期间的代表性 Ca2+ 迹线。在 2 Hz 和 30 Hz Ca2+ 迹线中,相同的颜色表示相同的神经元。(F)评估神经元之间功能连接的示意图。当橙色神经元受到刺激时,红色神经元同时做出反应,表明这些神经元之间存在功能连接。(G)在WT中表达GCaMP6m的S1HL神经元的典型图像。 比例尺= 10μm。 (H) 全息刺激(蓝色垂直线)期间的典型 Ca2+ 迹线,以 2 Hz(上)和 30 Hz(下)成像帧速率。受刺激的神经元用橙色圈出,有反应的神经元用红色圈出,无反应的神经元用灰色圈出。在 2 Hz 和 30 Hz 成像速度下都可以检测到对全息刺激的神经反应。 请点击此处查看此图的大图。
| 我们的设置 6 | 普拉卡什等人 25 | 马谢尔,J.H.等人12 | 罗宾逊等 14 | |
| 横向分辨率 | 1.2微米 | 1.27 微米 | ― | 2.22 微米 |
| 轴向分辨率 | 8.3微米 | 56.86 微米 | 15.5 微米 | 10.26 微米 |
| 物镜/数值孔径 | 25 倍/1.1 倍 | 20倍/0.5 倍 | 16倍/0.8 | 16倍/0.8 |
表1:以前报告和全息刺激空间分辨率系统的摘要。 描述了测量过程中使用的横向分辨率、轴向分辨率和物镜。
讨论
为了了解大脑功能,有必要通过提取神经活动的动力学来准确评估大脑功能背后的神经回路。此外,必须确定这种神经回路如何改变以阐明神经精神疾病的发病机制。事实上,已知在阿尔茨海默病4 和脆性X综合征26 的小鼠模型以及白质功能受损的小鼠3中神经活性升高。此外,在炎症性疼痛的小鼠模型中,神经活动和神经元之间功能连接的同步增加与症状有关24。双光子全息显微镜使我们能够同时观察单个神经元的活动和神经元之间的功能连接,这对于理解神经回路是必要的。我们使用25倍物镜,数值孔径= 1.1,波长为1,040 nm。理论点扩散函数是横向最大0.5 μm和轴向1.7 μm的全宽高斯分布。然而,实际数值孔径小于1.1,荧光珠上测得的光斑尺寸横向为1.2μm,轴向为8.3μm。鉴于神经元直径约为15μm,校准误差在3μm以内,因此靶向通常很好。然而,轴向的细胞可能会受到较长的光斑尺寸6的影响。在这里,我们描述了病毒注射,手术,全息刺激或照明系统的校准,以及使用我们的显微镜系统评估和操纵活小鼠神经活动的成像协议。
完成所有实验程序需要2-4周,从顶板植入和病毒注射到使用全息显微镜进行 体内 Ca2+ 成像的数据采集。该过程复杂而费力,实验的最终成功取决于多种因素,包括受术后炎症影响的颅窗状况,Ca2+ 指示剂和视蛋白的正确选择,以及是否可以纠正采集图像中的运动伪影。特别是,两个步骤对于成功的结果很重要。第一个涉及头板固定和手术;用牙科水泥将头板牢固地固定在鼠标头上至关重要。此外,在手术过程中使用冷ACSF反复清洁骨碎片和凝结的血液也很重要。由于坚持这一程序可以减少炎症,我们成功地观察了小胶质细胞的动力学,小胶质细胞是负责大脑免疫系统的细胞,而不会激活它们的过程和脊柱或神经元的微观结构27,28。第二个问题是神经活动的评估和操作。我们选择AAV2 / 8-CaMKII-GCaMP6m-P2A-ChRmine-Kv2.1在一个神经元中同时表达Ca2+ 指示剂和视蛋白。这是因为很难用不同的AAV类型有效地感染一个神经元。这种选择的另一个原因是ChRmine可以使用双光子激光器有效地激活1,040nm处的神经活动12。最近,据报道,ChRmine通过基于冷冻电子显微镜获得的结构信息改变其结构,改善了其功能29,这被认为可用于神经科学领域的靶功能分析。鉴于这些问题,有必要分享在使用全息显微镜读取神经活动和写入信息时评估和操纵神经元的有效方法。
成像和光遗传学的最新进展揭示了涉及大脑功能(如学习和记忆)的详细神经活动,并且可以人为地操纵这种神经活动来表达大脑功能30。然而,由于在大脑中插入光纤并且由于同时刺激一组表达视蛋白的细胞,因此操纵神经活动的常规方法是高度侵入性的,因此不可能以时间和空间精度操纵神经活动。我们的方法可以通过仅刺激大脑中的特定神经元来操纵神经活动,从而能够以特定的刺激模式和高时空分辨率操纵神经活动。此外,重要的是要注意,神经元之间的功能连接只能在少数神经元中使用脑切片实验31进行评估;然而,这种技术允许同时评估活体动物中的多个神经元。
当前全息显微镜的主要限制之一是需要固定鼠标头,这限制了鼠标的行为。最近,开发了小型化双光子显微镜32,随着该设备的进一步小型化,在自由移动的小鼠中,具有全息刺激的 体内 Ca2+ 成像成为可能。此外,通过提高成像的时间分辨率并将其与高灵敏度的电压敏感荧光蛋白相结合,可以扩大该显微镜的潜力33。
披露声明
作者没有利益冲突需要声明。
致谢
这项工作得到了创新领域科学研究补助金(19H04753、19H05219和25110732给H.W.)、变革性研究领域补助金(A)(20H05899至H.W.,20H05886至O.M.和21H05587至D.K.)、促进联合国际研究(B)(20KK0170至H.W.)、科学研究补助金(B)(18H02598至H.W.)、 科学研究补助金(A)(21H04663至O.M.),早期职业科学家补助金(20K15193至X.Q.),JST徽章资助号JPMJCR1755,日本和JST A-STEP资助号JPMJTR204C。
材料
| Name | Company | Catalog Number | Comments |
| 25x Objective | Nikon | N25X-APO-MP | Objective |
| A1MP | Nikon | A1MP | Microscope |
| AnesII | Bio machinery | AnesII | Anesthesia delivery system |
| C2 plus | Nikon | C2 plus | Microscope |
| DECADRON Phosphate Injection | Aspen | 21N024 | Avoid cerebral edema |
| Dental Drill | Jota | C1.HP.005 | Dental drill |
| Electric Microinjector | NARISHIGE | IM-31 | Pressure injection system |
| FEATHERS | FEARGER | FA-10 | Shaving |
| G-CEM ONE ADHESIVE ENHANCING PRIMER | GC | 2110271 | Resin cement primer for dental adhesion |
| G-CEM ONE neo | GC | 43093 | Resin cement for dental adhesion |
| Glass Capillary with Filament | NARISHIGE | GDC-1 | Glass capillary |
| Image Detector | Hamamatsu | H10770PA-40 | GaAsP photocathode photomultiplier tube |
| Imaging Software | Nikon | NISelements | Imaging software |
| Isoflurane Inhalation Solution | Pfizer | 229KAR | Anesthetics |
| iXon EMCCD Camera | Andor | iXon Life 888 | Image sensor |
| Ketamine | daiitisannkyou | s9-018506 | Anesthetics |
| Leica-M60 | Leica | M60 | Stereoscope |
| Linicon | Linicon | LV-125 | Vacuum pump |
| Mode-locked Ti:sapphire Chameleon Ultra II laser | Coherent | Chameleon Discovery NX | Femtosecond laser |
| Mos-Cure | U-VIX | mini 365 | Portable LED UV Light Source |
| PEN Bright | SHOFU INC. | PEN Bright | Dental light curing unit |
| Puller | SUTTER instaument | P-97 | Puller |
| Stereotaxic Instrument (for Mice) | NARISHIGE | SR-6M-H | Stereotaxic instrument |
| Stereotaxic Micromanipulator | NARISHIGE | SM-15R | Stereotaxic micromanipulator |
| Super-Bond CATALYST V | SUN MEDICAL | 8070 | Dental adhesive resin cement |
| Super-Bond Dental Adhesive Monomer | SUN MEDICAL | 8071 | Dental adhesive monomer |
| Super-Bond Teeth Color Polymer Powder | SUN MEDICAL | 145052000 | Teeth color polymer powder |
| Tarivid Ophthalmic Ointment 0.3% | Santen Pharmaceutical | TRN3952 | Eye ointment |
| UlTIMATE XL | NSK | Y141446 | Dental laboratory micromotor control unit |
| UV Curing Optical Adhesives | THORLABS | NOA61 | UV Curing Optical Adhesives |
| Xylazine | Bayer | KP0F2BK | Anesthetics |
参考文献
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nature Neuroscience. 17 (7), 987-994 (2014).
- Peters, A. J., Chen, S. X., Komiyama, T. Emergence of reproducible spatiotemporal activity during motor learning. Nature. 510 (7504), 263-267 (2014).
- Kato, D., et al. Motor learning requires myelination to reduce asynchrony and spontaneity in neural activity. Glia. 68 (1), 193-210 (2020).
- Busche, M. A., et al. Tau impairs neural circuits, dominating amyloid-β effects, in Alzheimer models in vivo. Nature Neuroscience. 22 (1), 57-64 (2019).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Quan, X., Kato, D., Daria, V., Matoba, O., Wake, H. Holographic microscope and its biological application. Neuroscience Research. 179, 57-64 (2022).
- Adesnik, H., Abdeladim, L. Probing neural codes with two-photon holographic optogenetics. Nature Neuroscience. 24 (10), 1356-1366 (2021).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nature Methods. 2 (12), 932-940 (2005).
- Svoboda, K., Denk, W., Kleinfeld, D., Tank, D. W. In vivo dendritic calcium dynamics in neocortical pyramidal neurons. Nature. 385 (6612), 161-165 (1997).
- Carrillo-Reid, L., Han, S., Yang, W., Akrouh, A., Yuste, R. Controlling visually guided behavior by holographic recalling of cortical ensembles. Cell. 178 (2), 447-457 (2019).
- Marshel, J. H., et al. Cortical layer-specific critical dynamics triggering perception. Science. 365 (6453), (2019).
- Gill, J. V., et al. Precise holographic manipulation of olfactory circuits reveals coding features determining perceptual detection. Neuron. 108 (2), 382-393 (2020).
- Robinson, N. T. M., et al. Targeted activation of hippocampal place cells drives memory-guided spatial behavior. Cell. 183 (6), 1586-1599 (2020).
- Packer, A. M., Russell, L. E., Dalgleish, H. W., Häusser, M. Simultaneous all-optical manipulation and recording of neural circuit activity with cellular resolution in vivo. Nature Methods. 12 (2), 140-146 (2015).
- Mardinly, A. R., et al. Precise multimodal optical control of neural ensemble activity. Nature Neuroscience. 21 (6), 881-893 (2018).
- Yang, W., Carrillo-Reid, L., Bando, Y., Peterka, D. S., Yuste, R. Simultaneous two-photon imaging and two-photon optogenetics of cortical circuits in three dimensions. Elife. 7, 32671 (2018).
- Forli, A., et al. Two-photon bidirectional control and imaging of neuronal excitability with high spatial resolution in vivo. Cell Reports. 22 (11), 3087-3098 (2018).
- Pégard, N. C., et al. Three-dimensional scanless holographic optogenetics with temporal focusing (3D-SHOT). Nature Communications. 8 (1), 1228 (2017).
- Dal Maschio, M., Donovan, J. C., Helmbrecht, T. O., Baier, H. Linking neurons to network function and behavior by two-photon holographic optogenetics and volumetric imaging. Neuron. 94 (4), 774-789 (2017).
- Russell, L. E., et al. All-optical interrogation of neural circuits in behaving mice. Nature Protocols. 17 (7), 1579-1620 (2022).
- Oron, D., Papagiakoumou, E., Anselmi, F., Emiliani, V. Two-photon optogenetics. Progress in Brain Research. 196, 119-143 (2012).
- Hernandez, O., et al. Three-dimensional spatiotemporal focusing of holographic patterns. Nature Communications. 7, 11928 (2016).
- Okada, T., et al. Pain induces stable, active microcircuits in the somatosensory cortex that provide a therapeutic target. Science Advances. 7 (12), 8261 (2021).
- Prakash, R., et al. Two-photon optogenetic toolbox for fast inhibition, excitation and bistable modulation. Nature Methods. 9 (12), 1171-1179 (2012).
- Gonçalves, J. T., Anstey, J. E., Golshani, P., Portera-Cailliau, C. Circuit level defects in the developing neocortex of Fragile X mice. Nature Neuroscience. 16 (7), 903-909 (2013).
- Akiyoshi, R., et al. Microglia enhance synapse activity to promote local network synchronization. eNeuro. 5 (5), (2018).
- Haruwaka, K., et al. Dual microglia effects on blood brain barrier permeability induced by systemic inflammation. Nature Communications. 10 (1), 5816 (2019).
- Kishi, K. E., et al. Structural basis for channel conduction in the pump-like channelrhodopsin ChRmine. Cell. 185 (4), 672-689 (2022).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Ko, H., et al. The emergence of functional microcircuits in visual cortex. Nature. 496 (7443), 96-100 (2013).
- Zong, W., et al. Large-scale two-photon calcium imaging in freely moving mice. Cell. 185 (7), 1240-1256 (2022).
- Villette, V., et al. ultrafast two-photon imaging of a high-gain voltage indicator in awake behaving mice. Cell. 179 (7), 1590-1608 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。