Method Article
分离小鼠肠系膜流动淋巴液以量化膳食脂质吸收和乳糜微粒分泌的 体内 动力学
摘要
本协议描述了一种详细的手术方案,用于分离流动的肠淋巴以响应小鼠十二指肠内营养输注。这允许对响应各种实验营养素的总肠道脂质吸收和乳糜微粒合成和分泌进行生理测定。
摘要
肠道脂蛋白,尤其是富含甘油三酯的乳糜微粒,是代谢、炎症和心血管疾病的主要驱动因素。然而,分离肠道脂蛋白在 体内 非常困难,因为它们首先从小肠分泌到肠系膜淋巴管中。然后,含乳糜微粒的淋巴液从胸导管排空到锁骨下静脉,将膳食的成分输送到心脏、肺,并最终输送到全身循环。从血液中分离出幼稚的乳糜微粒是不可能的,因为乳糜微粒甘油三酯在与脂蛋白脂肪酶和循环中的其他脂蛋白受体相互作用后会立即经历水解。因此,Bollman等人在大鼠中描述的原始2天淋巴瘘手术历来用于在新鲜肠系膜淋巴进入胸静脉之前将其用于分离新鲜肠系膜淋巴液。在过去的45年里,Patrick Tso的实验室对该协议进行了改进和专业化,允许分析这些关键的脂蛋白和肠道分泌物。Tso 淋巴瘘手术现已更新,并首次在这里直观地展示。这种修订后的手术是一种单日手术技术,用于安装十二指肠饲管、插管肠系膜淋巴管以及在有意识的小鼠饭后收集淋巴液。这些新技术的主要好处包括能够可重复地从小鼠身上收集淋巴液(利用遗传小鼠模型的力量);在十二指肠输液管和淋巴插管植入期间小鼠的麻醉时间减少;在整个喂养和餐后期间持续采集淋巴液的能力;在激素和细胞因子稀释和血液中酶解之前定量测量激素和细胞因子的能力;以及收集大量淋巴液以分离肠道脂蛋白的能力。该技术是直接定量测量膳食营养吸收、肠道脂蛋白合成和乳糜微粒分泌的有力工具。
引言
肠系膜淋巴系统的生理重要性
自公元前~300年以来,肠系膜淋巴管就以某种形式进行了描述,当时Herophilos描述了肝门系统和所有"肠道吸收静脉"1,2,3,4,5。在最初的描述之后的1,700多年里,肠淋巴管的一个决定性特征是餐后不久肠系膜淋巴液中存在乳白色液体3。现在已知乳糜微粒的乳白色淋巴("乳糜"淋巴液)不会流入门静脉和肝脏,而是通过乳糜池进入胸导管,最终在左锁骨下静脉6加入血液。由于这种解剖学安排,乳糜淋巴首先穿过心脏和肺部,然后循环到身体的其他部位。这意味着心脏和肺部在分泌物进入肠系膜淋巴液时获得"首过"7。
肠系膜淋巴管的一个主要作用是它们从小肠运输膳食脂质8,9,10。解剖学上,乳糜微粒,肠道免疫细胞11,12,13,14,肠道激素15,16,17,18,抗原19,20,21,非乳糜微粒亲脂性化合物22,23,多余的液体进入肠细胞基底膜下方的乳腺,然后通过淋巴毛细血管浓缩到肠系膜淋巴结。可能有许多未知的肠系膜淋巴成分,包括代谢物、抗原、环境污染物、营养物质和信号分子。
肠系膜淋巴的成分尚未系统鉴定,主要是由于难以分离肠系膜淋巴。进入肠系膜淋巴一直是一个严峻的挑战,因为淋巴管是无色的,除了在脂肪餐后变成乳糜状和乳白色外,肠系膜淋巴管含有无色淋巴液6,8,9,10。
目前和常见的肠道淋巴分离方法
肠系膜淋巴无法在人类中通路(发生严重胃肠道创伤的罕见和极端情况除外)24。 体内 淋巴收集手术复杂且要求苛刻。最初的2天淋巴瘘手术由Bollman等人描述25,并在过去45 年中由Patrick Tso实验室进行了改进和专业化26,27。淋巴瘘手术允许研究人员在6小时十二指肠脂质输注期间从有意识的动物收集流动的淋巴液。
淋巴瘘模型主要用于大鼠测量淋巴流速、甘油三酯和胆固醇(或其他十二指肠注入化合物)的输出、乳糜微粒组成和肠道激素浓度。在较小程度上,这种技术也可用于小鼠,尽管手术存活率和淋巴体积受到影响。由于难以看到肠系膜淋巴管,历史方法包括在较大的动物中插管肠系膜淋巴液,如迷你猪28,绵羊29,猪30,狗31和大鼠17。使用这些较大的模型是资源密集型的,不允许在敲入或敲除模型中进行研究。
还使用了替代方法。乳糜微粒可以在餐后状态下从血液中分离出来(尽管这些会被血浆脂蛋白脂肪酶部分水解)32,33,34,35。胸导管也可以插管,尽管那里收集的淋巴液含有肠系膜淋巴和肠外淋巴引流的混合物26,36。在体外,Caco-2细胞响应脂肪酸处理而分泌乳糜微粒样颗粒,这些细胞可以与相关的淋巴内皮或血管细胞共培养37,38。人类和小鼠肠道类器官培养物已被证明可以处理顶端脂质并分泌乳糜微粒39,40,41,42。这些模型非常有利,能够对小肠生理学进行机制分析,但它们无法复制原位肠系膜淋巴管的复杂性、理化梯度或动态淋巴流动。
这里介绍的1天小鼠淋巴瘘模型的优点
关于这些分离肠道脂蛋白的其他方法,Tso Lab淋巴瘘技术传统上被认为是测量膳食营养素吸收到肠系膜淋巴中的金标准技术。这种 体内 技术的优点是捕获膳食脂质吸收的关键生理方面 - 化合物在吸收期间的动态外观,这需要对具有十二指肠营养素的活体动物的肠系膜淋巴流动进行重复采样。这种手术技术还直接在其生理区室中而不是在血液中测量肠道激素和细胞因子,在血液中,它们被稀释和酶降解17,43。
如果实验问题需要了解脂质分泌动力学或任何疏水性GI化合物或药物的动态吸收和代谢,那么这种技术不仅合适,而且是唯一的方法,可以插值管腔内容物从近端到远端肠道(胃到结肠)和从顶端到基底外侧表面(腔内容物通过肠细胞到乳腺和门静脉循环)。由于该技术采用通过十二指肠内导管腔内输送营养物质,并且由于流动的肠系膜淋巴被转移和收集,因此整个吸收装置处于实验控制之下,可用于定性评估小肠吸收曲线。
这里首次直观地展示了对Tso Lab淋巴瘘模型的重大更新,该模型(1)将实验时间缩短为1天的手术植入和实验收集期;(2)提高小鼠存活率和动物福利考虑;(3)增加该方法在小鼠中的可重复性,以利用小鼠遗传模型的力量。该技术必须被视为肠道分泌物、脂蛋白或膳食脂质吸收等所有实验问题的金标准,并且是高保真测定脂质吸收动力学和乳糜微粒的最佳技术。
研究方案
所有外科手术均已获得匹兹堡大学内部动物护理和使用委员会[协议#20047008]的批准,并符合NIH实验动物护理和使用指南。C57BL6 / J雄性小鼠,8-14周龄,用于本研究。小鼠是从商业来源获得的(见 材料表)。将所有小鼠饲养在12小时的光照/黑暗循环 中,随意 获得标准食物和水。
1. 动物制备
- 根据实验设计,喂小鼠或让它们禁食。
注意:除非担心胃排空率的差异,否则不需要过夜禁食。 - 用5%异氟醚气体诱导麻醉,并通过捏尾和脚趾确保适当的麻醉。麻醉后,用2%-3%异氟醚气体将小鼠保持在适当的麻醉平面上,并用胶带将它们放置在手术平台上。
- 在利用循环温水的加热手术平台上保持小鼠温暖(见 材料表)。
2. 手术与实验设计
- 手术开始时,将兽医软膏涂抹在眼睛上,剃除腹部,并在手术部位涂抹抗菌手术磨砂膏(见 材料表)。这样可以对切口进行消毒,并减少中线切口期间空气中毛皮的产生。
- 通过使用无菌器械、窗帘和其他所需的设备和用品来保持无菌工作区域。
- 以5mg / kg的剂量注射第一剂卡洛芬(见 材料表)以缓解疼痛(ip)。
- 用镊子抓住皮肤,用小剪刀做一个中线腹部切口。切向胸骨(从不高于)并切到腹股沟脂肪。然后,用剪刀分别切开肌肉层。
注意:使用前对所有设备进行消毒。 - 使用牵开器,将腹膜内脏移开,直到淋巴管可见。
- 使用盐水浸泡的Q-tip(见 材料表),将肝脏移向身体的右上方,将肠胃移向动物的左侧。
- 将十二指肠横向向左拉伸,以暴露肠系膜上动脉和肠淋巴管。
- 通过在套管中插入钝针来准备30-40厘米长的套管(见 材料表),并使用1mL注射器通过管冲洗少量肝素(1,000U / L)。
注意:淋巴流动在重力的辅助下向动并流入冰上的微量离心机收集管。根据收集冰桶与手术装置相邻的位置,可能需要调整套管的长度。 - 用剪刀在套管的尖端剪一个斜面。
- 用虹膜剪刀(见 材料表)在淋巴管中做一个浅切口,距离其在小肠中的外观约5毫米。
- 用一对细镊子握住套管,然后将尖端斜面轻轻插入导管。
注意:重要的是不要将套管推入导管太远,因为当缩回的器官返回到其原始位置时,这可能会阻止淋巴流动。 - 淋巴管太脆弱了,无法进行与缝合线绑住导管相关的操作。相反,使用一滴氰基丙烯酸酯胶(见 材料表)将淋巴插管粘入肠系膜淋巴管。
- 检查乳白色淋巴液(如果使用术前橄榄油管饲法)或透明淋巴液(如果小鼠在手术前禁食),这些淋巴液立即开始流经淋巴瘘套管。
注意:检查淋巴插管是否成功放置并且淋巴液是否流动;继续放置十二指肠内套管。 - 使用 18 G 针,在幽门括约肌后方的胃幽门区域穿一个孔。
- 将十二指肠输液管(见 材料表)通过胃中的该孔插入幽门括约1-2毫米进入十二指肠。
- 使用真丝5-0缝合线(见 材料表)用针头将钱包绳结扎固定在胃上,并用一滴氰基丙烯酸酯胶水密封以防止泄漏。
- 开始十二指肠内输注 5% 葡萄糖-0.9% 盐水,速度为 0.3 mL/h。
注意:当使用体重差异较小的小鼠时,大约25g(~8周龄),0.3mL / h输注葡萄糖/盐水是合适的。如果小鼠明显变大,则必须向上调整输注速率以考虑体重和血容量的变化。 - 更换体腔中的器官,并分别缝合(5-0)肌肉和皮肤组织。
注意:淋巴插管和十二指肠内饲管都通过同一切口进行外部化。没有用缝合线分离管子的先例,也没有偏好管子外部化的角度。 - 手术后但在停用麻醉剂之前,将小鼠轻轻地置于依偎约束装置中(参见 材料表)以限制运动。
注意:紧贴约束装置可防止小鼠抓住或旋转头部以咀嚼缝线和管子。 - 然后,将小鼠放在旋转器上的透明有机玻璃盒中,轻轻摇晃,并使用粘附在收容盒侧面的温控市售两栖动物/爬行动物加热垫加热。在收容箱的角落也以无菌去离子水容器的形式提供加湿(见 材料表)。
- 在异氟醚撤出前30分钟,给予小鼠第二次止痛剂量(丁丙烯,0.1mg / kg,ip)。
- 根据实验,以0.3mL / h的速率向小鼠提供5%葡萄糖-0.9%盐水的连续十二指肠内输注1小时。
注意:5%葡萄糖-0.9%盐水溶液使用药房的无菌盐水袋(供人使用,pH 7.4)和供人用的无菌瓶50%葡萄糖制备,遵循严格的无菌准则。溶液必须新鲜,如果超过盐水袋或葡萄糖瓶上提供的有效期,则必须丢弃。 - 通过十二指肠内插管用表1中列出的脂质之一作为实验脂质的小鼠(参见材料表)。
注意:对于 图1所示的所有数据,十二指肠内输注SMOFlipid(20%脂质注射乳液,USP,参见 材料表)。这种十二指肠内和十二指肠内脂质推注后的输注可替代通过淋巴管引流的流失液体,是绝对必要的。小鼠现在准备注入实验脂质剂量。 - 通过十二指肠内输注管 进行 0.3mL脂质乳剂推注(SMOFlipid 20%脂质注射乳剂,USP)的经典脂质输注(参见 材料表)。
- 在推注十二指肠内脂质后,以 0.3 mL/h 的速度将输注切换回 5% 葡萄糖-0.9% 盐水,直到实验结束。
- 将淋巴样品收集在预先称重的微量离心管中60分钟,并将淋巴液保持在冰上。第二次称量试管以确定每60分钟分泌的淋巴液重量。
注意:预计在 0.3 mL 脂质推注后的 ~6 小时内,每只小鼠每小时收集约 50-300 μL 淋巴液。 - 淋巴液可以在脂质输注后流动长达6小时。在6小时时间点,通过异氟醚和宫颈脱位 对 小鼠实施安乐死。
注意:外科医生和/或实验室技术人员应在整个实验过程中在场监测动物。在观察过程中,注意淋巴引流中的凝块和表明疼痛/痛苦的动物行为变化。如果在实验过程中的任何时候淋巴管堵塞,实验终止,动物被安乐死。从技术上讲,动物可以在手术后存活长达 24 小时(根据 IACUC 生存手术规则)。然而,存活率随着时间的推移而降低,6小时是一个可重复的存活期,其中脂质吸收仍然模仿 体内 生理学,并且动物不会在生存中挣扎。 - 安乐死后进行末端组织收集(步骤3.1)。
注意:最近测试了手术后6小时或24小时小鼠的膳食脂质吸收曲线的差异44。我们发现24小时手术降低了动物存活率和膳食脂质进入淋巴液的偏移。出于这些原因,我们强烈建议使用6小时方法。这种更新的手术设计减少了不必要的动物死亡和术后动物窘迫的可能性。这支持了美国实验动物护理认证协会的一个主要目标,即动物"替代,减少,改进"[参考PMID:21595115]。
3.收集管腔内容物和粘膜组织
- 在6小时脂质输注期结束时,通过异氟醚和颈椎脱位处死小鼠。用5-0缝合线将胃,小肠和盲肠的两端绑在一起,以避免管腔内容物泄漏。
- 收集胃、盲肠和结肠,并将它们放入 15 mL 玻璃管中。将小肠分成三段或四段,纵向切开后,用2-3mL冷PBS冲洗组织来收集管腔内容物。
- 用弯曲的镊子刮取 2-3 mL 冷 PBS 中的每片,从肌肉层中去除包含上皮细胞和相关固有层的肠粘膜。
- 将所有组织、管腔和粘膜分离物以及肌肉层放入玻璃管中,并向每个管中加入 8 mL 的 2:1 体积/体积 CHCl3:MeOH。
- 在Folch提取45后,通过液体闪烁计数和/或甘油三酯测定试剂盒(参见材料表)确定放射性和/或脂质浓度。
4. 薄层色谱
- 通过改良的Folch提取45提取管腔和粘膜分离物的总脂质。
- 在氮气蒸发器下干燥溶剂中的提取脂质,然后将其重悬于2:1体积/体积的CHCl 3:MeOH中,然后将其加载到TLC硅胶板上(见 材料表)。
- 使用石油醚,乙醚和冰醋酸的溶剂系统(25:5:1体积/体积/体积)分离脂质。使用碘蒸气可视化不同的脂质,包括标准品。
- 在加入 4 mL 闪烁液(参见 材料表)进行闪烁计数之前,将对应于甘油单酯/磷脂、甘油二酯、脂肪酸、甘油三酯和胆固醇酯的 TLC 板上的斑点刮入单独的闪烁瓶中。
- 将数据表示为总推注脂质剂量的百分比或每个样品检测到的总脂质的分数。
5. 乳糜微粒分离与表征
- 将合并的淋巴样品从脂质推注后6小时(步骤2.29)转移到超速离心管中,与0.9%NaCl(300-500μL)混合,然后小心地用适当体积的0.87%NaCl(300-500μL)覆盖。
- 超速离心机(见 材料表)将样品在4°C下以110,000× g 放置16小时。收集含有分离乳糜微粒的顶部部分,并将它们转移到新的微量离心管中。
- 按照以下步骤确定乳糜微粒甘油三酯、胆固醇和 apoB 浓度。
- 使用甘油三酯和胆固醇检测试剂盒测定甘油三酯和胆固醇浓度(参见 材料表)。
- 简而言之,将2μL样品与200μL酶试剂在37°C下在96孔板中孵育5分钟。使用酶标仪在500nm处读取甘油三酯和600nm胆固醇。
注:标准品和空白用于计算浓度。使用小鼠ApoB ELISA试剂盒测定ApoB浓度(参见 材料表)。
- 确定乳糜微粒颗粒大小。
- 使用甘油三酯浓度约为 40 mg/dL 的新鲜乳糜微粒样品进行 TEM 成像。简而言之,将每个样品的 5-10 μL 放在 TEM 网格上并干燥。
- 用透射电子显微镜检查网格并捕获图像。测量脂蛋白颗粒大小并使用 ImageJ 软件进行分析(参见 材料表)。
结果
图2 显示了肠系膜淋巴液中的甘油三酯分泌和最近n = 17野生型(WT)小鼠的平均淋巴流速,这些小鼠接受了此处描述的单日淋巴瘘手术。如图 2A所示,淋巴液中的甘油三酯浓度响应于300μLSMOFLipid的十二指肠内推注而增加。在推注后~2-3小时达到甘油三酯峰值浓度,并在6小时时间(安乐死前立即)稳步下降。与甘油三酯分泌同时,淋巴流速从时间0推注到实验结束增加(图2B)。
这些结果表明,肠系膜淋巴管和十二指肠内插管的手术植入已经发生,并且代表了阳性对照,其他淋巴内容物(激素,肽,营养素)可以作为基准。如果淋巴液中的甘油三酯浓度没有响应于十二指肠内推注脂质而变化,这表明手术对小肠造成了重大损害,因此脂质吸收能力不存在,或者在以前未表型遗传模型中,这表明小鼠存在脂质吸收缺陷,这在生理上是有意义的。
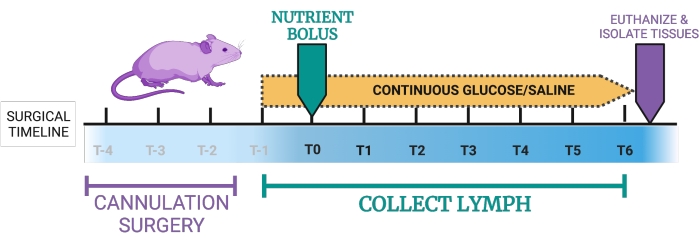
图1:淋巴瘘小鼠模型的拟议时间表。 T-4,T-3,T-2:双插管大约需要2-4小时,然后将小鼠放置在恢复室中。T-1:一旦小鼠处于恢复期,它们接受5%葡萄糖-0.9%盐水的连续十二指肠输注。T0:连续十二指肠内输注从5%葡萄糖-0.9%盐水切换到实验营养素输注。T0-T6:小鼠在盐水中连续接受十二指肠内5%葡萄糖,或者连续营养。在此期间每小时收集一次淋巴液。终点:对小鼠实施安乐死,并可以收集组织。这个数字是用 BioRender.com 创建的。 请点击此处查看此图的大图。
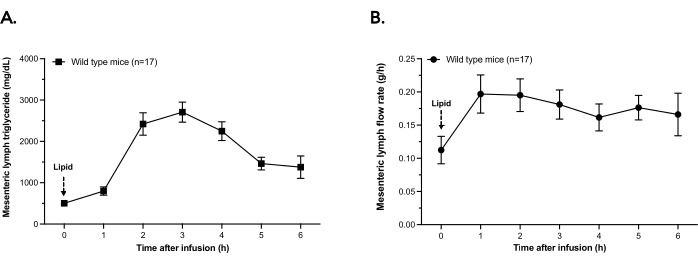
图2:肠系膜淋巴甘油三酯浓度和流速。 野生型小鼠装有十二指肠内饲管和肠系膜淋巴插管。小鼠接受300μL脂质的推注。每小时等分试样收集淋巴液6小时,并保存在冰上。(A)淋巴甘油三酯含量通过每小时等分试样中的化学测定来确定。(B)在推注后6小时内,淋巴流量绘制为每小时分泌的淋巴液克数。点是 SEM ±手段。 请点击此处查看此图的大图。
| 脂质输送方法 | 建议/说明 | |||||
| 混合脂质乳剂推注 | 可通过十二指肠内输注管使用 0.3 mL 剂量的 (A) 脂质素 III 20% 脂质注射剂或 (B) SMOFlipid 20% 脂质注射乳剂 USP。这些乳化脂质是有用的,因为它们不需要事先制备,在室温下是液体的,是无菌的,并且因为它们含有游离脂肪酸,甘油三酯,磷脂和牛磺胆酸钠的"易于消化"混合物。对于可能有胰腺或胆道功能不全的小鼠来说,这是一个很好的入门输液。 | |||||
| 推注甘油三酯 | 0.3毫升温和加热的橄榄油(或纯化的三油酸甘油酸)作为中性脂质,反映富含不饱和脂肪的饮食,猪油(反映高饱和脂肪含量的饮食)或椰子油(反映高中链甘油三酯含量的饮食)都可以通过十二指肠内输液管或口服强饲法给予。如果实验甘油三酯饱和,则必须在室温下将其加热为液体。 | |||||
| 混合餐推注 | 0.3毫升 确保含有0.075克脂肪(21.6%)、0.5克碳水化合物(64.0%)和0.1125克蛋白质(14.4%)的配方,并反映低脂混合餐,可通过十二指肠内输注给药。 | |||||
| 放射性标记的脂质推注 | 5.0 μCi 3 H标记的甘油三油酸酯和/或 1.0 μCi 14C 胆固醇在 0.3mL 橄榄油中可通过十二指肠内输注给药。14C-胆固醇:胆固醇-[4-14C],比活性为55Ci/mmol,浓度为0.1mCi/mL。3H-TG 三油酸甘油酯 [9,10-3H(N)] (3H-TG),比活性为 60Ci/mmol,浓度为 1mCi/mL | |||||
| 连续剂量 | 以 0.3 mL/h 的速率(而不是 0.3 mL 的总推注)输注上述任何实验性营养素制剂,将导致甘油三酯稳定地输出到淋巴中。这与推注不同,其中淋巴液中的甘油三酯浓度在~2-3小时达到峰值,然后在~6-8小时恢复到基线浓度。 | |||||
表1:脂质输注表。
讨论
最初的2天淋巴瘘手术由Bollman等人描述25,并由Patrick Tso的实验室实践了45 年26,27。这里介绍的方案是对这种经典的金标准方法的有力补充,用于识别、量化和了解小肠独特的乳糜分泌物,以及膳食营养吸收和代谢、肠道激素和肠道免疫的 体内 动力学。
该模型的优点包括:(1)能够在整个喂养和餐后期间连续取样肠系膜淋巴,而不是在吸收、消化或分泌过程中的某个时间点进行静态取样;(2)直接在其生理区室中而不是在血液中测量肠道激素和细胞因子,在那里它们被稀释和酶降解17,44;(3)能够分离、定量和表征摄入脂质粉后小肠分泌的脂蛋白,并且肠系膜淋巴中没有内皮脂肪酶,从而保留乳糜微粒甘油三酯浓度和天然乳糜微粒结构46,47;(4)能够直接测量淋巴流速、甘油三酯和胆固醇(或其他十二指肠注入化合物)的输出、乳糜微粒成分和肠道激素浓度。最后,该协议允许在6小时内每小时收集相对大量的>50μL淋巴液。随着十二指肠内盐水和葡萄糖输注补充液体,淋巴瘘模型比其他淋巴取样技术显着改善,并导致肠系膜淋巴液流动而不是静态池。由于体积是脂质组学、蛋白质组学和代谢组学方法的主要障碍,因此这是一个主要优势。
与原始淋巴瘘方案相比,此处描述的 1 天小鼠淋巴瘘方案有几个优点,包括由于手术后存活率更高,实验动物总数从先前描述的 2 天淋巴瘘方案26,27 减少;将整体实验时间从2天减少到一天;最后,小鼠的恢复期从可能发生突破性疼痛或术后不良结果的过夜(>18小时)缩短到术后更易于管理的~6小时。
这个为期 1 天的协议的一个特点是关注人道考虑和终点。这些必须优先考虑:(1)动物必须接受十二指肠内或静脉补液;(2)它们必须保持温暖并尽可能无痛(术后使用丁普瑞克斯和/或卡洛芬,取决于实验设计和避免抗炎作用的需要);(3)出血、颤抖、腹泻或痛苦迹象都是人道终点的令人信服的理由。根据严格的IACUC指南,异氟醚后颈椎脱位是一个很好的终点。单天的手术存活率为~70%(与最初的2天手术的~40%相比),但研究人员应该毫不犹豫地在出现痛苦迹象时结束实验。在规划动物数量时应考虑到这一点。
在排除该技术的故障方面,成功放置淋巴插管是该外科手术的主要瓶颈。在练习手术时,在手术前约2小时用0.3mL橄榄油管饲小鼠有助于。这将导致乳糜微粒分泌到肠系膜淋巴管中,使其看起来"乳白色"且更明显。也可以使用亚甲蓝,但通常不如乳白色淋巴管明显。如果在放置淋巴插管并用胶水放置后,肠系膜淋巴成功地通过套管流入收集血管,则可以继续放置十二指肠输液管。有时,淋巴液可能不会连续流动,但当动物放在旋转台上时可能会再次开始流动。至关重要的是,注意淋巴管内的凝块。这些应从管中按摩出来,以防止淋巴管上的回流压力。
除了甘油三酯分泌和淋巴流速外,该技术还可用于确定以下脂质吸收动力学和乳糜微粒特性:
乳糜微粒分泌45,48,49
在含有脂肪的膳食后,循环血浆甘油三酯会立即短暂升高。由于甘油三酯本身具有疏水性,因此必须首先乳化它们才能溶于血液50。小肠小肠细胞发挥这一作用,将膳食甘油三酯包装成乳糜微粒51。乳糜微粒的核心含有胆固醇和膳食甘油三酯,周围环绕着磷脂和载脂蛋白,包括apoB-48、apoA-I、apoA-IV和apoC-III52,53,54,55。ApoB-48是必需的结构蛋白,其他载脂蛋白具有乳糜微粒代谢和清除血液中所需的各种功能。为了确定乳糜微粒的关键特征,包括其甘油三酯和载脂蛋白含量,应使用此处所示的 1 天淋巴瘘技术。乳糜微粒分泌率是分泌到淋巴中的输注 3H-甘油三酯的百分比,并通过每小时计数淋巴样本通过闪烁来测量。这可以与详细的乳糜微粒表征相结合 48,49,56,57,58。每小时淋巴样本可以合并或单独保存。将淋巴液转移到超速离心管中,与0.9%NaCl混合,然后小心地用300-500μL的0.87%NaCl覆盖。然后将样品在4°C下以110,000×g超离心16小时。收集含有分离乳糜微粒的顶部馏分,并使用甘油三酯测定试剂盒测试甘油三酯浓度。简而言之,将2μL乳糜微粒(1:10稀释)与200μL酶试剂在室温下在96孔板中孵育10分钟。板由读板器在500nm处读取,标准品和空白用于计算甘油三酯浓度。然后可以通过负染色和透射电子显微镜(TEM)确定乳糜微粒的大小14,29。甘油三酯和胆固醇可以通过ELISA试剂盒或蛋白质印迹的化学测定和载脂蛋白含量(apoB-48,A-I,C-II,C-III)进行定量。
确定脂质吸收的主要部位48,59
通过在输注3H-甘油三酯或放射性标记的混合餐后6小时分离十二指肠,空肠和回肠的管腔和上皮细胞区室,提取内容物以确定有多少3 H-甘油三酯在上皮细胞膜上吸收(正常)或沿小肠长度保留在管腔(异常)中48.如果胃肠道动力存在潜在差异60,61,62,如果存在关于胆汁酸(在整个脂质吸收过程中高度活跃,并且它们本身在回肠中重吸收)的假设63,64,65,66,或者如果担心营养物质在错误的解剖位置(回肠甚至结肠)被吸收,则这些研究特别有影响67,68,69,70.
鉴定3H-甘油三酯转运到吸收性上皮细胞中的机制 48
这是通过计算 肠腔中水解成 3H-无H脂肪酸,吸收到粘膜中并在分泌为乳糜微粒之前重新酯化为细胞内 3H-甘油三酯的百分比来完成的。这是吸收/分泌缺陷的有力标志物,因为它可以追踪到膳食甘油三酯进入其分解产物并随后包装成乳糜微粒的运动。脂肪酸吸收机制(CD36,FABP,ACSL),再酯化途径(MGAT,DGAT,MTTP,apoB)和载脂蛋白(APOC-III,B-48,C-II,A-I,A-IV)的mRNA表达可以通过RT-PCR进一步定量。
该技术的未来应用仅受到对肠道器官串扰,新陈代谢,免疫力,营养吸收,环境饮食污染物或在胃肠道系统中起作用的任何其他疾病的兴趣的限制。由于难以进入关键的肠系膜淋巴系统,许多令人信服的实验和假设很可能已经停滞不前,并且这种可视化方案的目标是使该技术更容易获得。分离乳糜微粒及其最初所在的肠系膜淋巴液是了解全身代谢的关键部分;1天小鼠淋巴瘘模型是研究这些事件的强大生理模型。
披露声明
作者没有什么可透露的。
致谢
我们非常感谢囊性纤维化基金会(试点和可行性奖1810,ABK),Rainin基金会(协同奖,PI GJ Randolph和Co-I ABK)和美国国立卫生研究院(R01DK118239,R03DK116011到ABK)对这些研究的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride Injection, USP sterile | Hospira, Lake Forest, IL, US | NDC 0409-4888-06 | |
| 1.7 mL Eppendorf tubes | Fisher Scientific, Waltham, MA, US | 7200184 | |
| 14C-cholesterol: Cholesterol-[4-14C] (0.1mCi/ mL) | American Radiolabeled Chemicals Inc., St. Louis, MO, US | ARC 0857 | |
| 18 G needle | Becton Dickinson, Franklin Lakes, NJ, US | 305199 | |
| 2 Dumont micro-dissecting forceps | Fine Science Tools, Foster City, CA, US | 11251-35 | |
| 2 Forceps | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5130 | |
| 3H-TAG: Triolein [9,10-3H(N)] (3H-TG) (1mCi/ mL) | American Radiolabeled Chemicals Inc., St. Louis, MO, US | ART0199 | |
| 3H-TG Triolein [9,10-3H(N)] (3H-TG) | American Radiolabeled Chemicals, INC. St. Louis | MO 63146 | |
| 50% Dextrode Injection, USP 25grams/50 mL sterile | Hospira, Lake Forest, IL, US | NDC-0409-6648-16 | |
| Analtech TLC Uniplates: silica gel matrix Z265500-1PAK | Fisher Scientific, Waltham, MA, US | 11-101-0007 | |
| BD CareFusion ChloraPrep Swabstick | Fisher Scientific, Waltham, MA, US | 14-910-501 | |
| Betadine surgical scrub | Dynarex Corp., Orangeburg, NY, US | 1201 | |
| Bevel-cut cannula | Braintree Scientific., Braintree , MA, US | MRE025 | |
| Buprenorphine HCl Injection Carpuject PFS 0.3mg/mL 10/Bx (Buprenex) | HenrySchein, Warrendale, PA, US | 1278184 | |
| C57BL6/J male mice | Jackson Laboratory, Bar Harbor, Maine | ||
| ChloraPrep | Becton Dickinson, Franklin Lakes, NJ, US | 260100 | |
| Cholesterol Assay Kit | FujiFilm Healthcare, Lexington, MA, US | 99902601 | |
| Cholesterol-[4-14C] | American Radiolabeled Chemicals, INC. St. Louis | MO 63146 | |
| Clear plexiglass box L43cm X W26 X H 21 with temperature-controlled heating pad and humidification | our own design and modifications | ||
| commercially available amphibian/reptile heating pad | ShenZhen XingHongChang Electric CO., LTD. ShenZhen, China | XHC-F035D | |
| Cotton tip applicators | Fisher Scientific, Waltham, MA, US | 22363156 | |
| Duodenal infusion tube - canuala | Braintree Scientific, Braintree , MA, US | MRE037 | |
| Ensure | Abbott Nutrition, Columbus, OH | ||
| Heating pad surgical platform with circulating warm water pump combination | Patterson Scientific, Waukesha, WI, US | Gaymar T/Pump Classic | |
| Hetarin Sodium Injection, USP 1,000 units/mL sterile | Mylan, Morgantown, WV, US | NDC-67457-384-31 | |
| Image J Software | National Institute of Health, Bethesda, Maryland, | ||
| Iris scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5602 | |
| Isoflurane | Piramal Pharma Solutions, Riverview, MI, US | NDC 66794-017-25 | |
| Isoflurane induction apparatus and Anesthesia Apparatus | Patterson Scientific, Waukesha, WI, US | mouse induction chamber | |
| Krazy glue | Elmer's products Inc., Columbus, OH, US | KG484 | |
| Liposyn III 20% lipid injectable | Hospira Inc. Lake Forest, Illinois, USA | ||
| LS 6500 Multi-Purpose Scintillation Counter | Beckman Coulter, Brea, CA | ||
| Micro-dissecting Spring Scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5602 | |
| Mouse apoB ELISA Kit | ABCAM Inc., Waltham, MA, US | ab230932-1 | |
| Needle Holder | Fine Science Tools, Foster City, CA, US | 12002-12 | |
| Retractors | Kent Scientific Co., Torrington, CT, US | SURGI-5001 | |
| Rimadyl (Carprofen) | Zoetis Inc., Kalamazoo MI, US | 4019449 | |
| Rotating table Barnstead Thermolyne | Labquake, Zürich, Switzerland | Barnstead Thermolyne | |
| SMOFlipid 20% lipid injectable emulsion, USP | Fresenius Kabi, Warrendale, PA, US | NDC-63323-820-01 | |
| Snuggle | Lomir Biomedical Inc., Notre-Dame-de-l'Île-Perrot, QC J7V 7M4, Canada | MS 02.5PM | |
| Surgical Scissors | ROBOZ Surgical Instrument Co., Gaithersburg, MD, US | RS-5912SC | |
| Suture (5-0 silk with needle) | DemeTECH, Miami Lakes, FL, US | DT-719 | |
| Transmission Electron Microscope (JEOL 1400-FLASH 120KV ) | JEOL, Peabody, MA | ||
| Triglyceride Assay Kit | Randox Laboratories, Crumlin, United Kingdom | TR210 | |
| ULTIMA GOLD XR Scintillation Fluid | Perkin Elmer, Hebron, KY, US | 6013119 | |
| Ultracentrifuge, rotor S100AT4-497 | SORVALL RC M120 GX |
参考文献
- Natale, G., Bocci, G., Ribatti, D. Scholars and Scientists in the History of the Lymphatic System. Journal of Anatomy. 231 (3), 417-429 (2017).
- Loukas, M., et al. The lymphatic system: A historical perspective. Clinical Anatomy. 24 (7), 807-816 (2011).
- Suy, R., Thomis, S., Fourneau, I. The discovery of the lymphatic system in the seventeenth century. Part II: The discovery of Chyle vessels. Acta Chirurgica Belgica. 116 (5), 325-331 (2016).
- Azzali, G. Historical notes on the lymphatic vascular system. Acta Bio-medica de L'Ateneo Parmense. 61 (3-4), 113-125 (1990).
- Irschick, R., Siemon, C., Brenner, E. The history of anatomical research of lymphatics - From the ancient times to the end of the European Renaissance. Annals of Anatomy. 223, 49-69 (2019).
- Swartz, M. A. The physiology of the lymphatic system. Advanced Drug Delivery Reviews. 50 (1-2), 3-20 (2001).
- Deitch, E. A. Gut lymph and lymphatics: A source of factors leading to organ injury and dysfunction. Annals of the New York Academy of Sciences. 1207, 103-111 (2010).
- Tso, P., Gollamudi, S. R. Pluronic L-81: A potent inhibitor of the transport of intestinal chylomicrons. American Journal of Physiology. 247, 32-36 (1984).
- Tso, P., Karlstad, M. D., Bistrian, B. R., DeMichele, S. J. Intestinal digestion, absorption, and transport of structured triglycerides and cholesterol in rats. American Journal of Physiology. 268, 568-577 (1995).
- Mansbach, C. M., Dowell, R. F., Pritchett, D. Portal transport of absorbed lipids in rats. American Journal of Physiology. 261, 530-538 (1991).
- Bogunovic, M., et al. Origin of the lamina propria dendritic cell network. Immunity. 31 (3), 513-525 (2009).
- Balmer, M. L., et al. The liver may act as a firewall mediating mutualism between the host and its gut commensal microbiota. Science Translational Medicine. 6 (237), (2014).
- Ji, Y., Sakata, Y., Tso, P. Nutrient-induced inflammation in the intestine. Current Opinion in Clinical Nutrition & Metabolic Care. 14 (4), 315-321 (2011).
- Ji, Y., Sakata, Y., Yang, Q., Tso, P. Intestinal mucosal mast cells is activated by fat absorption. Gastroenterology. 140 (5), (2011).
- Wang, F., et al. Chronic high-fat feeding increases mixed meal-induced incretin secretion in Sprague-Dawley rats. American Journal of Physiology-Gastrointestinal and Liver Physiology. 309 (10), 807-815 (2015).
- Kindel, T. L., Yoder, S. M., D'Alessio, D. A., Tso, P. The effect of duodenal-jejunal bypass on glucose-dependent insulinotropic polypeptide secretion in Wistar rats. Obesity Surgery. 20 (6), 768-775 (2010).
- Kohan, A. B., Yoder, S. M., Tso, P. Using the lymphatics to study nutrient absorption and the secretion of gastrointestinal hormones. Physiology & Behavior. 105 (1), 82-88 (2011).
- Yoder, S. M., Yang, Q., Kindel, T. L., Tso, P. Stimulation of incretin secretion by dietary lipid: Is it dose dependent. American Journal of Physiology-Gastrointestinal and Liver Physiology. 297 (2), 299-305 (2009).
- Wang, Y., et al. Chylomicrons promote intestinal absorption and systemic dissemination of dietary antigen (ovalbumin) in mice. PLoS One. 4 (12), 8442 (2009).
- Vors, C., et al. Postprandial endotoxemia linked with chylomicrons and lipopolysaccharides handling in obese versus lean men: A lipid dose-effect trial. Journal of Clinical Endocrinology and Metabolism. 100 (9), 3427-3435 (2015).
- Ghoshal, S., Witta, J., Zhong, J., de Villiers, W., Eckhardt, E. Chylomicrons promote intestinal absorption of lipopolysaccharides. Journal of Lipid Research. 50 (1), 90-97 (2009).
- Jandacek, R. J., Rider, T., Keller, E. R., Tso, P. The effect of olestra on the absorption, excretion and storage of 2,2',5,5' tetrachlorobiphenyl; 3,3',4,4' tetrachlorobiphenyl; and perfluorooctanoic acid. Environment International. 36 (8), 880-883 (2010).
- Jandacek, R. J., Tso, P. Organochlorine compounds are absorbed via lymph and portal circulation. The FASEB Journal. 22, (2008).
- Utermann, G., Beisiegel, U. Apolipoprotein A-IV: A protein occurring in human mesenteric lymph chylomicrons and free in plasma. Isolation and quantification. European Journal of Biochemistry. 99 (2), 333-344 (1979).
- Bollman, J. L., Cain, J. C., Grindlay, J. H. Techniques for the collection of lymph from the liver, small intestine, or thoracic duct of the rat. Journal of Laboratory and Clinical Medicine. 33 (10), 1349-1352 (1948).
- Tso, P., Balint, J. A., Rodgers, J. B. Effect of hydrophobic surfactant (pluronic L-81) on lymphatic lipid transport in the rat. American Journal of Physiology. 239 (5), 348-353 (1980).
- Liu, M., et al. Sexual dimorphism in intestinal absorption and lymphatic transport of dietary lipids. Journal of Physiology. 599 (22), 5015-5030 (2021).
- Manolas, K. J., et al. Lymph, pancreatic and gastrointestinal hormones in response to feeding in the conscious pig. European Surgical Research. 17 (5), 324-332 (1985).
- Lascelles, A. K., Morris, B. Surgical techniques for the collection of lymph from unanaesthetized sheep. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 46, 199-205 (1961).
- Jensen, L. T., Olesen, H. P., Risteli, J., Lorenzen, I. External thoracic duct-venous shunt in conscious pigs for long term studies of connective tissue metabolites in lymph. Laboratory Animal Science. 40 (6), 620-624 (1990).
- Edwards, G. A., Porter, C. J., Caliph, S. M., Khoo, S. M., Charman, W. N. Animal models for the study of intestinal lymphatic drug transport. Advanced Drug Delivery Reviews. 50 (1-2), 45-60 (2001).
- Yasunaga, K., Saito, S., Zhang, Y. -. L., Hernandez-Ono, A., Ginsberg, H. N. Effects of triacylglycerol and diacylglycerol oils on blood clearance, tissue uptake, and hepatic apolipoprotein B secretion in mice. Journal of Lipid Research. 48 (5), 1108-1121 (2007).
- Curtin, A., et al. Elevated triglyceride-rich lipoproteins in diabetes. A study of apolipoprotein B-48. Acta Diabetologica. 33 (3), 205-210 (1996).
- Gordts, P. L. S. M., et al. ApoC-III inhibits clearance of triglyceride-rich lipoproteins through LDL family receptors. Journal of Clinical Investigation. 126 (8), 2855-2866 (2016).
- Ginsberg, H. N., et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. The Journal of Clinical Investigation. 78 (5), 1287-1295 (1986).
- Ormai, S., Palkovits, M. Size distribution of lymphocytes in the thoracic duct lymph in rat after lymphocyte mobilization induced by polymethacrylic acid. Blut Zeitschrift für die Gesamte Blutforschung. 24 (3), 161-165 (1972).
- Luchoomun, J., Hussain, M. M. Assembly and secretion of chylomicrons by differentiated Caco-2 cells. Nascent triglycerides and preformed phospholipids are preferentially used for lipoprotein assembly. Journal of Biological Chemistry. 274 (28), 19565-19572 (1999).
- Nollevaux, G., et al. Development of a serum-free co-culture of human intestinal epithelium cell-lines (Caco-2/HT29-5M21). BMC Cell Biology. 7 (1), 20 (2006).
- Li, D., Dong, H., Kohan, A. B. The Isolation, Culture, and Propagation of Murine Intestinal Enteroids for the Study of Dietary Lipid Metabolism. Organoids. Methods in Molecular Biology. 1576, 195-204 (2019).
- Jattan, J. J., et al. Using murine-derived primary intestinal enteroids for studies of dietary triglyceride absorption and lipoprotein synthesis, and to determine the role of intestine-specific ApoC-III in the intestine. Journal of Lipid Research. 58 (5), 853-865 (2017).
- Haring, E., et al. Bile acids regulate intestinal antigen presentation and reduce graft-versus-host disease without impairing the graft-versus-leukemia effect. Haematologica. 106 (8), 2131-2146 (2021).
- Date, S., Sato, T. Mini-gut organoids: Reconstitution of the stem cell niche. Annual Review of Cell and Developmental Biology. 31 (1), 269-289 (2015).
- Deacon, C. F. Circulation and degradation of GIP and GLP-1. Hormone and Metabolic Research. 36 (11-12), 761-765 (2004).
- Dedousis, N., Teng, L., Kanshana, J. S., Kohan, A. B. A single-day mouse mesenteric lymph surgery in mice: an updated approach to study dietary lipid absorption, chylomicron secretion, and lymphocyte dynamics. J Lipid Res. 63 (11), 100284 (2022).
- Li, D., et al. Intestinal basolateral lipid substrate transport is linked to chylomicron secretion and is regulated by ApoC-III. Journal of Lipid Research. 60 (9), 1503-1515 (2019).
- Glatzle, J., et al. Chylomicron components mediate intestinal lipid-induced inhibition of gastric motor function. American Journal of Physiology-Gastrointestinal and Liver Physiology. 282 (1), 86-91 (2002).
- Huang, J., Sloop, C. H., Roheim, P. S., Wong, L. Lipoprotein lipase and hepatic triacylglycerol lipase activities in peripheral and skeletal muscle lymph. Arteriosclerosis, Thrombosis, and Vascular Biology. 10 (5), 720-726 (1990).
- Wang, F., et al. Overexpression of apolipoprotein C-III decreases secretion of dietary triglyceride into lymph. Physiological Reports. 2 (3), 00247 (2014).
- Kohan, A. B., et al. Apolipoprotein A-IV regulates chylomicron metabolism-Mechanism and function. American Journal of Physiology. Gastrointestinal and Liver Physiology. 302 (6), 628-636 (2012).
- Hayashi, H., et al. Fat feeding increases size, but not number, of chylomicrons produced by small intestine. American Journal of Physiology. 259 (5), 709-719 (1990).
- Tso, P., Balint, J. A. Formation and transport of chylomicrons by enterocytes to the lymphatics. American Journal of Physiology. 250 (6), 715-726 (1986).
- Bhattacharya, S., Redgrave, T. G. The content of apolipoprotein B in chylomicron particles. Journal of Lipid Research. 22 (5), 820-828 (1981).
- Björkegren, J., Karpe, F., Milne, R. W., Hamsten, A. Differences in apolipoprotein and lipid composition between human chylomicron remnants and very low density lipoproteins isolated from fasting and postprandial plasma. Journal of Lipid Research. 39 (7), 1412-1420 (1998).
- Martins, I. J., Sainsbury, A. J., Mamo, J. C., Redgrave, T. G. Lipid and apolipoprotein B48 transport in mesenteric lymph and the effect of hyperphagia on the clearance of chylomicron-like emulsions in insulin-deficient rats. Diabetologia. 37 (3), 238-246 (1994).
- Mar, R., et al. Association of the APOLIPOPROTEIN A1/C3/A4/A5 gene cluster with triglyceride levels and LDL particle size in familial combined hyperlipidemia. Circulation Research. 94 (7), 993-999 (2004).
- Kassis, T., et al. Dual-channel in-situ optical imaging system for quantifying lipid uptake and lymphatic pump function. Journal of Biomedical Optics. 17 (8), 086005 (2012).
- Nauli, A. M., et al. Chylomicrons produced by Caco-2 cells contained ApoB-48 with diameter of 80-200 nm. Physiological Reports. 2 (6), 192-196 (2014).
- Drover, V. A., et al. CD36 deficiency impairs intestinal lipid secretion and clearance of chylomicrons from the blood. Journal of Clinical Investigation. 115 (5), 1290-1297 (2005).
- Kohan, A. B., et al. Is apolipoprotein A-IV rate limiting in the intestinal transport and absorption of triglyceride. American Journal of Physiology-Gastrointestinal and Liver Physiology. 304 (12), 1128-1135 (2013).
- De Lisle, R. C. Altered transit and bacterial overgrowth in the cystic fibrosis mouse small intestine. American Journal of Physiology-Gastrointestinal and Liver Physiology. 293 (1), 104-111 (2007).
- Debas, H. T., Farooq, O., Grossman, M. I. Inhibition of gastric emptying is a physiological action of cholecystokinin. Gastroenterology. 68 (5), 1211-1217 (1975).
- Spiller, R. C., et al. Further characterisation of the 'ileal brake' reflex in man--Effect of ileal infusion of partial digests of fat, protein, and starch on jejunal motility and release of neurotensin, enteroglucagon, and peptide YY. Gut. 29 (8), 1042-1051 (1988).
- Battle, M. A., et al. GATA4 is essential for jejunal function in mice. Gastroenterology. 135 (5), 1676-1686 (2008).
- Morgan, R. G., Borgström, B. The mechanism of fat absorption in the bile fistula rat. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 54 (2), 228-243 (1969).
- Davidson, N. O., Kollmer, M. E., Glickman, R. M. Apolipoprotein B synthesis in rat small intestine: Regulation by dietary triglyceride and biliary lipid. Journal of Lipid Research. 27 (1), 30-39 (1986).
- Bouchi, R., et al. FOXO1 inhibition yields functional insulin-producing cells in human gut organoid cultures. Nature Communications. 5, 4242 (2014).
- Bijvelds, M. J. C., et al. Fat absorption in cystic fibrosis mice is impeded by defective lipolysis and post-lipolytic events. American Journal of Physiology-Gastrointestinal and Liver Physiology. 288 (4), 646-653 (2005).
- Struyvenberg, M. R., Martin, C. R., Freedman, S. D. Practical guide to exocrine pancreatic insufficiency - Breaking the myths. BMC Medicine. 15 (1), 29 (2017).
- Tickell, K. D., Atlas, H. E., Walson, J. L. Environmental enteric dysfunction: A review of potential mechanisms, consequences and management strategies. BMC Medicine. 17 (1), 181 (2019).
- Lo, C. M., et al. Cholecystokinin knockout mice are resistant to high-fat diet-induced obesity. Gastroenterology. 138 (5), 1997-2005 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。