Method Article
秀丽隐杆线虫种系内突触复合体的超分辨率显微镜
摘要
超分辨率显微镜可以详细了解减数分裂中突触复合物内成分的组织。在这里,我们展示了一种解析 秀丽隐杆线虫 突触复合物的单个蛋白质的方案。
摘要
在减数分裂期间,同源染色体必须相互识别并粘附,以允许它们正确分离。确保同源染色体相互作用的关键事件之一是减数分裂前期I中突触复合体(SC)的组装。尽管不同物种之间SC内的蛋白质成分之间几乎没有序列同源性,但SC的总体结构在进化过程中一直高度保守。在电子显微照片中,SC表现为由横向元件或轴,横向细丝和中心元件组成的三方梯状结构。
然而,通过电子显微镜精确识别复合物中单个组分的定位以确定SC的分子结构仍然具有挑战性。相比之下,荧光显微镜可以鉴定复合物中的单个蛋白质成分。然而,由于SC只有~100nm宽,其亚结构无法通过衍射限制的传统荧光显微镜来解析。因此,确定SC的分子结构需要超分辨率光学显微镜技术,例如结构照明显微镜(SIM),受激发射耗尽(STED)显微镜或单分子定位显微镜(SMLM)。
为了保持SC内各个组分的结构和相互作用,重要的是在接近其生殖细胞天然环境的环境中观察复合物。因此,我们展示了一种免疫组织化学和成像方案,该方案能够用SMLM和STED显微镜研究完整的挤出 秀丽隐杆线虫 种系组织中SC的亚结构。将组织直接固定在盖玻片上可减少成像过程中样品的移动,并最大限度地减少样品中的像差,以实现在其生物学环境中可视化SC亚结构所需的高分辨率。
引言
在减数分裂期间将染色体数量减少一半是在有性繁殖生物中产生健康后代的关键。为了实现染色体数量的减少,同源染色体必须在减数分裂I期间配对和分离。为了确保同源染色体的准确分离,生殖细胞经历了延长的前期I,在此期间同源染色体配对,突触和重组以在同源物之间产生物理联系1。SC已成为调节减数分裂前期2正确进展的关键中心结构。
SC是一种复合物,其一般结构在进化上是保守的,即使其蛋白质成分之间几乎没有同源性。SC首先在电子显微照片中被鉴定为由两个横向元件或轴组成的三方梯状结构,一个由横向细丝形成的中心区域和一个中心元件3,4。确定复合体中各个组件的组织是促进我们对SC在减数分裂前期中的作用的理解的关键。
模式生物秀丽隐杆线虫非常适合研究SC的结构和功能,因为它的种系包含大量具有完全组装的SCs5的减数分裂细胞核。遗传和生化研究表明,染色体轴由秀丽隐杆线虫中三种不同的凝聚素复合物6,7 和四种称为 HTP-1/2/3 和 HIM-37,8,9,10,11 的 HORMA 结构域蛋白形成。在SC的中心区域,迄今为止已经鉴定出六种含有线圈结构域的蛋白质12,13,14,15,16,17。为了弥合两个轴之间的距离,SYP-1、-5 和 -6 以头对头的方式二聚化(图 1),而另外三种蛋白质稳定它们在中心元件16,17,18,19 中的相互作用。
详细了解这些蛋白质的组织对于了解SC在减数分裂过程中的许多功能至关重要。由于SC中心区域的宽度仅为~100nm,因此其亚结构无法通过衍射极限荧光显微镜解析。然而,通过超分辨率显微镜很容易实现这种尺寸结构中的组件可视化。事实上,结构照明显微镜(SIM)、扩展显微镜20、受激发射耗尽(STED)显微镜21和单分子定位显微镜(SMLM)22,23已成为研究SC跨物种分子结构的重要工具16,24,25,26,27,28,29,30.
为了克服分辨率限制,STED显微镜依赖于将发射光的衍射极限光斑与STED激光器的甜甜圈形光束叠加,理论上将点扩散函数限制在分子维度31,32。然而,STED在生物样品中实际可以实现的分辨率仍然在 xy33中的几十纳米范围内。
使用SMLM技术可以获得更高的生物样品分辨率。SMLM 利用特定荧光团的闪烁特性,通过及时分离空间重叠的荧光团,在亚衍射水平上分离物体。然后对样品进行重复成像以捕获荧光团的不同子集。然后,通过将点扩散函数(PSF)拟合到所有图像中获得的信号来确定样品中荧光团的位置,这可以解析低至15 nm23,34的结构。
总之,局部图像编码所有荧光团的位置。SMLM的分辨率由荧光团的标记密度和闪烁特性决定。根据奈奎斯特-香农准则,不可能可靠地解析小于平均标签到标签距离两倍的物体。因此,高分辨率成像需要高标记密度。对于 秀丽隐杆线虫中的SC,通过使用基因组编辑连接到内源性蛋白质特定位点的表位标签可以实现高标记密度。然后可以使用具有高亲和力的特异性单克隆抗体对表位标签进行高密度染色19,30。同时,单个荧光基团的循环必须足够短,以确保不会同时捕获空间重叠的荧光团35。
由于这两个要求,解析大分子复合物(如SC)的结构需要对足够多的图像进行成像,因此可能需要几个小时。长成像时间的缺陷是样品由于载物台的移动或样品缓冲液内的小电流而容易漂移;即使是 10 nm 量级的微小运动在 nm 分辨率下也是有害的,必须进行校正。然而,常用的漂移校正方法不够稳健,无法精确叠加顺序成像的两个通道的图像36。这是有问题的,因为生物学问题经常要求精确检测和定位同一样品中的多个靶标。为了规避这些问题,已经开发了比率成像等方法。比率成像允许同时对具有重叠激发和发射光谱的多个荧光团进行成像,随后根据光谱不同通道37,38 中的强度比将每个检测到的信号分配到其各自的荧光团。
此外,研究SC等大分子复合物的组织需要三维(3D)信息。为了实现三维超分辨率(3D-SMLM),在发射光的光路中加入了柱面透镜,该透镜根据荧光团与焦平面的距离扭曲其PSF的形状。因此,可以通过分析其发射信号35,39的形状来推断荧光团在z平面中的精确位置。结合SMLM中的这些进步,可以对包括SC在内的大分子复合物进行3D组织的成像。
研究方案
1. 溶液和盖玻片的制备
注意:有关所有材料和试剂的详细信息,请参阅 材料 表,有关本协议中使用的溶液组成,请参阅 表1 。
- 聚-L-赖氨酸包衣盖玻片
- 制备0.01%(w / v)聚-L-赖氨酸(见 表1)。
- 在乙醇中洗涤精密盖玻片(直径24毫米;0.17±0.005毫米,1.5号)10-30分钟。用ddH2O冲洗盖玻片以除去乙醇,并使盖玻片在室温下干燥。
- 等离子清洁器清洁盖玻片。
注意:等离子清洗可提高盖玻片的亲水性,并有助于以下步骤。如果没有等离子清洗机,则可以跳过此步骤,尽管这可能需要调整聚-L-赖氨酸溶液的体积和/或浓度。此修改尚未经过测试。 - 将一滴(120μL)的0.01%(w / v)聚-L-赖氨酸放在盖玻片上。在室温下孵育10分钟。
- 孵育后,在ddH2O中冲洗盖玻片并在室温下干燥。在4°C下储存长达1个月。
- 与荧光有机染料偶联的F(ab')2片段
- 按以下顺序添加到 PCR 管中:在 PBS 中加入 10 μL 0.6-0.7 mg/mL F(ab')2 片段,在 DMSO 中加入 1 μL 0.1 M NaHCO 3 (pH8.3 ) 和 1 μL 1 mM 琥珀酰亚胺 (NHS) 酯反应性荧光团(F(ab')2:染料的摩尔比为 ~1:17)。通过上下移液充分混合。
- 在室温下孵育1小时。
- 按照制造商的规格,使用脱盐柱(7K MWCO)将F(ab')2片段与剩余的游离活性染料分离。使用1x PBS平衡色谱柱并洗脱标记的F(ab')2片段。
- 将标记的F(ab')2片段在4°C下储存长达3个月。
注意:存储时间超过 3 个月尚未经过测试。
2. 解剖和固定
注意:解剖和固定程序从先前推荐的程序16,40修改,以获得用于超分辨率显微镜的最佳样品。
- 解剖
- 将年龄匹配的 秀丽隐杆线虫 (在本研究中在20°C下生长)采摘到盖玻片(22mm x 22 mm,1号)上的30μLEBTT(1x鸡蛋缓冲液41 ,含0.2%非离子洗涤剂, 表1)中。将盖玻片放在载玻片上,以便于操作。用 30 μL EBTT 上下移液数次洗涤。取出 30 μL 溶液,在盖玻片上留下 30 μL 的液滴。
注意:必须在所有移液蠕虫的溶液中添加少量非离子洗涤剂,以防止蠕虫粘附在塑料吸头上。 - 使用手术刀刀片切断蠕虫的头部和/或尾巴以挤出性腺(图2A)。
- 将年龄匹配的 秀丽隐杆线虫 (在本研究中在20°C下生长)采摘到盖玻片(22mm x 22 mm,1号)上的30μLEBTT(1x鸡蛋缓冲液41 ,含0.2%非离子洗涤剂, 表1)中。将盖玻片放在载玻片上,以便于操作。用 30 μL EBTT 上下移液数次洗涤。取出 30 μL 溶液,在盖玻片上留下 30 μL 的液滴。
- 固定
- 将 30 μL 固定溶液(表 1)移液到解剖蠕虫的液滴中,上下移液混合。
注意:上下移液几次可能有助于释放更多的性腺。 - 添加固定溶液后固定正好 1 分钟。
- 通过将蠕虫转移到充满TBST的PCR管中来停止固定(表1)。以尽可能小的体积(~15μL)转移蠕虫。
- 在小型台式离心机(2,000 × g,10 s)上旋转PCR管。除去上清液,每次用 200 μL TBST 洗涤 2 次。
- 用 200 μL PBST(表 1)洗涤 5-10 分钟。对最多四个样品重复步骤2.1.1至2.2.5,同时将解剖的样品保持在冰上。
注意:如果处理四个以上的样品,请在每四个样品后继续执行步骤2.2.6至2.2.7,以确保所有样品的样品固定保持一致。 - 在小型台式离心机(2,000 × g,10 s)上旋转解剖样品,取出PBST,然后加入50-100μL冷甲醇(-20°C)。
注意:甲醇有毒。穿戴防护设备,避免吸入。 - 通过上下移液混合,并将样品留在甲醇中30-60秒。在 200 μL PBST 中洗涤样品 2 次。
注意:如果处理四个以上的样品,请继续解剖剩余的样品(步骤2.1.1至2.2.7)。 - 用 200 μL PBST 第三次洗涤样品。
- 将 30 μL 固定溶液(表 1)移液到解剖蠕虫的液滴中,上下移液混合。
3. 抗体孵育
- 阻塞
- 在室温下将样品封闭在1x封闭溶液(表1)中45-60分钟。
注意:孵育时间的范围可以从室温下的30分钟到4°C下的几天(测试最多3天)。
- 在室温下将样品封闭在1x封闭溶液(表1)中45-60分钟。
- 一抗溶液
- 在1x封闭溶液中将抗HTP-3(鸡42)和抗HA(小鼠)抗体(或所选抗体)稀释到工作溶液(SMLM为1:250,STED显微镜样品为1:1,000)。
注意:用于标记 SMLM 样品的抗体比 STED 样品更浓缩,因为建议对 SMLM 显微镜使用更高的标记密度。 - 在小型台式离心机(2,000 × g,10 s)上旋转样品,除去封闭缓冲液,然后加入 30-50 μL 一抗溶液。在4°C(优选)下孵育过夜或在室温下孵育1-2小时。
- 孵育后,用PBST洗涤3 x 5-15分钟。
- 在1x封闭溶液中将抗HTP-3(鸡42)和抗HA(小鼠)抗体(或所选抗体)稀释到工作溶液(SMLM为1:250,STED显微镜样品为1:1,000)。
- F(ab')2片段与荧光染料偶联的工作溶液
- 将标记的F(ab')2片段(步骤1.2.4)稀释到工作溶液中(SMLM为1:100,STED显微镜样品为1:1,000)。
注意:对于这两种超分辨率技术,使用了先前报道的荧光团对,即用于SMLM的AlexaFluor647 / CF680和用于STED的AlexaFluor594 / Abberior STAR635P。AlexaFluor647和STAR645P用于标记抗小鼠(Fab')2片段以靶向SYP-5的C末端,并使用CF680 / AlexaFluor594标记的抗鸡(Fab')2片段靶向HTP-3。 - 在小型台式离心机(2,000 × g,10 s)上旋转样品,取出PBST,然后加入30-50 μL二抗溶液。在室温(优选)下孵育30分钟至2小时或在4°C孵育过夜。 用PBST清洗3 x 5-15分钟。
- 将标记的F(ab')2片段(步骤1.2.4)稀释到工作溶液中(SMLM为1:100,STED显微镜样品为1:1,000)。
4. 将样品安装在盖玻片上
- 固定后
注意:通过步骤 4.1.1-4.2.1 单独处理样品。- 旋转染色样品并除去上清液。加入 50 μL PBST0.2 ,并将染色的蠕虫转移到 22 mm x 22 mm 1 号盖玻片上。
注意:此步骤使用新鲜PBST 0.2和0.2 %非离子洗涤剂(表1),以防止蠕虫粘附在盖玻片上。 - 将 5.7-6.3 μL 固定后溶液移液到聚-L-赖氨酸盖玻片上。
注意:储存在4°C的聚-L-赖氨酸盖玻片应首先达到室温。 - 以相同体积(5.7-6.3μL)移取解剖的蠕虫,并转移到聚-L-赖氨酸盖玻片上的固定剂滴中(图2B)。
注意:在此步骤和后续步骤中,将解剖的组织保留在聚-L-赖氨酸包被的盖玻片的中心非常重要。如果将样品安装在定制支架中以适合此处使用的定制SMLM显微镜,这一点尤其重要(参见步骤5.1, 图2B)。 - 用小盖玻片(直径12毫米, 图2B)盖住样品。使用一小张滤纸去除多余的液体(图2B)。在暗室中固定3-5分钟。
- 旋转染色样品并除去上清液。加入 50 μL PBST0.2 ,并将染色的蠕虫转移到 22 mm x 22 mm 1 号盖玻片上。
- "冻裂"
- 通过将样品放在干冰中的铝块上来冷冻样品(图2B)。
注意:在将样品放在铝块上之前,必须在干冰中充分冷却铝块。继续对剩余样品进行后固定(步骤4.1.1至4.2.1)。在下一步(4.2.2)之前,样品需要在干冰上至少20分钟或长达1小时。 - 使用剃须刀取出较小的盖玻片(图2B)。
注意:对于 STED,请继续执行步骤 5.2.1。对于 SMLM,请继续执行步骤 4.2.3。 - 将盖玻片浸入含有冰冷PBS(优选)或-20°C甲醇的50mL锥形管中约10秒。
注意:温度是此步骤的一个非常重要的因素。因此,请使用新鲜解冻或保存在冰/乙醇浴中的PBS。 - 将盖玻片放入装有PBST缓冲液的六孔板的孔中。从孔中取出PBST并添加新鲜的PBS。将样品留在PBS中5分钟。
注意:将PBS移液到孔的侧面,以避免损坏和分离样品。 - 用新鲜的PBS洗涤,并将样品保持在4°C直至成像。
注意:样品可稳定长达 2 周,但如果样品在 2 天内成像,则可获得最佳结果。 - 成像前,在体视显微镜下评估样品安装的质量。
注意:成功安装的生殖系稳定附着,相对于盖玻片没有明显的移动。附着不良的种系会在缓冲溶液中翻盖。
- 通过将样品放在干冰中的铝块上来冷冻样品(图2B)。
5. 成像
- 单分子定位显微镜
注意:图像是在EMBL成像中心使用定制的单分子定位显微镜采集的,该显微镜围绕定制身体构建,如之前报道的那样38,43,具有 目录;请参阅 https://www.embl.org/about/info/imaging-centre- 获取 3D 磁珠校准
- 准备带有贴壁 100 nm 荧光珠的精密盖玻片(直径 24 毫米;0.17 ± 0.005 毫米,第 1.5 号),如前所述38,44。
- 将步骤5.1.1.1中的校准样品放在样品架上。
- 在干净的100x/1.5油镜上加入一滴浸油,并将校准样品安装在显微镜上。
- 在 MicroManager 2 45,46 中,指定校准样本中的15-20 个位置。
- 在EMU插件窗口47内,为步骤5.1.1.5中的每个位置设置z堆栈图像的采集。
注意:在这里,复合柱面透镜提供了3D成像所需的散光,并且为每个位置采集了201个z切片,范围在-1μm至1μm之间,增量为10nm。每个z切片使用2 kW/cm2 640 nm激光照明25 ms。 - 通过相同的光路获取100nm荧光珠的 z-stack图像,该光路将用于在步骤5.1.11中获取样品图像。
- 使用超分辨率显微镜分析平台(SMAP48),生成实验点扩散函数(PSF)的 cspline 模型,该模型将用于拟合步骤5.1.13中的3D-SMLM数据。
- 准备样品架。对于此处使用的定制支架,它使用磁环来创建成像室(图2B),用封口膜包裹磁环。
注意:或者,可以使用带有凹陷腔的显微镜载玻片来安装带载玻片支架的显微镜样品。 - 准备 1 mL 成像缓冲液44 (表 1)。
- 从步骤4.2.6中取出一张盖玻片,并将其放入定制的支架中。用封口膜包裹的磁环将盖玻片固定在支架中(步骤5.1.2)。
- 轻轻地将成像缓冲液(步骤5.1.3)移入由样品顶部的磁环产生的腔室中(图2B)。用封口膜密封腔室。
- 要安装样品,请在干净的100x/1.5油物镜上加入一滴浸油。在不向浸油中引入任何空气的情况下,将装有已安装样品的样品架(步骤5.1.5)轻轻地放在显微镜载物台上。
注意:在将样品放在显微镜上之前,请用纸巾和70%乙醇清洁盖玻片的底部。 - 使用MicroManager2 45,46中的EMU插件窗口47,移动压电平台,直到在象限光电二极管(QPD)处检测到来自聚焦锁定激光器的信号。
注意:为了在整个成像时间内保持固定焦点,焦点锁定是通过近红外光纤耦合激光器从盖玻片上全内反射以及随后在象限光电二极管(QPD)上进行高度敏感检测来实现的。QPD信号提供物镜压电卡口的闭环控制。 - 使用640 nm激发激光器以低功率(即1-5%)获取后焦平面图像,以确认浸油中没有气泡。
注意:如果检测到气泡,则从载物台上取下样品。清洁盖玻片底部和物镜,然后重复步骤5.1.6-5.1.8。否则,继续将焦点锁定在 EMU 软件47 内。 - 使用明场照明定位性腺组织。使用低强度的 640 nm 照明,专注于包含许多 SC 拉伸的组织部分。
注意:不要关注距离盖玻片超过2μm的结构。请勿使用更高的激光功率来定位样品,因为这可能会使某些荧光团过早地进入闪烁状态。在这里,在上升模式下使用1 kW / cm2 ,脉冲设置为1,000。 - 继续在高辐照度(27 kW/ cm 2)下用640 nm照明曝光样品~30秒,直到达到适当的闪烁率(补充视频1)。
- 使用 MicroManager 245,46 中的多维采集工具获取 200,000 帧,曝光时间为 20 毫秒。
- 同时,使用 EMU 插件38,47 的激活选项设置 UV 激活以保持所需的闪烁速率。
注意:在上升模式下使用3 kW / cm2 辐照度的紫外激光器,最大脉冲长度设置为10,000。 - 执行 SMLM 图像重建和后处理。
注意:要从原始 SMLM 数据重建映像,请参阅已发布的方法。此处提供的数据是使用 SMAP48,49 软件处理的。在SMAP48 软件中执行了超分辨率图像重建、通道分配、漂移校正以及定位精度差的定位滤波以及最大似然滤波器。
- 获取 3D 磁珠校准
- 受激发射损耗显微镜
注意:图像是在EMBL成像中心(https://www.embl.org/about/info/imaging-centre)配备白光激光器,775 nm脉冲STED激光器和FALCON Fluorescence Lifetime IM老化模块(材料表)的集成STED显微系统上采集的。- 将 20 μL 封片剂(材料表)滴到显微镜载玻片上。从步骤4.2.2中取出一个盖玻片,将样品轻轻地放在面向安装介质的载玻片上(图2B)。
注意: 避免在安装介质内引入气穴。 - 让封片剂固化过夜。
注意:第二天对样品进行成像或将其保持在4°C直至成像。 - 要安装样品,请在步骤5.2.2中的样品盖玻片上添加一滴浸油。使用100x/1.40油物镜将样品轻轻地放在显微镜载物台上。
- 聚焦样品并使用明场照明定位种系组织。
- 使用显微镜软件,指定将采集TauSTED图像的感兴趣区域。
- 选择激发激光器及其用于激发样品中使用的荧光团的适当功率。
注意:此处,使用功率为 4% 的 580 nm 激光对 AlexaFluor 594 偶联的 F(ab')2 二抗片段进行成像,以 3% 功率对 STAR 635P 偶联的 F(ab')2 片段进行成像。 - 使用显微镜软件,选择合适的STED耗尽激光功率并设置图像检测。
注意:在这里,775 nm STED 耗尽激光功率设置为 40%。探测器在计数模式下使用,增益值为10,用于光子检测,扫描速率为100 Hz,像素尺寸为17 nm。四线累积用于TauSTED收购。
- 将 20 μL 封片剂(材料表)滴到显微镜载玻片上。从步骤4.2.2中取出一个盖玻片,将样品轻轻地放在面向安装介质的载玻片上(图2B)。
结果
为了通过SMLM对 秀丽隐杆线虫 种系组织内的SC进行成像,我们采用了2色比例3D-SMLM来定位HTP-3,染色体轴的一个组成部分,以及用血凝素(HA)标签内源标记的横向细丝SYP-5的C末端。两种蛋白质在 秀丽隐杆线虫 SC中的位置先前已由其他研究确定16,30。
为了最大限度地减少厚生物样品中固有的光散射和光学像差,我们对含有SC的减数分裂细胞核的最底部 z截面进行了成像(图3,黄线)。对于每个采集的图像,当物镜聚焦在盖玻片上时,成像平面的压电平台位置相对于压电平台位置进行标记。这允许计算与盖玻片的压电距离。成功安装的样品稳定地附着在盖玻片附近并保持性腺形状(即,在固定后步骤中,组织不会在两个盖玻片之间被压碎)。样品安装的质量可以很容易地在体视显微镜下评估,因为附着良好的性腺在溶液中没有任何移动(步骤4.2.6)。然而,由于安装过程的随机性,性腺组织不一定完全平放在盖玻片上。因此,含有SC的细胞核的底平面可能位于相对于同一性腺内的盖玻片的不同距离处。
为了说明分辨率如何根据组织与盖玻片的附着而变化,我们采集了到盖玻片不同压电距离的图像。为了评估单个图像的质量,计算了傅里叶环相关(FRC)曲线50,51,并使用SMAP软件48中的FRCResolution插件确定了分辨率。图4显示了从两个单独的3D-SMLM图像中提取的两个代表性细胞核,这些图像是在与盖玻片不同距离处拍摄的。在靠近盖玻片的SC中,SYP-5::HA的染色体轴和C末端在所有三个维度上都得到了很好的分辨(图4A,距离盖玻片0.8μm)。为了解析由给定距离相隔的两个结构,在轴向分辨率中,实现的FRC分辨率通常必须小于此距离的一半。
为了横向分离相同的结构,需要实现更小的FRC分辨率值。事实上,在靠近盖玻片的样品中,AlexaFluor 647通道的FRC分辨率为38 nm,CF680通道的FRC分辨率为34 nm,因此远低于SYP-516的C端之间的预期距离84 nm。因此,该决议不仅在正面而且在侧面都很容易解决SC的组织问题(图4B i,ii)。相比之下,由于光散射和球差,位于距盖玻片5μm距离处的SC的分辨率会下降(图4B)。在这个距离上的FRC分辨率下降到47纳米(AlexaFluor 647)和41纳米(CF680),这不能完全解析SYP-5的C端。由于光学像差比轴向分辨率更严重地损害横向分辨率,因此在距离盖玻片 5 μm 距离的样品中,HTP-3 和 SYP-5 条带在侧视图的横截面上不再清晰分辨(图 4B ii)。比较在距盖玻片不同压电距离处获得的图像的FRC分辨率,发现成像的组织不应距离盖玻片2μm(图5)。这一结果强调了正确执行固定后步骤的重要性,在此期间,组织必须成功地交联到盖玻片的聚-L-赖氨酸涂层上。
为了证明使用另一种超分辨率技术可实现的分辨率,我们还使用TauSTED显微镜对固定的完整种系组织中的SC进行成像。图6A显示了本研究中达到的最高和最低分辨率的TauSTED图像,这是根据正面视图中SC的线轮廓估计的(图6B)。在两个细胞核中,我们可以解析染色体轴上HTP-3的两个定位带和中心区域的SYP-5的C末端,证明使用该优化方案在TauSTED中可实现的分辨率低于84 nm。在最佳条件下(图6A,顶部),我们可以在仅相隔50nm的SC略微倾斜的视图中解析C端(图6A,黄色矩形和6C)。

图1:秀丽隐杆线虫突触复合体的组织示意图。这幅漫画显示了秀丽隐杆线虫中SC的简化结构,桥接了两条同源染色体(灰色)。该结构以正面、横向和横截面视图显示。染色体轴显示为红色条,而横丝显示为青色。横向细丝蛋白(秀丽隐杆线虫中的SYP-1,5,6)在中央区域以头对头的方式(青色球棒图形)定向,以弥合两个轴之间的距离。指示了横丝的轴和C端之间的预期距离。缩写:SC =突触复合体。请点击此处查看此图的大图。
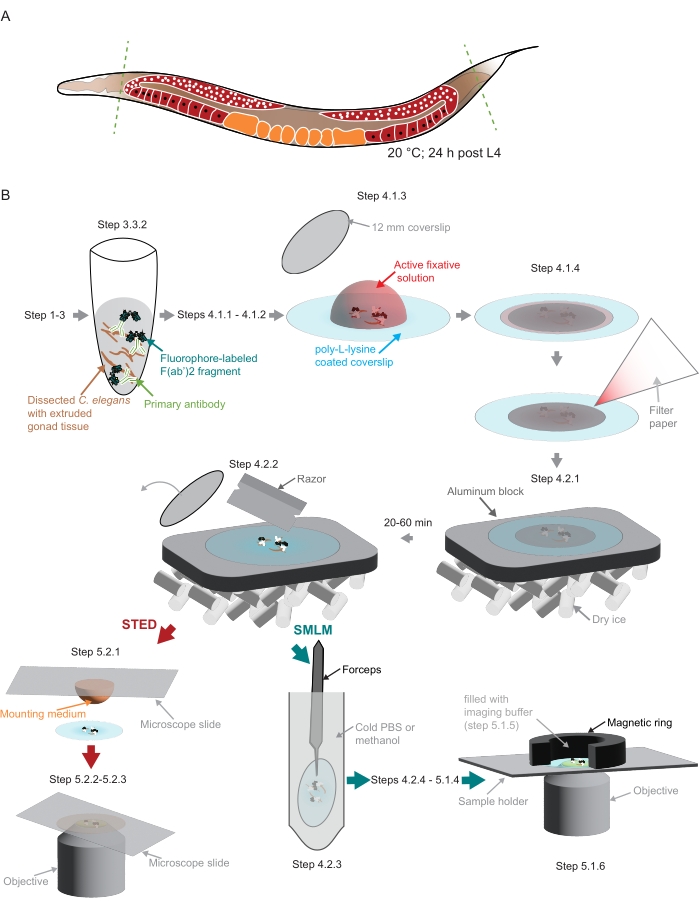
图2:研究中使用的样品制备图示 。 (A)将年轻的 秀丽隐杆线 虫成虫的头部或尾部解剖(绿色,虚线)并按照协议中的描述进行处理。(B)该方法的各个步骤用与灰色箭头连接的图形表示。缩写:STED = 受激排放消耗;SMLM = 单分子定位显微镜;PBS = 磷酸盐缓冲盐水。 请点击此处查看此图的大图。
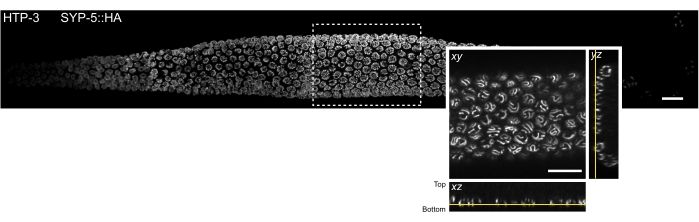
图3:可以通过单分子定位显微镜观察到的组织切片的位置。整个秀丽隐杆线虫性腺的旋转盘共聚焦图像的MIP。对组织进行HTP-3染色和SYP-5的C末端(SYP-5::HA),组合信号显示为灰色。使用Grid/Collection拼接斐济插件52拼接单个共聚焦图像,以创建整个性腺的图像。插图显示了包含 SC 的最底部 z 平面的 xy 视图。该平面的定位显示在组织切片的正交视图中,该视图由性腺MIP图像(黄线)中的矩形指示。比例尺 = 10 μm。缩写:MIP = 最大强度投影;SCs = 突触复合物。请点击此处查看此图的大图。
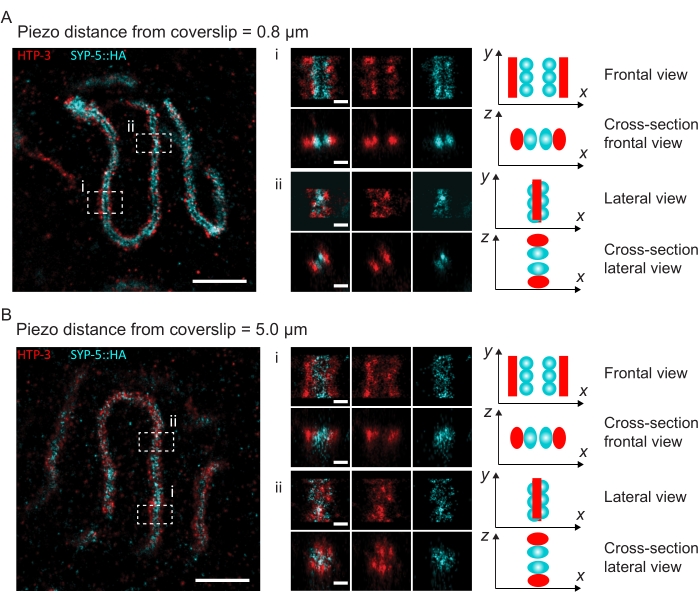
图 4:HTP-3 和 SYP-5 的 C 末端的单分子定位显微镜。 (A,B)左:SMLM图像显示HTP-3染色的厚扁烯核(红色)和SYP-5的C末端(SYP-5::HA,青色)(比例尺= 1μm)。中心:A和B中表示的感兴趣区域的放大图像,每个图像下方显示相应的横截面视图(i,ii;比例尺= 100nm)。旋转放大图像中SC的拉伸以平行于y轴定向染色体轴。右:SC中感兴趣蛋白质定位的图形表示,描绘了SC在图中央显示的放大区域中的方向。缩写:SMLM = 单分子定位显微镜;SC = 突触复合体。重建SMLM图像的原始数据可通过生物研究数据库60(入藏号:S-BIAD504)获得。请点击此处查看此图的大图。
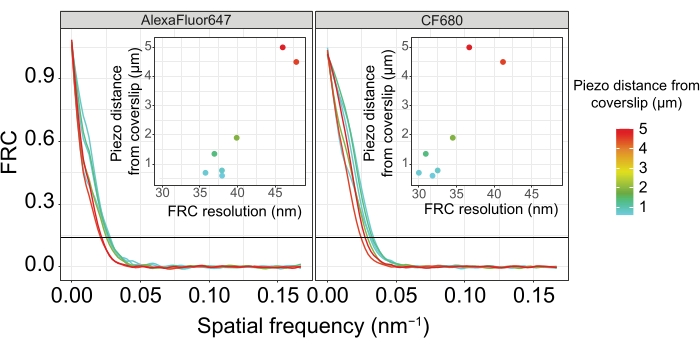
图 5:单分子定位显微镜图像的傅里叶环相关分辨率取决于成像的 z 平面与盖玻片平面的距离。 彩色线条表示从盖玻片不同距离(如彩色条所示)采集的图像的FRC曲线。用于确定FRC分辨率的1/7阈值由黑色水平线表示。插图显示了FRC分辨率对与盖玻片的压电距离的依赖性。绘图由自定义编写的 R 脚本(版本 4.1.2, 补充文件 1)执行,其中原始曲线使用"ggplot2"包中的函数进行平滑处理。缩写:FRC = 傅里叶环相关;SMLM = 单分子定位显微镜;SC = 突触复合体。FRC曲线和SMLM数据可通过生物研究数据库60 (入藏号:S-BIAD504)获得。请点击此处查看此图的大图。

图 6:由基于荧光寿命的信息 (TauSTED) 增强的受激发射耗尽显微镜解析了 HTP-3 和 SYP-5 C 末端的两个定位带。 (A)两个具有代表性的TauSTED图像显示厚质细胞核染色为HTP-3(红色)和SYP-5的C末端(SYP-5::HA,青色),具有较高(顶部)和较低(底部)的结构定义(比例尺= 1μm)。矩形标记区域,SYP-5的C端在正面(白色)和SC的略微倾斜视图(黄色)。 (B,C)HTP-3(红色)的分布和TauSTED分辨的SYP-5(青色)信号的C末端。在正面 (B) 或略微倾斜 (C) 视图中包含 SC 的感兴趣区域的线剖面显示为强度归一化为最大值的完整线。线轮廓是使用斐济图像J生成的。B中的虚线表示每种蛋白质的平均数据。C中的粗青色线对应于SYP-5的C端之间分辨距离最短的线剖面。为了确定靶向特定蛋白质的抗体之间的距离,使用自定义编写的R脚本(版本4.1.2,补充文件1)用双高斯拟合线谱(n = 9 (B),n = 7 (C))。标准差 (B) ±平均距离和以粗体 (C) 突出显示的最小值的范围分别显示在每个图形的顶部。缩写:STED = 受激发射损耗显微镜;SC = 突触复合体。显示的图像和绘制线剖面的数据点可通过生物研究数据库60(入藏号:S-BIAD504)获得。请点击此处查看此图的大图。
表1:本协议中使用的缓冲液和溶液的组成。请按此下载此表格。
补充视频1:单分子定位显微镜采集。 显示荧光团以适当速率闪烁的视频(显示 50 帧,比例尺 = 5 μm,20 毫秒/帧)。 请点击此处下载此视频。
补充文件1:数据分析脚本。请点击此处下载此文件。
讨论
SC的梯状组织对于同源染色体的正确重组和分离至关重要,大约70年前在电子显微镜3,4中首次观察到。虽然SC的整体组织在电子显微镜中很容易解决,但该复合物中单个组分的定位需要更有针对性的方法。SC的宽度仅为~100 nm,传统的荧光显微镜无法解析SC的亚结构。然而,超分辨率显微镜已成为突触复合体结构和功能新发现的主要驱动力16,19,24,25,26,27,28,29,30。为了促进这项研究,我们展示了一种安装程序,该程序允许使用SMLM和STED显微镜研究秀丽隐杆线虫性腺组织中SC的结构。
优化SMLM成像分辨率的关键步骤是将种系组织直接交联到聚-L-赖氨酸包被的盖玻片上(步骤4)。组织与盖玻片的共价附着对于减少样品内的运动至关重要,这些运动会导致较大的漂移,并使SMLM无法长时间成像。此外,即使是次优附着,使含有SC的细胞核与盖玻片保持一定距离,也会导致球差导致可实现的分辨率显着下降(图4)。除了这里使用的共价附着物之外,染色的种系组织也可以固定在一小滴成像缓冲液19,30中的两个密封盖玻片之间。然而,这种固定化方法将样品中成像缓冲液的体积从此处优化方案中使用的1 mL严重减少到仅几μL,这将导致成像缓冲液酸化并严重减少样品成像的时间38,53,54。
SMLM和STED显微镜的采集时间较长,限制了这些方法对化学固定样品的成像。在这里,多聚甲醛固定可确保在样品制备和成像过程中保留SC的结构。然而,尽管这里采取了预防措施来对完整组织中的SC进行成像,但固定后SC的结果结构不一定与活生物体内天然状态下的结构相同。此外,由于固定SC的单个图像代表生物结构的单个"快照",因此这种方法对 体内天然结构的动力学仍然视而不见。
然而,关于大分子结构的动力学和变异性的信息也可以通过获取不仅仅是单个而是许多"快照"来获得。虽然这种方法可以解决pachytene19期间SC结构的变化,但有几个因素限制了从使用该协议制备的单个样品中获取的图像数量。首先,图像采集过程中使用的高激光功率会导致荧光团永久漂白,并排除了相邻感兴趣区域或多个z平面的成像,从而大大减少了可以从单个样品中获取的图像数量。其次,该方法制备的盖玻片上的样品/组织密度较低,这极大地限制了从单个盖玻片中获取的图像数量。低样本密度也禁止使用有助于阐明其他生物学问题的自动图像采集管道34,55,56,57,58,59。但是,有经验的用户可以稍微增加样品密度。
此处介绍的实验方案经过优化,可获得在 SMLM35 中实现最佳分辨率所需的高标记密度。虽然以前的方案在免疫染色16之前将组织共价附着到盖玻片上,但这种新方案仅在样品在溶液中染色后将组织交联到盖玻片上。这种修饰允许用于免疫标记的抗体从各个侧面自由进入组织,而组织与盖玻片的共价附着可能会限制抗体到达最靠近盖玻片的细胞核,从而降低标记程度。总之,此处描述的修改将分辨率从40-50 nm(FRC分辨率)16 提高到30-40 nm(此协议)。
重要的是,虽然高标记密度和高浓度的抗体对于SMLM至关重要,但我们发现使用较低的抗体浓度可以获得更好的STED显微镜图像(步骤3)。在数十纳米的分辨率下,用于标记目标蛋白质的分子的大小变得越来越重要。因此,我们使用了F(ab')2片段,其大小是全长抗体的一半。与使用全长二抗相比,由于信号源较小,局部对比度的提高,因此通过这种修改获得的分辨率,允许TauSTED在中心区域内分离SYP-5的两个C末端,这是使用全长抗体(16 和数据未显示)的传统STED无法分离的。我们预计,这种用于完整秀 丽隐杆线虫种系中SC成像的优化方案将有助于研究减数分裂过程中SC的结构 - 功能关系。
披露声明
作者声明没有利益冲突。
致谢
我们要感谢Jonas Ries和Ries实验室共享用于SMLM成像的成像缓冲液。我们还要感谢Yumi Kim在本协议中使用的 秀丽隐杆线虫 菌株和Abby F. Dernburg的鸡抗HTP-3抗体。我们感谢海德堡EMBL高级光学显微镜设施的Marko Lampe和Stefan Terjung在使用奥林巴斯iXplore SPIN SR共聚焦显微镜方面的支持。这项工作得到了欧洲分子生物学实验室和德国研究基金会(DFG,德国研究基金会 - 452616889,SK)的支持。我们感谢欧洲分子生物学实验室(EMBL IC)成像中心提供的访问和服务,该中心得到了勃林格殷格翰基金会的慷慨支持。
材料
| Name | Company | Catalog Number | Comments |
| 100x/1.5 oil objective | Olympus | UPLAPO100XOHR | UPLAPO100XOHR |
| 2-mercaptoethylamine (MEA) | Sigma-Aldrich | 30070-10G | Dissolved in MilliQ water to 5 M solution, pH 8.7 adjusted with HCl. Aliquoted to a single-use volume, frozen, and kept at -80 °C. |
| Additional 640 nm booster laser | Toptica | IBEAM-SMART-640-S-HP | |
| AlexaFluor 594, NHS ester | ThermoFischer Scientific | A37572 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| AlexaFluor 647, NHS ester | ThermoFischer Scientific | A37573 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| anti-HA | Thermo Fisher Scientific | 2-2.2.14 | Mouse monoclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| anti-HTP-3 | a gift from Abby F. Dernburg | MacQueen et al., 2005 | Chicken polyclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| Caenorhabditis elegans strain YKM349 | a gift from Yumi Kim | Hurlock et al., 2020 | syp-5(kim9[syp-5::HA]) I; meIs8[pie-1p::GFP::cosa-1, unc-119(+)] II |
| CF6680, NHS ester | Biotium | 92139 | Dissolved in DMSO to 1mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Circular cover glass 12 mm No. 1 | Menzel-Gläser; VWR | 631-0713 | |
| Circular cover glass 24 mm No. 1.5 | Carl Roth | PK26.1 | |
| Cylindrical lenses | Thorlabs | LJ1516RM-A, LK1002RM-A | |
| Egg Buffer (10x) | Edgar 1995 | 250 mM HEPES, 1.18 M NaCl, 480 mM KCl, 20 mM EDTA, 5 mM EGTA, pH 7.4 | |
| Ethanol (absolute for analysis) | Merck | 64-17-5 | |
| F(ab’)2 fragment anti-chicken IgY | Jackson Immunoresearch | AB_2340347 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| F(ab’)2 fragment anti-mouse IgG | Jackson Immunoresearch | AB_2340761 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| Fisherbrand Microscope slides T/F Ground 0.8-1.0 mm thick | Fisher scientific | 7107 | |
| Gauge Worm Pick 30 diameter 0.254 mm - Iridium 10% | Kisker | 789265 | |
| Glucose oxidase/Catalase enzyme mix (GlOX/Cat ) | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 20x, 1916 U/mL glucose oxidase (Sigma G7141), 42350 U/mL catalase (Sigma C3155), 50 mM Tris-HCl pH 8.0, 51% glycerol, MilliQ water. Stored at -20 °C. |
| Imaging buffer base | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 50 mM Tris-HCl, pH 8.0, 10 mM NaCl, 10% D-Glucose. Aliquoted to a single-use volume (950 μL), frozen, and kept at -80 °C. |
| Invitrogen ProLong Glass Antifade Mountant | ThermoFischer Scientific | P36982 | |
| Leica Stellaris 8 STED FALCON | Leica | N/A | The microscope is equiped with the latest generation white light laser, a 775nm pulsed STED laser, the FALCON Fluorescence Lifetime IMaging module, HC PL APO CS2 100x/1.40 oil objective, and Leica HyD X detector. The system is capable of FLIM module enhanced Tau-STED which measures the specific fluorescence lifetime of a dye and is therefore capable of removing background signal based on differences in fluorescence lifetimes of the dyes, and dye conditions in the sample. Additionally, the resolution is increased by accounting for the variation of fluorescence lifetimes in different areas of the depletion donut. |
| Longwave channel emission filter | AHF Analysentechnik | F47-702 | 700/100 nm bandpass |
| Methanol (absolute for analysis) | Merck | 67-56-1 | |
| NaHCO3 | Sigma-Aldrich/Merck | S5761-500G | 100 mM NaHCO3, pH 8.3 |
| Near-infrared fiber-coupled laser | Toptica | IBEAM-SMART-PT-CD | Custom Design, 808 nm - 75mW |
| Objective lens piezo mount (PIFOC ) | Physik Instrumente | P-726.1.CD | 100 µm travel range |
| Orca Fusion BT sCMOS camera | Hamamatsu | C15440-20UP | |
| PCR tubes | Greiner Bio-One | 673283 | 0.2 mL |
| Phosphate Saline Buffer (PBS 10x) | N/A | 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7.4 | |
| Pierce 16% formaldehyde (w/v), methanol free | ThermoFischer Scientific | 28906 | 16% formaldehyde is transferred from the original glass ampule into 1.5 mL tube and kept at room temperature. |
| PlasmaPrep2 plasma cleaner | GaLa Instrumente GmbH | N/A | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich/Merck | P2636-25MG | 0.1% w/v solution was prepared in Milli-Q water, and stored in aliquots at -20 °C. |
| Primary dichroic (illumination reflecting) | AHF Analysentechnik | F73-866S | quad bandpass @ 405, 488, 561, 640 |
| Quadnotch filter | AHF Analysentechnik | F40-072 | 405/488/561/640 nm |
| Quadrant photodiode (QPD) | Laser Components | SD197-23-21-041, LC301DQD-PV | |
| Razor blades | Apollo Herkenrath Solinger | N/A | |
| Refractive beam shaper | AdlOptica | PiShaper 6_6_VIS | |
| Roche Blocking Reagent | Roche | 11096176001 | 10x solution was prepared according to recommendation. Frozen aliquots were stored at -20 °C. |
| Scalpel blade (Feather brand #11, No. 3) | Heinz Herenz Medizinalbedarf GmbH | 1110911 | |
| Scalpel removal box | Fisher scientific | 10002-50 | |
| Secondary dichroic (emission reflecting) | AHF Analysentechnik | F38-785S | 750 nm longpass |
| Shortpass filter | Semrock | BSP01-785R-25 | 750 nm |
| Shortwave channel emission filter | AHF Analysentechnik | F37-677 | 676/37 nm bandpass |
| Single molecule localization microscope | EMBL Imaging Centre | Diekmann et al., 2020 with modifications | The microscope provides widefield epi-illumination via a single-mode fiber-coupled laser engine, additional booster laser, and refractive beam shaper to provide a uniform illumination field (Stehr et al, 2019). Widefield images are captured on a sCMOS camera and appropriate relay optics for a system magnification of 61x and a pixel size of 106 nm. For ratiometric imaging of spectrally overlapping far-red dyes, an image splitter produces two spectrally distinct images on the camera (splitting dichroic: 665 nm long pass, shortwave channel emission filter: 676/37 nm bandpass, longwave emission filter: 700/100 nm bandpass. An additional 405/488/561/640 nm quadnotch filter and 750 nm shortpass filter are common to the two paths and provide additional laser blocking). A compound cylindrical lens provides the astigmatism required for 3D imaging. To maintain a fixed focus across acquisitions exceeding 2 hours in time (comprising 200 000 - 250 000 images), focus locking is achieved by total internal reflection of a near-infrared fiber-coupled laser from the coverslip and subsequent height sensitive detection on a quadrant photodiode (QPD). The QPD signal provided closed-loop control of the objective lens piezo mount. For access to this microscope, refer to https://www.embl.org/about/info/imaging-centre or contact ic-contact@embl.de |
| Single-mode fiber-coupled multi-laser engine | Toptica | iCHROME MLE-LFA-HP | Provides widefield epi-illumination of 100 mW at 405, 488, 561, 640 nm |
| Splitting dichroic | AHF Analysentechnik | F48-665SG | 665 nm long pass |
| Square cover glass 22 x 22 mm No.1 | Menzel-Gläser; VWR | 630-2882 | |
| STAR 635P, NHS ester | Abberior | ST635P-0002-1MG | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Stereo microscope Stemi 305 Stand K LAB | Zeiss | N/A | |
| Tetramisole hydrochloride | Sigma-Aldrich/Merck | T1512-2G | 1% (w/v) solution was prepared in Milli-Q water. Frozen aliquots were stored at -20 °C. Thawed aliquot was kept at 4 °C and used for several months. |
| TetraSpeck Microspheres | ThermoFischer Scientific | T7279 | 0.1 µm, fluorescent blue/green/orange/dark red |
| Tris Saline Buffer (TBS 10x) | N/A | 200 mM Tris-HCl, 1.5 M NaCl, pH 7.5 | |
| TWEEN 20 | Sigma-Aldrich/Merck | P9416-50ML | Kept at room temperature in original packaging. |
| WormStuff worm pick | Kisker | 789277 | |
| XY microscope stage | Smaract | N/A | Custom Design |
| Zeba Micro Spin Desalting Column | ThermoFischer Scientific | 89877 | 7K MWCO, 75 µL |
参考文献
- Zickler, D., Kleckner, N. Meiotic chromosomes: integrating structure and function. Annual Review of Genetics. 33, 603(1999).
- Ur, S. N., Corbett, K. D. Architecture and dynamics of meiotic chromosomes. Annual Review of Genetics. 55, 497-526 (2021).
- Fawcett, D. W. The fine structure ot chromosomes in the meiotic prophase of vertebrate spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (4), 403-406 (1956).
- Moses, M. J. Chromosomal structures in crayfish spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (2), 215-218 (1956).
- Hillers, K. J., Jantsch, V., Martinez-Perez, E., Yanowitz, J. L. Meiosis. WormBook. , 433-434 (2017).
- Pasierbek, P., et al. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes & Development. 15 (11), 1349-1360 (2001).
- Severson, A. F., Ling, L., Van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes & Development. 23 (15), 1763-1778 (2009).
- Zetka, M. C., Kawasaki, I., Strome, S., Müller, F. Synapsis and chiasma formation in Caenorhabditis elegans require HIM-3, a meiotic chromosome core component that functions in chromosome segregation. Genes & Development. 13 (17), 2258-2270 (1999).
- Martinez-Perez, E. HTP-1-dependent constraints coordinate homolog pairing and synapsis and promote chiasma formation during C. elegans meiosis. Genes & Development. 19 (22), 2727-2743 (2005).
- Couteau, F., Zetka, M. HTP-1 coordinates synaptonemal complex assembly with homolog alignment during meiosis in C. elegans. Genes & Development. 19 (22), 2744-2756 (2005).
- Goodyer, W., et al. HTP-3 Links DSB Formation with Homolog Pairing and Crossing Over during C. elegans Meiosis. Developmental Cell. 14 (2), 263-274 (2008).
- Colaiácovo, M. P., et al. Synaptonemal complex assembly in C. elegans is dispensable for loading strand-exchange proteins but critical for proper completion of recombination. Developmental Cell. 5 (3), 463-474 (2003).
- MacQueen, A. J., Colaiácovo, M. P., McDonald, K., Villeneuve, A. M. Synapsis-dependent and -independent mechanisms stabilize homolog pairing during meiotic prophase in C. elegans. Genes & Development. 16 (18), 2428-2442 (2002).
- Smolikov, S., et al. Synapsis-defective mutants reveal a correlation between chromosome conformation and the mode of double-strand break repair during Caenorhabditis elegans meiosis. Genetics. 176 (4), 2027-2033 (2007).
- Smolikov, S., Schild-Prüfert, K., Colaiácovo, M. P. A yeast two-hybrid screen for SYP-3 interactors identifies SYP-4, a component required for synaptonemal complex assembly and chiasma formation in Caenorhabditis elegans meiosis. PLoS Genetics. 5 (10), 1000669(2009).
- Hurlock, M. E., et al. Identification of novel synaptonemal complex components in C. Elegants. The Journal of Cell Biology. 219 (5), (2020).
- Zhang, Z., et al. Multivalent weak interactions between assembly units drive synaptonemal complex formation. The Journal of Cell Biology. 219 (5), (2020).
- Schild-Prüfert, K., et al. Organization of the synaptonemal complex during meiosis in Caenorhabditis elegans. Genetics. 189 (2), 411-421 (2011).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. The interaction of crossover formation and the dynamic architecture of the synaptonemal complex during meiosis. bioRxiv. , (2020).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6621), 543-548 (2015).
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Schücker, K., Holm, T., Franke, C., Sauer, M., Benavente, R. Elucidation of synaptonemal complex organization by super-resolution imaging with isotropic resolution. Proceedings of the National Academy of Sciences. 112 (7), 2029-2033 (2015).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences. 114 (33), 6857-6866 (2017).
- Zwettler, F. U., et al. Tracking down the molecular architecture of the synaptonemal complex by expansion microscopy. Nature Communications. 11 (1), 1-11 (2020).
- Yoon, S., Choi, E. H., Kim, J. W., Kim, K. P. Structured illumination microscopy imaging reveals localization of replication protein A between chromosome lateral elements during mammalian meiosis. Experimental & Molecular Medicine. 50 (8), 1-12 (2018).
- Prakash, K., et al. Superresolution imaging reveals structurally distinct periodic patterns of chromatin along pachytene chromosomes. Proceedings of the National Academy of Sciences. 112 (47), 14635-14640 (2015).
- Xu, H., et al. Molecular organization of mammalian meiotic chromosome axis revealed by expansion STORM microscopy. Proceedings of the National Academy of Sciences. 116 (37), 18423-18428 (2019).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. Superresolution microscopy reveals the three-dimensional organization of meiotic chromosome axes in intact Caenorhabditis elegans tissue. Proceedings of the National Academy of Sciences. 114 (24), 4734-4743 (2017).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Hein, B., Willig, K. I., Hell, S. W. Stimulated emission depletion (STED) nanoscopy of a fluorescent protein-labeled organelle inside a living cell. Proceedings of the National Academy of Sciences. 105 (38), 14271-14276 (2008).
- Jahr, W., Velicky, P., Danzl, J. G. Strategies to maximize performance in STimulated Emission Depletion (STED) nanoscopy of biological specimens. Methods. 174, 27-41 (2019).
- Thevathasan, J. V., et al. Nuclear pores as versatile reference standards for quantitative superresolution microscopy. Nature Methods. 16 (10), 1045-1053 (2019).
- Xu, K., Shim, S. -H., Zhuang, X. Super-resolution imaging through stochastic switching and localization of single molecules: an overview. Far-Field Optical Nanoscopy. , 27-64 (2013).
- Wang, Y., et al. Localization events-based sample drift correction for localization microscopy with redundant cross-correlation algorithm. Optics Express. 22 (13), 15982(2014).
- Winterflood, C. M., Platonova, E., Albrecht, D., Ewers, H. Dual-color 3D superresolution microscopy by combined spectral-demixing and biplane imaging. Biophysical Journal. 109 (1), 3-6 (2015).
- Diekmann, R., et al. Optimizing imaging speed and excitation intensity for single molecule localization microscopy. Nature Methods. 17 (9), 909(2020).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319 (5864), 810-813 (2008).
- Phillips, C. M., McDonald, K. L., Dernburg, A. F. Cytological analysis of meiosis in Caenorhabditis elegans. Methods in Molecular Biology. 558, 171-195 (2009).
- Edgar, L. G. Blastomere culture and analysis. Methods in Cell Biology. 48, 303-321 (1995).
- MacQueen, A. J., et al. Chromosome sites play dual roles to establish homologous synapsis during meiosis in C. elegans. Cell. 123 (6), 1037-1050 (2005).
- Stehr, F., Stein, J., Schueder, F., Schwille, P., Jungmann, R. Flat-top TIRF illumination boosts DNA-PAINT imaging and quantification. Nature Communications. 10 (1), 1-8 (2019).
- Hoess, P., Mund, M., Reitberger, M., Ries, J. Dual-color and 3D super-resolution microscopy of multi-protein assemblies. Methods in Molecular Biology. 1764, 237-251 (2018).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer Control of microscopes using µManager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. Journal of Biological Methods. 1 (2), 10(2014).
- Deschamps, J., Ries, J. EMU: reconfigurable graphical user interfaces for Micro-Manager. BMC Bioinformatics. 21 (1), 1-13 (2020).
- Ries, J. SMAP: a modular super-resolution microscopy analysis platform for SMLM data. Nature Methods. 17 (9), 870-872 (2020).
- Li, Y., et al. Global fitting for high-accuracy multi-channel single-molecule localization. Nature Communications. 13 (1), 1-11 (2022).
- Nieuwenhuizen, R. P. J., et al. Measuring image resolution in optical nanoscopy. Nature Methods. 10 (6), 557-562 (2013).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. Journal of Structural Biology. 183 (3), 363-367 (2013).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Shi, X., Lim, J., Ha, T. Acidification of the oxygen scavenging system in single-molecule fluorescence studies: in situ sensing with a ratiometric dual-emission probe. Analytical Chemistry. 82 (14), 6132-6138 (2010).
- Olivier, N., Keller, D., Rajan, V. S., Gönczy, P., Manley, S. Simple buffers for 3D STORM microscopy. Biomedical Optics Express. 4 (6), 885-899 (2013).
- Mund, M., et al. Superresolution microscopy reveals partial preassembly and subsequent bending of the clathrin coat during endocytosis. bioRxiv. , (2022).
- Mund, M., et al. Systematic nanoscale analysis of endocytosis links efficient vesicle formation to patterned actin nucleation. Cell. 174 (4), 884-896 (2018).
- Sabinina, V. J., et al. Three-dimensional superresolution fluorescence microscopy maps the variable molecular architecture of the nuclear pore complex. Molecular Biology of the Cell. 32 (17), 1523-1533 (2021).
- Cieslinski, K., et al. Nanoscale structural organization and stoichiometry of the budding yeast kinetochore. bioRxiv. , (2021).
- Sieben, C., Banterle, N., Douglass, K. M., Gönczy, P., Manley, S. Multicolor single-particle reconstruction of protein complexes. Nature Methods. 15 (10), 777-780 (2018).
- Sarkans, U., et al. The BioStudies database—one stop shop for all data supporting a life sciences study. Nucleic Acids Research. 46, (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。