Method Article
人诱导多能干细胞来源的心脏球体的生成、高通量筛选和生物样本库
* 这些作者具有相同的贡献
摘要
这里介绍的是一组方案,用于从以高通量、多维形式培养的人诱导多能干细胞衍生心肌细胞中生成和冷冻保存心脏球体 (CS)。该三维模型可作为疾病建模、高通量筛选的强大平台,并在冷冻保存后保持其功能。
摘要
人诱导的多能干细胞来源心肌细胞(hiPSC-CMs)对于人类心脏病建模和治疗至关重要。我们最近发表了一种具有成本效益的策略,用于在二维(2D)上大规模扩增hiPSC-CMs。两个主要限制是细胞不成熟以及高通量筛选(HTS)平台中缺乏三维(3D)排列和可扩展性。为了克服这些限制,扩增的心肌细胞形成了产生3D心脏细胞培养和组织工程技术的理想细胞来源。后者在心血管领域具有巨大潜力,可提供更先进和生理相关的HTS。在这里,我们描述了一种与 HTS 兼容的工作流程,该工作流程易于扩展,用于 96 孔格式的心球 (CS) 的生成、维护和光学分析。这些小型CS对于填补当前 体外 疾病模型和/或3D组织工程平台生成中存在的空白至关重要。CS呈现高度结构化的形态,大小和细胞组成。此外,作为CS培养的hiPSC-CMs显示出增加的成熟度和人类心脏的几个功能特征,例如自发的钙处理和收缩活性。通过自动化从CS生成到功能分析的完整工作流程,我们提高了批次内和批次间的重现性,如高通量(HT)成像和钙处理分析所证明的那样。所描述的协议允许在全自动HTS工作流程中对心脏病进行建模,并在复杂的3D细胞环境中评估单细胞水平的药物/治疗效果。此外,该研究描述了一种用于全球体长期保存和生物样本库的简单程序,从而为研究人员提供了创建下一代功能性组织储存的机会。HTS与长期储存相结合,将为广泛领域的转化研究做出重大贡献,包括药物发现和测试、再生医学和个性化疗法的开发。
引言
人类诱导多能干细胞(hiPSCs)的发现为在细胞水平上研究人类发育和疾病提供了前所未有的机会。在过去的十年中,利用发育经验,已经建立了各种方案,以确保hiPSCs有效分化为心肌细胞(CMs)1,2,3,4。hiPSC 来源的心肌细胞 (hiPSC-CM) 可以作为模拟遗传性心血管疾病 (CVD)、测试新药心脏安全性和心脏再生策略的资源5,6,7,8。尽管hiPSCs具有定向心脏分化,但不确定的CM数量在心脏领域仍然是一个挑战,因为成熟的hiPSC-CMs通常是非增殖性的,并且原代人细胞的数量不高。
最近,我们描述了伴随的Wnt信号激活与低细胞密度培养导致hiPSC-CMs9,10的大规模增殖反应(高达250倍)。这种通过培养瓶形式的连续传代 大规模 扩增hiPSC-CMs的经济高效的策略有助于大量功能性hiPSC-CMs的标准化和质量控制。此外,为了跟上各种供体对大批量hiPSC-CMs的需求,已经描述了hiPSC-CMs的生物样本库10。然而,接种在这些标准培养皿中的心肌细胞单层不能代表心脏中存在的复杂3D结构。此外,hiPSC-CMs的不成熟仍然是一个障碍,因此在模拟 体内 心血管环境的生物学和生理表型方面存在不足。
已经开发了新颖的3D体外模型,其中hiPSC-CMs表现出更紧密的生理行为,例如自组织11,12,细胞外基质(ECM)重塑13,增强成熟14,15,16和同步收缩17,18,19.3D模型已被用于药物发现,药物心脏毒性测试,疾病建模,再生疗法,甚至首次临床试验20,21,22,23,24。最常用的模型之一是基于纤维蛋白的工程心脏组织(EHT),其表现出组织样排列和心脏收缩力13,17,25。之前,我们发现由扩增的hiPSC-CMs产生的EHT表现出与未扩增的hiPSC-CMs相当的收缩性,显示出扩增9后细胞功能不受损害。然而,尽管从hiPSC-CMs生成EHT已经建立,但预计在建立HT评估平台方面会有进一步发展。在这里,快速生成大量96孔格式的自聚集心脏球体(CS)可以改善用于高通量筛选(HTS)目的的3D条件。
总体而言,CS作为3D细胞培养的优势在于其高可重复性和可扩展性。特别是,CS与机器人样品处理相结合,可以使CS培养、药物治疗和高内涵分析标准化和自动化20。在这里,我们描述了优化的方案以产生高纯度和高质量的CS,通过使用光学钙采集和分析系统进行Ca2 + 瞬态测量,可以有效地冷冻保存和筛选心脏功能。该模型提供了一个简单而强大的工具,可以在数百到数千个球体17,18上执行高通量筛选。
研究方案
注意:本研究中使用的hiPSC-CM是根据先前描述的hiPSC培养和CM分化方案26,27生成的。或者,hiPSC-CM可以在开始CS方案之前扩增和冷冻保存(第4节)10。
1. 细胞培养基、溶液和等分试样的制备
- 准备基础培养基
- 将青霉素-链霉素和培养基 (RPMI 1640) 平衡至室温 (RT) 并确保其完全解冻。混合 500 mL 培养基和 5 mL 笔/链球菌。在4°C下储存长达8周;使用前平衡至37°C。
- 准备 RPMI + B27
- 将 B27 补充剂和基础培养基平衡至 RT。 确保完全解冻补充剂。混合 490 mL 基础培养基和 10 mL 50x B27 补充剂。在4°C下储存长达2周;使用前平衡至37°C。
- 制备 hiPSC-CM 重镀介质
- 将含有蛋白激酶 (ROCK) 抑制剂(2 μM 终浓度)和 10% 敲除血清替代 (KSR) 的 Rho 相关线圈添加到 RPMI + B27 培养基中。根据需要将 ROCK 抑制剂直接添加到 RM 培养基中。补充后不要储存培养基。
- 准备CM解冻培养基
- 向RPMI + B27培养基中加入1:100浓度的细胞存活补充剂(例如Revitacell)和20%KSR,并在使用前平衡至37°C。
- 准备成熟补充剂
- 前面描述的成熟培养基式28 包括:3mM葡萄糖,10mM L-乳酸,5mg / mL维生素B12,0.82mM生物素,5mM肌酸一水合物,2mM牛磺酸,2mM左旋肉碱,0.5mM抗坏血酸,1x NEAA,0.5%(w / v)相蛋白,1x B27和1%KOSR。要准备一整瓶(500毫升)的成熟补充剂,请从一瓶不含葡萄糖的DMEM中取出65毫升,并补充2.7克葡萄糖,5.6克L-乳酸,0.025毫克维生素B12,1毫克生物素,3.73克一水肌酸,1.25克牛磺酸,1.975克左旋肉碱,0.7125克抗坏血酸, 50 mL NEAA、12.5 g 白蛋白和 5 mL 青霉素-链霉素。
- 通过带有0.22μm孔聚醚砜(PES)膜的无菌一次性过滤装置进行过滤。
- 分装到 45 mL(制备 500 mL 成熟培养基)或 4.5 mL(制备 50 mL 成熟培养基)中。在20°C下储存长达6个月。
- 准备成熟培养基
- 在室温下平衡 B27 补充剂、敲除 SR、青霉素-链霉素、成熟补充剂28 和 DMEM 无葡萄糖培养基。 确保完全解冻补充剂。将 435 mL DMEM 无葡萄糖培养基与 10 mL 50x B27 补充剂、5 mL 青霉素-链霉素、5 mL 敲除 SR 和 45 mL 成熟补充剂混合。在4°C下储存长达2周;使用前在37°C下平衡。
- 制备荧光光亮培养基
- 在室温下平衡青霉素 - 链霉素和DMEM氟布里特培养基。 确保补充剂完全解冻。将 500 mL DMEM 荧光培养基与 5 mL 青霉素-链霉素混合。在4°C下储存长达1个月;使用前在37°C下平衡。
- 制备非离子洗涤剂溶液
- 将 20% w/v 非离子洗涤粉(例如 F-127)与 PBS 混合。使用0.22μm过滤器过滤,并在4°C下储存长达6个月;使用前在室温下平衡。
- 制备钙染料培养基
- 在荧光光亮培养基中混合非离子洗涤剂溶液(终浓度为0.04%v / v)和0.1x钙染料(例如Cal520 AM)。在 50 mL 锥形管中,加入 10 μL Cal520 和 20 μL 非离子洗涤剂溶液。混合直至完全溶解。在加入细胞之前,将溶液放在黑暗中。
2. 缓冲液的制备
- 制备透化和封闭缓冲液:该缓冲液含有 10 mL PBS、5% wt/v BSA 和 0.3% v/v Triton-X-100。
- 制备流式细胞术缓冲液:该缓冲液含有 50 mL PBS、1% wt/v BSA 和 0.3% v/v Triton-X-100。
- 流式细胞术洗涤缓冲液:该缓冲液含有 50 mL PBS 和 1% wt/v BSA。
- 球状体洗涤缓冲液 (SWB):该缓冲液在 1 L PBS 中含有 1 mL Triton-X-100、2 mL 10%(DPBS 中的 w/v)SDS 和 2 g BSA。
注意:SWB可以在4°C下储存长达2周。 - 制备包埋溶液 (ES):要制备 100 mL 包埋溶液,请将 50 mL 甘油与 9.09 mL dH2O、1 mL Tris 缓冲液(1 M,pH 8.0)和 200 μL EDTA (0.5 M) 混合。加入 22.7 克果糖,在室温下在黑暗中混合直至溶解。澄清后,加入 22.2 克果糖并混合直至溶解。然后加入15g尿素并混合直至溶解(在黑暗中储存在4°C)。
- 准备PBT(含吐温-20的PBS)缓冲液。该缓冲液含有PBS/吐温-20(0.1% v/v)。对于 1 L PBS,加入 1 mL 吐温-20。
3. 小分子的制备
- 在DMSO中以50μL的10mM等分试样复溶噻唑维林(ROCK抑制剂)粉末,并在-20°C下储存长达6个月。避光。
- 在DMSO中制备2.5 mM等分试样,每份10μLCal-520 AM,并将其在-20°C下储存长达6个月。避光。
4. 心球生成
注意:对于大量 CS,在带有 2 mL hiPSC-CM 重镀培养基的 6 孔超低附着板中接种多达 100 万个 CM。这项研究在96孔板的每个孔中使用了至少2,500(2.5k CS)至20,000(20k CS)hiPSC-CM。
- 对于一个 96 孔板,制备含有至少 2 x 106 人诱导的多能干细胞衍生心肌细胞 (hiPSC-CM) 的细胞培养物10。
- 当培养的hiPSC-CMs达到汇合时,向每个孔中加入0.1mL / cm2 无菌心脏分离溶液(例如,tryple)。将板在37°C孵育15分钟。
- 使用 5 mL 移液管,用 2 mL 温热的基础培养基冲洗以机械方式解离细胞,制成单细胞悬液。用明场显微镜(4倍放大倍率)确认脱离;单元格将看起来是白色的,呈圆形。
- 将细胞悬液转移到15mL锥形管中,并以300× g离心3分钟。
- 吸出上清液并将细胞重悬于 1 mL hiPSC-CM 重镀培养基中。
- 使用 1,000 μL 移液管吸头,机械解离细胞沉淀。混合三到四次后,溶液看起来均匀。计数细胞。将 100 μL 重镀培养基中适量的细胞转移到每个超低附着圆底 96 孔中。
- 将CS板放在培养箱中以70rpm的轨道振荡器上放置24小时。将培养箱条件设置为 37 °C、5% CO 2、21% O2 和 90% 湿度。
- 从每个孔中吸出 50 μL 培养基,并在前 48 小时内每孔加入 100 μL RPMI + B27 培养基。
注意:始终将 50 μL 培养基保存在 96 孔板中,以避免意外误吸和球体破裂。 - 从每个孔中吸出 100 μL 培养基,每孔加入 100 μL 成熟培养基。将细胞保持在成熟培养基中,每2-3天刷新一次培养基。
5. CS的冷冻保存
注意:CS 可以冷冻保存以长期储存。CS可以从CS生成后的第3天开始进行,CS可以直接冷冻保存在96孔板的孔中,也可以作为CS悬浮液保存在冷冻管中。
- 通过将板放在冰上10分钟来预冷板。
- 以70 x g 离心球状体板3分钟。
- 取出上清液直至残留 50 μL,每孔加入 200 μL 冰冷的 hiPSC 冷冻培养基。
注意:在整个手术过程中将CS悬浮液保持在冰上。对于带有球状体的 6 孔板,在 500 μL 冷冻培养基冷冻管中冷冻一个孔。 - 用板密封膜密封板。
注意:96孔板需要存放在聚苯乙烯盒中,或者,如果没有,可以按照步骤5.5.1中所述制作硅模具。 - 为确保孔板和冷冻机之间的均匀热交换,请将板小心地放入聚苯乙烯盒或硅胶模具中。
- 准备硅模具:以 10:1 的比例剧烈混合硅弹性体套件的两种成分。使用真空泵将溶液除泡15-20分钟。随后,将溶液浇铸在孔板的底部,并使用真空泵去泡10分钟。将模具放入烘箱中,在60°C下固化8小时,以获得从板上剥离的半柔性弹性体。
- 将板在-80°C下冷冻在聚苯乙烯盒或制备的硅模具中至少4小时。
- 将板转移到液氮罐或-150°C冰箱中长期储存。
6. 心球解冻
注意:一次不要解冻多个板,以确保快速解冻过程。
- 在50 mL锥形管中制备20mL预热的37°C基础培养基。
- 从液氮中收集带有CS的细胞板,并将其置于培养箱中15分钟。将培养箱条件设置为 37 °C、5% CO 2、21% O2 和 90% 湿度。
- 除去上清液和细胞沉淀残留物,并将每个孔重悬于温暖的基础培养基中。每孔使用 200 μL 培养基。
- 以70 x g 离心3分钟。
- 重复步骤 6.3 和 6.4。
- 除去上清液直至细胞沉淀残留,并在每个孔中加入 200 μL CM 解冻培养基。
- 将CS板放在培养箱中以70rpm的速度放在轨道振荡器上24小时。将培养箱条件设置为 37 °C、5% CO 2、21% O2 和 90% 湿度。
- 从每个孔中吸出 50 μL 培养基,并在前 48 小时内每孔加入 100 μL RPMI + B27 培养基。
- 从每个孔中吸出 100 μL 培养基,每孔加入 100 μL 成熟培养基。将细胞保持在成熟培养基中,每2-3天刷新一次培养基。
7. 细胞内 Ca2+ 瞬变的评估
注意:CS在培养中总共培养3周;冷冻前 2 周和解冻后 1 周。"新鲜"控件与年龄匹配。
- 培养 1 周后,解冻的 CSS 最适合钙处理光学成像。使用钙染料(例如Cal520AM)评估细胞中Ca2+ 的摄取和释放。
- 每孔用100μL钙染料培养基处理它们,并在培养箱中孵育60分钟。将培养箱条件设置为 37 °C、5% CO 2、21% O2 和 90% 湿度。
注:Cal520AM 对光敏感。在黑暗中执行所有加载程序和实验。 - 准备钙采集和分析系统。
- 为显微镜供电,确保环境控制选项已打开。
- 调整相机和取景光圈尺寸以最小化背景区域。
注意:这里使用了徕卡雷霆DMi8显微镜;其他显微镜系统也适用,直到它们允许超过30帧/秒(FPS)的采样率。
- 在10 s内录制具有2−10个峰的一致流的视频,并扫描96孔板,最初向左移动,然后以锯齿形方式向下以覆盖整个板。使用488nm激光测量钙信号;在钙释放期间将对比度设置为带有亮绿色信号的黑色背景。
- 获取Ca2+ 瞬变后,根据制造商的说明使用荧光痕量分析软件(例如,CyteSeer,Vala Sciences)分析数据。
8. 解离心脏球体的流式细胞术分析
注意:在本研究中,流式细胞术用于确定解冻过程前后CS的活力。
- 使用 5 mL 移液管将 CS 收集在 15 mL 锥形管中以避免球体损坏,并以 70 x g 离心 3 分钟。吸出上清液并加入 1 mL PBS。
- 以200 x g 离心3分钟。吸出上清液并通过加入 1 mL 心脏脱离溶液(例如 tryple)解离 CS。将管在37°C孵育15分钟。
- 使用 5 mL 移液管,用 2 mL 基础培养基冲洗机械解离细胞,直到在显微镜下观察时可以看到单个细胞。
- 以200 x g 离心3分钟。
- 吸出上清液,并在 1x PBS 中用 200 μL 4% 多聚甲醛 (PFA) 溶液固定 CM。在室温下孵育10分钟。
- 以200 x g 离心3分钟。吸出上清液并加入 1 mL PBS。
注意:暂停点:固定的hiPSC-CMs可以在4°C下储存长达4周。 - 将细胞悬液转移到FACS管中,并以200× g离心3分钟。吸出上清液并将 1 x 105 个细胞重悬于 50 μL 透化缓冲液中。
- 将细胞在4°C孵育30分钟。
- 对于免疫荧光流式细胞术分析,执行步骤8.9.1-8.9.4。
- 将细胞重悬于含有α-肌动蛋白抗体的流式细胞术缓冲液(50μL)中,稀释度为1:300。在另一个 FACS 管中,用相应的同种型对照(例如,FITC小鼠IgM,κ同种型[1:200稀释])将1 x 105 个细胞重悬于流式细胞术缓冲液(50μL)中。同样,将 1 x 105 个细胞重悬于 50 μL 流式细胞术缓冲液中以进行阴性对照。
- 将细胞在4°C孵育30分钟。
- 加入2.5mL流式细胞术缓冲液,并在4°C下以200× g 离心细胞3分钟;弃去上清液并重复该洗涤步骤两次。
- 将细胞重悬于50μL流式细胞术缓冲液中,并加入二抗山羊抗小鼠(1:300稀释)。
注意:将试管放在黑暗中,因为二抗溶液对光敏感。
- 为了用碘化丙啶(PI)进行活性检查,每个样品加入150μL的PI(1:1,000)并孵育15分钟。
注意:将试管放在黑暗中,因为PI溶液对光敏感。 - 根据标准设门策略调整门,如 补充图1 所示,并用流式细胞仪分析细胞。
9. 整个3D球体的免疫荧光染色
注意:该协议基于免疫荧光标记时整个类器官的高分辨率3D成像方案,该协议先前发表于29 并针对心脏球体进行了调整。在此过程中,所有移液器吸头和锥形管都可以涂上1%wt/v BSA-PBS,以防止球体粘附在塑料上。要涂覆材料,请浸入 1% 的 BSA-PBS 中。小心不要使用 5 mL 移液管损坏球体,避免机械损坏。
- 用 5 mL 移液管将 CS 收集在 15 mL 包被管中。球体肉眼可见。收集每种抗体组合~20-50个球状体。以70× g 离心3分钟并吸出上清液。
- 使用包被的 1 mL 吸头小心地将球体重悬于 1 mL 冰冷的 4% 多聚甲醛 (PFA) 溶液中,置于 1x PBS 中。
- 在4°C固定45分钟。20 分钟后,使用包被的 1 mL 吸头轻轻重悬球体。这均匀了所有球体之间的注视。
- 将 10 mL 冰冷的 PBS 加入试管中,并通过倒置试管轻轻混合。在4°C孵育10分钟,并以70× g 旋转3分钟。
注意:从此步骤开始,通常不需要涂覆尖端和锥形管,因为CS在固定后不会粘在尖端上。 - 通过将沉淀重悬于冰冷的 SWB(每孔 200 μL SWB)中来阻断 CS,并将球状体转移到 24 孔悬浮培养板中。
注意:来自一个大沉淀的CS可以分成多个孔以执行不同的染色。每种抗体组合使用 ~20-50 个 CS。 - 在4°C孵育至少15分钟。
- 在空孔中加入 200 μL SWB 作为参比孔。
注意:对于免疫荧光染色,也可以使用48孔板或96孔板来减少抗体的使用。然而,由于每孔体积较小,染色和洗涤结果可能会降低。 - 让球体沉淀在板的底部,让板以 45° 角倾斜 5 分钟。
- 取出 SWB,将 CSS 留在 200 μL 的 SWB 中(使用参比孔估计 200 μL 的最小体积)。
- 加入 200 μL 一抗 2x 浓缩的 SWB(例如,ɑ-肌动蛋白 [1:200] 和肌钙蛋白 T [1:200]),并在 4 °C 下孵育过夜,同时摇动/摇动(在水平摇床上 40 rpm)。
- 第二天,向每个孔中加入 1 mL 的 SWB。
- 让球体以 45° 角离开板 55 分钟,让球体沉降在板底部。
- 取出 SWB,在板中留下 200 μL。加入 1 mL SWB 并缓慢摇动/摇动洗涤 2 小时。
- 再重复步骤 9.12 和 9.13 两次。
- 让CS沉降在板的底部,让板倾斜45°5分钟。取出 SWB,在每个孔中留下 200 μL
- 加入 200 μL 的 SWB,加入二抗、偶联抗体和 2x 浓缩染料(例如 DAPI [1 μg/mL]、小鼠-AF488 [1:500]、兔-AF568 [1:500]),并在 4 °C 下在黑暗中孵育过夜,同时缓慢摇动/摇动。
- 第二天,再重复步骤 9.12 和 9.13 两次。
- 小心地将CS转移到1.5 mL管中,并以70 x g 离心3分钟。
- 在不中断CS的情况下,通过移液尽可能多地去除SWB。
- 使用 200 μL 尖端加入包埋溶液(ES;至少 50 μL,室温下),末端被切断并轻轻重悬以防止气泡形成并在室温下孵育 20 分钟。
- 同时,在载玻片上用指甲油或硅酮密封剂制作一个方形容器。
- 切下 200 μL 吸头的末端,并将 ES 中的 CSS 转移到方形容器的中间。
- 在上面放一个方形盖玻片。为减少气泡,请先放置盖玻片的一侧,然后将盖玻片从一侧缓慢降低到另一侧,直到表面下没有滞留的空气,然后松开盖玻片。
- 轻轻推盖玻片的所有边缘,将其密封在指甲油或硅酮密封胶上。
- 将载玻片在室温下放置过夜。第二天,载玻片准备好进行成像。
注意:ES的光学清除会导致轻微的组织收缩。然而,这不能影响CS的整体形态。通过将载玻片储存在4°C(至少1周)或-20°C(至少6个月)下,可以在此处暂停染色程序。
结果
图1A所示的实验方案描述了从先前扩展的hiPSC-CM生成CS。CS在接种后第1天在超低附着圆底板中获得3D结构,并且可以培养长达6周(图1B)。通过免疫荧光染色评估,3周龄CS中的大多数细胞表达肌瘤蛋白,如α-肌动蛋白和肌钙蛋白T,并显示出规则的肌节组织(图1C)。为了定量α-肌动蛋白阳性细胞,进行了流式细胞术分析。根据免疫荧光结果,流式细胞术数据在第0天(76.9%±16.6%)和3周龄CS(71.1%±22.7%)中显示出相当高水平的α-肌动蛋白(图1D),表明培养过程中细胞组成恒定且高度纯化。与 hiPSC-CM 衍生球体(第 42 天)中连接(GJA1、JPH2 和 PKP2)、桥粒 (DES) 和线粒体 (ATP5A) 的心脏基因表达增加,与 hiPSC-CM 在 2D 中培养 90 天相比(图 1E)。这些基因的表达是细胞间相互作用和成熟的标志30。
随后,在不同时间点评估CSs的功能特性,即跳动速率和Ca2+处理(图2)。如图2A,B所示评估了钙瞬态参数,如上升时间、峰值时间、衰减时间和钙瞬态持续时间(CTD90)。在生成后的前 3 周,击败 CS 的百分比相似,但在第 6 周 (Wk6) CS 中显着下降(图 2C)。与Wk1相比,Wk3的跳动率显着降低,与CS的跳动百分比类似,在Wk6处急剧下降(图2D)。在Wk6,观察到CS恶化,这可以解释跳动速率和跳动CS数量的下降。 钙瞬态参数的测量表明Wk2处的峰值显着更高(图2E),而与Wk1相比,Wk3处的上升时间,衰减时间和CTD90显着增加(图2F-H).综上所述,这些结果表明,hiPSC-CM衍生的球体在生成后第2周和第3周左右在功能上是最佳的。
图3显示了球体尺寸对跳动速率和钙处理的影响。通过在 96 孔板的孔中接种 2.5 x 10 4、5 x 104、10 x 104 和 20 x 104 hiPSC-CM 来生成 CS,每个条件总共 24 个 CS/孔(图 3A)。正如预期的那样,球体尺寸随着所用细胞数量的增加而增加,范围从 178 ± 36 μm 到 351 ± 65 μm(图 3A,右图)。在四种不同的播种密度下测量了3周龄CS中的Ca2+瞬变(图3B)。对击败CS的测量表明,只有约50%的较小尺寸CS(2.5K和5K-CS)跳动,而较大尺寸的CS(10K和20K-CS)的百分比显着更高(约85%)(图3C)。5K、10K和20K-CS显示出类似的跳动率(约28 bpm),与2.5K-CS相比明显更高(图3D)。钙图像的峰值在所有测试条件下相似(图3E),但是,与较小的CS(2.5K和5K-CS)相比,较大尺寸的CS(10K和20K-CS)的上升时间(图3F)、衰减时间(图3G)和CTD90(图3H)显着增加。综上所述,这些结果表明,当使用10K至20K hiPSC-CMs/孔的接种密度时,hiPSC-CM衍生的球状体是钙处理筛选的最佳选择。
接下来,我们评估了冷冻保存对CS活力和功能的影响。在分析之前,解冻的CS在培养物中维持1周(图4A)。如流式细胞术(图4B)和钙黄绿素-AM(图4C)细胞活力测试所示,冷冻保存不影响CS内的细胞活力。 此外,与新鲜年龄匹配的CS相比,解冻的CS显示出相似的肉瘤蛋白表达水平(图4D)。这些数据表明,CSs可以有效地冷冻保存,用于随后的心脏功能分析和高通量筛选。
最后,在新鲜和冷冻保存的CS中测量打浆活性和Ca2+处理(图5)。分别在解冻后的不同时间点测量击败CSs的百分比,分别为2天,5天和7天。虽然大多数新鲜CS随着时间的推移显示出跳动活性,但显然冷冻保存的CS需要长达1周的培养才能恢复其跳动活性(图5B)。解冻的CS与新鲜CS的跳动率没有显着变化;然而,在一些冷冻CS中没有观察到自发跳动活动(图5C)。尽管与新鲜CS相比,冷冻/解冻CS的峰值显着降低(图5D),但与新鲜CS相比,冷冻/解冻CS的上升时间,腐烂时间和CTD90没有显着变化(图5E-G)。这些数据表明,解冻后,重要的是让CS在培养箱中恢复至少1周,然后再测量跳动活性和Ca2+瞬态。
综上所述,这些结果表明,hiPSC-CM衍生球体的冷冻保存可保持心肌细胞活力,肌瘤结构及其功能特征,例如自发跳动活性和钙处理。因此,hiPSC-CM衍生的球状体代表了在 体外准确概括心脏电生理学的合适模型。
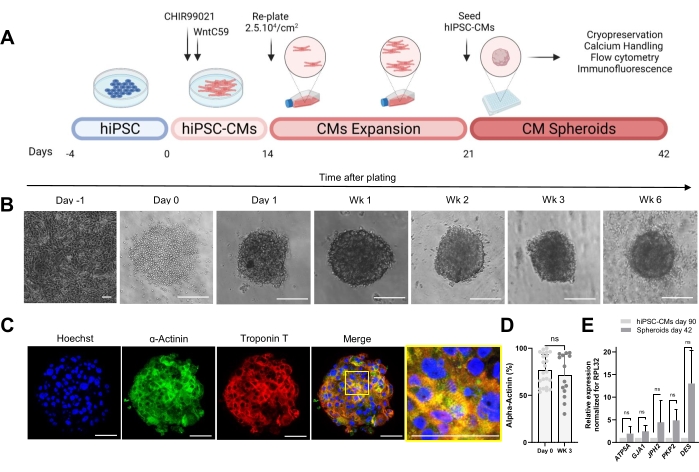
图1:心脏球体的生成 。 (A)基于Wnt的定向心脏分化,hiPSC-CM的后续扩增以及CS的产生示意图 biorender.com。(B)CS培养不同时间点的明场图像。比例尺,200 μm。周代表周。(C)3周龄CS中心脏肌瘤蛋白α-肌动蛋白和肌钙蛋白T的代表性免疫荧光图像。 免疫荧光:Hoechst(蓝色),α-肌动蛋白(绿色)和肌钙蛋白T(红色)。比例尺,200 μm。右侧放大的合并图片显示了肌节组织。比例尺,50 μm。 (D)在CSs形成之前(第0天)和3周前(第0天)和3周对α-肌动蛋白阳性细胞进行流式细胞术定量。 (n = 14-23每种条件。(E)对培养90天(2D)的hiPSC-CMs和培养42天的球状体样品进行RT-qPCR,以确定与细胞连接,中间丝和线粒体相关的不同心脏基因的表达水平。(n = 1-3 批次)。数据表示为平均值±标准偏差。 NS(非显著性),由非配对 t 检验计算得出。 请点击此处查看此图的大图。
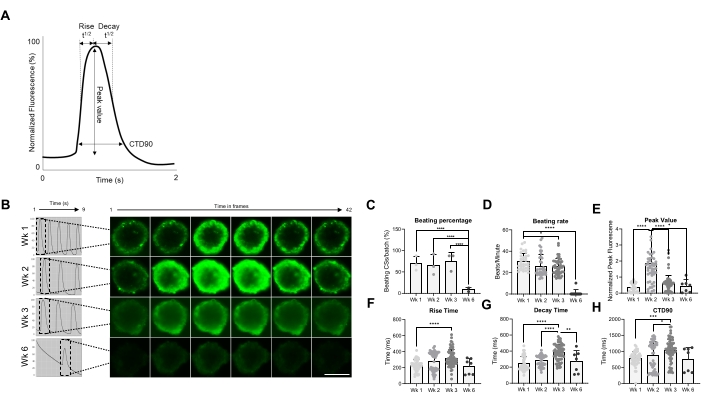
图2:CS在生成后不同周的跳动率和钙处理。 (A)Cyteseer软件中Vala科学分析算法计算的钙瞬态参数示例。(B)CSs在生成后不同时间点(周)的代表性钙瞬态迹线和延时图像。比例尺,200 μm。 (C)自发跳动活动的时程量化表示为跳动CS的百分比。 (D)培养期间CS的跳动率。(E-H)钙瞬变的定量,显示峰值、上升时间、衰减时间和CTD90。显示的数据是SD±平均值,生物学重复= 3,技术重复= 38,50,66和7。*p < 0.05, ****p < 0.001;单因素方差分析,然后是Tukey的事后多重比较测试。缩写;CTD = 钙瞬时持续时间,Wk = 周,CSs = 人心球。请点击此处查看此图的大图。
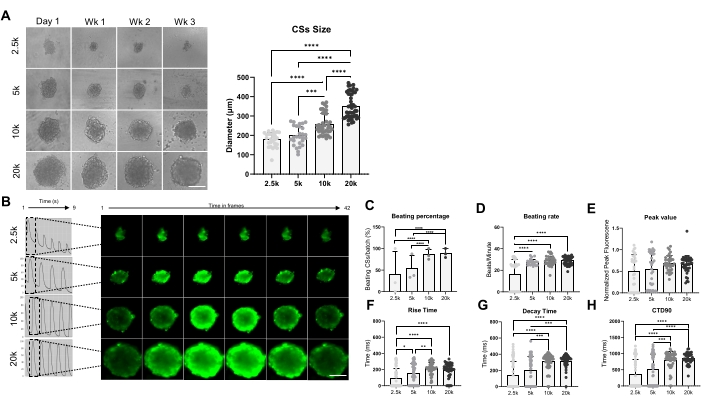
图 3:使用不同细胞接种密度生成的 CS 中的跳动速率和钙处理。 (A)使用不同数量的hiPSC-CM生成的CS的明场成像(左)和尺寸测量(右)。比例尺,200 μm。 (B)2.5K-20K-CSs的代表性钙瞬态迹线和延时图像。(中,四)2.5K-20K-CS的跳动率和跳动率。(E-H)2.5K-20K-CS中的峰值、上升时间、衰减时间和CTD90。数据平均值±SD.生物学重复= 3,技术重复= 28-39。*p < 0.05, ****p < 0.001;单因素方差分析,然后是Tukey的事后多重比较测试。缩写:CTD = 钙瞬时持续时间,Wk = 周,k = x 1,000 个细胞,CSs = 心脏球状体。请点击此处查看此图的大图。
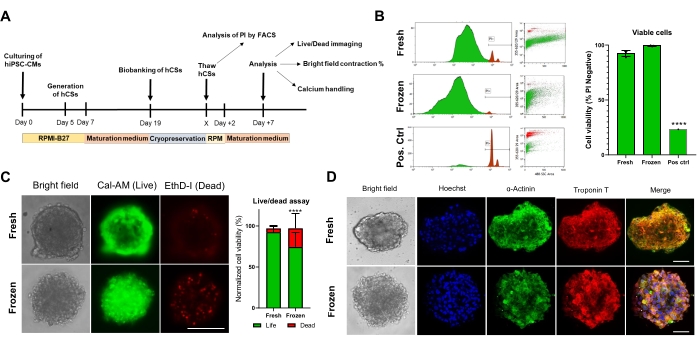
图4.冷冻保存对心脏球状体活力和结构的影响。 (A)CS生成,随后的生物样本库和解冻的示意图。(B)新鲜和冷冻保存的CS中的流式细胞术细胞活力测试。作为阳性对照,使用10%Triton-X溶液处理5分钟。(每个条件 n = 4)。数据表示为标准偏差±平均值。 ** **p < 0.001;单因素方差分析,然后是Tukey的事后多重比较测试。(C)培养7天后新鲜与解冻CS中的钙黄绿素-AM细胞活力测试(n = 15-17每个条件,** **p <0.001,通过配对t检验;比例尺,200μm)。(D)新鲜和解冻CS中α-肌动蛋白和肌钙蛋白T表达的代表性明场(左)和免疫荧光染色。 免疫荧光:Hoechst(蓝色),α-肌动蛋白(绿色)和肌钙蛋白T(红色)。右侧合并的图片显示了CS中的肌节条纹。 比例尺,50 μm。 缩写:X = 选择的解冻日,PI = 碘化丙啶,Cal-AM = 钙黄绿素-AM,EthD-I = 乙锭同型二聚体 I。 请点击此处查看此图的大图。
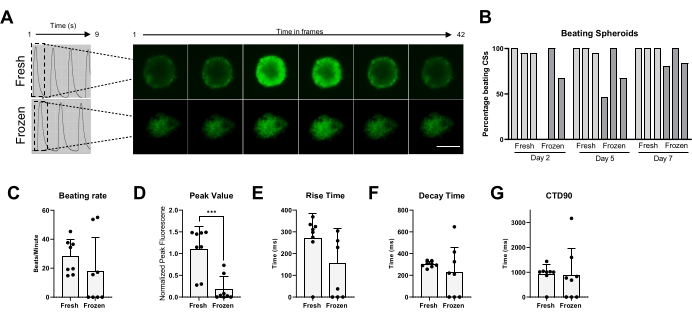
图5:新鲜与解冻CS中的钙瞬变。 (A)冷冻保存前和解冻后1周CS的代表性钙瞬态迹线和延时图像。(B)新鲜和冷冻/解冻的心脏球体的跳动百分比。条形表示单个实验。(C)新鲜和冷冻/解冻的心脏球体的跳动速率。(D-G)钙瞬态参数的量化:峰值、上升时间、衰减时间和CTD90。数据平均值±标准偏差*p < 0.05,****p < 0.001;单因素方差分析,然后是Tukey的事后多重比较测试。缩写;CTD = 钙瞬时持续时间,CSs = 心脏球状体。请点击此处查看此图的大图。
补充图1:流式细胞术分析的代表性门控策略。 (A)纯人群中α-肌动蛋白阳性hiPSC-CMs的代表性门控策略与阴性对照和同种型对照的比较。α-肌动蛋白阳性分析细胞的数量为25 x 105。缩写;SSC = 侧散射,PI+ = 碘化丙啶阳性。(B)用于新鲜,解冻,阳性对照(Triton-X)和阴性对照(未染色)的活力分析的代表性门控策略。 请点击此处下载此文件。
讨论
心脏药物发现受到依赖非人类动物和细胞模型的阻碍,这些模型的通量和生理保真度不足,无法准确执行读数。hiPSC-CM生物学与HT仪器和生理探针相结合,有可能将人类模型重新引入心脏病建模和药物发现的最早阶段。我们开发了一种3D心脏组织生成方法,可产生高质量和功能性的CS,用于最佳的心脏病建模和药物筛选平台。此外,将球体技术结合在用于工业电动汽车生产的 3D 生物反应器系统中,可以朝着基于 EV 的疗法的临床转化迈出必要的一步。这里描述的方法依赖于几个关键因素,是现有协议9,10,28,29的变体。这些方法包括:1)生成3D组织构建体,2)筛选前的最佳细胞数量和时间,3)提高仪器的灵敏度和高通量能力,以及4)能够在任何功能分析之前冷冻球体。与先前描述的协议不同,所提出的协议描述了每天产生多达1,500个微球以及HTS的适用性。使用现有的 96 孔钙成像系统或 24 孔多重工程心脏组织对 6 x 0.5 对数剂量的 100 种化合物进行 10 次重复的常规分析需要大约 5 亿至 30 亿个 hiPSC-CMs31,32。与传统系统相比,所提出的应用使心脏筛查的成本和时间效率更低,因为与所述方法相比,96孔板只需要10%的接种密度。此外,与以前的协议(例如悬挂-下降法)相比,通过在超低附着板中自聚集生成微球可实现单个微组织的高质量自动成像33。
这个小型3D模型模拟 了体内 心血管环境的生物学和生理表型。如前所述,与2D单层细胞培养物相比,3D心脏组织构建体中的钙瞬变显着增加34。
接下来,我们发现播种密度和适当的培养时间也是成功CS筛选的关键因素。每个球体10K-20K hiPSC-CMs的密度和生成后2-3周之间的筛选是最佳的,而太小或太旧的球体显示出钙处理紊乱(图2 和 图3)。因此,保持播种密度尽可能一致非常重要,因为尺寸会影响功能参数。此外,尽管这种光学方法为整个组织的活体3D培养提供了良好的结果,但在(亚)细胞水平的较大球体内获取数据具有挑战性,而不依赖耗时的组织学方法。最近,已经发布了几种使用"光学清除"的方法,该方法能够采集整个3D球体,并有机会对标记物进行单细胞定量。在这里,我们调整了从CS收集到图像分析的3天方案,该方案针对使用共聚焦显微镜29 的3D成像进行了优化(图1C 和 图4D)。
最后,随着3D心脏组织应用和商业应用的增加,各种捐赠者对长期存储和患者特定生物样本库的需求正在上升。冷冻保存是一种有效的策略,可以随着时间的推移从多个批次中生成HTS板。hiPSC-CMs的冷冻在前面已经描述过,与其他培养细胞类型10,35,36相比没有区别。最近,已经描述了用2D细胞冷冻板的方法37。在这里,我们发现与其他三种(数据未显示)相比,PSC冷冻保存试剂盒是最佳条件,并使用该培养基有效冷冻球状体。冷冻保存后,活力仍然很高(图4B,C),但CS的电生理特性受到影响,解冻后需要一段时间的孵育。事实上,解冻后1周,CSs表现出自发的跳动活性和钙处理。然而,已经描述新鲜和回收的hiPSC-CMs并不总是表现出相同的分子和生理特性38。当使用冷冻保存的hiPSC-CMs评估药物诱导的心脏读数时,需要考虑这一限制。此外,尽管我们有效地调节了每个球状体的细胞数量和钙瞬时成像的最佳时间,但通过将hiPSC来源的心肌细胞与内皮细胞,成纤维细胞,细胞-细胞连接和细胞外基质(如壳聚糖,胶原蛋白IV,纤连蛋白,基质胶或层粘连蛋白)混合,可以改善心球39,40.总体而言,我们提出了一个循序渐进的方案,以有效地生成适用于下游应用的CS,例如疾病建模和HT药物筛选。
披露声明
作者没有什么可透露的。
致谢
我们要感谢VARA科学为Cyteseer软件包和自动3D钙分析的优化。我们要感谢 PLN 基金会 (RM) 的赠款支持。P.A.D.和F.S.由CUREPLaN Leducq支持。J.P.G.S.得到了欧洲研究理事会(ERC)的H2020-EVICARE (#725229)的支持。J.W.B.得到了UMC乌得勒支临床奖学金,荷兰心脏研究所奖学金和CVON-Dosis青年人才奖学金的支持;荷兰心脏基金会(CVON-Dosis 2014-40)。北卡罗来纳州得到了荷兰科学研究组织(RegmedXB #024.003.013)的引力计划"材料驱动的再生"和玛丽·斯克沃多夫斯卡-居里行动(赠款协议RESCUE #801540)的支持。V.S.-P.由联盟基金(UMCU、UU、TU / E)支持。A.v.M.由欧盟资助的项目BRAVE(H2020,ID:874827)提供支持
材料
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
参考文献
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。