需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
胶原蛋白表面固定和胶原蛋白结合测定的优化方法
* 这些作者具有相同的贡献
摘要
这项工作提出了一种优化的方案,可可重复地将 I 型和 III 型胶原蛋白固定和定量到微孔板上,然后采用改进的 体外 结合测定方案,以使用时间分辨荧光方法研究胶原蛋白-化合物相互作用。提供了随后的分步数据分析和数据解释。
摘要
纤维化发生在各种组织中,作为对损伤或损伤的修复反应。然而,如果过量,纤维化会导致组织瘢痕形成和器官衰竭,这与高发病率和死亡率有关。胶原蛋白是纤维化的关键驱动因素,I 型和 III 型胶原蛋白是许多纤维化疾病的主要类型。与用于固定其他蛋白质(例如弹性蛋白、白蛋白、纤连蛋白等)的常规方案不同,用于可重复固定不同类型胶原蛋白以产生稳定涂层的综合方案并不容易获得。固定胶原蛋白非常具有挑战性,因为多种实验条件可能会影响固定化的效率,包括胶原蛋白的类型、pH 值、温度和所用微孔板的类型。在这里,提供了可重复固定和定量 I 型和 III 型胶原蛋白的详细方案,从而产生稳定且可重复的凝胶/膜。此外,这项工作展示了如何进行、分析和解释 体外 时间分辨荧光结合研究,以研究胶原蛋白和候选胶原蛋白结合化合物(例如,与携带铕 [Eu(III)] 的金属螯合物偶联的肽)之间的相互作用。这种方法可以普遍应用于各种生物医学应用,包括分子成像领域以开发靶向成像探针、药物开发、细胞毒性研究、细胞增殖研究和免疫测定。
引言
作为组织损伤后自然伤口愈合过程的一部分,纤维结缔组织的积累被称为纤维化。然而,如果纤维组织的沉积未能终止并继续超过组织修复所需的范围,则纤维化变得过度 1,2。过度纤维化会损害器官的生理和功能,并可能导致器官损伤和潜在的器官衰竭 3,4,5。纤维化的两个主要驱动因素是细胞外基质 (ECM) 蛋白 I 型和 III型 6 型胶原蛋白。胶原蛋白是一种存在于各种器官中的结构蛋白,约占人体总蛋白质含量的三分之一1。人类基因组测序鉴定出 28 种不同类型的胶原蛋白,其中最丰富的是纤维状胶原蛋白7。初级纤维胶原蛋白是 I 型胶原蛋白,它为 ECM 提供拉伸强度和抗变形性8。III 型胶原蛋白是一种结构成分,可提供弹性并与 I 型胶原蛋白共定位。它在胚胎发生过程中表达,天然在成人皮肤、肌肉和血管中少量存在9。
体内 胶原蛋白合成始于细胞内过程,其中 mRNA 在细胞核中转录,然后移动到细胞质,在那里被翻译。翻译后,形成的链在内质网中经历翻译后修饰,在那里形成前胶原蛋白(胶原蛋白的前体)。然后,前胶原蛋白进入高尔基体进行最终修饰,然后排泄到细胞外间隙10。通过蛋白水解切割,前胶原蛋白转化为原胶原蛋白。然后 通过 赖氨酰氧化酶 (LOX) 催化的酶介导的交联 途径或通过涉及 美拉德反应的非酶介导的交联途径进行交联11。固定胶原蛋白的 体外 方案主要依赖于胶原蛋白的自组装能力。胶原蛋白是根据其溶解度从组织中提取的,这在很大程度上取决于单个胶原纤维的交联程度7。原纤维胶原蛋白溶解在乙酸中,当 pH 值和温度调整时,原纤维会重组12。 在体外,胶原蛋白的原纤维生成可以看作是一个两阶段过程7。第一阶段是成核阶段,胶原纤维形成二聚体和三聚体原纤维,然后重新排列形成三螺旋结构。第二阶段是生长期,原纤维开始横向生长并导致特征性的 D 带形成,这通常通过浊度7 的变化来观察到。原子力显微镜 (AFM) 研究还表明,I 型和 III 型胶原蛋白具有不同的特性(表 1)13。
为了研究胶原蛋白与其他化合物之间的结合相互作用,需要可重复地将胶原蛋白固定在微孔板的孔中。有多种方案可用于固定可溶性胶原蛋白 14,15,16。市售的预涂胶原蛋白微孔板通常用于细胞培养。然而,预包被的微孔板在孔上涂有一层非常薄的未知量胶原蛋白,这使得它们不适合体外结合测定。将胶原蛋白固定到板孔上时存在几个挑战。关键挑战之一是选择合适的微孔板类型,因为不同类型的胶原蛋白(例如 I 型和 III 型)具有不同的化学性质,因此,根据微孔板的材料,可以更稳定、更有效地固定。另一个挑战是固定方案的实验条件,因为原纤维生成过程取决于多种因素,包括温度、pH 值、胶原蛋白的原液浓度和缓冲液的离子浓度7。
为了研究胶原蛋白(靶标)与其他化合物(即靶向肽)之间的相互作用,还需要开发一种稳健的筛选测定法,通过测量解离常数 Kd 来研究化合物对靶标的特异性和选择性。蛋白质(胶原蛋白)和配体之间双分子复合物形成的平衡位置用缔合常数 Ka 表示,其大小与结合亲和力成正比。然而,最常见的是,生物化学家用双分子复合物的平衡解离常数 Kd 来表达亲和关系,其定义为 Kd = 1/Ka(Kd 并且是 Ka 的倒数)。Kd 值越低,蛋白质与配体之间的结合强度越强。使用 Kd 来比较不同配体对同一蛋白质的结合亲和力(反之亦然)的优势在于,双分子复合物的 Kd 单位是 mol/L(即浓度单位)。在大多数实验条件下,Kd 值对应于在平衡时导致靶标上可用结合位点饱和 50% 的配体浓度17,18。解离常数通常通过分析受体占有率 (FO) 来提取,FO 定义为占据的结合位点与总可用结合位点之间的比率,作为配体浓度的函数。只要有能够区分和测量结合配体量的分析分析,就可以做到这一点。
可以使用各种生物分析方法进行体外配体结合测定,包括光学光度法、放射配体法、电感耦合等离子体质谱法 (ICP-MS) 和表面等离子体共振 (SPR)。在光度法中,基于荧光发射的方法通常需要用荧光团标记配体或蛋白质,以提高灵敏度并提高检测限。某些镧系元素 (III) 离子的螯合物,例如 Eu(III),作为荧光团非常有吸引力,因为它们具有较大的斯托克斯位移、窄发射带(提供良好的信噪比)、有限的光漂白和较长的发射寿命。重要的是,后一种特性能够使用 Eu(III) 荧光团的时间分辨荧光 (TRF) 来消除背景自发荧光19。在基于 Eu(III) 的 TRF 测定的解离增强镧系元素荧光免疫测定 (DELFIA) 版本中,用非发光 Eu(III) 螯合物标记的配体与固定在微孔板上的受体一起孵育。标记的配体/受体复合物与未结合的配体分离,Eu(III) 荧光在酸性 pH 值下解离被激活,然后与荧光增强螯合剂重新络合,形成胶束包埋的高荧光 Eu(III) 复合物20。
使用螯合剂(例如五乙酸二乙烯三胺 (DTPA))可以合理地实现解络步骤,这些螯合剂显示出快速的解络动力学。然而,与某些大环螯合剂的 Eu(III) 配合物,如 DOTA(1,4,7,10-四氮杂环十二烷1,4,7,10-四乙酸)及其单酰胺衍生物 (DO3AAm),表现出高热力学稳定性和非常高的动力学惰性。在这种情况下,必须准确优化分解步骤,以实现基于 Eu(III) 的 TRF21 的充分且可重复的激活。值得注意的是,镧系元素 (Ln(III))-DOTA 和 Ln(III)-DO3AAm 复合物是磁共振成像 (MRI) 技术最常用作 体内 分子成像造影剂的复合物22。因此,基于 Ln(III) 的 TRF 测定是 体外 研究 MRI 分子探针与其预期生物靶标的结合亲和力的首选工具。目前,缺乏用于固定 I 型和 III 型胶原蛋白的全面且可重复的方案以及用于进行 体外 结合 Eu(III) TRF 实验的可重复管道。为了克服这些限制,开发了可重复的方法,用于自组装和固定 I 型和 III 型胶原蛋白,并分别产生稳定的凝胶和薄膜,具有 体外结合测定 所需的足够浓度的胶原蛋白。提出了一种针对基于高惰性 Eu(III)-DO3Aam 的复合物的 Eu(III) TRF 的优化方案。最后,展示了一种优化的 体外 微孔板 Eu(III) TRF 测定法,用于测量 Eu(III) 标记的配体对固定的 I 型和 III 型胶原蛋白的 Kd (图 1)。
研究方案
注意:用于这项工作的所有产品信息均列在 材料表中。
1. 胶原蛋白固定
注:确保在结合测定期间使用的微孔板中的每个孔都有空邻孔,以避免交叉荧光。在冰上执行这部分方案,因为胶原蛋白会在温度和 pH 值升高时自组装。在组织培养罩和无菌条件下执行此程序,因为微孔板随后在组织培养 (TC) 培养箱中孵育。
- I 型胶原蛋白固定在 96 孔微孔板上(图 2)
第 1 天- 准备一个装有冰块的硅胶托盘。将含有 I 型胶原蛋白的小瓶、冷的 10x 磷酸盐缓冲盐水 (PBS) 和微孔板放在冰上,并用 70% 乙醇喷洒所有物质。将材料放在 TC 引擎盖下。
- 使用等体积的 I 型胶原蛋白和 10x PBS (pH 7.4) 中和胶原蛋白。
- 将溶液倒置几次,确保没有气泡形成。
- 将 100 μL 中和的胶原蛋白添加到微孔板的每隔一孔和每隔一行中,并在 37 °C 下孵育 18-20 小时以使胶原蛋白蒸发至干燥。
第 2 天 - 用 100 μL 的 1x PBS(pH 值为 7.4)洗涤微孔板两次,以去除任何未结合的胶原蛋白。
- 将微孔板转移到 37 °C 的培养箱中再干燥 2 小时,然后再用于进一步的结合实验。
- III 型胶原固定在 96 孔微孔板上(图 3)
第 1 天- 准备一个装有冰块的硅胶托盘。将含有 III 型胶原蛋白的小瓶、冷的 10x PBS 和微孔板放在冰上,并用 70% 乙醇喷洒所有物质。将材料放在 TC 引擎盖下。
- 使用等体积的 III 型胶原蛋白和 10x PBS (pH 7.4) 中和胶原蛋白。
- 将 70 μL 中和的胶原蛋白添加到微孔板的每隔一孔和每隔一行中,并将微孔板放在组织培养罩下,在 37 °C 下孵育 2 小时,以使胶原蛋白蒸发至干燥。
第 2 天 - 用 70 μL 的 1x PBS(pH 值为 7.4)洗涤微孔板两次,以去除任何未结合的胶原蛋白。
- 将微孔板转移到 37 °C 的培养箱中 1 小时,然后将微孔板转移到工作台上,并让其干燥 1 小时,然后再用于进一步的结合实验。
2. 固定化胶原凝胶/膜的稳定性评估
- 与 PBS 孵育 1 小时
注:在结合实验期间,将固定的胶原蛋白与感兴趣的化合物一起孵育。研究所得胶原凝胶或胶原膜的稳定性非常重要。为此,请测量三个条件的稳定性: 不洗涤 = 孵育后立即测量固定的胶原蛋白; 洗涤 = 用 100 μL PBS 洗涤板两次后测量固定的胶原蛋白;和 1小时的PBS模拟和洗涤 =在与PBS孵育1小时后测量固定的胶原蛋白,然后用PBS洗涤两次。下面,解释了 PBS 孵育方法。- 向每个涂有胶原蛋白的孔中加入 70 μL PBS (1x),并在室温下孵育微孔板 1 小时。
- 使用移液管从每个孔中吸出多余的液体,并在进行下述蛋白质定量测定之前用 PBS (1x) 洗涤两次。
- 使用二辛可宁酸测定 (BCA) 定量固定化胶原蛋白的量
注:按照制造商的说明使用 Pierce BCA 蛋白检测试剂盒(材料表)。为该测定制作相应的胶原蛋白标准品。I 型胶原的浓度范围为 0-3,000 μg/mL,III 型胶原的浓度范围为 0-750 μg/mL。总共为每个胶原蛋白制作 11 个标准品。- 按照制造商的说明准备所需的工作试剂 (WR) 总体积。
- 将 25 μL 每种胶原蛋白标准品添加到微孔板孔中(一式两份)。这些解决方案用于绘制标准曲线。
- 向含有标准品的每个孔中加入 200 μL 工作试剂溶液,并向涂有未知浓度胶原蛋白的孔中加入。
- 将微孔板放在平板振荡器上 30 秒。盖上微孔板,并在 37 °C 下孵育 30 分钟。
- 取出微孔板,并在室温下冷却。使用读板器测量 560 nm 处的吸光度。
- 通过将 A560 (AU) 与 11 种标准溶液的浓度 (μg/mL) 作图来绘制校准曲线,并使用校准曲线计算胶原蛋白的量。
3. 铕 (III) TRF 配体结合测定(图 1)
注:使用的化合物是用单个 Eu(III)-DO3AAm 复合物标记的候选胶原结合肽 (CBP),称为 Eu(III)-DO3AAm-CBP(图 4)。
- 胶原包被板与 Eu(III)-DO3AAm-CBP 化合物的孵育
- 在 1x PBS 中制备浓度范围为 0.1-15 μM(0.1 μM、0.5 μM、1 μM、3 μM、5 μM、7 μM、10 μM 和 15 μM)的 Eu(III)-DO3AAm-CBP 化合物溶液。
- 将 75 μL 每种浓度的化合物加入胶原包被的孔中(板 A)。一式三份进行实验,以计算与胶原蛋白结合的化合物的量。
- 使用第二个未包被的板(板 B),向空孔中加入 75 μL 每种化合物,以计算化合物与板的非特异性结合。每个浓度一式三份。
- 将微孔板在室温下孵育 1 小时。
- 使用移液管,从每个孔中吸出并丢弃多余的溶液,并用 1x PBS 洗涤孔两次以去除多余的未结合化合物。使用胶原包被和未包被的微孔板执行此步骤。
- 向第三个未涂层板(板 C)中,添加 10 μL 相同范围的 Eu(III)-DO3AAm-CBP 浓度(一式两份)。使用溶液中 Eu(III)-DO3AAm-CBP 的荧光读数绘制校准曲线。
注:请勿从该板中洗涤或吸出溶液。
- 铕 (III) 和时间分辨荧光 (TRF) 读数的酸萃取
注:请参阅有关酸性溶液 (AS) 和缓冲溶液 (BS) 体积制备和校准的补充信息。在本研究中,可重现地达到最佳 pH 值所需的 AS 和 BS 体积分别为 54 μL 和 46 μL。在板 A、板 B 和板 C 上执行以下作。- 向每个孔中加入 54 μL 酸性溶液 (AS),将板置于 37 °C 的培养箱中 90 分钟,用箔纸覆盖微孔板以避免蒸发。必须仔细控制温度和孵育时间,以实现可重现的解络。
- 向每个孔中加入 46 μL 缓冲溶液 (BS),轻轻摇动板 30 秒。
- 加入 100 μL 增强溶液 (ES),摇动板 30 秒。
- 等待 30 分钟,然后使用 TRF 读板器读取板。使用 表 2 中列出的参数。
4. 数据分析
- 定量固定在孔上的胶原蛋白浓度
- 获得 A560 (AU) 的校准曲线与 11 种标准溶液的浓度 (μg/mL) 的方程。
- 使用从含有胶原蛋白标准品的孔中获得的吸光度读数。
- 将重复孔的平均值制成表格,并绘制平均吸光度与已知蛋白质(胶原蛋白)浓度 (μg/mL) 的关系图,以获得标准曲线的方程式。
- 使用吸光度值计算固定化胶原蛋白的质量 (μg) 和浓度 (M)。
- 计算包含固定化胶原蛋白的三个孔的平均吸光度值,并记录标准偏差。
- 使用从胶原蛋白标准曲线(步骤 2.2.6)获得的标准曲线方程,将从胶原蛋白包被的孔中测量的吸光度转换为协同。由此,计算固定在实验孔内的胶原蛋白浓度(以 μg/mL 为单位)。
- 首先将步骤 4.1.2.2 (μg/mL) 中计算的浓度转换为克/升,然后根据胶原蛋白的分子量转换为摩尔 (M)。
- 最后,通过将浓度除以添加到孔中的胶原蛋白体积(I 型胶原蛋白为 100 μL,III 型胶原蛋白为 70 μL)来计算固定在每个孔中的胶原蛋白的质量。
- 获得 A560 (AU) 的校准曲线与 11 种标准溶液的浓度 (μg/mL) 的方程。
- 解离常数 (Kd) (图 4)
- 提取荧光读数。
- 将荧光读数从读板器导出到电子表格。
注意:在结合测定中,重要的是要考虑化合物与板塑料表面的潜在非特异性结合。 - 计算三个不同板的每种化合物浓度一式三份测量的平均值:来自包被孔(板 A)的特异性结合读数,来自未涂层孔(板 B)的非特异性结合和未涂层孔中溶液中的总 Eu(III)-DO3AAm-CBP(板 C)。
- 通过从包被孔(板 A)中减去未包被孔(板 B)的荧光读数来确定结合化合物的荧光值。
公式 1:确定结合的荧光17:
结合荧光 = 特异性(包被孔) - 非特异性(未包被孔) - 使用溶液中 Eu(III) 标记化合物的读数(板 C)生成校准曲线。绘制相对于 Eu(III) 标记化合物浓度获得的荧光读数。执行线性回归拟合。
- 将荧光读数从读板器导出到电子表格。
- 将荧光读数转换为浓度。
- 使用标准荧光曲线将结合荧光的读数(步骤 4.2.3)转换为浓度,该曲线来自使用溶液中化合物浓度(步骤 4.2.1.4)生成的数据。
注:当比较一种化合物与以不同浓度固定的不同靶蛋白的结合特性时,在计算与靶标结合的化合物量(即结合化合物/蛋白质)时,需要考虑后者。 - 将结合化合物的浓度除以固定在孔中的蛋白质的浓度。
注:对于此计算,使用在孔与 PBS 孵育 1 小时后计算的固定化胶原蛋白的浓度(所谓的 PBS 模拟实验;上文第 2.1 节)。这是为了解释在孵育步骤和洗涤步骤中胶原蛋白的潜在损失,这些损失不会影响最终的荧光信号。 - 使用散点图绘制数据,该散点图在 x 轴上是化合物的浓度 (μM),在 y 轴上是结合的化合物/蛋白质。
- 使用标准荧光曲线将结合荧光的读数(步骤 4.2.3)转换为浓度,该曲线来自使用溶液中化合物浓度(步骤 4.2.1.4)生成的数据。
- 获取 Kd 值。
- 使用两种可能的结合动力学模型拟合步骤 4.2.2.3 中获取的数据:单位点结合和单位点结合与山坡。每个模型的方程如图 6 所示。
- 在拟合数据时,选择提供具有最高 R 平方值的无歧义拟合的模型。
- 排除每组荧光读数的异常值 (s) 每个板每个浓度。
- 计算最终的 Kd 值,并将数据表示为独立实验的平均值±标准差。
注:为了获得可靠的结果,请在每个微孔板内进行一式三份测量,并使用不同的微孔板至少进行三个独立实验。
- 计算占用分数 (FO)。
注:从公式 2 中,目标的浓度是未知的,因此,通过使用代数和 Kd,从公式 3 中,以公式 4 的形式出现计算分数占用率的可行公式。
方程 2:分数占用率的定义17:
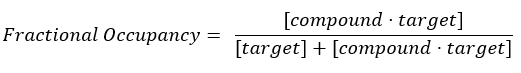
公式 3:解离常数 Kd,即化合物在平衡状态下占据目标浓度的50% 17:
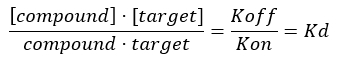
公式 4:重新排列公式以计算 FO 公式17:
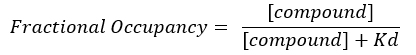
- 使用为每个单独板获得的独立 Kd 值计算 FO。绘制 FO 的结果、平均值和标准差与化合物浓度的关系图。
- 报告值范围为 0 到 1 的 FO,或以百分比报告值范围为 0%-100%。
- 提取荧光读数。
结果
评估固定在凝胶/薄膜中的 I 型和 III 型胶原蛋白的稳定性和浓度
使用三种不同的条件对每孔固定的胶原蛋白浓度进行定量:a) 在固定蛋白质后未用 PBS 洗涤的孔中(不洗涤);b) 在固定后进行洗涤步骤(PBS 两次)的孔中去除任何未包被的蛋白质;c) 与 PBS 孵育 1 小时后在孔中(PBS 模拟实验)。进行 PBS 孵育模拟步骤,以了解在实际结合测定期间与含有候?...
讨论
这项工作提出了一种固定 I 型和 III 型胶原蛋白的可重复方法。它还演示了一种用于获取、分析和解释体外 Eu(III) TRF 结合数据的方案,以表征候选配体对 I 型和 III 型胶原的结合特性。此处介绍的固定 I 型和 III 型胶原蛋白的方案是考虑到先前发表的关于体外 I 型和 III 型胶原纤维生成的工作而开发和优化的 13,16...
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢以下资助者支持这项工作:(1) 英国医学研究委员会 (MR/N013700/1) 和伦敦国王学院 MRC 生物医学科学博士培训伙伴关系的成员;(2) BHF 计划拨款 RG/20/1/34802;(3) BHF 项目资助 PG/2019/34897;(4) King's BHF Centre for Research Excellence 拨款 RE/18/2/34213;(5) ANID 千年科学倡议计划 - ICN2021_004;(6) ANID 基础赠款 FB210024。
材料
| Name | Company | Catalog Number | Comments |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| Ice | |||
| Ice | |||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH meter (sevenCompact) | Mettler Toledo | ||
| pH meter (sevenCompact) | Mettler Toledo | ||
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Type I bovine collagen, 3 mg/mL | Corning | 354231 | |
| Type III human placenta collagen, 0.99 mg/mL | Advanced Biomatrix | 5021 |
参考文献
- Distler, J. H. W., et al. Review: Frontiers of antifibrotic therapy in systemic sclerosis. Arthritis and Rheumatology. 69 (2), 257-267 (2017).
- Wynn, T. A. Fibrotic disease and the TH1/TH2 paradigm. Nature Reviews Immunology. 4 (8), 583-594 (2004).
- Saha, P., et al. Magnetic resonance T1 relaxation time of venous thrombus is determined by iron processing and predicts susceptibility to lysis. Circulation. 128 (7), 729-736 (2013).
- Mirshahi, M., et al. Defective thrombolysis due to collagen incorporation in fibrin clots. Thrombosis Research. 8, 73-80 (1988).
- Comerota, A. J. The ATTRACT trial: Rationale for early intervention for iliofemoral DVT. Perspectives in Vascular Surgery and Endovascular Therapy. 21 (4), 221-225 (2009).
- Bateman, E. D., Turner-Warwick, M., Adelmann-Grill, B. C. Immunohistochemical study of collagen types in human foetal lung and fibrotic lung disease. Thorax. 36 (9), 645-653 (1981).
- Pawelec, K. M., Best, S. M., Cameron, R. E. Collagen: A network for regenerative medicine. Journal of Materials Chemistry B. 4 (40), 6484-6496 (2016).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Copes, F., Pien, N., Van Vlierberghe, S., Boccafoschi, F., Mantovani, D. Collagen-based tissue engineering strategies for vascular medicine. Frontiers in Bioengineering and Biotechnology. 7, 166 (2019).
- Veis, A. The biochemistry of collagen. Annals of Clinical and Laboratory Science. 5 (2), 123-131 (1975).
- Bielajew, B. K., Hu, J. C., Athanasiou, K. A. Collagen: Quantification, biomechanics, and role of minor subtypes in cartilage. Nature Reviews Materials. 5, 730-747 (2020).
- Zhao, Z., et al. Structural and functional plasticity of collagen fibrils. DNA and Cell Biology. 38 (4), 367-373 (2019).
- Eryilmaz, E., Teizer, W., Hwang, W. In vitro analysis of the co-assembly of type-I and type-III collagen. Cellular and Molecular Bioengineering. 10 (1), 41-53 (2017).
- Jagnow, J., Clegg, S. Klebsiella pneumoniae MrkD-mediated biofilm formation on extracellular matrix- and collagen-coated surfaces. Microbiology. 149 (9), 2397-2405 (2003).
- O'Sullivan, D., O'Neill, L., Bourke, P. Direct plasma deposition of collagen on 96-well polystyrene plates for cell culture. ACS Omega. 5 (39), 25069-25076 (2020).
- Caravan, P., et al. Collagen-targeted MRI contrast agent for molecular imaging of fibrosis. Angewandte Chemie - International Edition. 46 (43), 8171-8173 (2007).
- Copeland, R. A. . Enzymes: A Practical Introduction to Structure, Mechanism, and Data Analysis. , (2000).
- Salahudeen, M. S., Nishtala, P. S. An overview of pharmacodynamic modelling, ligand-binding approach and its application in clinical practice. Saudi Pharmaceutical Journal. 25 (2), 165-175 (2017).
- Bünzli, J. C. G., Piguet, C. Taking advantage of luminescent lanthanide ions. Chemical Society Reviews. 34 (12), 1048-1077 (2005).
- Hemmilii, I. Luminescent lanthanide chelates - A way to more sensitive diagnostic methods. Journal of Alloys and Compounds. 225 (1-2), 480-485 (1995).
- De Silva, C. R., Vagner, J., Lynch, R., Gillies, R. J., Hruby, V. J. Optimization of time-resolved fluorescence assay for detection of europium-tetraazacyclododecyltetraacetic acid-labeled ligand-receptor interactions. Analytical Biochemistry. 398 (1), 15-23 (2010).
- Digilio, G., Lacerda, S., Lavin Plaza, B., Phinikaridou, A. Extracellular matrix targeted MRI probes. Analysis & Sensing. 3 (1), (2022).
- Phinikaridou, A., et al. Tropoelastin: A novel marker for plaque progression and instability. Circulation. Cardiovascular imaging. 11 (8), 007303 (2018).
- Guzaeva, T. V., et al. Protein A used in DELFIA for the determination of specific antibodies. Immunology Letters. 35 (3), 285-289 (1993).
- Nasiri, A. H., Nasiri, H. R. Polymerase assays for lead discovery: An overall review of methodologies and approaches. Analytical Biochemistry. 563, 40-50 (2018).
- Capuana, F., et al. Imaging of dysfunctional elastogenesis in atherosclerosis using an improved gadolinium-based tetrameric MRI probe targeted to tropoelastin. Journal of Medicinal Chemistry. 64 (20), 15250-15261 (2021).
- Drescher, D. G., Drescher, M. J., Ramakrishnan, N. A. Surface plasmon resonance (SPR) analysis of binding interactions of proteins in inner-ear sensory epithelia. Methods in Molecular Biology. 493, 323-343 (2009).
- Murali, S., Rustandi, R. R., Zheng, X., Payne, A., Shang, L. Applications of surface plasmon resonance and biolayer interferometry for virus-ligand binding. Viruses. 14 (4), 717 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。