需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
明胶甲基丙烯酰基颗粒水凝胶支架:高通量微凝胶制造、冻干、化学组装和 3D 生物打印
摘要
本文介绍了使用微流体装置制造高通量明胶甲基丙烯酰基微凝胶的协议,将微凝胶转化为可重悬粉末(微气凝胶),微凝胶的化学组装以形成颗粒水凝胶支架,以及开发具有保留微孔隙率的颗粒水凝胶生物墨水用于3D生物打印。
摘要
通过组装水凝胶微粒(HMP) 制造的 颗粒水凝胶支架(GHS)的出现使微孔支架能够原 位形成。与传统的块状水凝胶不同,GHS中互连的微尺度孔有助于与降解无关的细胞浸润以及氧气,营养和细胞副产物的转移。甲基丙烯酰基改性明胶(GelMA)是一种(光)化学可交联的蛋白质基生物聚合物,含有细胞粘合剂和可生物降解的部分,已被广泛用作细胞响应/指导性生物材料。将散装GelMA转化为GHS可能会为组织工程和再生带来大量机会。在本文中,我们展示了高通量GelMA微凝胶制造,转化为可重悬的干燥微凝胶(微气凝胶),通过微凝胶的化学组装 形成 GHS以及用于挤出生物打印的颗粒生物墨水制造的过程。我们展示了通过冷却和光交联的顺序物理化学处理如何能够形成机械坚固 的 GHS。当光线无法接触时(例如,在深层组织注射期间),可以使用谷氨酰胺转移酶通过酶促交联 进行 生物正交组装单独交联的 GelMA HMP。最后,通过多相带电纳米颗粒的界面自组装 ,证明了 低HMP堆积密度下微孔GHS的三维(3D)生物打印。
引言
组装HMP构建块以形成组织工程支架在过去几年中获得了极大的关注1。通过HMP组件制造的GHS与散装同类产品相比具有独特的性能,包括源自离散构建块之间的空隙的细胞级微孔隙。其他特性,如注射性、模块化和刚度与孔隙率的解耦,使 GHS 成为增强组织修复和再生的有前途的平台2.不同的生物材料已被用于GHS制造,包括合成PEG基聚合物3,4和多糖,如藻酸盐5和透明质酸6,7。在天然衍生聚合物中,用于GHS制造的最常见的基于蛋白质的生物聚合物是GelMA8,9,10,11,这是一种可交联,生物相容性,生物粘附性和可生物降解的生物材料12,13。
HMP可以通过间歇乳化8、流动聚焦14、15或分步乳化9、11微流体装置、共混16或复合聚结17、18来制备。通常,制造吞吐量和HMP单分散性之间存在权衡。例如,混合技术产生不规则形状和高度分散的HMP。 间歇乳化或复杂凝聚能够生产大量多分散球形HMP。 聚焦流动微流体装置已被用于制造变异系数为<5%的高度单分散液滴,但通量显着降低。在分步乳化微流体器件中,高度并行化的步骤能够实现单分散HMP的高通量制造19。
甲基丙烯酰改性明胶 (GelMA) HMP 构建块具有热响应性和(光)化学交联性,可实现轻松的 GHS 制造20。当冷却到临界溶液温度(UCST)21以下(例如,在4°C下)时,含有GelMA溶液的液滴转化为物理交联的HMP。然后利用外力(例如,通过离心)填充这些 HMP 构建块以产生卡住的微凝胶悬浮液。通过(光)化学交联在相邻的HMP之间建立颗粒间链接,以形成机械坚固的GHS14。GHS最重要的特性之一是微孔率,使体外细胞易于渗透11,并增强体内组织向内生长22。HMP的三维(3D)生物打印通常使用紧密包装的微凝胶悬浮液进行,这会影响微孔23。
我们最近开发了一类基于GelMA微凝胶的界面纳米工程的新型颗粒生物墨水,通过吸附带异质电荷的纳米颗粒 , 然后纳米颗粒可逆自组装。该策略使松散包装的微凝胶剪切产量和挤出3D可生物打印,从而保留了增材制造的GHS11的微尺度孔隙率。本文介绍了高通量 GelMA 液滴制造方法、将这些液滴转化为物理交联的 HMP、使用可重悬粉末制造 GelMA HMP、GelMA GHS 形成、GelMA 纳米工程颗粒生物墨水 (NGB) 制备和 3D 生物打印。
Access restricted. Please log in or start a trial to view this content.
研究方案
注意:有关本协议中使用的所有材料、仪器和试剂的详细信息,请参阅 材料表 。
1. 凝胶MA合成
注意:GelMA合成应在化学通风橱中进行,并应始终使用适当的个人防护设备(PPE)。
- 将200mL的Dulbecco磷酸盐缓冲盐水(DPBS,1x)加入锥形瓶中,并将溶液加热至达到50°C。 用铝箔盖住烧瓶以防止蒸发。
- 在50°C下向DPBS溶液中加入20g明胶粉,同时以240rpm搅拌直至粉末完全溶解。
- 通过玻璃巴斯德移液管 将 16、2.5 或 0.5 mL 甲基丙烯酸酸酐 (MA) 滴加到明胶溶液中,以分别以高、中或低程度的甲基丙烯酰基取代合成 GelMA。
注意:MA是一种有害物质。使用 MA 时应使用适当的 PPE。MA也是光敏的,因此通过用铝箔包裹烧瓶来保护反应免受光照。 - 2小时后,在50°C下加入400mL的DPBS以停止反应。让其在50°C下继续搅拌10分钟。
- 将溶液倒入截止分子量为12-14kDa的透析膜管中,然后将管子置于装有40°C超纯水的5L烧杯中。在240rpm和40°C下搅拌水。
- 将溶液与超纯水透析10天,每天换水2次,以除去未反应的甲基丙烯酸酸酐,副产物和其他杂质。
- 10天后,向GelMA溶液中加入400°C的400mL超纯水。以240rpm搅拌溶液15分钟。
- 使用咖啡过滤器过滤溶液两次,然后通过0.2μm真空过滤装置 进行 真空过滤。
- 将25mL过滤溶液倒入50mL离心管中,并在-80°C下冷冻,将试管水平放置。
- 2天后,取下盖子并用实验室湿巾盖住离心管。使用胶带或橡皮筋紧紧握住湿巾。
- 冻干冷冻的GelMA溶液以产生白色固体GelMA。
- 为了进行质子核磁共振(1H NMR)波谱,分别在1mL氧化氘(D2O)中加入30mg明胶粉(对照)或冻干GelMA,并将样品保持在37°C,直到明胶粉或GelMA完全溶解。
- 获得 1H NMR 波谱,并通过分别在 ~6.5-7.5 和 ~3.0 ppm 的化学位移处对芳香酸和赖氨酸亚甲基质子峰进行积分来确定甲基丙烯酰基取代程度。使用芳香酸峰作为参考,并根据公式(1)使用赖氨酸亚甲基峰确定取代度(DS):
DS (%) = [1 - (GelMA 中赖氨酸亚甲基的面积 / 明胶中赖氨酸亚甲基的面积)] × 100 (1)
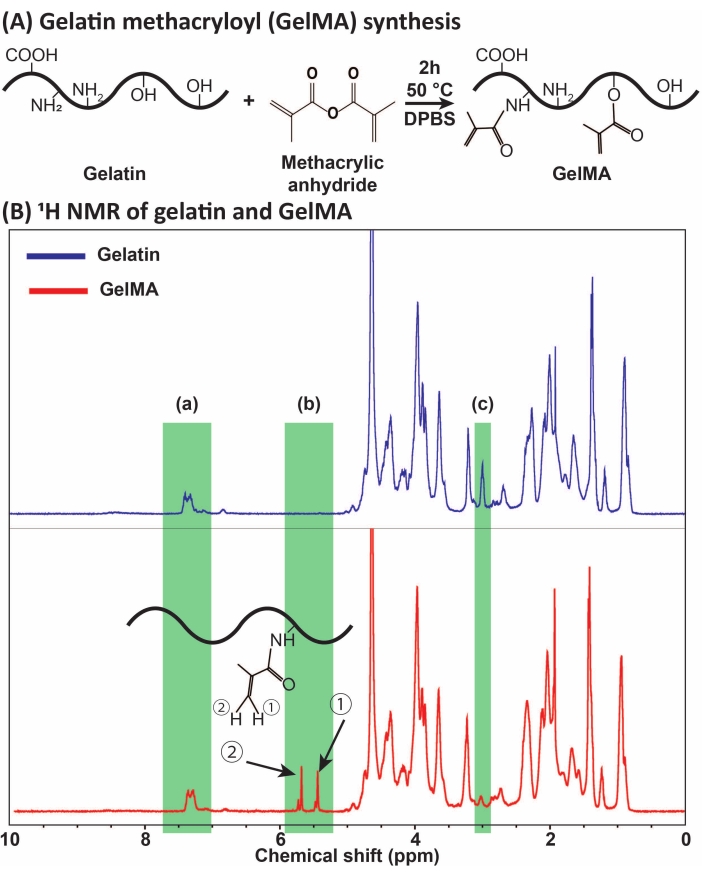
图1:GelMA的合成和表征。 (A)GelMA合成反应。用甲基丙烯酸酐在50°C下修饰明胶2小时。 (B)明胶和GelMA的质子核磁共振(1H NMR)波谱:(a)芳香酸的峰,选择作为校准的参考,(b)明胶MA修饰后的乙烯基官能团峰,以及(c)赖氨酸蛋白的峰。在本例中,MA替代度为71%±3%(n = 3)。该图经Ataie等人许可修改11 缩写:GelMA =明胶甲基丙烯酰;DPBS = 杜尔贝克的磷酸盐缓冲盐水;MA = 甲基丙烯酰基。请点击此处查看此图的大图。
2. 高通量GelMA微凝胶制备
- 设备主模具微细加工
注意:母模可以使用KMPR 1000负光刻胶系列19通过软光刻进行微加工。- 解冻KMPR 1025和1035过夜。避免任何光线照射。
- 要涂覆晶圆上的第一层,请将KMPR 1025直接添加到晶圆的中间,制成约5厘米的光刻胶圆圈。以 3,000 rpm 的速度运行旋涂机30 s。
- 在100°C加热板上软烘烤12分钟。然后,在冷却板上冷却5分钟。
- 将第一层掩模连接到空白的钠钙上,然后使用掩模对准器将涂层晶圆暴露在紫外线下,剂量为 645 mJ/cm2 。
- 在100°C加热板上烘烤3分钟。在冷却板上冷却5分钟。
注意:请勿在此步骤之后开发。在流程结束时仅开发一次。 - 使用 KMPR 1035 在晶圆上旋转涂覆第二层。以 1,000 rpm 的速度运行旋涂机30 s。
- 在100°C加热板上软烘烤30分钟。在冷却板上冷却5分钟。
- 将第二层面膜连接到空白的苏打石灰上,并使用对准器通过标准对齐标志对齐第二个面罩。使用高达 2,000 mJ/cm 的掩模对准器暴露在紫外线下2.
- 在100°C加热板上烘烤5分钟。
- 在 SU-6 显影剂中开发 >8 分钟。
注意:如果晶圆看起来呈乳白色,则应继续较长时间的开发。每次和中间都使用新的开发人员以获得更好的结果。 - 喷洒异丙醇。确保晶圆是透明的,没有乳白色残留物。使用氮气(N2)彻底干燥晶圆。
- 微流控装置制造
- 将 50 克聚二甲基硅氧烷 (PDMS) 底座倒入透明塑料杯中。然后,将5g交联剂加入塑料杯中。用刮刀将基料和交联剂剧烈混合,直到获得奶油质地。
- 使用干燥器对混合物进行真空脱气20分钟,直到它变得澄清。将混合物倒在主模具上,母模具放置在内部并粘贴在培养皿上。
注意:确保浇注的PDMS的厚度(高度)为≤8毫米。 - 将培养皿放入干燥器中,再次对PDMS混合物进行真空脱气20分钟,直到除去所有气泡。将培养皿置于70°C烘箱中2小时,直到PDMS交联。将培养皿从烤箱中取出并让它冷却。
- 使用手术刀将设备从模具中切出。将设备从主模具上缓慢拆下。使用活检冲头(直径 1.5 毫米)在入口和出口处切孔。
- 使用遮蔽胶带清除PDMS设备和载玻片上的任何灰尘,并将载玻片和设备放入等离子清洁室中。在气压低于400 mTorr的情况下进行45秒(当腔室变为紫色时开始)进行等离子体处理。从腔室中取出载玻片和设备,将设备放在载玻片上,然后施加轻微的压力。将设备放入70°C烘箱中30分钟以增强粘合。
- 在工程流体中填充三氯(1H,1H,2H,2H-全氟辛基)硅烷(F-硅烷,2% v / v),以使通道表面具有亲氟性。通过出口注入F-硅烷溶液,并确保所有设备都暴露在外。等待5-10分钟。
注意:F-硅烷应新鲜制备。此外,F-硅烷不应长时间暴露在空气中。 - 通过水溶液入口将F-硅烷溶液从设备中吸出。使用工程流体清洗设备两次,然后再次吸出。将设备置于70°C烘箱中30分钟以蒸发剩余的油。
- 液滴形成和GelMA微凝胶制备
- 将 10 mg 苯基-2,4,6-三甲基苯甲酰次膦酸锂 (LAP) 加入 10 mL DPBS 中,制备光引发剂 (PI) 溶液 (0.1% w/v)。用铝箔包裹溶液,使其免受光照。
- 将所需量的GelMA溶解在PI溶液中,并将其置于37°C炉中1小时,直到获得澄清溶液。用铝箔包裹保护溶液免受光照。
- 为了制备油相,在工程流体中制备2%的生物相容性表面活性剂溶液。
- 将 Tygon 管插入 PDMS 设备的入口和出口。在 Tygon 管的另一端插入 25 G 钝针,用于入口。使用尽可能长的管路长度。
- 将设备放在显微镜下。使用吹风机和/或空间加热器保持环境温暖(~40°C)。
- 将水溶液和油溶液装入单独的注射器中,连接到设备。分别以 160 和 80 μL/min 的流速启动油相(连续)和水相(分散)的注射泵。
注意:首先启动油相;确保油充满通道,然后开始水相。 - 将液滴收集在容器中,并通过光学显微镜成像 在 成像室中对其进行评估。
- 将液滴在4°C下过夜,同时保护它们免受光照以启动GelMA HMP物理交联,并在4°C下将液滴转化为稳定的微凝胶。
3. 通过微工程乳液到粉末(MEtoP) 技术将 微凝胶转化为可重悬粉末
注意:已经开发了将含水油乳液基HMP转化为微粒粉末(微气凝胶)的MEtoP技术,这些粉末具有可重悬性,形状,尺寸和组装等特性。
- 要实施MEtoP,请使用耐热微量离心管或冷冻管收集工程流体中的物理交联HMP。打开管盖并用实验室擦拭布和胶带密封。
- 将物理交联的HMP在液氮(-196°C)中深度冷冻10分钟。
- 将速冻管转移到冷冻干燥仪器中。在低压(例如,0.06 mbar)下冻干试管至少6小时以产生粉末。
注意:冻干循环完成后,缓慢打破压力,以免粉末损失。 - 向粉末中加入 1 mL 冷却的 PI 溶液 (0.1% w/v,4 °C) 以制成微凝胶悬浮液。涡旋5秒,然后以3,000 ×g 离心15秒。弃去上清液。
- 使用外置活塞式移液器将包装好的微凝胶悬浮液转移到模具中,然后以400nm波长以15mW / cm2 的紫外光暴露60秒以形成GHS。

图 2:通过 MEtoP 技术制备 GelMA 微粒粉末。 (A)从MEtoP技术或常规HMP冻干中获得的GelMA粉末的图像。在MEtoP技术或传统冻干中,HMP分别悬浮在油表面活性剂或水性介质中。工程流体可保护分散相(HMP)免受聚集,并在冻干过程中保留GelMA微粒的理化特性。(B)通过MEtoP制备的干燥HMP与在水介质中冻干的HMP的比较示意图。(C)与传统冻干法相比,通过MEtoP制备的干燥GelMA微粒的SEM图像。比例尺 = 2 mm(左;A), 500 μm (右;A), 10 μm (左;C)和200μm(右;该图经Sheikhi等人许可修改,26缩写为:GelMA=明胶甲基丙烯酰;DPBS = 杜尔贝克的磷酸盐缓冲盐水;MEtoP = 微工程乳液到粉末;HMP = 水凝胶微粒;SEM = 扫描电子显微镜。请点击此处查看此图的大图。
4. 凝胶MA GHS形成
注意:该协议用于制备400μL微凝胶悬浮液。对于更大的数量,需要扩大规模。为了保持GelMA HMP的物理交联,所有步骤都应在约4°C下通过将微凝胶容器放入冰水桶中进行。
- 将 400 μL 工程流体中的 1H,1H-全氟-1-辛醇 (PFO) 溶液 (20% v/v) 添加到物理交联的 GelMA HMP 中。然后,涡旋5秒,并以300 ×g离心15秒。
注意:工程流体中的PFO溶液应新鲜制备并储存在封闭的容器中以防止蒸发。 - 通过移液 从 GelMA HMP 中去除油相。
- 向微凝胶悬液中加入 400 μL 在 4 °C 下的 PI 溶液 (0.1% w/v)。然后,涡旋5秒,并以300 × g 离心15秒。之后丢弃油。
- 重复上一步,但以 3,000 × g 离心。通过移液 去除 包装的GelMA HMP的上清液。
- 使用外置活塞式移液器将包装好的GelMA HMP转移到模具中,然后进行紫外线照射(波长= 400nm,强度= 15mW / cm2,曝光时间= 60秒)。
5. 纳米工程颗粒生物墨水(NGB)用于GHS的3D生物打印,并保留微孔隙率
- 将100mg纳米片粉加入3mL的4°C超纯水中,形成纳米颗粒分散体(3.33%w / v)。在4°C冰箱内剧烈涡旋分散体15分钟,以去除原本聚集的纳米颗粒。适当剥离的纳米颗粒产生清晰的分散体。
- 将 50 mg LAP 溶解在 5 mL 的 4 °C 超纯水中以制备储备 PI 溶液 (1% w/v)。
- 向剥离的纳米颗粒分散体中加入 333 μL PI 溶液 (1% w/v)。用铝箔包裹以防止环境光照射。涡旋1分钟以混合纳米颗粒分散体和PI。最终粘土和PI浓度分别为3% w/v和0.1% w/v。
- 在工程流体 (4 °C) 中加入 PFO 20% v/v,体积比为 1:1。彻底涡旋5秒。然后,以300 ×g 离心15秒,弃去含有表面活性剂的油相。
- 将补充LAP的纳米颗粒分散体(4°C)加入洗涤的GelMA HMP中。 涡旋15秒,以3,000× g 离心15秒,并丢弃底部的剩余油以及上清液分散体。
- 将悬浮液储存在4°C,同时使用铝箔保护其避光1天。这一步的产物是 GelMA NGB。
- 将NGB装入3 mL注射器中,用盖子和封口膜密封装入的注射器,并以200 × g 脉冲离心以除去滞留的空气。使用母-母 Luer-Lok 连接器将生物墨水转移到 3 mL 墨盒中。再次以 200 × g 的速度短暂离心滤芯以除去滞留的空气。使用前将NGB保持在4°C的冰箱中。
- 在制备含有细胞的生物墨水之前,制备浓缩的细胞悬液(例如,NIH/3T3鼠成纤维细胞),在100μL细胞培养基中含有~2400万个细胞。将细胞悬液装入 3 mL 注射器中,使用母-母 Luer-Lok 连接器偶联装载 NGB 的注射器和细胞加载注射器,并通过来回推动 40 倍轻轻混合细胞和 NGB。
- 使用带有标准锥形喷嘴的适当生物打印机打印NGB或含有细胞的NGB。将喷嘴装入 3 mL 打印头。保持打印床温度低于10°C。 打印前优化打印参数,如 速度 和 背压 。
- 选择基材和喷嘴类型(配备标准锥形喷嘴的气动 3 mL 注射器),使用设备指南校准生物打印机,选择所需的 gcode 或 STL 文件,然后开始打印。
注意:在进行含有细胞的生物打印时,所有材料和设备都应保存在生物安全柜下,以尽量减少污染。 - 打印后,将构建体暴露在紫外光下进行光交联(波长 = 400 nm,强度 = 15 mW/cm2,曝光时间 = 60 s)。
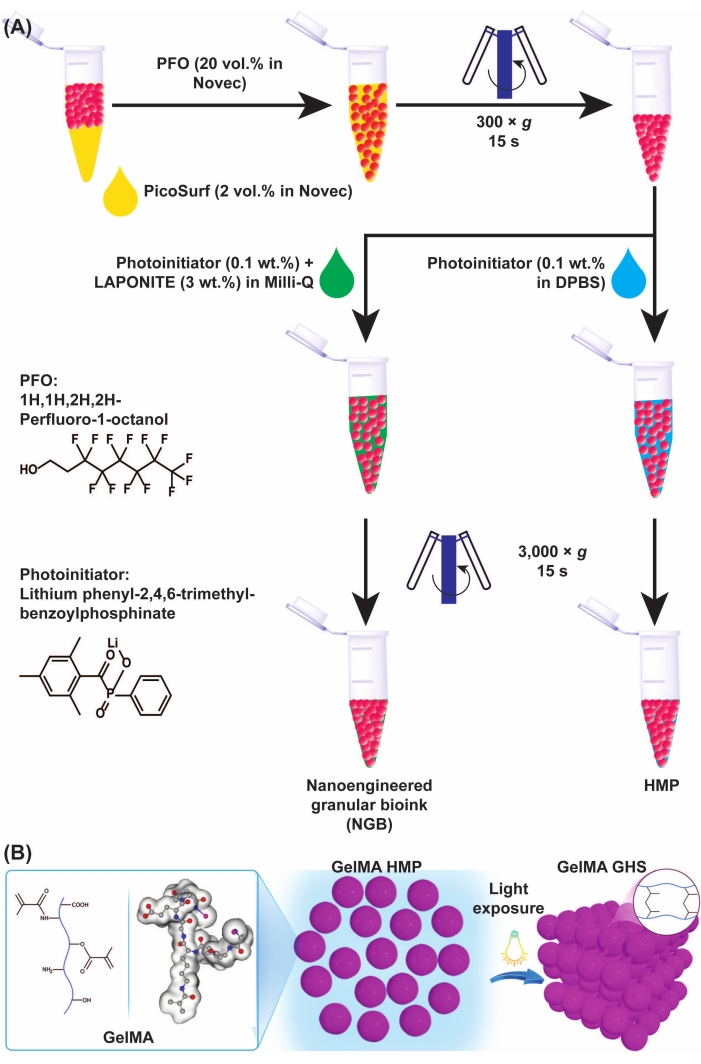
图3:GelMA微凝胶和GHS形成的示意图。 (A)GelMA微凝胶从油和NGB制备中分离的示意图。将PFO(工程流体中的20%v/v)以1:1的体积比加入到GelMA微凝胶油乳液中,然后以300 × g涡旋和离心15 s。为了制造GelMA GHS,将PI溶液(DPBS中的LAP 0.1% w/v)添加到GelMA HMP中,然后以3,000 × g涡旋和离心15 s。为了制备NGB,将PI溶液(LAP 0.1% w / v在超纯水中)和纳米片分散体(超纯水中3% w / v)加入到GelMA HMP悬浮液中,然后以3,000 × g涡旋和离心15 s。 图3A经Ataie,Z.等人的许可进行了修改11(B)将包装的GelMA HMP暴露在光下产生GHS。图3B经Sheikhi等人许可修改,15缩写:GelMA =明胶甲基丙烯酰;GHS = 颗粒水凝胶支架;NGB = 纳米工程颗粒生物墨水;全氟辛烷磺酸 = 1H,1H-全氟-1-辛醇;PI = 光引发剂;LAP = 苯基-2,4,6-三甲基苯甲酰次膦酸锂;HMP = 水凝胶微粒;DPBS = Dulbecco的磷酸盐缓冲盐水。请点击此处查看此图的大图。
Access restricted. Please log in or start a trial to view this content.
结果
GelMA是通过明胶与MA的反应合成的,如图 1A所示。通过调整反应条件,如MA浓度,得到不同程度的MA取代。为了量化MA取代的程度, 通过1H NMR波谱评估GelMA(图1B)。在~5-6 ppm的化学位移处具有代表性峰的乙烯基官能团证实了明胶成功合成GelMA。透析和无菌过滤后的反应收率为>70%(mg的GelMA/mg的明胶)。液滴/微凝胶制备产率为~100%。可以使用?...
Access restricted. Please log in or start a trial to view this content.
讨论
明胶及其衍生物是HMP制造中最常用的基于蛋白质的生物材料。使用步进乳化微流体装置可以克服通量与粒径单分散性权衡的挑战。这些装置每小时能够形成超过4000万个液滴,变异系数小于5%27。在本文中,我们讨论了含有GelMA溶液的液滴的微细加工,然后将其转化为GelMA HMP,粉末,GHS和NGB。
GelMA的热响应性使微流体的HMP制造和稳定变得简单。在高于UCST的温度?...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明不存在利益冲突。
致谢
作者要感谢宾夕法尼亚州立大学(宾夕法尼亚州立大学)化学工程系的研究支持专家T. Pond,宾夕法尼亚州立大学纳米制造实验室的工作人员以及Partillion Bioscience的J. de Rutte博士关于纳米制造过程的帮助和讨论。A. Sheikhi感谢材料研究所(MRI)和工程材料物质学院在人类水平种子基金,生活多功能材料系统融合中心(LiMC2)和卓越集群生活,适应性和能源自主材料系统(livMatS)生活多功能材料合作研究种子资助计划,以及宾夕法尼亚州立大学的启动基金的支持。本出版物中报告的研究得到了美国国立卫生研究院(NIH)国家生物医学成像和生物工程研究所(NIBIB)的部分支持,奖励号为R56EB032672。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1H,1H-perfluoro-1-octanol | Alfa Aesar, MA, USA | B20156-18 | 98% purity |
| Biopsy punch | Integra Miltex, NY, USA | 33-31A-P/25 | 1.5 mm Biopsy Punch with Plunger System |
| Blunt needle | SANANTS | 30-002-25 | 25 G |
| Bruker Avance NEO 400 MHz | 400 MHz Bruker NEO, MA, USA | NMR device | |
| Centrifuge | Eppendorf, Germany | 5415 C | |
| Centrifuge tube | Celltreat, MA ,USA | 229423 | |
| Coffee filters | BUNN, IL, USA | 20104.0006 | BUNN 8-12 Cup Coffee Filters, 6 each, 100 ct |
| Desiccator | Thermo Scientific | 5311-0250 | Nalgene Vacuum Desiccator, PC Cover and Body, 280 mm OD |
| Deuterium oxide | Sigma, MA, USA | 151882 | |
| Dialysis membrane (12-14 kDa) | Spectrum Laboratories, NJ, USA | 08-667E | |
| Dulbecco's phosphate buffered saline (DPBS, 1x) | Sigma, MA, USA | 56064C-10L | dry powder, without calcium, without magnesium, suitable for cell culture |
| Erlenmeyer flask | Corning, NY, USA | 4980 | Corning PYREX |
| Ethanol | VWR, PA, USA | 89125-188 | Koptec 200 proof |
| External thread cryogenic vials (cryovials) | Corning, NY, USA | 430659 | |
| Freeze dryer | Labconco, MO, USA | 71042000 | Equipped with vacuum pump (Catalog# 7587000) |
| Gelatin powder | Sigma, MA, USA | G1890-5100G | Type A from porcine skin, gel strength ~300 g Bloom |
| Glass microscope slides | VWR, PA, USA | 82027-788 | |
| Hotplate | FOUR E'S SCIENTIFIC | MI0102003 | 5 inch Magnetic Hotplate Stirrer Max Temp 280 °C/536 °F |
| Kimwipes | Fischer scientific, MA, USA | 06-666 | |
| KMPR 1000 negative photoresist series | Kayaku Advanced Materials, MA, USA | 121619 | KMPR1025 and KMP1035 are included |
| LAPONITE XLG | BYK USA Inc., CT, USA | 2344265 | |
| Lithium phenyl-2,4,6-trimethylbenzoylphosphinate (LAP) | Sigma, MA, USA | 900889-1G | >95% |
| Luer-Lok connector | BD, NJ, USA | BD 302995 | |
| MA/BA Gen4-Serie Mask- und Bond-Aligner | SÜSS MicroTeck, German | Nanofabrication device | |
| Methacylate anhydride | Sigma, MA, USA | 276685-100ML | contains 2,000 ppm topanol A as inhibitor, 94% |
| Milli-Q water | Millipore Corporation, MA, USA | ZRQSVR5WW | electrical resistivity ≈ 18 MΩ at 25 °C, Direct-Q 5 UV Remote Water Purification System |
| Novec 7500 engineering fluid | 3M, MN, USA | 3M ID 7100003723 | |
| Oven | VWR, PA, USA | VWR-1410 | 1410 Vacuum Oven |
| Parafilm | Fischer scientific, MA, USA | HS234526C | |
| Pasteur pipette | VWR, PA, USA | 14673-010 | |
| Petri dish | VWR, PA, USA | 25384-092 | polystyrene |
| Pico-Surf | Sphere Fluidics, UK | C022 | (5% (w/w) in Novec 7500) |
| Pipette | VWR, PA, USA | 89079-970 | |
| Pipette tips | VWR, PA, USA | 87006-060 | |
| Plasma cleaner chamber | Harrick Plasma, NY, USA | PDC-001-HP | |
| Polydimethylsiloxane | Dow Corning, MI, USA | 2065623 | SYLGARD 184 Silicone Elastomer Kit |
| Positive displacement pipette | Microman E M100E, Gilson, OH, USA | M100E | |
| Silicon wafers | UniversityWafer, MA, USA | 452/1196 | 4-inch mechanical grade |
| Spatula | VWR, PA, USA | 231-0104 | Disposable |
| SU-8 | Kayaku Advanced Materials, MA, USA | ||
| Syringe pump | Harvard Apparatus, MA, USA | 70-2001 | PHD 2000 |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Millipore Sigma, MA, USA | 448931-10G | 97% |
| Tygon tubings | Saint-globain, PA, USA | AAD04103 | |
| UV light | QUANS | Voltage: 85 V-265 V AC / Power: 20 W | |
| Vacuum filtration unit | VWR, PA, USA | 10040-460 | 0.20 µm |
| Vortex | Fischer scientific, USA | 14-955-151 | Mini Vortex Mixer |
参考文献
- Feng, Q., Li, D., Li, Q., Cao, X., Dong, H. Microgel assembly: Fabrication, characteristics and application in tissue engineering and regenerative medicine. Bioactive Materials. 9, 105-119 (2022).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Griffin, D. R., et al. Activating an adaptive immune response from a hydrogel scaffold imparts regenerative wound healing. Nature Materials. 20 (4), 560-569 (2021).
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Ding, A., et al. Jammed micro-flake hydrogel for four-dimensional living cell bioprinting. Advanced Materials. 34 (15), 2109394(2022).
- Muir, V. G., et al. Sticking together: injectable granular hydrogels with increased functionality via dynamic covalent inter-particle crosslinking. Small. 18 (36), 2201115(2022).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science and Engineering. 2 (11), 2034-2041 (2016).
- Molley, T. G., Hung, T., Kilian, K. A. Cell-laden gradient microgel suspensions for spatial control of differentiation during biofabrication. Advanced Healthcare Materials. , 2201122(2022).
- Zoratto, N., et al. In situ forming microporous gelatin methacryloyl hydrogel scaffolds from thermostable microgels for tissue engineering. Bioengineering and Translational. 5 (3), (2020).
- Yuan, Z., et al. In situ fused granular hydrogels with ultrastretchability, strong adhesion, and mutli-bioactivities for efficient chronic wound care. Chemical Engineering Journal. 450, 138076(2022).
- Ataie, Z., et al. Nanoengineered granular hydrogel bioinks with preserved interconnected microporosity for extrusion bioprinting. Small. 18 (37), 2202390(2022).
- Annabi, N., et al. 25th anniversary article: rational design and applications of hydrogels in regenerative medicine. Advanced Materials. 26 (1), 85-124 (2014).
- Rajabi, N., et al. Recent advances on bioprinted gelatin methacrylate-based hydrogels for tissue repair. Tissue Engineering. Part A. 27 (11-12), 679-702 (2021).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A., De Rutte, J. Methods for fabricating modular hydrogels from macromolecules with orthogonal physico-chemical responsivity. U.S. Patent Application. , 17/279,283 (2021).
- Sheikhi, A., et al. Microfluidic-enabled bottom-up hydrogels from annealable naturally-derived protein microbeads. Biomaterials. 192, 560-568 (2019).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), (2015).
- Seymour, A. J., Shin, S., Heilshorn, S. C. 3D printing of microgel scaffolds with tunable void fraction to promote cell infiltration. Advanced Healthcare Materials. 10 (18), 2100644(2021).
- Lee, A., et al. 3D bioprinting of collagen to rebuild components of the human heart. Science. 365 (6452), 482-487 (2019).
- de Rutte, J. M., Koh, J., Di Carlo, D. Scalable high-throughput production of modular microgels for in situ assembly of microporous tissue scaffolds. Advanced Functional Materials. 29 (25), 1900071(2019).
- Sheikhi, A., et al. Modular microporous hydrogels formed from microgel beads with orthogonal thermo-chemical responsivity: Microfluidic fabrication and characterization. MethodsX. 6, 1747-1752 (2019).
- Van Den Bulcke, A. I., et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules. 1 (1), 31-38 (2000).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194(2022).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3d printing applications. Advanced Science. 6 (1), 1801076(2019).
- Claaßen, C., et al. Quantification of substitution of gelatin methacryloyl: best practice and current pitfalls. Biomacromolecules. 19 (1), 42-52 (2018).
- Sheikhi, A., Di Carlo, D., Khademhosseini, A. Methods for converting colloidal systems to resuspendable/redispersable powders that preserve the original properties of the colloids. U.S. Patent Application. , 17/425,027 (2022).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Lee, S., de Rutte, J., Dimatteo, R., Koo, D., Di Carlo, D. Scalable fabrication and use of 3d structured microparticles spatially functionalized with biomolecules. ACS Nano. 16 (1), 38-49 (2022).
- Charlet, A., Bono, F., Amstad, E. Mechanical reinforcement of granular hydrogels. Chemical Science. 13 (11), 3082-3093 (2022).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。