需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
高级别浆液性卵巢癌患者来源类器官的生成和培养
摘要
患者来源类器官(PDO)是一种三维(3D)培养物,可以在 体外模拟肿瘤环境。在高级别浆液性卵巢癌中,PDO代表了研究新型生物标志物和治疗方法的模型。
摘要
类器官是3D动态肿瘤模型,可以从患者来源的卵巢肿瘤组织,腹水或胸腔积液中成功生长,并有助于发现卵巢癌的新疗法和预测性生物标志物。 这些模型概括了克隆异质性、肿瘤微环境以及细胞间和细胞间基质相互作用。此外,它们已被证明在形态学、细胞学、免疫组织化学和遗传学上与原发肿瘤相匹配。因此,类器官有助于肿瘤细胞和肿瘤微环境的研究,并且优于细胞系。本协议描述了从患者肿瘤,腹水和胸腔积液样本中生成患者来源的卵巢癌类器官的不同方法,成功率高于97%。患者样品通过机械和酶消化分离成细胞悬浮液。然后使用基底膜提取物(BME)对细胞进行铺板,并用含有特异性用于培养高级别浆液性卵巢癌(HGSOC)的补充剂的优化生长培养基支持。在形成初始类器官后,PDO可以维持长期培养,包括传代以扩增以进行后续实验。
引言
2021 年,美国约有 21,410 名女性新诊断出患有上皮性卵巢癌,12,940 名女性死于这种疾病1。尽管在手术和化疗方面已经取得了足够的进展,但超过 70% 的晚期疾病患者会出现化疗耐药性,并在诊断后 5 年内死亡2,3。因此,迫切需要治疗这种致命疾病的新策略和具有代表性的、可靠的临床前研究模型。
由原发性卵巢肿瘤产生的癌细胞系和患者来源的异种移植物(PDX)是卵巢癌研究中使用的主要仪器。癌细胞系的一个主要优点是它们的快速扩增。然而,它们的持续培养导致表型和基因型改变,导致癌细胞系偏离原始原发性癌症肿瘤样本。由于癌细胞系和原发肿瘤之间存在差异,在细胞系中具有积极作用的药物测定在临床试验中无法具有相同的效果2。为了克服这些限制,使用了 PDX 模型。这些模型是通过将新鲜的卵巢癌组织植入免疫缺陷小鼠中创建的。由于它们是 体内 模型,它们更准确地类似于人类生物学特征,反过来,更能预测药物结果。然而,这些模型也有很大的局限性,包括生成它们所需的成本、时间和资源4.
PDO为临床前研究提供了一种替代模型,克服了癌细胞系和PDX模型的局限性。PDO概括了患者的肿瘤和肿瘤微环境,因此为临床前研究提供了理想的体外可处理模型2,3,5。这些3D模型具有模拟原发性肿瘤的自组织功能,这是它们的二维(2D)细胞系对应物所不具备的特征。此外,这些模型已被证明在遗传和功能上代表其亲本肿瘤,因此是研究新疗法和生物过程的可靠模型。简而言之,它们提供类似于细胞系的长期扩增和储存能力,但也包括小鼠模型固有的微环境和细胞间相互作用4,6。
本协议描述了从患者来源的肿瘤、腹水和胸腔积液样本中创建 PDO,成功率高于 97%。然后,PDO培养物可以扩增多代,并用于测试药物治疗敏感性和预测生物标志物。这种方法代表了一种可用于根据PDO的治疗反应进行个性化治疗的技术。
研究方案
为研究收集的所有人体组织标本都是根据机构审查委员会(IRB)批准的协议获得的。下面概述的方案是在无菌人体组织培养环境中进行的。从人类受试者那里获得了知情的书面同意。符合条件的患者必须有卵巢癌的诊断或推定诊断,愿意并能够签署知情同意书,并且至少年满18岁。肿瘤组织(恶性原发性肿瘤或转移部位)、腹水和胸腔积液是在手术时从同意的患者那里获得的。这些标本立即被运送到实验室,并使用下面概述的方法处理类器官生成。
1. 培养基制备
- 完整的类器官培养基制备
- 根据先前发表的报告7 制备 R-spondin 1/Noggin 条件培养基。
注意:R-spondin-1 / Noggin条件培养基是市售重组蛋白的更实惠的替代品。HEK293T细胞通过慢病毒介导稳定分泌R-spondin-1和Noggin是圣路易斯华盛顿大学医学院的Ron Bose和纽约长老会/哥伦比亚大学欧文医学中心8,9,10的Anil Rustgi的慷慨礼物。商业条件培养基可用作替代品(见材料表)。
- 根据先前发表的报告7 制备 R-spondin 1/Noggin 条件培养基。
- 要制备完整的类器官培养基,请混合 10% R-spondin 1/Noggin 条件培养基、50 ng/mL EGF、10 ng/mL FGF-10、10 ng/mL FGF2、1x B27、10 mmol/L 烟酰胺、1.25 mmol/L N-乙酰半胱氨酸、1 μmol/L 前列腺素 E2、10 μmol/L SB202190、500 nmol/L A83-01 和 10 μM ROCK 抑制剂(参见材料表)。
注意:培养基可在4°C下储存长达3个月。这种媒介改编自Hill等人11。培养基的浓度和成分相同,但添加了ROCK抑制剂。 - 通过将 500 mL DMEM/F12 的高级配方与 1% 青霉素-链霉素、1x 二肽、L-丙氨酰-L-谷氨酰胺和 1x HEPES (10 mM) 混合制备类器官基础培养基(参见 材料表)。
2. 从腹水和胸腔积液中采集类器官
注意:腹水和胸腔积液必须尽快处理,以获得类器官的最佳产量。将先前的BME,DNase I和DNase I反应缓冲液(参见 材料表)放在冰上解冻,直到内容物液化。
- 在标准护理手术或程序时从同意的患者那里获取腹水和胸腔积液,并在室温下用旅行容器运送到实验室。
注意:所有腹水或胸腔积液处理应在无菌环境中进行。 - 将 50 mL 腹水或胸腔积液转移到 50 mL 锥形管中(管数取决于获得的腹水体积)。在4°C下以1,650× g 离心5分钟。 离心后,使用玻璃巴斯德移液管小心吸出上清液。
- 继续向先前离心的沉淀中加入50mL腹水或胸腔积液,并在4°C下再次以1,650× g 离心5分钟。 使用玻璃巴斯德移液管小心地吸出上清液。重复此步骤,直到处理完所有腹水或胸腔积液。
- 通过混合 1,000 μL 无核酸酶水、100 μL DNase I 反应缓冲液和 10 μL DNase I 制备 100 μg/mL DNase I 溶液。
注意:无论某些患者样品中是否存在细胞聚集体,所应用的DNase I处理都足以使单细胞悬液12。 - 将每个细胞沉淀重悬于 1 mL 的 100 μg/mL DNase I 溶液中。轻轻滴加DNase I溶液,并使试管在室温下孵育15分钟。
注意:加入至少 1 mL 的 DNase I 溶液。如果 1 mL 不足以干扰沉淀,请再添加 1 mL。 - 孵育后,向细胞中加入 25 mL 类器官基培养基(步骤 1.3),轻轻倒置以混合。然后,在4°C下以1,650× g 离心5分钟。 离心后,使用玻璃巴斯德移液管小心地吸出上清液。
- 将新形成的细胞沉淀重悬于预热的5 mL 1x红细胞(RBC)裂解缓冲液中(参见 材料表)。将涡旋设置为458 x g ,并涡旋每个锥形管中的溶液。溶液均匀后,使用血清移液管将所有锥形管的内容物合并到单个 50 mL 锥形管中。
- 将含有涡旋溶液的锥形管在室温下孵育5分钟。孵育完成后,在4°C下以1,650× g 离心5分钟。
注意:检查颗粒。粉红色/红色沉淀表明存在红细胞,这需要重复红细胞裂解缓冲液步骤,直到沉淀不再红色。 - 离心后,使用玻璃巴斯德移液管小心地吸出上清液。然后,用10mL PBS洗涤沉淀,以458×g涡旋溶液,并在4°C下以1,650×g离心5分钟。
- 如果形成大细胞沉淀,请使用玻璃巴斯德移液管吸出PBS,并在沉淀顶部加入1mL类器官基培养基(步骤1.3)。以 458 x g 涡旋溶液,并将 300-400 μL 转移到微量离心管中。在4°C下以1,650× g 离心微量离心管5分钟。
注意:未放置在微量离心管中的细胞沉淀部分可以冷冻以备将来使用(500 μL 细胞到 1 mL 10% DMSO 中的 FBS 中)。冷冻细胞沉淀可以在-80°C下储存数周,如果放置在液氮13中,则可以储存数年。 - 使用玻璃巴斯德移液管小心地吸出类器官基础培养基(步骤1.3),并使用冷吸头重悬于BME(见 材料表)。
注意:BME的量取决于颗粒的大小。建议使用25%类器官碱基(步骤1.3),重悬细胞至75%BME。 - 将 40 μL 等分试样重悬的细胞溶液接种到 6 孔板上。每孔最多铺五等分试样(图1)。
- 立即将板置于37°C培养箱中20分钟,以使BME凝固。孵育后,向每个孔中轻轻加入 2 mL 完全类器官培养基(步骤 1.2)。

图 1:患者来源的卵巢癌类器官的铺板。 类器官镀层的代表性图像。类器官混合物的等分试样被仔细电镀,确保不会形成气泡。 请点击此处查看此图的大图。
3. 从组织中收获类器官
注意:必须尽快处理组织,以获得类器官的最佳产量。
- 在含有PBS的旅行容器中收集肿瘤并将其运输到冰上。
- 将样品放在10厘米的组织培养皿上(图2)。使用一次性手术刀,将纸巾切碎。接下来,使用一次性注射器的钝端压碎组织,直到产生均匀的混合物。
- 使用镊子将均匀的组织混合物放入解离管中。对于每 1-2 mL 匀浆组织,在类器官基质培养基(步骤 1.3)和 1 mL DNase I 溶液中加入 7-8 mL 的 1 mg/mL II 型胶原酶溶液(参见 材料表)。以458 x g 涡旋溶液。
注意:组织的数量将决定胶原酶溶液的量和所需的管数。 - 使用解离机(见 材料表)在胶原酶溶液中液化组织。运行程序37C_h_TDK3(1小时),直到它是单细胞悬液。
注意:如果得到的混合物不均匀(即,如果混合物中仍然存在组织碎片),则需要重新运行程序。如果组织被消化但溶液是粘稠的,则使用类器官碱基稀释(步骤1.3)。 - 将匀浆混合物转移到新的 50 mL 锥形管中,并加入 20-40 mL 类器官基培养基(步骤 1.3)。然后,通过 100 μm 细胞过滤器将溶液过滤到新标记的 50 mL 锥形管中。
- 将过滤后的混合物在4°C下以1,650× g 离心5分钟。 然后,使用玻璃巴斯德移液管小心地吸出上清液。
- 通过混合 1,000 μL 无核酸酶水、100 μL DNase I 反应缓冲液和 10 μL DNase I 制备 100 μg/mL DNase I 溶液。
注意:无论某些患者样品中是否存在细胞聚集体,所应用的DNase I处理都足以使单细胞悬液12。 - 将细胞重悬于 1 mL 的 100 ug/mL DNase I 溶液中。轻轻滴加DNase I溶液,并使试管在室温下孵育15分钟。
- 孵育后,向细胞中加入 25 mL 类器官基培养基(步骤 1.3),轻轻倒置以混合。然后,在4°C下以1,650× g 离心5分钟。 离心后,使用玻璃巴斯德移液管小心地吸出上清液。
- 将新形成的细胞沉淀重悬于5 mL预热的1x RBC裂解缓冲液中。以458 x g 涡旋每个锥形管中的溶液。
- 孵育含有重悬于红细胞裂解缓冲液中的细胞沉淀的锥形管5分钟。孵育完成后,在4°C下以1,650× g 离心5分钟。
注意:检查颗粒。粉红色/红色沉淀表示存在红细胞,这需要重复红细胞裂解缓冲液步骤,直到沉淀呈白色。 - 离心后,使用玻璃巴斯德移液管小心地吸出上清液。然后,用10mL PBS洗涤沉淀,以458×g涡旋溶液,并在4°C下以1,650×g离心5分钟。
- 如果形成大细胞沉淀,请使用玻璃巴斯德移液管吸出PBS,并在沉淀顶部加入1mL类器官基培养基(步骤1.3)。以 458 x g 涡旋溶液,并将 300-400 μL 转移到微量离心管中。在4°C下以1,650× g 离心5分钟。
注意:未放置在微量离心管中的细胞沉淀部分可以冷冻以备将来使用(500μL细胞至1mL的10%DMSO在FBS中)(步骤5.1)。冷冻细胞沉淀可以在-80°C下储存数周,如果放置在液氮13中,则可以储存数年。 - 使用玻璃巴斯德移液管小心地吸出类器官基础培养基,并使用冷吸头重悬于BME中。
注意:BME的量取决于颗粒的大小。建议将 25% 类器官碱基(步骤 1.3)与重悬细胞添加到 75% BME。 - 将重悬的细胞溶液以 40 μL 等分试样接种到 6 孔板上。每孔最多铺五等分试样。
- 立即将孔板放入培养箱中20分钟。孵育后,向每个孔中轻轻加入 2 mL 完全类器官培养基(步骤 1.2)。

图2:解剖前的肿瘤组织。 为类器官生成而获得的肿瘤组织的代表性图像。 请点击此处查看此图的大图。
4. 类器官的传代
注意:如果样品汇合,则每个类器官孔可以每周传代到两个新孔中。
- 使用 1 mL 移液器,向每个孔中加入 1 mL 类器官基础培养基(步骤 1.3),然后将培养基直接上下移液到类器官标签上以将其解离。将所有含有重悬沉淀的培养基收集在 15 mL 锥形管中。
- 将含有混合物的15mL锥形管在4°C下以1,650× g 离心5分钟。 然后,使用玻璃巴斯德移液管小心地吸出上清液。
- 向细胞沉淀中加入 1 mL 无动物源性重组酶(参见 材料表),以 458 x g 涡旋溶液,然后转移到 1.5 mL 微量离心管中。让管在37°C水浴中孵育15分钟。
- 孵育后,在4°C下以1,650× g 离心5分钟。 然后,使用玻璃巴斯德移液管小心地吸出上清液。
- 将颗粒重悬于BME中。
注意:BME的量取决于颗粒的大小。建议将 25% 类器官碱基(步骤 1.3)与重悬细胞添加到 75% BME。 - 将重悬的细胞溶液以 40 μL 等分试样接种到 6 孔板中。每孔最多铺五等分试样。一旦所有等分试样都铺好,立即将孔板放入培养箱中20分钟。孵育后,向每个孔中轻轻加入 2 mL 完全类器官培养基(步骤 1.2)。
5. 类器官的冷冻和解冻
- 类器官的冷冻
- 从步骤 4.1-4.4 开始。
- 将细胞沉淀重悬于0.5-1 mL的回收细胞培养冷冻培养基中(参见 材料表),并将1 mL转移到每个冷冻管中。
- 然后,将冷冻管放入-80°C的异丙醇填充容器中长达2周,然后将它们转移到液氮罐中长期储存13。
- 类器官解冻
- 从液氮罐中取出样品,并在37°C水浴中解冻。
- 解冻后,转移到15mL锥形管中,并在4°C下以1,650× g 离心5分钟。 离心后,使用玻璃巴斯德移液管小心地吸出上清液。
- 将颗粒重悬于BME中。
注意:BME的量取决于颗粒的大小。建议将 25% 类器官碱基(步骤 1.3)与重悬细胞添加到 75% BME。 - 将重悬的细胞溶液以 40 μL 等分试样接种到 6 孔板上。每孔最多放置五个等分试样。
- 立即将板放入培养箱中20分钟。孵育后,向孔中轻轻加入 2 mL 完全类器官培养基(步骤 1.2)。
6. 嵌入并生成福尔马林固定石蜡包埋 (FFPE) 载玻片以评估类器官组成
- 在培养类器官至少 10 天以确保足够的大小后,从孔中取出完整的类器官培养基,并加入 1 mL 的 2% 多聚甲醛固定剂 (PFA)。在室温下孵育5-10分钟。
- 孵育后,用 1 mL PBS 洗涤培养的类器官等分试样 3 次,每次 5 分钟。
- 从每个孔中取出PBS,并向每个孔中加入1mL温热的2%琼脂去离子H2O。添加琼脂时,使用刮刀从盘子中取出培养的类器官等分试样。
注意:重要的是在提起培养的类器官等分试样之前不要让琼脂变硬。- 让琼脂在室温下在孔中凝固。
- 使用小刮刀,从孔中释放固化的琼脂,并将其储存在盒中长达48小时(参见 材料表),在4°C的70%乙醇中直至处理14。
- 将样品嵌入石蜡15中,将载玻片切割至5μm的厚度,并使用标准方案15用苏木精和伊红(H&E,参见材料表)染色载玻片。
结果
为了产生PDO,将样品以机械和酶促方式消化成单细胞悬浮液。然后将细胞重悬于BME中,并补充专门设计的培养基(图3)。类器官通常在 10 天的时间范围内建立,之后它们在培养物中展示离散的类器官(图 4)。
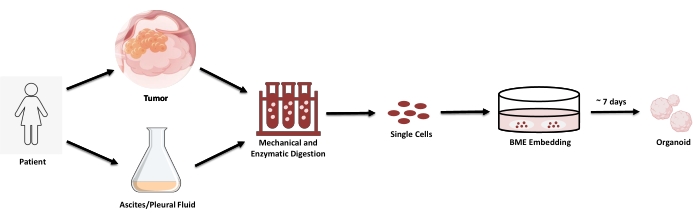
图3
讨论
卵巢癌由于其诊断时的晚期以及化疗耐药性的普遍发展而极其致命。通过利用癌细胞系和PDX模型,卵巢癌研究取得了许多进展;然而,显然需要一种更具代表性和负担得起的 体外 模型。PDO已被证明可以准确代表肿瘤异质性,肿瘤微环境以及其原发性肿瘤的基因组和转录组学特征,因此是各种研究方法的理想临床前模型,例如在药物治疗中实施类器官模型16。
披露声明
作者没有什么可透露的。
致谢
我们感谢Ron Bose,MD,PhD的指导,以及Barbara Blachut,MD的协助,以建立此协议。我们还要感谢华盛顿大学圣路易斯医学院妇产科和妇科肿瘤科、华盛顿大学院长学者计划和生殖科学家发展计划对该项目的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1% HEPES | Life Technologies | 15630080 | |
| 1% Penicillin-Streptomycin | Fisher Scientific | 30002CI | |
| 1.5 mL Eppendorf Tubes | Genesee Scientific | 14125 | |
| 10 cm Tissue Culture Dish | TPP | 93100 | |
| 10 mL Serological Pipet | |||
| 100 µm Cell Filter | MidSci | 100ICS | |
| 15 mL centrifuge tubes | Corning | 430052 | |
| 2 mL Cryovial | Simport Scientific | T301-2 | |
| 2% Paraformaldehyde Fixative | Sigma-Aldrich | ||
| 37 °C water bath | NEST | 602052 | |
| 3dGRO R-Spondin-1 Conditioned Media Supplement | Millipore Sigma | SCM104 | |
| 6 well plates | TPP | 92006 | |
| 70% Ethanol | Sigma-Aldrich | R31541GA | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Advanced DMEM/F12 | ThermoFisher | 12634028 | |
| Agar | Lamda Biotech | C121 | |
| B-27 | Life Technologies | 17504044 | |
| Centrifuge | |||
| Cultrex Type 2 | R&D Systems | 3533-010-02 | basement membrane extract |
| DNase I | New England Bio Labs | M0303S | |
| DNase I Reaction Buffer | New England Bio Labs | M0303S | |
| EGF | PeproTech | AF-100-15 | |
| FBS | Sigma-Aldrich | F2442 | |
| FGF-10 | PeproTech | 100-26 | |
| FGF2 | PeproTech | 100-18B | |
| gentleMACS C Tubes | Miltenyi BioTech | 130-096-334 | |
| gentleMACS Octo Dissociator with Heaters | Miltenyi BioTech | 130-096-427 | We use the manufacturers protocol. |
| GlutaMAX | Life Technologies | 35050061 | dipeptide, L-alanyl-L-glutamine |
| Hematoxylin and Eosin Staining Kit | Fisher Scientific | NC1470670 | |
| Histoplast Paraffin Wax | Fisher Scientific | 22900700 | |
| Microcentrifuge | |||
| Mr. Frosty Freezing Container | Fisher Scientific | 07202363S | |
| N-acetylcysteine | Sigma-Aldrich | A9165 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| p1000 Pipette with Tips | |||
| p200 Pipette with Tips | |||
| Pasteur Pipettes 9" | Fisher Scientific | 1367820D | |
| PBS | Fisher Scientific | MT21031CM | |
| Pipet Controller | |||
| Prostaglandin E2 | R&D Systems | 2296 | |
| Puromycin | ThermoFisher | A1113802 | |
| Recombinant Murine Noggin | PeproTech | 250-38 | |
| Recovery Cell Culture Freezing Medium | Invitrogen | 12648010 | |
| Red Blood Cell Lysis Buffer | BioLegend | 420301 | |
| ROCK Inhibitor (Y-27632) | R&D Systems | 1254/1 | |
| SB202190 | Sigma-Aldrich | S7076 | |
| T75 Flask | MidSci | TP90076 | |
| Tissue Culture Hood | |||
| Tissue Embedding Cassette | |||
| TrypLE Express | Invitrogen | 12604013 | animal origin-free, recombinant enzyme |
| Type II Collagenase | Life Technologies | 17101015 | |
| Vortex |
参考文献
- Bray, F., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians. 68 (6), 394-424 (2018).
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Pauli, C., et al. Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discovery. 7 (5), 462-477 (2017).
- Fujii, E., Kato, A., Suzuki, M. Patient-derived xenograft (PDX) models: Characteristics and points to consider for the process of establishment. Journal of Toxicologic Pathology. 33 (3), 153-160 (2020).
- Yang, J., et al. Application of ovarian cancer organoids in precision medicine: Key challenges and current opportunities. Frontiers in Cell and Developmental Biology. 9, 701429 (2021).
- Yang, H., et al. Patient-derived organoids: A promising model for personalized cancer treatment. Gastroenterology Report. 6 (4), 243-245 (2018).
- Karakasheva, T. A., et al. Generation and characterization of patient-derived head and neck, oral, and esophageal cancer organoids. Current Protocols in Stem Cell Biology. 53 (1), 109 (2020).
- Madison, B. B., et al. Let-7 represses carcinogenesis and a stem cell phenotype in the intestine via regulation of Hmga2. PLoS Genetics. 11 (8), 1005408 (2015).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Murray, E., et al. HER2 and APC mutations promote altered crypt-villus morphology and marked hyperplasia in the intestinal epithelium. Cellular and Molecular Gastroenterology and Hepatology. 12 (3), 1105-1120 (2021).
- Hill, S. J., et al. Prediction of DNA repair inhibitor response in short-term patient-derived ovarian cancer organoids. Cancer Discovery. 8 (11), 1404-1421 (2018).
- Passarelli, M. C., et al. Leucyl-tRNA synthetase is a tumour suppressor in breast cancer and regulates codon-dependent translation dynamics. Nature Cell Biology. 24 (3), 307-315 (2022).
- Pleguezuelos-Manzano, C., et al. Establishment and culture of human intestinal organoids derived from adult stem cells. Current Protocols in Immunology. 130 (1), 106 (2020).
- Stumm, M. M., et al. Validation of a postfixation tissue storage and transport medium to preserve histopathology and molecular pathology analyses (total and phosphoactivated proteins, and FISH). American Journal of Clinical Pathology. 137 (3), 429-436 (2012).
- Feldman, A. T., Wolfe, D. Tissue processing and hematoxylin and eosin staining. Methods in Molecular Biology. 1180, 31-43 (2014).
- Ooft, S. N., et al. Patient-derived organoids can predict response to chemotherapy in metastatic colorectal cancer patients. Science Translational Medicine. 11 (513), (2019).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5 (7), 539-551 (2020).
- Nanki, Y., et al. Patient-derived ovarian cancer organoids capture the genomic profiles of primary tumours applicable for drug sensitivity and resistance testing. Scientific Reports. 10, 12581 (2020).
- Mead, B. E., et al. Screening for modulators of the cellular composition of gut epithelia via organoid models of intestinal stem cell differentiation. Nature Biomedical Engineering. 6 (4), 476-494 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。