Method Article
光诱导介电泳表征人间充质干细胞的电行为
摘要
在这里,我们将光诱导介电泳作为一种无标记方法,用于表征异质细胞系,特别是人间充质干细胞(hMSCs)。本文描述了一种协议,用于使用和优化具有光导层的微流体器件,以表征hMSC的电行为而不改变其天然状态。
摘要
人间充质干细胞(hMSCs)为进行疾病的机制研究或多种治疗应用提供了患者来源的细胞来源。近年来,了解hMSC特性,例如它们在不同成熟阶段的电行为变得越来越重要。介电泳(DEP)是一种可以在非均匀电场中操纵细胞的方法,通过该方法可以获得有关细胞电特性的信息,例如细胞膜电容和介电常数。DEP的传统模式使用金属电极(例如三维电极)来表征细胞对DEP的反应。在本文中,我们提出了一种由光导层构建的微流体装置,该光导层能够通过光投影操纵细胞,这些光投影充当具有易于适应几何形状的 原位 虚拟电极。这里提出了一个方案来证明这种现象,称为光诱导DEP(LiDEP),用于表征hMSC。我们表明,LiDEP诱导的细胞响应(以细胞速度测量)可以通过改变输入电压,光投影的波长范围和光源强度等参数来优化。在未来,我们设想该平台可以为无标记技术铺平道路,并对hMSCs或其他干细胞系的异质群体进行实时表征。
引言
人间充质干细胞(hMSCs)因其免疫抑制特性1而得到认可,这导致它们被用于治疗多种疾病,如II型糖尿病2,移植物抗宿主病3和肝病4。HMSC是异质性的,包含分化为脂肪细胞,软骨细胞和成骨细胞的细胞亚群。HMSC来源于脂肪组织、脐带组织和骨髓,其分化潜力取决于起源组织和所使用的细胞培养过程5。例如,根据Sakaguchi等人的一项研究,来源于脂肪组织的hMSCs更有可能分化为脂肪细胞,而源自骨髓的hMSCs更有可能分化为骨细胞6。然而,hMSCs的组织起源对其分化潜力的影响仍然是一个需要进一步了解的现象。此外,hMSCs的不同分化潜力有助于其固有的异质性,并为将hMSCs应用于治疗带来了挑战。因此,异质干细胞系的表征和分选对于开发这些细胞的体外和临床应用至关重要。流式细胞术是检查细胞表型差异的金标准技术,它利用细胞表面抗原和荧光染料标记靶细胞,并根据光散射或细胞特异性荧光特性对其进行表征6,7,8。该方法的缺点包括细胞表面抗原生物标志物的可用性有限,设备和操作的高成本,以及细胞表面染色可能潜在地损坏细胞膜并影响治疗应用的事实9,10,11。因此,在不影响细胞膜天然状态的情况下探索细胞表征的新技术可能有利于干细胞治疗的临床性能。
介电泳(DEP)是一种不使用表面标记的细胞表征方法,是当前工作的重点。DEP是一种在微流体平台上实施的无标记或非染色方法,用于根据其电特性表征异质细胞群。DEP 使用交流 (AC) 电场代替荧光染色(即基于标记的方法)7。使用基于DEP的微流控装置进行细胞表征的其他优点包括使用小体积(微升),快速分析时间,最小的细胞样品制备要求,最小的样品污染风险,最小的废物产生和低成本12,13。DEP 的另一个好处是实时监控细胞14、15、16。对于DEP,悬浮细胞暴露于由电极产生的不均匀交流电场中,并且它们变得极化6。这种极化导致电池移动,并允许根据施加的交流电场的频率和电压进行电池操作。通过调整频率,通常在5 kHz至20 MHz之间,可以将细胞吸引到电极或从电极排斥,分别对应于正和负DEP行为6。
DEP 表征有多种模式,即传统、场流分馏和光诱导,按其电极配置和/或操作策略分类17。3DEP 分析仪是 DEP 的传统模式,它包含物理金属电极并监测蜂窝对交流电场的响应。该系统使用由具有多个三维圆形电极的微孔组成的芯片,并检测光强度的变化以表征电池DEP行为18,19,20,21。当细胞沿着微孔壁向圆形电极的边缘移动时,观察到正 DEP,导致微孔中心的光强度增加。当细胞聚集在微孔中心远离圆形电极时,观察到负 DEP,导致微孔中心的光强度降低。这两种现象如图1所示。传统的DEP方法能够表征异质细胞群的电特性18,20,21。例如,Mulhall等人证明了使用3DEP分析仪根据膜电容21的差异区分正常口腔角质形成细胞(HOK)和恶性口腔角质形成细胞(H357)细胞系的潜力。然而,传统DEP模式的一个限制是固定电极几何形状。由于hMSCs是异质的,因此能够在DEP评估期间轻松修改电极几何形状是有利的。例如,能够实时修改电极或电极阵列以进行单细胞捕获,可以根据速度和DEP行为对细胞进行表征。实时电极修饰在hMSCs的DEP评估中的应用允许在从样品组织中获取hMSCs后立即对其进行单细胞分析,以表征样品群体的异质性。
为了克服传统DEP模式(即固定物理电极)的局限性,并探索利用DEP现象实时修改电极配置的新机会,已经探索了光诱导DEP(LiDEP)。LiDEP是一种非传统的DEP模式,它使用光导微流体装置22,23通过光投影操纵细胞,局部电极产生不均匀的电场,类似于传统的DEP方法。这种方法还允许电极几何形状的灵活性以及在微流体装置内移动电极。这减轻了固定电极的局限性,并提供了获得有关细胞异质性的更多信息的机会。LiDEP已被用于检测和分析同质和异质细胞群中的不同细胞类型22,23,24。例如,Liao等人使用LiDEP将表达上皮细胞粘附模块(EpCAMneg)的循环肿瘤细胞(CTC)从红细胞中分离出来,以探索它们在癌症转移中的意义22。LiDEP的单细胞分析已成功用于通过胰腺致瘤性分层来表征和操纵癌细胞23以及分析转移前后样品中的CTCs24。
在这里,我们描述了如何利用LiDEP来操纵具有各种电极几何形状(圆形,菱形,星形和平行线)和系统设置(施加的电压,光强度和微流体器件材料)的hMSC,从而提供了一种表征具有虚拟电极的人源性干细胞行为的方法。
研究方案
1. LiDEP微流控器件制备
注意:制造过程包括组合三个分层组件:(i) 将非晶硅 (A:Si) 和钼沉积在氧化铟锡 (ITO) 玻璃基板上的光电导层;(ii) 从双面胶带上切出的微通道层;(iii)顶部ITO玻璃基板,在细胞悬浮液的入口和出口处钻孔。
- 光导氧化铟锡(ITO)的玻璃涂层
- 通过在表面以足以移动可见灰尘颗粒的流速流动氮气 (N2) 气体来清洁 ITO 涂层玻璃基板(15-20 Ω阻力)。完成此步骤后,用丙酮冲洗底物。
- 将ITO涂层的载玻片转移到异丙醇浴中以洗去丙酮残留物,用去离子水冲洗,然后再次流动N2 气体,直到基材完全干燥。
- 将带有ITO涂层的一面朝上的载玻片放入真空溅射系统中。
- 将 10 nm 厚的钼层溅射到 ITO 涂层玻璃基板(钼靶)上,沉积速率为 0.7 Å/s,沉积时间为 140 s。
- 在玻璃基板的一侧添加阴影掩模,使玻璃基板边缘露出 2 毫米,以便进行电气连接。使用电感耦合等离子体增强化学气相沉积(ICP-PECVD)沉积1μm的A:Si,如Medjdoub等人25中所述。
- 用N2 气体清洁载玻片以去除灰尘和其他杂质。对于沉积在阴影掩模下的任何 A:Si,将边缘浸入 25% w/v 氢氧化钾溶液中直至 2 mm 标记以蚀刻 A:Si。
- 激光芯片器件制造
- 要形成微通道,请获得双面胶带(52 mm x 25 mm),并在距离较短尺寸边缘5-6 mm处打孔(直径= 4 mm),并在胶带的较长边之间居中。使用手术刀在孔上切割两条直线(相距 3 毫米)。确保在整个微通道切割步骤中,双面胶带两面的保护片都打开。
- 在顶部ITO载玻片上钻两个直径为3毫米的孔。胶带可以对齐在ITO涂层玻璃的顶部,胶带的长边缘与玻璃的长边缘对齐。用可清洗的记号笔标记孔位置。确保钻孔与双面胶带上打孔的孔对齐。这两个孔将充当微流体装置的入口和出口孔。
- 取下双面胶带上保护膜的一面,将胶带上的孔与顶部ITO载玻片对齐,然后将它们压在一起。轻轻按压以去除气穴,尤其是微通道附近。气穴可能使介质或其他溶液渗入胶带下方,这可能会损坏微流体装置或导致霉菌。
- 从双面胶带上取下另一层保护膜,然后压在钼和 A:Si 涂层 ITO 玻璃面上。将与 2 mm 间隙侧相对的光导载玻片边缘与朝向顶部 ITO 载玻片中心的双面胶带边缘相匹配。顶部ITO载玻片和涂有光导材料涂层的ITO载玻片将有宿醉。
- 按压在平坦的表面上以确保良好的附着力。玻璃基板和双面胶带层的示意图如图 1A所示。剪掉侧面多余的胶带。
- 将铜带贴在A层和C层的边缘以连接函数发生器。为此,将胶带缠绕在ITO或光导材料的侧面,具体取决于它是A层还是C层,从双面胶带的边缘到玻璃基板的未涂层面约3厘米。
- 为确保成功制造器件,请使用万用表测试玻璃基板的涂层载玻片和附着在玻璃上的铜带之间的电阻读数。
- DEP 缓冲液制备
- 量出 4.25 g 蔗糖,并将其放入 50 mL 锥形管中。然后,测量出 0.15 g 葡萄糖,并将其放入相同的 50 mL 锥形管中。
- 用 25 mL 超纯水填充锥形管,盖上盖子并混合。一旦大约一半的蔗糖和葡萄糖溶解,用超纯水填充锥形管,直至 50 mL 线。剧烈混合,直到所有蔗糖和葡萄糖溶解。DEP 缓冲溶液含有 8.5% (w/v) 蔗糖和 0.3% (w/v) 葡萄糖。
- 获得20mL制备的蔗糖和葡萄糖溶液,并将其放入50mL锥形管中。然后,测量出 0.1 g 牛血清白蛋白 (BSA),并将其放入含有蔗糖和葡萄糖溶液的 50 mL 锥形管中。涡旋直至BSA溶解。最终的DEP缓冲溶液含有0.5%(w/v)BSA。
- 细胞制备
- 使用先前研究中描述的细胞培养方案获得至少 1 x 106 个细胞(hMSC 或 HEK 293)悬浮在 1 mL 生长培养基中26,27。将细胞悬液放入 10 mL 离心管中。
- 将HEK 293细胞以201 x g 离心5分钟,将hMSCs以290 x g 离心10分钟。离心后,吸出上清液,并将细胞重悬于含有0.5%BSA的1mL DEP缓冲溶液中。确保不要太快添加缓冲溶液,因为可能会形成气泡。
- 再重复离心过程两次,然后将细胞重悬于具有0.5%BSA的DEP缓冲液中以进行LiDEP表征。列出的细胞制备方案足以进行 10 次运行。例如,一次频率测试至少需要 15 次运行,因此需要制作浓度为 1 x 106 个细胞/mL 的 2 mL 细胞。
2. LiDEP表征
- 实验设置
- 组装以下设备用于量化细胞对LiDEP的反应的实验装置:笔记本电脑,投影仪,物镜,数码显微镜和函数发生器。使用笔记本电脑设计灯光投影(星形、菱形、三线和椭圆形),并将其连接到投影仪。
- 使用投影仪作为光源,将光投影显示在LiDEP芯片的光导表面(C层)上。设置它,使来自光源(投影仪)的光通过10倍物镜传播到LiDEP芯片的微通道区域。10倍物镜位于投影机镜头的顶部。 补充图1 显示了投影机与LiDEP系统的集成。
- 将LiDEP芯片连接到函数发生器以施加交流电场。通过使用数码显微镜进行成像和视频记录来观察经历LiDEP力的细胞。 图1B 示出了实验装置的示意图。对所有测试的细胞遵循标准细胞培养方案26,27 。
- 实验程序
- 用70%乙醇冲洗微通道,然后用0.5%BSA溶液冲洗。再次用0.5%BSA溶液冲洗微通道两次,以确保乙醇和先前的细胞完全洗掉。已经暴露于DEP场的细胞将产生与新鲜细胞不同的反应,并可能破坏数据收集。
- 用移液管取出0.5%BSA溶液,并将微流体装置安装到装置支架中。
- 将鳄鱼夹连接到设备上的每个铜带连接。将函数发生器设置为所需的电压(电压峰峰值,Vpp)和频率(Hz)。这里测试的频率范围为30 kHz至20 MHz。
- 将 70 μL 细胞悬液(细胞 + 含有 0.5% BSA 的 DEP 缓冲液)添加到设备微通道中。由于微通道很薄(~0.05 mm),可能会从入口和出口孔溢出。为了帮助减少溢出量,请使用较小的移液器吸头,并将吸头在孔中稍微倾斜到微通道。任何访问溶液(0.5%BSA或溶液中的细胞)都可以用一次性纸巾擦去并丢弃到生物危害废物中。
- 将所需的虚拟电极几何形状(此处为圆形、菱形、星形和/或平行线)投影到 LiDEP 芯片上。
- 在数码显微镜软件中,将视频长度设置为3分钟。将实验室计时器设置为 2 分 30 秒。一旦细胞在LiDEP芯片的微通道中静止,在数码显微镜软件中按 开始 开始视频录制过程。
- 等待10秒,然后按函数发生器通道输出的 ON 按钮施加交流电场,然后按 启动 定时器。通过数码显微镜监测细胞DEP行为,并防止在设置周围晃动或移动。
- 定时器关闭后,按下函数发生器通道输出的 ON 按钮。这将关闭函数发生器通道输出,并且交流电场不再通过电极提供。在3分钟后停止视频录制,并保存到数码显微镜以备将来分析。
- 通过将含有 0.5% BSA 的 60 μL DEP 缓冲液缓慢推入微通道并同时收集在出口处,将细胞移出 LiDEP 芯片的出口端。继续,直到微通道中几乎没有细胞。
- 重复步骤2.2.3-2.2.9,直到测试完所有频率。
结果
使用上述程序完成电压和电极颜色测试,步骤2.2.3和步骤2.2.10略有变化。对于电压测试,电极颜色和频率保持不变,并施加5 V pp,10 V pp和20 Vpp。对于电极颜色测试,施加的电压和频率保持在30 kHz和20 Vpp的恒定,并检查蓝色,红色,白色和黄色(分别由十六进制颜色代码#4472C4,#FF0000,#FFFFFF和#FFFF00参考)投影电极。通过用台盼蓝染色细胞并使用血细胞计数器计数活细胞和死细胞的数量来检查细胞活力。
通过LiDEP设置,我们能够操纵hMSCs并生成DEP响应曲线以响应输入频率,这是表征细胞电行为的一种方法。通过操纵施加的电压和投影的电极颜色(即使用图形编辑器软件创建的具有不同颜色的形状)等参数,进行了一系列实验,以观察电池行为与虚拟电极产生的非均匀交流电场的一致行为。将使用LiDEP(非传统DEP)收集的细胞反应数据与3DEP分析仪(传统DEP)的结果进行比较。
第一个优化测试侧重于LiDEP芯片中hMSCs(即向虚拟电极移动的细胞)的正DEP响应。没有表现出正DEP响应的细胞要么通过远离虚拟电极而表现出负DEP响应,要么静止和旋转,要么对电场无响应。通过在 ImageJ 中跟踪细胞在 2 分 30 秒期间的速度 (μm/s) 来量化细胞的反应。虚拟电极使用黄色椭圆投影,并在30 kHz的设定频率下检查施加的5 V pp,10 V pp和20 Vpp电压。我们专注于在交流电场开启时距离虚拟电极50μm以内的电池,以确保一致性并最大限度地减少异常值。20 V pp导致HEK 293电池的最快细胞运动,平均速度为0.035μm/s,其次是10 V pp时的0.032μm/s和5 Vpp时的0.020μm/s,这意味着这些细胞代表了相对均匀的对照。在hMSCs上也观察到了类似的趋势,其在20 V pp时的平均速度为0.051 μm/s,在10 V pp时为0.036 μm/s,在5 Vpp时为0.025 μm/s,如图2A所示(此处,*表示p < 0.05)。在20 Vpp下,观察到hMSCs同时经历正负DEP。hMSCs在经历DEP力后的活力结果表明,较高的电压通常会导致较低的细胞活力,66%的细胞在5 V pp下存活,58%的细胞在10 V pp下存活,57%的细胞在20 V pp下存活, 如图 2B 所示(此处 ** 表示 p < 0.01)。
由于LiDEP是基于光学的系统,因此光强度和电极颜色是可以轻松调整以控制LiDEP芯片性能的参数。在这里,评估了基于投影形状生成的不同电极颜色(白色,黄色,红色和蓝色),以确定对细胞DEP响应的影响。HEK 293 细胞和 hMSC 在 20 Vpp 和 30 kHz 下进行评估。选择了白色、黄色、红色和蓝色的电极,但通过LiDEP芯片的照明受到具有红橙色的光导层的影响。因此,投影的白色电极显示为黄色,内部为白色,红色电极显示为橙色,具有红色轮廓,蓝色电极呈浅绿色(图3A-D)。这四种颜色的功率输出如下:白色、黄色、红色和蓝色分别为 77.7 μW ± 0.7 μW、92.7 μW ± 1.3 μW、21.9 μW ± 0.2 μW 和 56.7 ±μW 和 0.9 μW。这强烈表明黄色和白色具有最强的DEP场,而蓝色和红色较弱,如图3E所示(此处,***表示HEK 293细胞的p <0.001,**表示hMSC的p <0.01)。在施加DEP力期间,还观察到黄色和白色虚拟电极边缘上的电池的静止旋转。对于所有电极颜色变化,同时发生负和正DEP响应,与电压测试在20 Vpp下显示的情况相关。此外,虽然细胞的速度根据电极颜色而变化,但50μm边界内的几乎所有细胞都对LiDEP有反应。hMSCs的大小测量为19.2μm±5.8μm。
为了评估LiDEP与传统电极的DEP相比的能力,我们评估了使用LiDEP的细胞的DEP行为与3DEP分析仪分析的细胞之间的DEP行为之间的差异。hMSCs的DEP响应是在低电导率DEP缓冲溶液中测量的,其中含有0.5%BSA(~100μS/cm)。为了模拟3DEP分析仪,将单个椭圆形黄色虚拟电极投射到10 Vpp。hMSCs的DEP行为表征范围为30 kHz至20 MHz。在低于25 kHz的频率下,我们观察到电解,这导致微流体装置内金属层表面产生气泡。对于LiDEP,在较低频率下,hMSCs经历了正DEP力,如图 4A所示,表示为吸引到虚拟电极的细胞的百分比。细胞开始时具有强大的正DEP力,随着频率的增加而减弱。细胞在30 kHz至97 kHz范围内经历了最强的正DEP力。在这些频率下施加交流电场后,一些电池变得无响应,而其他电池则表现出负的DEP行为。这种趋势偏离了使用 3DEP 分析仪量化的观察到的响应;如图 4B所示,电池在正DEP中从37 kHz增加到255 kHz,在正DEP中从1,772 kHz降低到20 MHz。
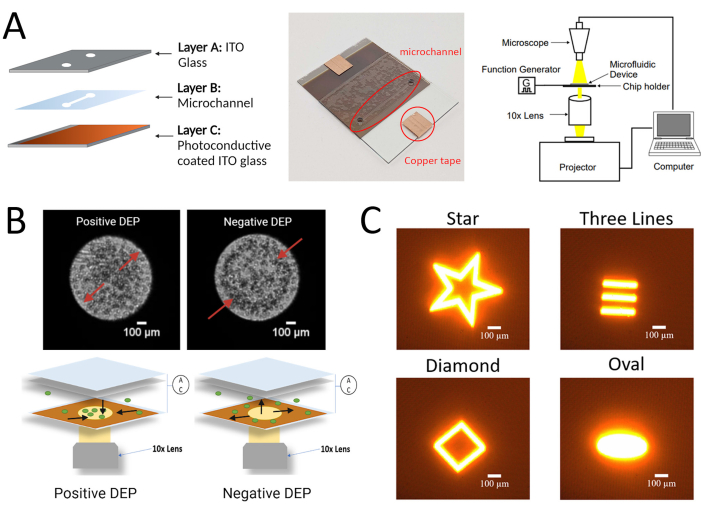
图 1:此处描述的 hMSC LiDEP 方案的实验设置。 (A)带有光导层的LiDEP芯片的示意图和真实图像以及实验设置。(B) 3DEP 分析仪中细胞正负 DEP 响应的代表性图像(使用常规 DEP 电极,顶部)和使用 LiDEP 的细胞正负 DEP 响应的示意图(使用光投影作为虚拟电极,底部)。(C)可以作为虚拟电极投影到设备上的不同形状的示例。用 BioRender.com 创建的图。 请点击此处查看此图的大图。
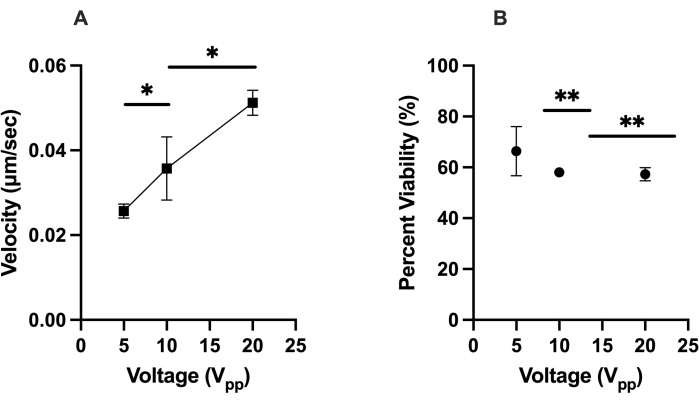
图2:hMSCs的DEP响应(速度)及其在给定条件下的活力的表征。 (A)hMSCs对5 V pp,10 Vpp和20V pp的正DEP响应的测量速度。hMSCs在20 V pp时以0.051 μm/s移动,在10 V pp时以0.036 μm/s移动,在5 Vpp时以0.025 μm/s移动。(B)hMSCs在经历虚拟电极产生的正DEP力后的生存能力。20 V pp、10 Vpp 和 5 Vpp 的生存能力分别为 57%、58% 和 66%。误差线表示标准偏差 (SD)。使用 t 检验(*p < 0.05 和 **p < 0.01)对合并数据集完成统计分析。请点击此处查看此图的大图。
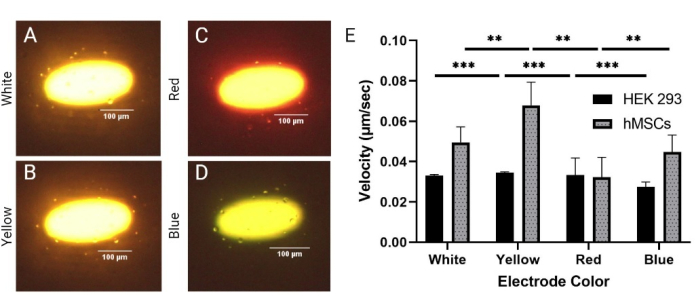
图 3:比较均质 (HEK 293) 和异质 (hMSC) 细胞系之间的 DEP 响应。hMSCs细胞在20 Vpp和30 kHz下对(A)白色,(B)黄色,(C)红色和(D)蓝色电极的正DEP响应。(E)HEK 293细胞和hMSCs对不同颜色电极的速度响应。HEK 293电池表现出最高的速度,黄色和红色电极分别为0.035 μm/s和0.033 μm/s。HEK 293电池表现出最低的速度,蓝色电极为0.027 μm/s。hMSCs表现出最高的速度,黄色和白色电极分别为0.068 μm/s和0.049 μm/s。hMSCs的红色电极速度最低,为0.039 μm/s。误差线表示 SD。 使用 t 检验(*p < 0.05、**p < 0.01 和 ***p < 0.001)对合并数据集完成的统计分析。请点击此处查看此图的大图。
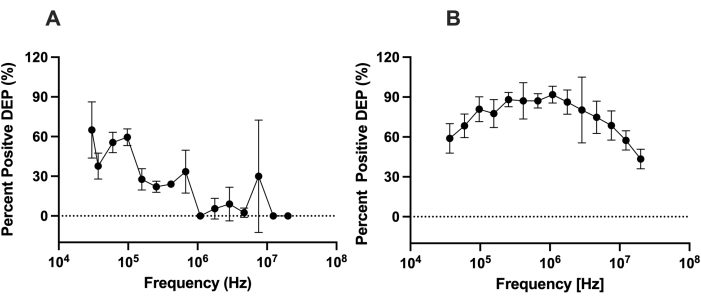
图4:比较使用LiDEP和3DEP的hMSCs的DEP响应。 用(A)LiDEP和(B)3DEP分析仪在10Vpp下测量的hMSCs的DEP响应。使用LiDEP,hMSC的正DEP响应从30 kHz衰减到20 MHz。从 3DEP 分析仪中,电池的正 DEP 从 37 kHz 增加到 255 kHz,正 DEP 从 1,772 kHz 增加到 20 MHz。 误差线表示标清。 请点击此处查看此图的大图。
补充图1:用于本协议实验的LiDEP设置的代表性图像。 LiDEP 系统的放大图显示了投影机的集成。光从光源(投影仪)通过10倍物镜传播到LiDEP芯片的微通道上。10倍物镜位于投影机镜头顶部。每个组件在图片中都有编号,并列在侧面。 请点击此处下载此文件。
补充视频1:hMSCs响应白色,黄色,红色和蓝色虚拟电极的代表性视频。 细胞被可视化为经历正DEP(向虚拟电极移动),经历负DEP(远离虚拟电极),静止和旋转,或对电场无响应。hMSC在37 kHz和20 Vpp下进行了测试,视频速度提高了20倍。 请点击此处下载此文件。
讨论
检查hMSCs的异质性对于它们在治疗学中的进步非常重要。这项工作为使用LiDEP作为评估hMSCs的分析工具提供了第一步。我们通过量化速度来检查LiDEP中电池正DEP响应的电压依赖性。预计较高的电压应该会产生更强的正DEP力,我们在测量的速度中观察到了这种模式。10 Vpp和20 Vpp电压足以使用LiDEP操作hMSC。较低的电压(即5 Vpp)导致较慢的电池响应;虽然对hMSCs不是最佳的,但这可能对其他细胞类型有利。hMSCs的活力随电压相关地降低了约9%。这与以前的文献6,12,28,29略有不同,其中使用传统的DEP和LiDEP检查生物细胞并没有降低细胞活力。然而,每项研究的实验目标各不相同。Glasser和Fuhr监测了细胞培养基28中金属电极上贴壁L929小鼠成纤维细胞的生长。相反,Lu等人检查了暴露于不同时间段的交流电场的神经干细胞的活力12。Adams等人用金属电极12表征了hMSCs的介电特性,Li等人用LiDEP29操纵白血病细胞。这些研究与我们的研究之间的区别在于BSA的使用,这可能是我们观察到的活力下降的原因。然而,较低的总生存能力也可能是由于此处建立的方案中使用的暴露时间(2分30秒)。选择这个时间是为了在暴露于不均匀的交流电场期间提供足够的时间来可视化细胞操作。
通过电极颜色测试细胞表征方法,以确定我们按照协议中所述构建的LiDEP系统的功能和局限性。在此特定协议中,可以根据通过图形编辑器文件投影的形状的颜色来控制电极颜色。我们使用了四种颜色:白色、黄色、红色和蓝色。根据每种颜色的功率输出读数,测量投影的黄色(#FFFF00)和白色(#FFFFFF)电极具有更高的强度,这是为什么这些颜色更适合在随后的实验中使用的基础。此外,由于已建立光导材料30,31的光强度依赖性,结果表明LiDEP器件的性能依赖于光导A:Si,并且可以通过选择投影电极颜色来调整。使用LiDEP也观察到hMSCs的正负DEP反应的组合,这与传统DEP方法中的现象相似。对于每种电极颜色,hMSCs经历了负DEP力,正DEP力和细胞旋转,表明细胞样品在单个频率下是异质的(补充视频1)。这与Adams等人6的发现一致,即hMSCs在单个频率下表现出负性和阳性DEP行为。这些条件(电极颜色、电极形状和光导材料)可以为检测hMSC样品中的异质性水平提供额外的参数。
最后,将LiDEP评估的结果与3DEP分析仪的结果进行比较,作为hMSC DEP行为的基准。观察到hMSCs的正DEP响应的频率范围存在差异,但通过LiDEP和3DEP分析仪 收集 的数据总体趋势相似(即,正DEP响应随着频率的增加而降低)。当交流电场提供给LiDEP芯片并将光投射到其上时,光投影内区域的电导下降,从而产生不均匀的电场。因此,光源的特性(即强度和波长)会影响LiDEP芯片内电池的预期响应,从电压和电极颜色变化测试结果中可以看出。其他可以修改的参数是光导层的材料和DEP缓冲溶液的电导率。因此,用于评估细胞DEP行为的条件必须基于LiDEP系统的设置进行评估。相反,对于3DEP分析仪或其他使用金属电极施加DEP力的方法,电极特性是恒定的,不能立即改变以适应所研究细胞的需要。DEP阳性行为的这种变化可能有利于未来研究hMSC样品中不同细胞类型的表征,单细胞分析或细胞分选。此外,随着电池远离虚拟电极,交流电场变弱。但是,使用3DEP分析仪或其他使用金属电极的传统DEP模式,可以应用更大的电场区域,从而可以操纵更多的电池。因此,每个LiDEP实验中经历LiDEP芯片微通道内交流电场影响的细胞较少。设备性能随时间的变化(即 2 小时或 3 小时)可能导致进一步的差异,这仍在调查中。水、乙醇和DEP缓冲溶液的恒定流动可能会破坏微通道层(即光导材料)的表面,需要考虑。对于一个LiDEP芯片的扩展使用,还需要考虑电池表征的器件性能。实时修改实验参数只需几秒钟到几分钟。使用图形编辑器软件中的设置立即调整电极颜色和几何形状。
总之,本文展示了LiDEP操纵和表征具有异质细胞群(如hMSCs)的细胞系的能力。使用这种设置和所描述的协议,我们能够在20 Vpp 和投影虚拟黄色电极的条件下成功表征hMSC。未来的研究应侧重于调整hMSCs的暴露时间,以适应通过LiDEP 产生的 交流电场,增加虚拟电极的光强度,并评估hMSC(或其他干细胞群)的不同来源,以开发异质干细胞群电信号的LiDEP目录。
披露声明
作者报告没有利益冲突。
致谢
这项工作得到了国家科学基金会通过 CBET获得 的CAREER奖(2048221)的支持。我们要感谢UCI综合纳米系统研究设施(INRF)的Mo Kebaili。此外,我们要感谢Devin Keck博士协助LiDEP系统的开发。
材料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300054 | |
| 10x objective | AmScope | --- | |
| Amorphous silicon (A:Si) | Millipore Sigma | S5130 | |
| Antibiotic-Antimycotic (100X) | Gibco | 15240-062 | |
| Bovine Serum Albumin (BSA) | Fisher | BP9706-100 | |
| Copper Tape | Zehhe | BF4964 | |
| Dextrose (glucose) | Fisher | D16-1 | |
| Digital microscope | Keyence | VHX-7000 | |
| Double Sided Tape | Insulectro | FLX000484 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Gibco | 14190-144 | |
| Fetel Bovine Serum (FBS) | Corning | 35-011-CV | |
| Function Generator | Tektronix | AFG 31102 | |
| Graphic editor software | Microsoft Office Powerpoint | --- | |
| Indium tin oxidec coated glass slides | MSE Supplied | GL0333 | |
| L-Alanyl-L-Glutamine | ATCC | PCS-999-034 | |
| Laptop | Dell | Inspiron 14, 2-in-1 | |
| Mesenchymal Stem Cell Basal Medium | ATCC | PCS-500-030 | |
| Mesenchymal Stem Cell Growth Kit for Umbilical and Adipose Cord-Derived MSCs | ATCC | PCS-500-040 | |
| Minimum Essential Mediaum Alpha (MEM a, 1X) | Giblo | A10490-01 | |
| Molybdenum, 99.95% | Kurt J. Lesker | EJTMOXX352A4 | Sputtering target |
| Phenol Red | Sigma | P5530 | |
| Power Meter | Thor Labs | S130VC/PM400 | |
| Projector | Vecupoi | --- | |
| Roswell Park Memorial Institute (RPMI) 1640 Media | Gibco | 11875-093 | This media has L-Glutamine and Phenol Red. |
| Sucrose | Fisher | BP220-1 | |
| Trypan Blue Stain | Gibco | 15250-061 | 0.40% |
| Trypsin Neutralizer | Gibco | R002100 | |
| Vacuum Sputtering System | Denton | DV-502M |
参考文献
- Mahla, S. R. Stem cells applications in regenerative medicine and disease therapeutics. International Journal of Cell Biology. 2016, (2016).
- Bhansali, A. Efficacy of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cells and Development. 18 (10), 1407-1416 (2009).
- Bouchlaka, M. N. Human mesenchymal stem cell-educated macrophages are a distinct high IL-6-producing subset that confer protection in graft-versus-host-disease and radiation injury models. Biology of Blood and Marrow Transplantation. 23 (6), 897-905 (2017).
- Alfaifi, M., Eom, Y. W., Newsome, P. N., Baik, S. K. Mesenchymal stromal cell therapy for liver diseases. Journal of Hepatology. 68 (6), 1272-1285 (2018).
- Oswald, J. Mesenchymal stem cells can be differentiated into endothelial cells in vitro. Stem Cells. 22 (3), 377-384 (2004).
- Sakaguchi, Y., Sekiya, I., Yagishita, K., Muneta, T. Comparison of human stem cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis and rheumatism. 52 (8), 2521-2529 (2005).
- Poirier, J. T., Uthamanthil, R., Tinkey, P. Chapter 5 - Genetic profiling of tumors in PDX models. In Patient Derived Tumor Xenograft Models: Promise, Potential and Practice. , 149-159 (2017).
- . Sino Biological. Fluorescence-activated cell sorting (FACS) Available from: https://www.sinobiological.com/category/fcm-facs-facs (2023)
- González-González, M., Vázquez-Villegas, P., García-Salinas, C., Rito-Palomares, M. Current strategies and challenges for the purification of Stem Cells. Journal of Chemical Technology and Biotechnology. 87 (1), 2-10 (2011).
- Flanagan, A. L. Unique dielectric properties distinguish stem cells and their differentiated progeny. Stem Cells. 23 (3), 656-665 (2007).
- Vykoukal, J., Vykoukal, D. M., Freyberg, S., Alt, E. U., Gascoyne, P. R. C. Enrichment of putative stem cells from adipose tissue using dielectrophoretic field-flow fractionation. Lab on a Chip. 8 (8), 1386-1393 (2008).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cells and the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), (2014).
- Wu, H. W., Lin, C. C., Lee, G. B. Stem cells in microfluidics. Biomicrofluidics. 5 (1), (2011).
- Adams, T. N. G. Label-free enrichment of fate-biased human neural stem and progenitor cells. Biosensors and Bioelectronics. 152, 111982 (2020).
- Zhao, K., Larasati, ., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Song, H. Continuous-flow sorting o stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15, 1320-1328 (2015).
- Khoshmanesh, K., Nahavandi, S., Baratchi, S., Mitchell, A., Kalantar-Zadeh, K. Dielectrophoretic platforms for bio-microfluidic systems. Biosensors and Bioelectronics. 26 (5), 1800-1814 (2010).
- Hoettges, K. F. Ten-second electrophysiology: Evaluation of the 3DEP platform for high-speed, high-accuracy cell analysis. Scientific Reports. 9, 19153 (2019).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. IEE Proceedings - Nanobiotechnology. 152 (4), 150-154 (2005).
- Hoettges, K. F. Dielectrophoresis-activated multiwell plate for label-free high-throughput drug assessment. Analytical Chemistry. 80 (9), 2063-2068 (2008).
- Mulhall, H. J. Cancer, pre-cancer and normal oral cells distinguished by dielectrophoresis. Analytical and Bioanalytical Chemistry. 401 (8), 2455-2463 (2011).
- Liao, C. -. J. An optically induced dielectrophoresis (ODEP)-based microfluidic system for the isolation of high-purity CD45neg/EPCAMNEG cells from the blood samples of cancer patients-Demonstration and initial exploration of the clinical significance of these cells. Micromachines. 9 (11), 563 (2018).
- McGrath, J. S. Electrophysiology-based stratification of pancreatic tumorigenicity by label-free single-cell impedance cytometry. Analytica Chimica Acta. 1101, 90-98 (2019).
- Chiu, T. K. Optically-induced-dielectrophoresis (ODEP)-based cell manipulation in a microfluidic system for high-purity isolation of integral circulating tumor cell (CTC) clusters based on their size characteristics. Sensors and Actuators, B: Chemical. 258, 1161-1173 (2018).
- Medjdoub, M., Courant, J. L., Maher, H., Post, G. Inductively coupled plasma - plasma enhanced chemical vapor deposition silicon nitride for passivation of InP based high electron mobility transistors (HEMTs). Material Science and Engineering: B. 80 (1-3), 252-256 (2001).
- . Umbilical cord-derived mesenchymal stem cells; Normal, human Available from: https://www.atcc.org/products/pcs-500-010 (2023)
- . 293 [HEK-293] Available from: https://www.atcc.org/products/crl-1573 (2023)
- Glasser, H., Fuhr, G. Cultivation of cells under strong ac-electric field-differentiation between heating and trans-membrane potential effects. Bioelectrochemistry and Bioenergetics. 47 (2), 301-310 (1998).
- Li, B. Implementation of flexible virtual microchannels based on optically induced dielectrophoresis. Nanotechnology. 33, 295102 (2022).
- Schellenberg, J. J., Kao, K. C. On the relationship between photoconductivity and light intensity in solids. Journal of Physics D: Applied Physics. 21, 1764-1768 (1988).
- Aoyagi, Y., Masuda, K., Namba, S. Explaination of light-intensity dependence of photoconductivity in zinc phthalocyanine. Journal of Applied Physics. 43, 249-251 (1972).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。