Method Article
使用参考试剂确认细胞因子释放测定法预测单克隆抗体安全性的稳健性
摘要
使用细胞因子释放测定参比试剂可实现免疫治疗性单克隆抗体更具可重复性和标准化的 体外 安全性。在这里,我们描述了如何将细胞因子释放测定与参考试剂组合一起使用,以预测某些治疗性单克隆抗体的安全性。
摘要
旨在通过阻断或激活免疫系统的内源性调节因子来直接刺激特定免疫细胞或间接增强免疫反应的新型免疫刺激抗体药物,有可能引起严重的免疫相关不良事件,例如细胞因子释放综合征 (CRS)。因此,在首次人体给药之前,通过体内和体外实验的组合来评估此类药物的安全性至关重要。细胞因子释放试验 (CRA) 将拟议的抗体治疗药物与人类免疫细胞(如外周血单核细胞 (PBMC)、全血或其他细胞)共培养,并测量产生的炎性细胞因子的量,对于危害识别至关重要。然而,使用不同的对照抗体的不同实验室可能会威胁到 CRA 的协调,并且临床相关的对照(例如 TGN1412)可能难以获得,这可能导致结果不太准确或可靠,或者难以在实验室之间进行比较。在 CRA 中包含阳性和阴性对照可以确保结果的准确性和可靠性。美国国家生物标准与控制研究所 (NIBSC) 生产了一组冻干抗体对照品,旨在用于各种 CRA 平台,以协调各种实验室和检测方法的结果。一组三种不同的阳性对照抗体包括抗 CD52、抗 CD3 和抗 CD28 超激动剂 (SA),已知它们会在患者中诱导剂量依赖性 CRS。每种抗体都配有同种型匹配的阴性对照抗体。这组参比试剂先前已被证明具有良好的实验室间重现性,并且是提高来自各种 CRA 平台的安全数据的可信度和稳健性的合适对照。
引言
诱导细胞因子释放可能是某些免疫调节单克隆抗体 (mAb) 的预期和预期效果。然而,促炎细胞因子的意外释放会导致以发热、疲劳甚至多器官衰竭为特征的患者出现细胞因子释放综合征 (CRS)1。因此,通过在细胞因子释放试验 (CRA) 中测量细胞因子的释放,在 体外 测试新的免疫刺激性 mAb 是否可能引起 CRS 至关重要。
TGN1412 是一种单克隆抗体,通过充当 CD28 超激动剂 (CD28SA) 作为 B 细胞慢性淋巴细胞白血病的潜在治疗方法而开发,能够通过交联共刺激受体 CD282 激活 T 淋巴细胞。2006 年,在一项临床试验中接受 TGN1412 治疗的 6 名健康志愿者在接受药物后的数小时内出现了严重的副作用,包括 CRS1。这导致试验停止,TGN1412退出进一步开发。其他已知可引起 CRS 副作用的抗体包括抗 CD52 mAb、Campath-1H3 和抗 CD3 mAb Muromonab (OKT3)4。鉴于它们能够在患者中诱导剂量依赖性 CRS,TGN1412、OKT3 和 Campath-1H 是合适的阳性对照抗体,用于从 CRA 产生稳健可靠的结果。然而,由于成本高或可用性有限,这些对照抗体以前并不容易获得。
然而,美国国家生物标准与控制研究所 (NIBSC) 最近提供了这三种抗体 5,6,7 以及同种型匹配的阴性对照的再制造冻干参考组合。这组参比试剂先前已被证明具有良好的实验室间重现性8,因此是提高来自各种 CRA 平台的安全数据的可信度和稳健性的合适对照。因此,将该方案与这些试剂一起使用的基本原理是改善 CRA 协调,这些试剂的优势已在国际合作研究中得到验证8。
本文介绍了如何在固相 (SP) PBMC CRA 和水相 (AQ) 全血 (WB) CRA 中最好地使用这组参比试剂来预测抗体诱导的 CRS。由于抗体呈递模式(固相间接与水性相直接)以及它们靶向不同的反应细胞组,这两种 CRA 形式是互补的。相同的方案可能适用于稀释的全血 (dWB) 或内皮:PBMC 共培养物。
研究方案
以下协议遵循 NIBSC 研究伦理委员会的指导方针。根据适用的法规和指南,获得健康捐献者或患者的书面知情同意书。使用无菌技术在层流式细胞培养罩中执行方案的所有制备步骤。有关所有试剂和设备的详细信息 ,请参阅材料表 。
1. 制备用于固相 (SP) 分析的 mAb 包被板
- 用 1 mL 无菌蒸馏水复溶参比试剂安瓿瓶的内容物。静置 5-10 分钟进行再水化,然后混合抗体溶液并转移到无菌加盖试管中。
- 在 1 mL 水中复溶后,以下重组抗体的储备浓度为 200 μg/mL:抗 CD3 (15/162)、抗 CD52 (15/178)、抗 CD52 的 IgG1K 同种型对照 (15/198)、抗 CD3 的 IgG2a 同种型对照 (15/218)、抗 CD28SA 的 IgG4 同种型对照 (15/232)。
- 在 1 mL 水中复溶后,抗 CD28SA (15/144) 的储备浓度为 100 μg/mL。如需短期储存长达 7 天,请将复溶材料在无菌加盖管中转移至 4 °C。
- 在无菌 PBS 中稀释复溶的抗体和测试抗体至 10 μg/mL,并用 100 μL 稀释抗体溶液(1 μg/孔)包被无菌非 TC 处理的 U 型底聚丙烯 96 孔微量滴定板的孔,并在 4 °C 下孵育过夜。
注:使用聚丙烯板进行蛋白质吸附很重要,因为这些板用于标准试剂的验证9。
2. PBMC 的制备
- 将至少 30 mL 外周全血 (WB) 收集到肝素化/含肝素的试管中,并倒置数次以确保与肝素钠正确混合。
- 将 15 mL WB 转移到单独的试管中,以便稍后用于制备水相全血测定(步骤 3.1)
- 用 PBS 或无血清 RPMI-1640 培养基以 1:1 的体积比稀释剩余的 15 mL 血液,然后将稀释的血液轻轻地铺在 50 mL 试管中的 15 mL 密度梯度培养基(例如淋巴制备、Ficoll-Hypaque)的顶部。
- 在室温下将试管在无制动器且加速度降低的水平转子中以 500 x g 离心 20 分钟,以将血液分离成不同的成分。
- 离心后,密度梯度将分离为血浆顶层,然后是一层含有 PBMC 的薄薄血沉棕黄层和含有红细胞 (RBC) 和多形核粒细胞(包括中性粒细胞和嗜酸性粒细胞)的底层。通过将移液管直接穿过上层血浆层插入 PBMC 来小心地收获 PBMC。或者,在收集细胞之前去除上层。
- 将血沉棕黄层轻轻重悬于 10 mL PBS 或无血清 RPMI-1640 培养基中。再次以 500 x g 离心试管 10 分钟以沉淀细胞。去除上清液并丢弃。
- 重复洗涤步骤 2.6。并将沉淀重悬于 2 mL 含 10% FCS(完全 RPMI-1640,cRPMI)的 RPMI 中
- 使用血细胞计数器计数细胞10.
- 在 cRPMI 中将 PBMC 调整至 1 x 106 个细胞/mL 的浓度。
3. 水相 (AQ) 全血 (WB) 细胞因子释放测定的制备
- 将 190 μL WB 添加到 96 孔 U 形底聚苯乙烯板的孔中。如果尚未达到 100 μg/mL,则在 PBS 中将所有处理抗体和参比试剂预稀释至 100 μg/mL。
- 将 10 μL 稀释抗体加入 190 μL WB 中,得到 95% WB 中的最终抗体浓度为 5 μg/mL 抗体。
- 将板在 37 °C 的加湿培养箱中孵育 48 小时。
4. 固相 (SP) PBMC 细胞因子释放测定的制备
- 使用多通道移液器从包被板中取出并丢弃抗体溶液(如步骤 1 所述),用 PBS 填充试剂储液槽,并用 200 μL PBS 洗涤板 3 次,以去除未结合的 mAb。
- 向每个孔中加入 200 μL 步骤 2.8 中的细胞悬液。将板在 37 °C、5% CO2 的加湿培养箱中孵育 48 小时。
5. 收集上清液或血浆
- 与对照和测试 mAb 孵育 48 小时后,将板以 400 x g 离心 5 分钟并收集细胞条件培养基或血浆,注意不要干扰细胞沉淀。将收集的上清液或血浆在-20°C下冷冻。
注意:收集血浆时,请确保不要干扰红细胞沉淀。
6. 对上清液或血浆中的细胞因子进行定量
- 使用收集的上清液或血浆,使用首选的多重选项对 IFN-γ、IL-2、TNF-α 和 IL-6 浓度进行细胞因子分析。之前已发表过使用细胞计数微珠测定法进行多重细胞因子分析的示例方法11。
注:请参阅 材料表 ,了解用于生成代表性结果的多重试剂盒。
结果
SP 测定的结果应显示 48 小时时所有阳性对照抗体在 pg/mL 范围内释放 IL-2、IFN-γ、IL-6 和 TNF-α12 ,并且应在统计学上显着大于匹配的同种型对照。我们的代表性结果表明,在 PBMC SP 测定中运行时,与匹配的同种型对照相比,阳性对照抗体 αCD28、αCD3 和 αCD28SA 诱导的 IFN-γ、IL-6 和 TNF-α 水平显着高(图 1)。该测定的另一个特征是,与其匹配的同种型 (859.0) 相比,αCD28SA 刺激释放的 IL-2 呈高倍数变化。而 αCD3 和 αCD52 虽然仍然诱导 IL-2 表达,但导致比 αCD28SA 更低的倍数变化(αCD3 和 αCD52 分别为 6.2 和 3.3, 图 2)。
在 WB AQ 测定(图 3)中,可检测细胞因子的水平明显低于 PBMC SP 测定,但其特征是对 αCD52 抗体刺激的敏感性更高(图 2 和图 3),IL-2、IFN-γ 和 IL-6 的平均倍数变化高于 100。
一种测试抗体,与相关同种型对照相比,预计未来的首次人体给药不会导致细胞因子释放的任何意外显着增加。尽管如此,与其停止新的治疗性 mAb 的开发,不如将 CRA 的阳性结果视为风险/收益管理的一部分13。在开发新的 CRA 平台时,应使用不同的供体组重复测定,以确保平台的可重复性。还应重视考虑供体之间反应的可变性14,因此建议进行有力的实验15。为了了解反应的广度并获得在供体反应中可以观察到的变异性的完整表示,除了在重复实验中检测治疗剂外,理想情况下还应与多个个体供体一起进行检测。

图 1:PBMC-SP 实验中的细胞因子释放。 使用参考试剂抗体时,48 小时后从 PBMC-SP 细胞因子释放测定(3 个独立实验,每个实验包含 5-8 个供体;n=8、n=10、n=5 [从上到下])获得的 IFN-γ、IL-2、IL-6 和 TNF-α 释放的代表性结果。缩写:PBMC = 外周血单核细胞;SP = 固相;IFN-γ = 干扰素-γ;IL-2 = 白细胞介素 2;IL-6 = 白细胞介素 6;TNF-α = 肿瘤坏死因子 α。 请单击此处查看此图的较大版本。
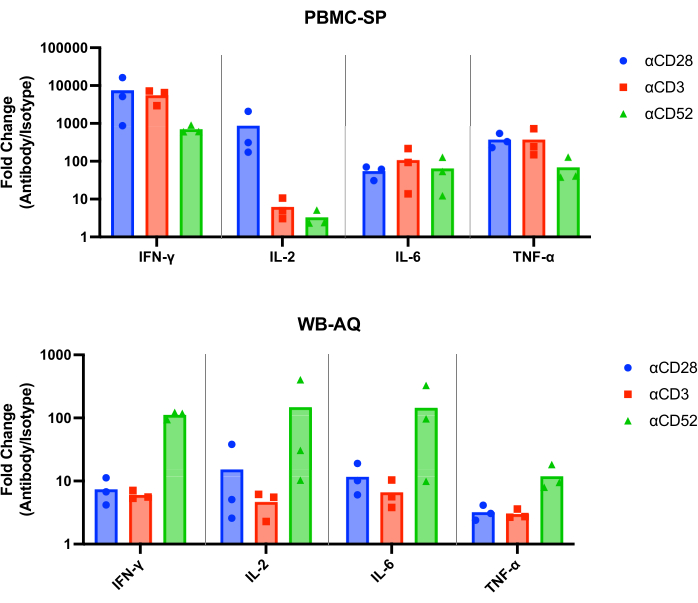
图 2:PBMC-SP 和 WB-AQ 实验的细胞因子倍数变化增加。 48 小时后,从 PBMC-SP 和 WB-AQ 细胞因子释放测定中获得的 CRS 诱导抗体参比试剂的 IFN-γ、IL-2、IL-6 和 TNF-α 释放的倍数变化。缩写:PBMC = 外周血单核细胞;SP = 固相;WB = 全血;AQ = 水性(相);IFN-γ = 干扰素-γ;IL-2 = 白细胞介素 2;IL-6 = 白细胞介素 6;TNF-α = 肿瘤坏死因子 α;CRS = 细胞因子释放综合征。 请单击此处查看此图的较大版本。
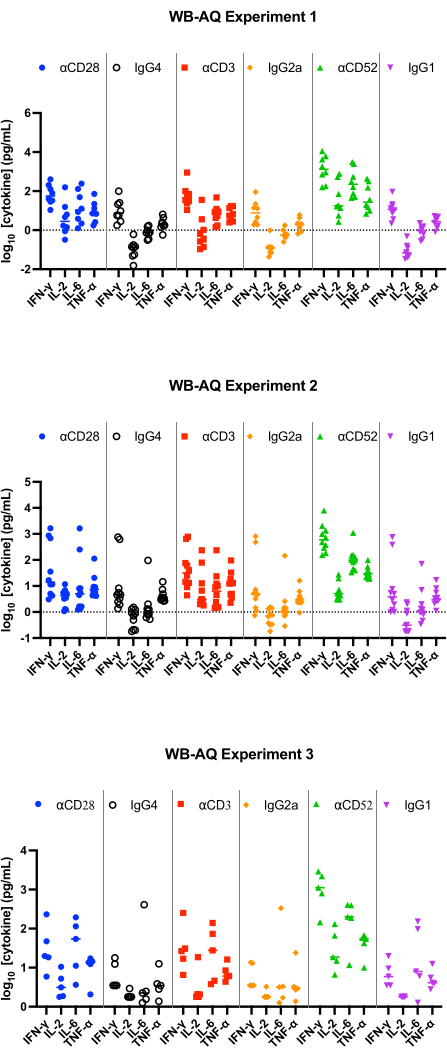
图 3:WB-AQ 实验中的细胞因子释放。 使用参考试剂抗体时,48 小时后从 WB-AQ 细胞因子释放测定(3 个独立实验,每个实验包含 5-8 个供体;n=8、n=10、n=5 [从上到下])获得的 IFN-γ、IL-2、IL-6 和 TNF-α 释放的代表性结果。缩写:WB = 全血;AQ = 水性(相);IFN-γ = 干扰素-γ;IL-2 = 白细胞介素 2;IL-6 = 白细胞介素 6;TNF-α = 肿瘤坏死因子 α。 请单击此处查看此图的较大版本。
讨论
这里描述的是测量抗体介导的刺激后 PBMC 和 WB 释放细胞因子的方法,使用一组用于阳性和阴性对照的参考试剂。这些检测方法中的每一种都有其自身的相关优势和劣势。PBMC 和 WB 检测是互补的,因为在用于 CRA 的两种实验基质中,各种免疫细胞(如淋巴细胞、单核细胞和粒细胞)的比例不同。有趣的是,尽管与 PBMC 单一培养相比,WB 测定可能更好地代表 体内 条件,但前者平台对 TGN1412 和 OKT3 的 T 细胞介导的 CRS 风险的预测性较低15;红细胞上的血型糖蛋白 A 抑制 IL-2 介导的 T 细胞扩增的结果16。然而,由于 WB CRA 中存在嗜中性粒细胞(在步骤 2 中描述的常规密度梯度方法中丢失,用于 PBMC 分离),抗 CD52 对 CRS 风险的预测仍然完整。
CRA 的格式 (SP 或 AQ 呈报) 对于检测 CRS 的特定机制至关重要。例如,在 TGN1412 的临床前体外安全性测试中采用的 mAb 水相呈递给人淋巴细胞17,18 未能识别 CRS 风险,这可能是由于缺乏局部细胞受体聚集和参与19 以及随后由水相抗体介导的 T 细胞活化。事实上,TGN1412介导的 CRS 只能以人工复制 Fc-γ 受体 (FcγR) 交联的 SP 形式准确检测,如此处所述,或通过高密度 PBMC 预培养中的接触依赖性引发以及与 CD32+ 免疫细胞(如 B 细胞20 和单核细胞21)的 Fc 相互作用。
除了这些平台之外,还有其他方法可以使用更复杂的共培养系统进行 CRA。这些方法中描述的替代 CRA 的一个例子是将 PBMC 与自体血液生长内皮细胞 (BOEC) 共培养22。该检测在 2015 年被描述为通过去除混杂组织错配对当时传统的混合供体 HUVEC:PBMC 检测的改进。与 WB 测定相比,它表现出对抗 CD28SA CRS 的敏感性,并且还通过模拟 体内存在的内皮细胞和白细胞的组合克服了 PBMC 单一培养测定的局限性,但代价是需要专门的细胞培养技术的更漫长的程序步骤22。
此外,虽然该协议特别关注 IFN-γ、IL-2、IL-6 和 TNF-α 的释放,但 MHRA 的同事之前已经研究了 IL-12 和其他在这种情况下的释放23。这些阳性对照 CRS 抗体增加了 IL-12 的产生,尽管它不是特别敏感,因此在这种模式下可能不是 CRS 的一个很好的预测指标。一些细胞因子,如 IL-15 等,从未经过测试,尽管我们的方案中评估的 4 种细胞因子很好地表明了 CRS 的潜在风险。当然,根据检测的方式和抗体,可以评估其他细胞因子。
综上所述,这些观察结果强调了注意的重要性,即尽管使用参比试剂可以帮助识别新抗体的 CRS 风险,但应注意避免使用可能无法识别 CRS 潜力的次优 CRA 平台。至关重要的是,治疗药物的预测作用机制,无论是 通过其 Fc 区域还是其对抗原表达细胞的假设作用,都必须与测定的生物学特性相匹配。因此,虽然本文讨论的受试治疗试剂和参比试剂的作用机制的差异可能会造成潜在的限制,以至于受试抗体的相关 CRA 可能与参比试剂的生物学特性不相容,但该检测为危害识别提供了一个稳健、可靠的平台。然而,涵盖各种作用机制和免疫细胞亚群的几种 CRA 格式的结果对于安全性评估数据的最佳可信度可能是必要的。
披露声明
EM 曾受雇于药品和保健品监管局 (MHRA)。其余作者没有利益冲突。
致谢
这项工作由国家生物标准与控制研究所资助。我们感谢 Sandra Diebold 审阅手稿并提出有益的意见和建议。我们也感谢 Ka Seng Ieong 拍摄了这段视频。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
参考文献
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。