线粒体的两步无标签分离,用于改进蛋白质发现和定量
摘要
我们提出了一个用于高质量线粒体分离的两步方案,该方案与蛋白质组规模的蛋白质发现和定量兼容。我们的协议不需要基因工程,因此适用于研究来自任何原代细胞和组织的线粒体。
摘要
大多数生理和疾病过程,从中枢代谢到对神经变性的免疫反应,都涉及线粒体。线粒体蛋白质组由1000多种蛋白质组成,每种蛋白质的丰度可以响应外部刺激或疾病进展而动态变化。在这里,我们描述了一种从原代细胞和组织中分离高质量线粒体的方案。两步程序包括(1)机械均质和差速离心以分离粗线粒体,以及(2)线粒体的无标签免疫捕获以分离纯细胞器并消除污染物。通过定量质谱分析每个纯化阶段的线粒体蛋白,并计算富集产量,从而通过减法蛋白质组学发现新的线粒体蛋白。我们的实验方案为研究细胞系、原代细胞和组织中的线粒体含量提供了一种灵敏而全面的方法。
引言
线粒体是复杂而动态的细胞器,能够感知和适应细胞的代谢需求。线粒体是细胞代谢复杂性的核心,是碳水化合物、蛋白质、脂质、核酸和辅因子代谢反应汇聚的代谢枢纽1。它们还充当先天免疫反应途径的信号细胞器,并响应离子和活性氧的变化2,3。迄今为止,大约有1,100种蛋白质被映射到线粒体4,5,6,但我们可以假设还有更多的蛋白质有待发现,特别是那些仅在某些细胞类型中表达或在特定环境条件下短暂表达的蛋白质。开发量化感兴趣的代谢状态下线粒体组成变化的新方法将增加我们对这些细胞器的了解,并突出以线粒体功能障碍为特征的疾病的新治疗途径7。
目前,有不同的线粒体分离方案可用,具有不同的产量和纯度水平8。基于离心的方法因其简单性和低成本而最受欢迎。虽然适用于大多数应用,但当使用更复杂的基于密度梯度的应用时,差速离心的缺点是线粒体纯度较低,并且需要大量起始材料。近年来,出现了分离线粒体的新方法,例如基于标签的免疫捕获(“MITO-IP”)9 和荧光激活细胞器分选10。尽管这两种程序都可以生成高纯度的样品,但前者需要基因工程来标记线粒体以进行亲和纯化,这使得该方案与来自未改性生物体或人类供体的主要材料不兼容。同时,后者依赖于流式细胞术和分选仪器的可及性。结合不同的分离方法,有望产生更稳健的实验方案和更高的纯度。
在这里,我们提出了一种基于两种现有方法组合的线粒体分离新方案:(1)差异离心以分离粗线粒体部分,以及(2)线粒体的无标签免疫捕获,超顺磁珠与外线粒体膜22(Tomm22)11(一种无处不在的线粒体外膜蛋白)的转位酶抗体共价结合(图1).我们描述的程序与定量蛋白质质谱兼容,并且由于它是无标签的并且不需要遗传操作,因此可以应用于广泛的研究模型,从细胞系到体液再到整个动物组织。此外,在协议中使用两个步骤可以使用减法蛋白质组学6,12 来发现新的线粒体蛋白并研究其表达。
研究方案
必须始终佩戴手套,并在层流罩下进行细胞培养步骤。将细胞保持在含有5%CO2的37°C培养箱中。该协议中提出的研究已获得批准,并按照洛桑大学和瑞士的动物使用指南进行。
1. RAW264.7巨噬细胞系的培养
- 在Dulbecco的改良鹰培养基(DMEM)中培养小鼠巨噬细胞RAW264.7细胞,高葡萄糖和谷氨酰胺补充有5%热灭活胎牛血清(HI-FBS)和100 IU / mL青霉素和100μg/ mL链霉素(P / S)。
注意:要分离线粒体,单个汇合的15厘米板(约70 x 10 7 RAW264.7细胞)就足够了。 - 将RAW264.7细胞维持在组织培养板中。初始接种密度为 1 x 105 个细胞/mL 可在 3 天内形成汇合板。在培养基中使用 25 mL 细胞悬液用于 15 cm 平板。RAW264.7细胞具有高细胞分裂率,需要比大多数细胞系更频繁地分裂。
- 分离 RAW264.7 细胞
- 吸出培养基并用磷酸盐缓冲盐水(PBS)洗涤细胞一次。
- 对于15cm板,加入8mL温热的RAW解离缓冲液(270mM氯化钾,30mM柠檬酸钠二水合物在H2O中,无菌过滤),并将细胞在37°C孵育5分钟。
- 向平板中加入等量体积的培养基(解离缓冲液的1:1稀释),并移液器以分离和均质化细胞。
- 将细胞悬液转移到锥形管中,并在室温下以300× g 离心管3分钟。
- 吸出上清液并将沉淀重悬于适当体积的培养基(如步骤1.1中所述)中进行细胞计数。
注意:可以使用其他方法来分离RAW264.7细胞,例如胰蛋白酶或细胞刮刀。然而,这些方法对细胞更苛刻,并可能导致它们在分离后的几天内极化成M1样巨噬细胞。
2. 骨髓来源巨噬细胞(BMDM)的分离和培养
注意:此处描述的协议适用于单个鼠标,可以针对多个鼠标进行放大。BMDM分离和培养的详细方案已在别处描述13,14。
- 用高剂量的CO2牺牲8-12周大的C57BL / 6小鼠。
注意:可以使用雄性或雌性小鼠。 - 用75%乙醇喷洒鼠标进行消毒。
- 解剖并收集小鼠的臀部、股骨和胫骨15.
- 要从股骨和胫骨收集骨髓,请切除两块骨头的膝关节端15。通过切除髋臼从臀部恢复骨髓。
- 将骨头转移到 50 mL 锥形管中,将 4 mL BMDM 培养基放在冰上(含有高葡萄糖和谷氨酰胺的 DMEM,补充有 5% HI-FBS、P/S 和 10 mM HEPES)。
注意:重要的是将骨骼保存在培养基中,以避免在解剖过程中骨髓干燥。 - 在 6 孔板的两个不同孔中加入 4 mL PBS 和 4 mL 温热的 BMDM 培养基。
- 将骨头和培养基从 50 mL 锥形管转移到 6 孔板的空孔中。
- 使用一对镊子,将骨头转移到PBS井中清洗它们。
- 将骨头转移到含有温BMDM培养基的孔中。
- 用镊子在两个 0.5 mL 管的底部开一个直径为 1-2 mm 的孔,然后将它们放入 1.5 mL 管中。
注意:对于此快速步骤,无需将介质添加到管中。 - 在每个 0.5 mL 管中,放置股骨、胫骨和髋关节,使暴露骨骼的骨髓朝向管底部。
- 在室温下以 13,000 x g 离心管 1 分钟,以通过 0.5 mL 管的孔收集骨髓和剩余培养基并进入 1.5 mL 管中。丢弃带有骨头的 0.5 mL 管。
- 将骨髓沉淀重悬于BMDM培养基中,并转移到15 mL锥形管中。
- 加入高达 10 mL 的 BMDM 培养基。
- 将 40 μm 细胞过滤器放在 50 mL 锥形管上,并通过它过滤骨髓悬浮液。
- 在室温下以300× g 离心过滤的悬浮液5分钟,以恢复完整的细胞并从细胞悬液中去除小碎片。
- 制备 70 mL BMDM 培养基,补充有 50 ng/mL 巨噬细胞集落刺激因子 (M-CSF)。
- 将沉淀重悬于 10 mL 补充 M-CSF 的 BMDM 培养基中。
- 将 9 mL 补充 M-CSF 的 BMDM 培养基添加到七个 10 cm 培养皿中的每一个中。
- 在七个 10 cm 培养皿中的每一个中平板 1 mL 细胞(约 1 x 107 个细胞)。
- 通过在平板上小心地上下移液,使每个板中的细胞悬液均质化,并将板转移到培养箱中。
- 3 天后,向每个平板中加入 5 mL 补充有 50 ng/mL M-CSF 的温热 BMDM 培养基。
- 3天后(第6天,骨髓分离后),通过显微镜检查BMDM的粘附和分化。
注意:此时,可以直接进行线粒体分离(步骤3)。或者,可以重新铺板BMDM,这允许用细胞因子和小分子处理它们。 - 分离 BMDM
- 从每个板中吸出培养基,并加入 7 mL 补充有 5 mM 乙二胺四乙酸 (EDTA) 的冷 PBS。
- 将细胞在4°C孵育7-8分钟。
- 使用 10 mL 移液器小心地上下移液,分离 BMDM。
- 将来自所有七个板的重悬BMDM汇集到单个50 mL锥形管中,并在室温下以300 x g 离心3分钟。
- 吸出上清液并将细胞重悬于40 mL温热的BMDM培养基中进行细胞计数。
注意:每只鼠标获得 7-9 x 107 BMDM 。对于蛋白质组学,建议至少使用 6 x 107 BMDM 进行线粒体分离。 - 如果需要,根据实验目标对BMDM进行铺板和处理。如果没有,请直接执行步骤 3.3。
3.差速离心制备粗线粒体级分
注意:在4°C下执行所有离心步骤。 需要两台离心机,一台带有外摆式转子和适配器,用于相对离心力至少为 300 x g 的锥形管,另一台相对离心力至少为 21,000 x g,适用于 1.5 mL 管。使用贴壁细胞时,请使用细胞刮刀。
- 对于贴壁细胞,吸出培养基并每 15 cm 板添加 10 mL PBS。
注意:在PBS中刮细胞可以同时清洗它们。如果细胞已经处于悬浮状态,请直接进入步骤3.3。 - 使用细胞刮刀分离细胞,并将其汇集在单个 50 mL 锥形管中。通过上下移液使细胞悬液均质化。
注意:可以使用细胞刮刀分离细胞,因为这更快,并且很快就会裂解。 - 对于每个实验条件,将5%的细胞悬液体积转移到1.5mL管中,并在室温下以300× g 离心5分钟。
注意:使用悬浮细胞时,请确保在之前用PBS清洗一次细胞,以去除培养基(如FBS)中可能的污染物。 - 弃去上清液并将沉淀放在冰上。
注意:这将代表蛋白质组学的“总细胞”部分。 - 将步骤3.1或3.2中的其余样品在室温下以300 ×g 离心5分钟。
- 在冰上并使用冰冷的缓冲液执行以下所有步骤。
- 吸出上清液并将细胞沉淀重悬于 5 mL 冰冷线粒体缓冲液 (MB)(210 mM 甘露醇、70 mM 蔗糖、10 mM HEPES/NaOH [pH 7.4] 和 1 mM EDTA)中。
- 通过在4°C下以300× g 离心5分钟来回收细胞。
- 将细胞沉淀重悬于0.5 mL冷MB中,并将其转移到1.5 mL管中。
注意:此过程产生的细胞浓度约为 1.5 x 10 8 BMDM 细胞/mL 或 3 x 108 RAW264.7 细胞/mL。 - 使用装有 25 G 针头的 1 mL 注射器,将细胞悬液均质化 30 次(图 1A)。
- 向试管中加入 1 mL 冷 MB 并通过倒置混合。在4°C下以2,000× g 离心匀浆细胞悬液5分钟。
- 将 1 mL 上清液转移到冰上的新鲜 1.5 mL 管中,而不会干扰细胞沉淀。重悬细胞沉淀并再次均质化,如步骤3.7所示。
- 将来自前两个步骤的匀浆细胞沉淀和上清液汇集在单个1.5mL管中,并在4°C下以2,000× g 离心5分钟。
注意:此时,沉淀主要包含细胞核和未破碎的细胞,并被丢弃。上清液含有细胞碎片,细胞质和细胞器,包括线粒体(图1B)。 - 将上清液分配到四个 1.5 mL 管中。
注意:在此阶段将上清液分配到多个管中可改善以下步骤中污染物的去除。 - 加入 MB 以使四个试管中每个管中的最终体积为 1 mL。倒置混合并在4°C下以13,000× g 离心管10分钟。
注意:在此步骤之后,可以看到具有两层的颗粒。底部,坚硬的棕色颗粒含有线粒体,并保留用于进一步纯化(图1C)。上部,松散的白色颗粒包含其他细胞结构,可以丢弃。 - 请仔细执行此步骤。用尽可能多的白色上沉淀除去上清液。通过轻轻移液,可以重悬白色颗粒,然后将其丢弃,使棕色线粒体颗粒完好无损。
- 将装有线粒体沉淀的四个试管中的一个放在冰上。这代表了蛋白质组学的“粗线粒体”部分。
- 将其他三个沉淀汇集在 1.5 mL 管中,最终体积为 1 mL MB。
4. 基于超顺磁性抗体的线粒体纯化
注意:在4°C的冷藏室中执行以下所有步骤。
- 将步骤 3.18 中的 1 mL 粗线粒体制剂转移到 15 mL 锥形管中,并加入 7 mL 补充有 150 mM NaCl (MB + NaCl) 的 MB。
注意:NaCl的添加可改善抗体结合并减少污染物与磁珠和线粒体的非特异性结合。 - 将 50 μL Tomm22 珠子加入 8 mL 粗线粒体悬浮液中(图 1D),并将管在 4 °C 下在旋转轮上低速孵育 15 分钟。
注意:Tomm22磁珠与小鼠中产生的Tomm22单克隆抗体共价结合,与超顺磁珠偶联。 - 同时,在磁铁上放置一根柱子。
- 用 8 mL MB + NaCl 平衡色谱柱并丢弃流出物。
- 在4°C下用Tomm22珠孵育样品15分钟后,将样品转移到色谱柱中。丢弃流出物。
注意:线粒体将保持附着在色谱柱中的磁珠上(图1E)。 - 用 8 mL MB + NaCl 洗涤色谱柱 3 次。
- 从磁铁上取下色谱柱,并将其放入 15 mL 锥形管中。
- 通过向色谱柱中加入1.5 mL MB + NaCl来洗脱线粒体,并立即应用柱塞将纯化的线粒体洗脱到管中。
- 将洗脱的线粒体转移到1.5mL管中,并在4°C下以21,000× g 离心10分钟。
注意:将形成棕色颗粒。其中包含分离的线粒体和一些抗体偶联珠(图1F)。 - 小心地从沉淀中除去上清液。该沉淀代表蛋白质组学的“纯线粒体”部分。该颗粒与步骤3.4和3.17中的颗粒一起可以储存在-20°C,并准备用于下游应用。
代表性结果
在本协议中生成三种线粒体纯度递增的样品:总细胞,粗线粒体(“mito-purde”)和纯线粒体(“mito-pure”)(图1)。我们通过在凝胶上加载每个级分的等量蛋白质并进行免疫印迹验证了RAW264.7巨噬细胞系线粒体的纯化,发现线粒体柠檬酸合酶(Cs)在每个纯化步骤中富集;同时,来自细胞质(GAPDH),质膜(Na / K ATPase),细胞核(Lamin B),溶酶体(Lamp1)和内质网(ER)(Pdi)的蛋白质逐渐消失(图2A)。使用BMDM获得了类似的结果。为了进一步验证分离的线粒体的纯度和完整性,对纯线粒体部分进行了电子显微镜检查。我们观察到线粒体具有经典的椭圆形和完整的嵴,周围环绕着对应于抗体包被珠子的电子致密颗粒(图2B)。因此,可以得出结论,我们的协议丰富了线粒体,耗尽了其他细胞成分,并保持了线粒体结构的完整性。
接下来,使用液相色谱与质谱联用(LC / MS)对每个馏分进行蛋白质组分析。从总细胞中提取的提取物中总共鉴定出6,248种蛋白质,其中907种先前在MitoCarta3.0清单5中被注释为线粒体。在过滤阈值至少为两种独特肽的蛋白质后,我们根据每个样品中每种蛋白质的强度与总细胞的比较计算了每种蛋白质的富集评分。然后,我们使用基因本体(GO)16,17和MitoCarta3.05作为参考,将蛋白质分配到七个主要的亚细胞区室:线粒体,ER,溶酶体,高尔基体,细胞骨架,细胞核和细胞质。重要的是,观察到线粒体蛋白在粗线粒体和纯线粒体部分中的平均富集分别超过10倍和20倍以上(图2C)。相比之下,分析的其他六个细胞区室的组分在纯化过程中耗尽。特别值得注意的是,在粗线粒体部分中,我们观察到ER和溶酶体蛋白的瞬时富集,这两类污染物蛋白在差异离心方案18之后经常出现。这可能是由于细胞器-细胞器相互作用和相似的沉降系数,特别是溶酶体,其在巨噬细胞中含量很高19。虽然两者都在免疫捕获后大部分耗尽,但我们检测到来自丝分裂纯部分ER-线粒体接触位点的蛋白质的小信号。
然后,我们直接比较了来自总细胞和丝分裂纯样品的蛋白质丰度,并观察到两个不同的群体,对应于线粒体和非线粒体蛋白质(图2D)。虽然绝大多数MitoCarta蛋白聚集在一起,但我们发现一些(<5%)与非MitoCarta蛋白聚集在一起。这些蛋白质可能代表(1)胞质线粒体相互作用蛋白(MitoCarta3.0版本中注释的新类别),(2)双定位蛋白,或(3)错误注释的蛋白质。相反,我们发现了一些非MitoCarta蛋白与线粒体蛋白聚集的实例。虽然这些蛋白质可能代表分离过程的污染物,但它们也可能代表以前未被归类为存在于线粒体中的蛋白质。
为了研究这一类新的潜在线粒体蛋白,使用了减法蛋白质组学,这种方法已被证明对发现细胞器蛋白质组(包括线粒体6,12)有用。减法蛋白质组学假设线粒体在纯化步骤中应该变得富集,污染物应该被耗尽6。例如,虽然污染物可能在差异离心(例如,由于相似的沉降特性)或免疫捕获期间(例如,由于非特异性抗体结合)期间积累,但只有 真正的 线粒体蛋白应该在两者中显着积累。因此,可以过滤掉在纯线粒体部分中发现但显示出不一致的富集模式的蛋白质。在RAW264.7细胞的本例中,通过为丝裂粗和丝分裂纯样品设置≥1的独特肽阈值,并使用严格的富集阈值,我们能够从差异离心后最初在粗线粒体级分中发现的1,127种蛋白质中细化回收的线粒体蛋白质组列表,在使用Tomm22免疫选择进行第二轮纯化后,细化到481种蛋白质。丝图纯级分中MitoCarta注释蛋白数量的减少反映了对选择的高度严格性。有趣的是,Mito-pur部分中存在的70种蛋白质在MitoCarta3.0清单中不存在(图3A,B)。后一种蛋白质可能代表潜在的新型线粒体候选蛋白质,其可能仅在RAW264.7巨噬细胞系和相关细胞中表达,值得进一步研究。
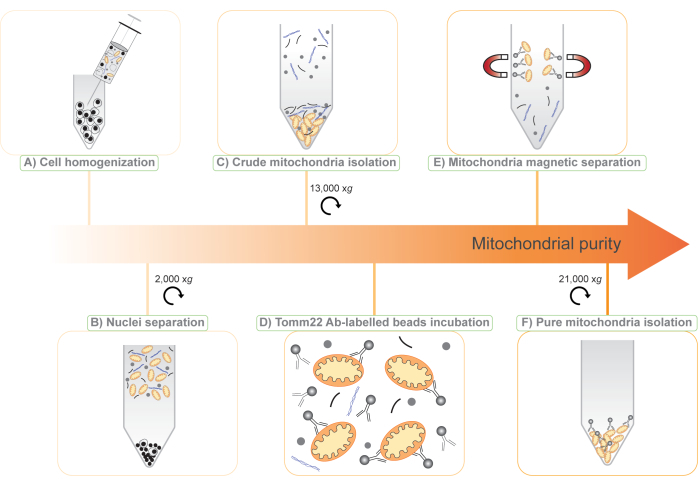
图 1:两步无标签线粒体分离方案的图示。 (A)通过25G针头破坏细胞悬液。(B)通过以2,000×g离心分离细胞核和整个细胞,并保存上清液。(C)粗线粒体通过上清液在13,000×g(mito-粗)下的差异离心分离。(D)然后将粗线粒体与与超顺磁珠共价连接的Tomm22抗体(Ab)一起孵育。(E)使用磁柱将线粒体-Tomm22抗体-珠复合物与污染物分离并洗脱。(F)通过离心(水线纯)收集并浓缩纯线粒体。请点击此处查看此图的大图。
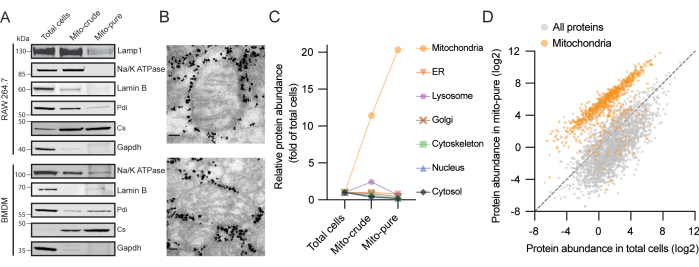
图2.从两个巨噬细胞来源分离线粒体的代表性结果。 (A) 使用线粒体柠檬酸合酶(Cs - 线粒体)、甘油醛 3-磷酸脱氢酶(Gapdh - 细胞质)、钠钾泵(Na/K ATP 酶 - 质膜)、层粘连蛋白 B(层粘连蛋白 B - 细胞核)、溶酶体相关膜蛋白 1(Lamp1 - 溶酶体)和蛋白质二硫醚异构酶 (Pdi - ER) 的抗体对 RAW264.7(顶部)和 BMDM 细胞(底部)进行蛋白质免疫印迹分析。(B)从RAW264.7细胞纯化的线粒体的电子显微镜检查。线粒体周围的高密度颗粒对应于从色谱柱中洗脱后与丝图纯样品一起进行的Tomm22珠。比例尺:80 nm。(C) RAW264.7 细胞中七个细胞区室的总细胞、丝氨酸粗和丝氨酸纯的富集评分。MitoCarta3.0和GO用于蛋白质注释,并表示平均分数。缩写:ER = 内质网。(D)来自RAW264.7细胞的总细胞和丝线纯样品中蛋白质的蛋白质丰度值(riBAQ)。MitoCarta3.0蛋白以橙色显示。 请点击此处查看此图的大图。
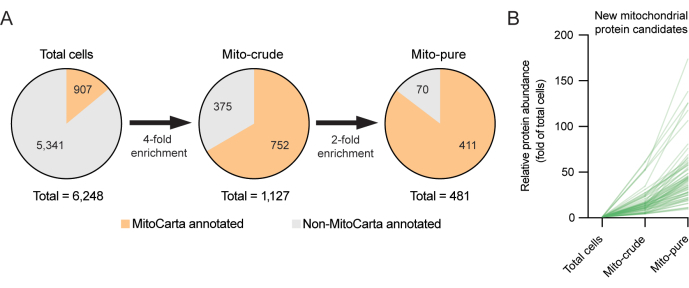
图3.使用减法蛋白质组学发现新型线粒体蛋白。 (A)用于发现新型线粒体蛋白的减法蛋白质组学策略。应用高选择阈值(4x 和 2x)以最大程度地减少误报的选择。(B)先前未在MitoCarta3.0清单中注释的新线粒体候选蛋白的富集产量(总细胞的倍数)。 请点击此处查看此图的大图。
讨论
我们结合了差速离心和免疫捕获,以提高线粒体分离的纯度。我们的程序允许访问用于鉴定和表征新型线粒体蛋白的主要材料。该方案简单而稳健,可以应用于细胞系、原代细胞和组织,而无需进行基因改造。我们通过对整个纯化过程中不同阶段采集的样品进行免疫印迹和蛋白质组学分析来验证我们的方案。
与单一分离方法相比,不同性质的富集步骤(此处为离心和免疫标记)的组合可生成更强大的方案来分离线粒体。这是因为,虽然线粒体蛋白在两次纯化中都会富集,但在两次富集步骤后,污染物也不太可能富集。虽然密度梯度超速离心也可以实现高线粒体纯度,但这种方法需要大量的起始材料和超速离心机。最后,与最近基于基于标签的线粒体分离20的方法相比,我们的方法不需要对样品进行基因修饰,使其适用于任何来源的主要材料。
在应用我们的协议时,在实验设计中需要考虑一些技术和生物学因素。(1)起始材料的量对于获得足够的材料至关重要。不可避免地,在匀浆过程中(步骤3.10)会丢失少量线粒体,因为并非所有细胞都被裂解,或者在三柱洗涤期间(步骤4.6)。虽然我们的方案侧重于纯度而不是产量,但线粒体分离的效率及其产量尚未得到测量或优化。使用更多的Tomm22珠和更多的色谱柱有望提高线粒体回收率。同时,对均质化步骤进行彻底优化也可以提高线粒体产量。该协议以及我们在此处报告的RAW264.7细胞和BMDM的初始细胞数足以用于蛋白质组学,并且可以针对其他应用进行调整。在原代BMDM的情况下,我们发现一只小鼠足以进行一次复制。必要时,可以扩大该程序以从多种动物中分离BMDM,然后可以将其汇集以获得足够的材料。可以根据细胞类型、大小和线粒体含量优化细胞数量。(2)Tomm22在所有细胞类型和组织的线粒体上表达21,但其表达水平可能会有所不同。因此,在设计比较不同条件的实验时,重要的是要确保Tomm22的表达水平具有可比性。此外,由于Tomm22的普遍表达,不可能研究复杂组织中的细胞类型特异性线粒体蛋白。(3)产生纯线粒体所需的时间(约2.5小时)与瞬时事件的研究不相容,例如代谢谱的变化。在这种情况下,我们建议直接基于标签的免疫捕获9,这也允许研究细胞类型的特异性线粒体 in vivo20.(4)尽管单独使用Tomm22抗体标记的磁珠获得的分离线粒体的研究在功能测定中显示出活性11,还有待确定使用我们的协议生成的线粒体是否与下游基于活性的测定兼容。MitoTracker或四甲基罗丹明甲酯高氯酸盐(TMRM)染色或呼吸测量是量化分离线粒体功能的潜在方法22.(5)从色谱柱中洗脱“mito-pure”样品后,一些Tomm22珠将存在于纯线粒体部分(图2B).虽然我们观察到胰蛋白酶消化和蛋白质质谱没有干扰,但在其他下游应用中应考虑这些磁珠和免疫球蛋白的存在。Tomm22抗体是在小鼠体内产生的单克隆抗体23,因此重要的是要记住,当在免疫印迹中使用针对小鼠的二抗时,它将在免疫球蛋白链的大小上产生非特异性条带。(6)细胞悬液的完全均质化是成功分离线粒体的关键。在这里,我们使用带有25 G针头的注射器来裂解RAW264.7细胞和BMDM。然而,根据细胞类型及其大小,其他机械均质方法(例如使用Dounce均质器)或更受控的方法(例如细胞均质器设备)可能更合适。也可以考虑非机械均质方法,例如温和超声处理。组织均质化方法在其他研究中进一步讨论24,25.(7)尽管免疫印迹验证是最直接和更便宜的方法,但其结果可能并不总是与整个细胞器水平的变化相关。这就是为什么我们建议使用蛋白质组学来完全验证线粒体和其他细胞器的富集或消耗。
这里描述的两步线粒体纯化方案使我们能够生成线粒体纯度增加的顺序样品,这使我们能够通过减法蛋白质组学发现新的线粒体蛋白候选物12。对于我们的分析,我们使用严格的阈值来选择显着富集的线粒体蛋白,尽管这可能无法识别一些已知的线粒体蛋白(图3A),但新线粒体蛋白发现的假阳性率降低。然而,重要的是要强调,我们的协议揭示的任何候选蛋白质都必须通过正交方法进行验证。我们建议使用羧基末端GFP标记或使用针对内源性蛋白的抗体,以通过显微镜或蛋白酶保护测定验证与线粒体的关联。
在未修饰的细胞和组织的情况下直接应用我们的方法提供了一个强大的工具来研究线粒体在健康和疾病条件下如何改变和适应其环境。将我们的方案应用于细胞系,动物疾病模型,人体体液,甚至手术活检可能被证明对增强我们对线粒体及其相关疾病的理解特别有用。
披露声明
作者没有什么可透露的。
致谢
我们感谢Manfredo Quadroni,蛋白质分析设施和洛桑大学的电子显微镜设施的帮助。我们还要感谢H.G. Sprenger,K. Maundrell和Jourdain实验室的成员对手稿的建议和反馈。这项工作得到了Pierre-Mercier pour la Science基金会和瑞士国家科学基金会(项目资助310030_200796)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Plastipal | 309628 | |
| 25 G Needle | BD Microlance | 300400 | |
| 40 µm cell strainer | Corning | 352340 | |
| Anti-TOM22 Microbeads, mouse | Miltenyi Biotec | 130-127-693 | |
| Cell scraper | FisherScientific | 11577692 | |
| DMEM, high glucose, GlutaMAX | ThermoFisher | 31966 | |
| Ethylenediaminetetraacetic acid | FisherScientific | BP-120-1 | |
| Fetal bovine serum | Gibco | 10270 | |
| HEPES | BioConcept | 5-31F00-H | |
| LS columns and plungers | Miltenyi Biotec | 130-042-401 | |
| Macrophage colony-stimulating factor | Immunotools | 12343115 | |
| Mannitol | Sigma | M4125 | |
| Sodium chloride | Sigma | 71380 | |
| Sucrose | Sigma | S1888 | |
| Penicillin/Streptomycin | BioConcept | 4-01F00-H | |
| Petri dishes | Corning | BH93B-102 | |
| Phosphate-buffered saline 10X | Eurobio Scientific | CS3PBS01-01 | |
| QuadroMACS Separator | Miltenyi Biotec | 130-090-976 | |
| Vi-CELL BLU Cell Viability Analyzer | Beckman Coulter | C19196 |
参考文献
- Spinelli, J. B., Haigis, M. C. The multifaceted contributions of mitochondria to cellular metabolism. Nature Cell Biology. 20 (7), 745-754 (2018).
- West, A. P., Shadel, G. S., Ghosh, S. Mitochondria in innate immune responses. Nature Reviews Immunology. 11 (6), 389-402 (2011).
- Chakrabarty, R. P., Chandel, N. S. Mitochondria as signaling organelles control mammalian stem cell fate. Cell Stem Cell. 28 (3), 394-408 (2021).
- Morgenstern, M., et al. Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. Cell Metabolism. 33 (12), 2464-2483 (2021).
- Rath, S., et al. MitoCarta3.0: an updated mitochondrial proteome now with sub-organelle localization and pathway annotations. Nucleic Acids Research. 49, D1541-D1547 (2021).
- Pagliarini, D. J., et al. A mitochondrial protein compendium elucidates complex I disease biology. Cell. 134 (1), 112-123 (2008).
- Diaz-Vegas, A., et al. Is mitochondrial dysfunction a common root of noncommunicable chronic diseases. Endocrine Reviews. 41 (3), 005 (2020).
- Bury, A. G., Vincent, A. E., Turnbull, D. M., Actis, P., Hudson, G. Mitochondrial isolation: when size matters. Wellcome Open Research. 5, 226 (2020).
- Chen, W. W., Freinkman, E., Sabatini, D. M. Rapid immunopurification of mitochondria for metabolite profiling and absolute quantification of matrix metabolites. Nature Protocols. 12 (10), 2215-2231 (2017).
- Daniele, J. R., Heydari, K., Arriaga, E. A., Dillin, A. Identification and characterization of mitochondrial subtypes in Caenorhabditis elegans via analysis of individual mitochondria by flow cytometry. Analytical Chemistry. 88 (12), 6309-6316 (2016).
- Franko, A., et al. Efficient isolation of pure and functional mitochondria from mouse tissues using automated tissue disruption and enrichment with anti-TOM22 magnetic beads. PLoS One. 8 (12), e82392 (2013).
- Yates, J. R., Gilchrist, A., Howell, K. E., Bergeron, J. J. M. Proteomics of organelles and large cellular structures. Nature Reviews Molecular Cell Biology. 6 (9), 702-714 (2005).
- Trouplin, V., et al. marrow-derived macrophage production. Journal of Visualized Experiments. (81), e50966 (2013).
- Ying, W., Cheruku, P. S., Bazer, F. W., Safe, S. H., Zhou, B. Investigation of macrophage polarization using bone marrow derived macrophages. Journal of Visualized Experiments. (76), e50323 (2013).
- Toda, G., Yamauchi, T., Kadowaki, T., Ueki, K. Preparation and culture of bone marrow-derived macrophages from mice for functional analysis. STAR Protocols. 2 (1), 100246 (2020).
- Gene Ontology Consortium. The Gene Ontology resource: enriching a GOld mine. Nucleic Acids Research. 49, D325-D334 (2021).
- Ashburner, M., et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nature Genetics. 25 (1), 25-29 (2000).
- Hartwig, S., et al. A critical comparison between two classical and a kit-based method for mitochondria isolation. Proteomics. 9 (11), 3209-3214 (2009).
- Delamarre, L., Pack, M., Chang, H., Mellman, I., Trombetta, E. S. Differential lysosomal proteolysis in antigen-presenting cells determines antigen fate. Science. 307 (5715), 1630-1634 (2005).
- Bayraktar, E. C., et al. MITO-Tag mice enable rapid isolation and multimodal profiling of mitochondria from specific cell types in vivo. Proceedings of the National Academy of Sciences. 116 (1), 303-312 (2019).
- Nusinow, D. P., et al. Quantitative proteomics of the cancer cell line encyclopedia. Cell. 180 (2), 387-402 (2020).
- Iuso, A., Repp, B., Biagosch, C., Terrile, C., Prokisch, H. Assessing mitochondrial bioenergetics in isolated mitochondria from various mouse tissues using seahorse XF96 analyzer. Methods in Molecular Biology. 1567, 217-230 (2017).
- Hornig-Do, H. T., et al. Isolation of functional pure mitochondria by superparamagnetic microbeads. Analytical Biochemistry. 389 (1), 1-5 (2009).
- Liao, P. C., Bergamini, C., Fato, R., Pon, L. A., Pallotti, F. Isolation of mitochondria from cells and tissues. Methods in Cell Biology. 155, 3-31 (2020).
- Lanza, I. R., Nair, K. S. Functional assessment of isolated mitochondria in vitro. Methods in Enzymology. 457, 349-372 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。