需要订阅 JoVE 才能查看此. 登录或开始免费试用。
一套快速了解中性粒细胞功能的筛查技术
摘要
该协议具有一组中性粒细胞功能测定,可用作筛选方法,以涵盖来自不同信号通路的功能。该协议包括对细胞活力、纯度、活性氧产生、实时迁移、吞噬作用的初步和简单评估,以及中性粒细胞细胞外陷阱的初步建议。
摘要
中性粒细胞被称为先天免疫反应的第一道防线之一,可以执行许多特定的细胞功能,例如趋化性、反向迁移、吞噬作用、细胞毒性酶和代谢物的脱颗粒,以及 DNA 作为中性粒细胞胞外陷阱 (NET) 的释放。中性粒细胞不仅自身具有严格调节的信号传导,而且还参与免疫系统其他成分的调节。由于新鲜的中性粒细胞是终末分化的、短暂的,并且个体之间差异很大,因此充分利用收集的样本非常重要。研究人员通常需要进行筛选分析,以评估可能受评估的特定条件影响的许多中性粒细胞功能的概述。为了满足这一需求,开发了一套遵循正常密度中性粒细胞单一分离过程的测试,寻求速度、全面性、成本和准确性之间的平衡。研究结果可用于推理和指导深入的后续研究。该过程可以在平均 4 小时内进行,包括评估细胞活力、活性氧 (ROS) 产生、实时迁移和载玻片上酵母的吞噬作用,留下足够的细胞用于更详细的方法,如组学研究。此外,该程序包括一种在通过光学显微镜观察快速全景染色后轻松观察NETs初步建议的方法,尽管缺乏特异性标记,但足以表明是否值得以这种方式进行进一步的努力。测试功能的多样性结合了测试之间的共同点,减少了分析时间和费用。该程序被命名为NeutroFun Screen,虽然有局限性,但它平衡了上述因素。此外,这项工作的目的不是一个明确的测试集,而是一个可以很容易地根据每个实验室的资源和需求进行调整的指南。
引言
中性粒细胞是人体血液中最丰富的先天免疫细胞,已知在感染和炎症中起主要作用,是到达组织损伤部位的第一反应者1.近年来,人们越来越认识到中性粒细胞在各种疾病和支持体内平衡方面发挥的关键作用2。中性粒细胞不仅自身具有严格调节的信号传导,而且还参与免疫系统其他成分的调节3,4,5。因此,在许多研究环境中,研究中性粒细胞及其许多不寻常的细胞功能,如趋化性、反向迁移6、吞噬作用7、呼吸爆发8 和中性粒细胞胞外陷阱 (NETs) 的释放7,在许多研究环境中势在必行,需要评估由所分析的特定条件引发的潜在中性粒细胞功能、形态或分子变化。
新鲜分离的中性粒细胞是终末分化的、短命的、高动态的和容易激活的9.然而,尚未实现不影响中性粒细胞反应的有效储存方法,因此很难进行必须不间断的多种检测。此外,当需要对中性粒细胞进行广泛和初步评估时,先前描述的功能分析10,11基于需要细胞术和/或荧光染色的测定可能不是可行的选择。
为了解决这些问题,该协议描述了一组可以在单个分离过程之后进行的测试,包括评估细胞活力,活性氧(ROS)产生,实时迁移和 酿酒酵母的吞噬作用,其结果可用于推理深入的后续研究。该程序名为NeutroFun Screen,旨在包含除脱颗粒以外的主要效应器活动,并且可以在平均4小时内完成,包括1小时的激活。此外,剩余的细胞可用于更详细的方法,如组学研究。这种方法的优点在于它在速度、全面性、成本和准确性之间取得平衡。
此外,有一种方法可以很容易地观察到NET的初步建议,没有具体的标记,但足以表明是否值得朝这个方向进一步努力。测试功能的多样性旨在结合测试之间的共同点,减少分析时间和费用。该方法的主要目标是提供关于速度、全面性、成本和准确性的平衡、功能分析,从而可以概述中性粒细胞的反应,使其成为研究新刺激对正常密度中性粒细胞影响的有用的第一步。
研究方案
所有实验都严格遵循巴西利亚大学机构审查委员会制定的伦理准则(流程13364819.0.0000.5558),并且样本通过代码进行识别,以确保捐赠者的匿名性。这些细胞是从年龄在 18-35 岁之间的正常健康男性供体中获得的,他们签署了知情同意书并符合以下资格标准:非吸烟者/电子烟使用者,没有慢性健康状况,并且在过去 14 天内没有炎症病史。
1. 采血
- 无菌地将 0.3 mL 的 5,000 IU/mL 肝素(见 材料表)放入无菌的 20 mL 注射器中以使其肝素化。
- 在穿刺部位上方约 4 处使用静脉止血带,并确定用于静脉穿刺的正中肘静脉或头静脉。
注意: 确保止血带的总时间不超过 1 分钟。 - 用 70% 酒精清洁穿刺部位并进行静脉穿刺。
- 收集血液后,轻轻将注射器倒置三到四次,以适当地混合血液和肝素。
2.中性粒细胞分离
注意:多形核白细胞 (PMN) 通过密度梯度离心分离,然后对剩余的红细胞 (RBC) 进行低渗裂解,如前所述11 有一些变化。该方法不是进行筛选测定的强制性方法,只要所选方法的存活率为 >97%,引发或激活 <3% 的 PMN,并产生足够的细胞用于所有测定、重复和条件,就可以替换该方法。在无菌条件下执行这些步骤并使用无内毒素溶液是强制性的,以避免细胞活化。
- 在 50 mL 锥形管中稀释 12 mL 60% 和 70% 分离培养基(市售;参见 材料表)。
- 使用5 mL移液管,在60%稀释液中一次加入4 mL,从下到上制备梯度。轻轻地执行此操作以防止混合接口。
- 小心地将 12 mL 肝素化血液涂在密度梯度的顶部。在室温下以200× g 离心15分钟。
注意:从这一步开始,直到PMN激活,所有使用的试剂和试管都必须保存在装满冰的冷却器中。 - 丢弃血浆/单核细胞层,然后轻轻地将红细胞沉淀上方的层转移到两个 15 mL 锥形管中,每个锥形管中约 7.5 mL。用Hank平衡盐溶液(HBSS;见 材料表)弥补管体积。
- 在19°C下以300× g 离心5分钟。
- 用HBSS洗涤细胞沉淀。
- 倒入试管弃去上清液,轻轻将沉淀重悬于7mL HBSS中。
- 在19°C下以300× g 离心5分钟以除去所有分离介质。
- 对剩余的红细胞进行低渗裂解。
- 弃去上清液,将沉淀混合在单个管中。
- 将 RBC/PMN 沉淀重悬于 3 mL 无菌 H2O 中,并在 25 秒内加入 3 mL HBSS (2x) 以恢复渗透压。然后,在19°C下以300× g 离心5分钟。
- 重复步骤 2.8.1 和 2.8.2 以获得白色、无红细胞的沉淀。
注意:必须尽快去除上清液,以尽量减少中性粒细胞与红细胞分解产物的接触。或者,可以通过轻轻重悬残留的红细胞层并去除所有上清液来代替第二次低渗裂解,因为剩余的红细胞将沉积在 PMN 沉淀上方。
- 通过倒入试管弃去上清液,轻轻地将PMN重悬于剩余的缓冲液中,并将它们转移到冰冷的微管中。
注意:确保在用微量移液管转移重悬细胞时注释体积。 - 将 3 x 1 μL 细胞悬液转移到干净的载玻片(三个孔,每个孔 1 μL)中,并用快速全景染色(参见 材料表)进行形态和纯度评估12。
- 要用快速全景染色,将载玻片浸入全景固定剂 n° 1 中 5 次,在曙红 n°2 中浸泡 6 次,在苏木精 n°3 中浸泡两次,每次浸泡持续 1 秒。
- 用蒸馏水轻轻清洗载玻片。
- 沥干并风干。
- 在显微镜下观察并计数每个孔中的300个随机细胞,从而将中性粒细胞与其他粒细胞区分开来。
- 将 1 μL 细胞悬液转移到 49 μL 0.2% 台盼蓝染料13 中,并使用 Neubauer 室对细胞进行计数,区分死细胞和活细胞。
- 使用补充有钙和镁的 50% 自体血浆和 50% HBSS 的溶液将细胞浓度调节至 6,667 个细胞/μL。将 6,667 个细胞/μL 悬浮液均匀地分配到与待测试条件相对应的微管中,包括阴性对照。
注意:可以使用与模式生物中循环中性粒细胞相似的任何细胞浓度,但在所有实验中使用相同的细胞浓度以提高可重复性很重要。
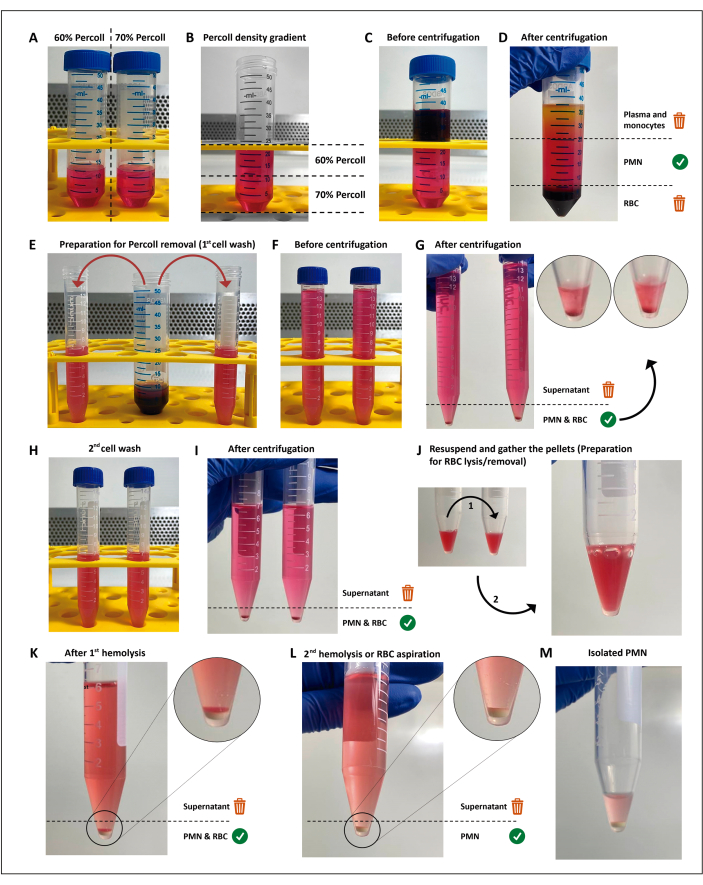
图1:中性粒细胞分离方案。将两种浓度的分离介质 (percoll) (A) 堆积 (B),然后将血液分层在分离梯度 (C) 的顶部。离心后,PMN 位于中心层 (D),该中心层分为两个 15 mL 管 (E)。将细胞悬液在HBSS中洗涤两次并离心(G-I)以除去培养基,然后将细胞重悬,并将残留的红细胞提交两轮低渗裂解(J-M)。请点击这里查看此图的较大版本.
3.中性粒细胞活化的准备
- 在 1.5 mL 微管中,为每种条件制备活化系统,使最终细胞浓度为 6,600 个细胞/μL。例如,为了测试 100 nM fMLP(N-甲酰基-甲硫酰基-亮氨酰-苯丙氨酸;参见 材料表)的作用,将 5 μL 的 10 μM fMLP 加入 495 μL 的 6,667 细胞/μL 悬浮液中。对于阴性(未刺激)对照,添加含有 Ca2+ 和 Mg2+ 的 HBSS。
注:为了证明这种方法,使用了以下刺激的最终浓度:100 nM fMLP、16 μM fallaxin、一种天然存在的抗菌肽14 和 100 nM PMA(佛波醇 12-肉豆蔻酸酯 13-乙酸酯)(参见 材料表)。 - 在37°C下孵育,不旋转。
注意:所有用于功能测定的等分试样均取自该细胞悬液,以下称为活化系统。
4. 硝基四唑蓝氯化物(NBT)测定法,用于评估ROS的产生
- NBT工作溶液的制备:对于每种实验条件,使用以下步骤制备6mM的NBT(见 材料表)工作溶液:
- 将0.0005gNBT溶于10μL二甲基亚砜(DMSO)中,涡旋至少15分钟。
- 加入 90 μL HBSS Ca2+Mg2+ 并涡旋至 2 分钟。
注意: 所有涉及 NBT 的步骤都必须在黑暗中执行。
- 执行 NBT 玻片测试。
- 细胞活化 20 分钟后,轻轻混合细胞悬液,小心地将 2 μL PMN 转移到干净的载玻片中。在37°C的加湿室中孵育20分钟。
注意:不要将细胞悬液过多地铺在载玻片上;否则,它可能会在孵化前变干。 - 在细胞上加入 1 μL NBT 工作溶液,并在避光下进一步孵育 20 分钟。
- 用热空气干燥载玻片,并在每个孔中滴一滴甲醇固定1分钟。用0.03%番红染色(见 材料表)1分钟。
- 用蒸馏水轻轻清洗载玻片。
- 让载玻片风干并在显微镜下观察。
- 在每个孔中计数100个随机细胞,区分有和没有甲臜沉积物的中性粒细胞。
- 细胞活化 20 分钟后,轻轻混合细胞悬液,小心地将 2 μL PMN 转移到干净的载玻片中。在37°C的加湿室中孵育20分钟。
- 进行NBT分光光度法测定。
- 细胞活化 40 分钟后,轻轻混合细胞悬液,并将 90 μL PMN 从活化系统转移到干净的微管中。然后,小心地加入 20 μL 的 6 mM NBT 溶液。在37°C下在黑暗中孵育20分钟。
- 加入 100 μL 10% 十二烷基硫酸钠 (SDS;见 材料表) 并涡旋。
- 使用尖端超声仪以 60% 的振幅进行超声处理,五个周期,每个周期 15 秒,间隔 15 秒。以12,000× g 离心5分钟。
- 将 60 μL 上清液转移到透明底 96 孔板中,并在 570 nm 处测量甲瓒产物的吸光度。
5. 吞噬作用测定
- 为每种情况制备 33,000 个酵母/μL 的悬浮液,如下所述:
- 将约0.75mg干酵母 (酿酒酵母;参见 材料表)加入200μLHBSS Ca2 + Mg中 ,并在100°C下以500rpm孵育至少15分钟。
- 通过涡旋将混合物匀浆,并将 5 μL 酵母悬浮液转移到 45 μL 0.2% 台盼蓝染料中。使用Neubauer室对酵母进行计数。
- 使用HBSS Ca2 + Mg2+将初始悬浮液的浓度调节至33,000个酵母细胞/ μL。将悬浮液放在冰上直至使用。
- 细胞活化 20 分钟后,轻轻混合细胞悬液,并将 5 μL 活化系统转移到新的无菌微管中的 5 μL 33,000 酵母/μL 酿酒酵母 悬浮液中。
注意:中性粒细胞与酵母的比例为 1:5(PMN:酵母)。 - 立即将 6 μL PMN/酵母悬浮液转移到干净载玻片的三个孔中(每个孔 2 μL),并将载玻片在加湿室中孵育 40 分钟。
注意:不要将细胞悬液过多地铺在载玻片上;否则,它可能会在孵化前变干。 - 如上述步骤 2.9 所述,在热空气中干燥载玻片并用快速全景染色。
注:快速全景染色的第三步对于载玻片的显微镜分析至关重要。在此步骤中对载玻片染色 ≥3 秒可能使其不适合分析,因为很难区分酵母菌和中性粒细胞核叶。 - 在显微镜下观察载玻片,计算每个孔的100个随机中性粒细胞,并区分吞噬作用阳性和阴性的PMN。
注意:PMN 细胞膜内或直接接触的至少一个酵母颗粒表明 PMN 对吞噬作用呈阳性。如果对酵母/中性粒细胞比率感兴趣,也要计算吞噬的酵母颗粒的数量。
6. 实时PMN趋化性测定
注:迁移测定的执行方式与前15条所述的方案类似,具有以下调整:
- 通过向基于阻抗的实时细胞分析仪 (RTCA) 板的下腔室中加入 160 μL 化学引诱剂(例如 fMLP、IL-8、C5 或 LTB4;参见 材料表)来制备趋化梯度。对于阴性对照和空白,加入 160 μL HBSS Ca2+Mg2+。
- 连接上腔室并加入 25 μL HBSS Ca2+Mg2+。在室温下孵育至少1小时以形成趋化梯度。
- 细胞活化 60 分钟后,轻轻混合细胞悬液,并将 60 μL 细胞悬液放入上腔室。向空白中加入 60 μL HBSS Ca2+Mg2+ 。
- 放置RTCA板并对RTCA软件进行编程,以每60秒测量一次细胞指数(CI),持续2小时。
注意: 如前所述,RTCA 板可以清洗以重复使用16.总之,用磷酸盐盐水(PBS)清洗RTCA室和电极三次,然后用I型超纯水清洗两次。用0.25%胰蛋白酶0.53mM乙二胺四乙酸(EDTA)孵育下腔室和上腔室40分钟。用超纯水清洗三次。
7. 神经内分泌瘤提示性检测
- 细胞活化 10 分钟后,轻轻混合细胞悬液,并从每个被评估的活化系统中转移 4 μL PMN,分成两个干净载玻片的孔。在37°C的加湿室中孵育30分钟。
- 向其中一个孔中加入1μLDNAse I,并在37°C(在湿室中)孵育20分钟。
- 干燥载玻片并用快速全景染色,如先前在“中性粒细胞分离”部分的步骤2.9中所述。
- 在显微镜下评估载玻片。
注意:寻找任何NET释放的迹象,其特征是存在网状结构。一旦确定,确认DNAse I处理是否能够去除这些结构。该测定提示 NET 形成,因为需要额外的测试来确认它们的存在。
结果
本研究中使用的基于密度的分离方法(图1)符合所提出的实验标准。从该方法获得的中性粒细胞参数包括活力≥98%、纯度≥94%和细胞产量≥1.5 x 107,筛选试验未检测到活化。分离 PMN 的两个相关步骤是抗凝和去除红细胞。在密度梯度上分层之前,将抗凝血管或注射器保持在轻轻摇晃状态,并选择红细胞去除方法来防止活化和污染,可能会影响实验产量和可重复性。
讨论
中性粒细胞是高度动态和反应性的细胞,寿命短,尚不能冷冻保存19,这使得对其生物学的研究具有挑战性。因此,必须遵循谨慎的步骤来获得可存活、富集和静息的中性粒细胞11,20。本研究采用了基于密度的隔离技术,强调温和和最小的操作,以及在活化步骤之前使用低温。此外,血液处理必须在静脉穿刺后 30 分钟内进行,并在室温...
披露声明
作者声明没有利益冲突。
致谢
作者感谢以下资助机构:FAPDF、CNPq、CAPES、UnB、FINEP 和 FINATEC。
材料
| Name | Company | Catalog Number | Comments |
| CIM-Plate 16 | Agilent | 5665825001 | |
| CLARIOstar Plate Reader | BMG LABTECH | US Patent Number 9,733,124 Product details: MARS Data Analysis Software | |
| Dimethyl sulfoxide | Dinâmica | 1582 | |
| DNAse I | Sigma - Aldrich | DN 25 | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate | Sigma - Aldrich | E5134 | |
| Fast panoptic stain | Laborclin | 620529 | |
| Glass slide | Exacta | 7102 | |
| Hank’s Balanced Salt Solution with calcium, with magnesium, without phenol red. | Sigma - Aldrich | 55037C | |
| Hank’s Balanced Salt Solution without calcium chloride, magnesium sulfate and sodium bicarbonate. | Sigma - Aldrich | H4641 | |
| Heparin | Blau | 7896014655229 | |
| Laminar flow cabinet | Veco | VLFS-12 | |
| Microscope | Zeiss | 415501-0101-002 | Product details: Primostar 1 |
| Mixing Block | BIOER | MB-102 | |
| Neubauer improved bright-lined | New Optik | 1110000 | |
| N-formyl-methionyl-leucyl-phenylalanine | Sigma - Aldrich | F3506 | |
| Nitroblue tetrazolium | Neon | CAS 298-83-9 | |
| Percoll | Cytiva | 17089101 | separation media |
| Phorbol 12-myristate 13-acetate | Sigma - Aldrich | P8139 | |
| Phosphate buffered saline tablet | Sigma - Aldrich | P4417 | |
| ROTOFIX 32 A | Hettich | 1206 | |
| Saccharomyces cerevisiae | Fleischmann | ||
| Safranin | Sigma - Aldrich | 50240 | |
| Sodium dodecyl sulfate | Cytiva | 17-1313-01 | |
| Sonicator | Qsonica | Q125 | |
| Trypan blue solution | Vetec | C.I. 23850 | |
| Vortex Genie 2 | Scientific Industries, Inc. | 0K-0500-902 | |
| xCELLigence Real-Time Cell Analysis (RTCA) DP (dual purpose) | Agilent | 380601050 | Product details: RTCA system composed of detection hardware, cell plates and software |
参考文献
- Nauseef, W. M., Borregaard, N. Neutrophils at work. Nature Immunology. 15 (7), 602-611 (2014).
- Groeneweg, L., Hidalgo, A. Emerging roles of infiltrating granulocytes and monocytes in homeostasis. Cellular and Molecular Life Sciences. 77 (19), 3823-3830 (2020).
- Rosales, C., Lowell, C. A., Schnoor, M., Uribe-Querol, E. Neutrophils: their role in innate and adaptive immunity 2017. Journal of Immunology Research. 2017, 9748345 (2017).
- Castro, M., et al. Proteome analysis of resting human neutrophils. Protein & Peptide Letters. 13 (5), 481-487 (2006).
- Li, Y., et al. The regulatory roles of neutrophils in adaptive immunity. Cell Communication and Signaling. 17, 147 (2019).
- de Oliveira, S., Rosowski, E. E., Huttenlocher, A. Neutrophil migration in infection and wound repair: going forward in reverse. Nature Reviews Immunology. 16 (6), 378-391 (2016).
- Burn, G. L., Foti, A., Marsman, G., Patel, D. F., Zychlinsky, A. The neutrophil. Immunity. 54 (7), 1377-1391 (2021).
- El-Benna, J., et al. Priming of the neutrophil respiratory burst: role in host defense and inflammation. Immunological Reviews. 273 (1), 180-193 (2016).
- Castro, M. S., Cilli, E. M., Fontes, W. Combinatorial synthesis and directed evolution applied to the production of alpha-helix forming antimicrobial peptides analogues. Current Protein & Peptide Science. 7 (6), 473-478 (2006).
- Mihaila, A. C., et al. Transcriptional profiling and functional analysis of N1/N2 neutrophils reveal an immunomodulatory effect of S100A9-blockade on the pro-inflammatory N1 subpopulation. Frontiers in Immunology. 12, 708770 (2021).
- Kuhns, D. B., Priel, D. A. L., Chu, J., Zarember, K. A. Isolation and functional analysis of human neutrophils. Current Protocols in Immunology. 111 (1), 7-23 (2015).
- Paulíková, E., Kociková, A., Sabol, M. Modification of a panoptic method of staining isolated cells. Bratislavske Lekarske Listy. 94 (12), 638-640 (1993).
- Strober, W. Trypan blue exclusion test of cell viability. Current Protocols in Immunology. 111 (1), 1-3 (2015).
- Libério, M. S., et al. Anti-proliferative and cytotoxic activity of pentadactylin isolated from Leptodactylus labyrinthicus on melanoma cells. Amino Acids. 40 (1), 51-59 (2011).
- Cano, P. M., Vargas, A., Lavoie, J. P. A real-time assay for neutrophil chemotaxis. BioTechniques. 60 (5), 245-251 (2016).
- Stefanowicz-Hajduk, J., Adamska, A., Bartoszewski, R., Ochocka, J. R. Reuse of E-plate cell sensor arrays in the xCELLigence Real-Time Cell Analyzer. BioTechniques. 61 (3), 117-122 (2016).
- Björkstén, B., Nyström, K., Lindqvist, B. The nitroblue tetrazolium (NBT) test in endemic benign (epidemic) nephropathy. Acta Medica Scandinavica. 199 (1-6), 147-150 (1976).
- Aquino, E., et al. Proteomic analysis of neutrophil priming by PAF. Protein & Peptide Letters. 23 (2), 142-151 (2016).
- Blanter, M., Gouwy, M., Struyf, S. Studying neutrophil function in vitro: cell models and environmental factors. Journal of Inflammation Research. 14, 141-162 (2021).
- Hsu, A. Y., Peng, Z., Luo, H., Loison, F. Isolation of human neutrophils from whole blood and buffy coats. Journal of Visualized Experiments. (175), e62837 (2021).
- Moghadam, Z. M., Henneke, P., Kolter, J. From flies to men: ROS and the NADPH oxidase in phagocytes. Frontiers in Cell and Developmental Biology. 9, 628991 (2021).
- Pattan, S. S., Bhat, K. G., Pattar, G. D., Kuntagi, M. Comparison of three different techniques for isolation of neutrophils from blood and their utility in performing nitroblue tetrazolium test. International Journal of Basic and Applied Physiology. 8 (1), 41 (2019).
- Gooty, J. R., Shashirekha, A., Guntakala, V. R., Palaparthi, R. Estimation of phagocytic activity of polymorphonuclear leukocytes in chronic and aggressive periodontitis patients with nitroblue tetrazolium test. Journal of Indian Society of Periodontology. 23 (4), 316 (2019).
- Langer, S., et al. Clinical and laboratory profiles of 17 cases of chronic granulomatous disease in north India. Indian Journal of Hematology and Blood Transfusion. 37 (1), 45-51 (2021).
- Oualha, R., et al. Infection of human neutrophils with Leishmania infantum or Leishmania major strains triggers activation and differential cytokines release. Frontiers in Cellular and Infection Microbiology. 9, 153 (2019).
- Zilinskas, J., Zekonis, J., Zekonis, G., Valantiejiene, A., Periokaite, R. The reduction of nitroblue tetrazolium by total blood in periodontitis patients and the aged. Stomatologijal. 9 (4), 105-108 (2007).
- Benov, L. Improved formazan dissolution for bacterial MTT assay. Microbiology Spectrum. 9 (3), e01637 (2021).
- Chen, Y., Junger, W. G. Measurement of oxidative burst in neutrophils. Methods in Molecular Biology. 844, 115-124 (2012).
- Richardson, M. P., Ayliffe, M. J., Helbert, M., Davies, E. G. A simple flow cytometry assay using dihydrorhodamine for the measurement of the neutrophil respiratory burst in whole blood: comparison with the quantitative nitrobluetetrazolium test. Journal of Immunological Methods. 219 (1-2), 187-193 (1998).
- Jancinová, V., et al. The combined luminol/isoluminol chemiluminescence method for differentiating between extracellular and intracellular oxidant production by neutrophils. Redox Report. 11 (3), 110-116 (2006).
- Nosál, R., et al. Pharmacological intervention with oxidative burst in human neutrophils. Interdisciplinary Toxicology. 10 (2), 56-60 (2017).
- Mol, S., et al. Efficient neutrophil activation requires two simultaneous activating stimuli. International Journal of Molecular Sciences. 22 (18), 10106 (2021).
- Schneider, L., et al. Flow cytometry evaluation of CD14/CD16 monocyte subpopulations in systemic sclerosis patients: a cross sectional controlled study. Advances in Rheumatology. 61 (1), 27 (2021).
- Akin, E., Pelen, N. N., Tiryaki, I. U., Yalcin, F. Parameter identification for gompertz and logistic dynamic equations. PLoS One. 15 (4), e0230582 (2020).
- Guy, J. B., et al. Evaluation of the cell invasion and migration process: A comparison of the video microscope-based scratch wound assay and the boyden chamber assay. Journal of Visualized Experiments. (129), e56337 (2017).
- Brinkmann, V., et al. Neutrophil extracellular traps kill bacteria. Science. 303 (5663), 1532-1535 (2004).
- de Bont, C. M., Koopman, W. J. H., Boelens, W. C., Pruijn, G. J. M. Stimulus-dependent chromatin dynamics, citrullination, calcium signalling and ROS production during NET formation. Biochimica et Biophysica Acta. Molecular Cell Research. 1865, 1621-1629 (2018).
- Masuda, S., et al. Measurement of NET formation in vitro and in vivo by flow cytometry. Cytometry Part A. 91 (8), 822-829 (2017).
- Zharkova, O., et al. A flow cytometry-based assay for high-throughput detection and quantification of neutrophil extracellular traps in mixed cell populations. Cytometry Part A. 95 (3), 268-278 (2019).
- Hosseinnejad, A., et al. DNase I functional microgels for neutrophil extracellular trap disruption. Biomaterials Science. 10 (1), 85-99 (2022).
- Chrysanthopoulou, A., et al. Neutrophil extracellular traps promote differentiation and function of fibroblasts. The Journal of Pathology. 233 (3), 294-307 (2014).
- Tong, M., Abrahams, V. M. Visualization and quantification of neutrophil extracellular traps. Methods in Molecular Biology. 2255, 87-95 (2021).
- Santana, C. J. C., et al. Biological properties of a novel multifunctional host defense peptide from the skin secretion of the chaco tree frog, boana raniceps. Biomolecules. 10 (5), 790 (2020).
- Murphy, M. P., et al. Guidelines for measuring reactive oxygen species and oxidative damage in cells and in vivo. Nature Metabolism. 4 (6), 651-662 (2022).
- Boero, E., et al. Use of flow cytometry to evaluate phagocytosis of staphylococcus aureus by human neutrophils. Frontiers in Immunology. 12, 635825 (2021).
- Karsten, C. B., et al. A versatile high-throughput assay to characterize antibody-mediated neutrophil phagocytosis. Journal of Immunological Methods. 471, 46-56 (2019).
- Smirnov, A., Solga, M. D., Lannigan, J., Criss, A. K. Using imaging flow cytometry to quantify neutrophil phagocytosis. Methods in Molecular Biology. 2087, 127-140 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。