全安装荧光 原 位杂交研究 按 蚊精子发生
摘要
鉴于其简单的解剖结构, 按蚊 睾丸为研究精子发生提供了良好的细胞学模型。该方案描述了全安装荧光 原位 杂交,一种用于研究该生物过程的技术,以及携带参与精子生产的基因突变的转基因菌株的表型。
摘要
精子发生是一个复杂的生物过程,在此过程中,二倍体细胞经历连续的有丝分裂和减数分裂,然后发生巨大的结构变化以形成单倍体精子。除了生物学方面,研究精子发生对于理解和开发基因驱动和合成性别比扭曲器等遗传技术至关重要,通过分别改变孟德尔遗传和精子性别比,可用于控制害虫种群。这些技术已被证明在实验室环境中非常有前途,并有可能用于控制按蚊的野生种群, 按蚊 是疟疾的媒介。 由于睾丸解剖结构的简单性和医学重要性, 冈比亚按蚊是撒哈拉以南非洲的主要疟疾病媒,是研究精子发生的良好细胞学模型。该协议描述了如何使用全安装荧光 原位 杂交(WFISH)来研究细胞核结构的显着变化,使用特异性染色X和Y染色体的荧光探针的精子发生。FISH通常需要破坏生殖器官以暴露有丝分裂或减数分裂染色体,并允许用荧光探针对特定的基因组区域进行染色。WFISH能够保留睾丸的天然细胞学结构,同时通过靶向重复DNA序列的荧光探针进行良好的信号检测。这使研究人员能够沿着器官结构跟踪经历减数分裂的细胞的染色体行为的变化,其中可以清楚地区分该过程的每个阶段。该技术对于研究染色体减数分裂配对和研究与合成性别比例扭曲、杂交雄性不育和参与精子发生的基因敲除相关的细胞学表型特别有用。
引言
疟疾给全球人口的健康和福祉带来了巨大负担。2021 年,世界卫生组织 (WHO) 估计疟疾造成 619,000 人死亡,其中 96% 发生在撒哈拉以南非洲1。该病由按蚊属的蚊子传播,在撒哈拉以南非洲,三个物种,即冈比亚按蚊(An. gambiae)、按蚊(An, coluzzi)和阿拉伯按蚊 (An. Arabiensis)在疟疾传播中起着不成比例的巨大作用,占全球疟疾病例的95%。依靠杀虫剂和抗疟药物等传统方法的控制计划挽救了数百万人的生命;然而,近年来,对这些控制方法的抵制不断增加,对其疗效提出了挑战1,2。此外,COVID-19大流行施加的限制影响了关键疟疾控制干预措施的可用性,根据世卫组织《2022年世界疟疾报告》,这增加了疟疾发病率1。在过去的二十年中,在实验室环境中开发了针对按蚊3,4,5,6,7,8,9,10的新型遗传控制方法。在这些策略中,基于基因驱动系统(GDS)和合成性别比扭曲器(SDs)的策略似乎很有前途。GDS依赖于以非常高的频率传播影响雌性生育能力或损害蚊子寄生虫生命周期的基因修饰的可能性5,11,12。相反,SD 通过使蚊子后代的性别比例偏向雄性来发挥作用,随着时间的推移,由于缺乏雌性,这导致目标种群崩溃 4,6,13。这些遗传系统的主要组成部分主要作用于蚊子的生殖器官,配子、卵子和精子是在减数分裂后产生的 14.
在该协议中,细胞遗传学技术的进步用于探索冈比亚安蚊中的精子发生,重点是染色体的原位行为。 蚊子睾丸的结构及其内部发生的生物学过程之前已使用多种细胞学方法进行研究,例如免疫荧光、荧光报告基因转基因以及 DNA 和 RNA 荧光原位杂交 (FISH)15,16,17,18,19,20;器官呈纺锤形,其中下极连接到连接到男性附属腺体的顺应导管上。在上极,生殖干细胞生态位增殖并分化为嵌入由体细胞形成的精囊内的精原细胞。经过多轮有丝分裂后,精原细胞分化为精母细胞,进入减数分裂。在前期,常染色体和性染色体与其同源物配对,并发生交叉。减数分裂后,产生圆形单倍体精子细胞并进入精子发生,这一过程导致成熟单倍体精子的形成,其中细胞质已被去除,核染色质凝聚,鞭毛出现在细胞核的基部21,22(图1和图2)。
一般来说,精子发生大约在蛹中期开始,在蛹后期可以在精子库中检测到成熟的精子23。精囊的成熟过程在成年后继续进行23,24,25。在按蚊睾丸中,通过观察每个精囊中细胞的核形态,可以很容易地识别精子发生的每个步骤(图2)。本协议中描述的全安装荧光原位杂交(WFISH)允许研究人员特异性标记染色体区域并在精子发生过程中对其进行跟踪,同时保留器官的天然结构和细胞核位置;与标准DNA FISH方案相比,这代表了一个优势,在该方案中,器官通常被压扁,导致组织损伤19。在目前的方案中,荧光探针用于染色性染色体上的重复序列,从而跟踪它们在精子发生过程中的行为,从二倍体分裂细胞到成熟的单倍体精子。WFISH对于研究性染色体减数分裂配对和研究与合成性别比扭曲、杂交雄性不育和参与精子发生的基因敲除相关的细胞学表型特别有用4,19,26,27。
鉴于按蚊作为疟疾病媒的作用,它们成为越来越多的遗传病媒控制策略的目标,这些策略通常作用于这些生物体的生殖器官。已经产生了几种蚊子突变体和细胞学表型,需要研究新的细胞学技术26,27,28,29。本研究中描述的方法阐明了对精子发生的理解,以及有可能控制疟疾传播蚊子的遗传策略背后的细胞学机制。
研究方案
1. DNA探针标记
注:以下是生成荧光DNA探针的技术步骤,这些探针专门标记 冈比亚蚊 子的性染色体。
- 使用PCR进行探针标记
- 使用市售的基因组DNA提取试剂盒从蛹或成年雄性中提取基因组DNA,以标记X或Y染色体(参见 材料表)。
- 制备PCR反应混合物:200ng基因组DNA,0.05mM未标记核苷酸(dATP,dCTP,dGTP),0.015mMdTTP和1uL荧光标记dUTP(Cy3,Cy5或其他荧光染料),50pmol正向和反向引物(表1),5μL10x PCR缓冲液和10U Taq DNA聚合酶(参见 材料表)。
- 为了标记18S rDNA和卫星AgY53B(表1),使用以下PCR参数进行PCR反应:一个95°C循环10分钟;95 °C 30 s、52 °C 30 s、72 °C 45 s 的 35 次循环;一个72°C循环5分钟;并在4°C下最终保持。
注:为了使用PCR标记方法获得良好的探针浓度(~1μg,5μL中),这对于WFISH的成功至关重要,PCR反应应该是高效的。因此,在标记探针之前,强烈建议测试选择用于扩增的引物的功效。此外,在PCR反应中加入阳性对照(不含荧光dUTP)将有助于验证标记反应的功效。 - 将探头在-20°C的黑暗处存放。
- 获得 3' 末端荧光寡核苷酸探针
- 通过将Cy3或Cy5荧光染料(或任何其他荧光染料)添加到核苷酸序列的3'端,获得作为修饰寡核苷酸的市售荧光寡核苷酸探针(参见 材料表)。参见 表1 中的引物/寡核苷酸,了解用于标记Y连接卫星AgY477-AgY53B连接区域和来自Contig_240的X连接卫星的参考序列。
注意:没有与 3' 末端标记寡核苷酸浓度相关的技术障碍,因为用户通常可以在购买前选择。我们建议在杂交缓冲液中稀释~800 ng寡核苷酸探针溶液,以便使用寡核苷酸探针进行高效标记。Liang 和 Sharakhov19 先前已将 X 和 Y 特异性寡核苷酸探针用于 WFISH,参考序列见 表 1。
- 通过将Cy3或Cy5荧光染料(或任何其他荧光染料)添加到核苷酸序列的3'端,获得作为修饰寡核苷酸的市售荧光寡核苷酸探针(参见 材料表)。参见 表1 中的引物/寡核苷酸,了解用于标记Y连接卫星AgY477-AgY53B连接区域和来自Contig_240的X连接卫星的参考序列。
2.杂交溶液的制备
注意:步骤1中生成的荧光探针必须掺入与目标序列杂交的化学溶液中。
- 荧光 原位 杂交前的探针沉淀
- 向 1.5 mL 试管中加入 5 μL 标记的 DNA 探针(如果通过 PCR 标记方法获得)或 2.2 μL 来自步骤 1 的 3' 修饰寡核苷酸探针(~800 ng 探针)和 5 μL 鲑鱼精子 DNA(参见 材料表)。将特异性探针组合在同一管中,并将它们用作以下步骤中的独特解决方案。
- 通过加入0.1体积的3M乙酸钠和2体积的100%乙醇沉淀DNA探针。在-20°C下保持至少2.5小时(在-20°C下增加孵育时间将增加最终产量)。在这个阶段,探针也可以在离心前存放过夜。
- 在4°C下以17,000× g 离心20分钟,除去乙醇,并在室温下在黑暗中风干沉淀~20分钟。
- 杂交解决方案
- 在进行睾丸解剖(步骤3)之前,通过在1.5管中混合以下试剂来制备杂交缓冲液:500μL甲酰胺,0.2g硫酸葡聚糖,100μL20x盐水柠檬酸钠(SSC)和200μL无菌H20(参见 材料表)。涡旋杂交溶液1分钟,并使硫酸葡聚糖在37°C下溶解30分钟。
- 将步骤2.1.3中的沉淀溶解在20-30μL杂交缓冲液中(涡旋约1分钟,快速旋转,并将试管在37°C下在黑暗中储存)以获得杂交溶液。
3.睾丸解剖和固定
- 在室温(RT)下,在无菌1x磷酸盐缓冲盐水(PBS)溶液中解剖来自蛹或1日龄成人的至少 ~20个睾丸,并将它们转移到含有新鲜滴1x PBS溶液的干净显微镜载玻片上。
- 使用P1,000宽孔过滤尖端或解剖针的尖端从1x PBS滴转移到含有3.7%甲醛的1x PBS和0.1%吐温-20(PBST)的胚胎培养皿中,并在室温下孵育10分钟。
- 在室温下在1x PBST中洗涤睾丸5分钟,将睾丸在0.1mg / mL RNAse A(参见 材料表)中孵育,在无菌1x PBS中稀释,在37°C下孵育30分钟。
- 取出RNAse溶液,加入渗透溶液(1%Triton / 0.1M HCl在1x PBST中),并在室温下孵育10分钟。
注:蛋白酶K可用作10μg/ mL的渗透剂,在1x PBST中终浓度为10μg/ mL,以增加睾丸的通透性。 - 在室温下在1x PBST中洗涤睾丸两次,每次5分钟。
4. 杂交
注意:本节介绍 原位 杂交的最后步骤。
- 洗涤步骤(步骤3.5)后,将睾丸转移到1.5mL管中,其中含有含有先前制备的探针的20-30μL杂交溶液(步骤2.2.2)。使用移液器的尖端轻轻混合溶液。轻轻轻弹试管五次,然后继续下一步。
- 在75°C下孵育5分钟用于DNA变性。
- 在37°C下孵育过夜(如果可能,以低于100rpm摇摆)进行DNA-DNA杂交。
- 使用P1,000宽孔过滤尖端将睾丸转移回胚胎培养皿中,并在预热至50°C的2x SSC中洗涤5分钟。
注意:在杂交步骤之后,需要使用2x SSC进行最后的洗涤步骤;这在去除由器官组织内存在未杂交探针引起的任何背景信号方面起着重要作用。如果存在强背景信号,建议重复最后的洗涤步骤。 - 取出2x SSC,并使用含有4′,6-二脒基-2-苯基吲哚(DAPI)(参见 材料表)的市售封固剂将睾丸安装在磨砂载玻片上,用盖玻片密封剂密封,并在室温下在黑暗中孵育至少2小时。
- 进行共聚焦成像。整个睾丸可以使用40倍或63倍油浸物镜进行可视化。如果执行 z 堆栈,我们建议使用 1.25 μm 的 z 步长。
代表性结果
在这项工作中,WFISH用于研究 冈比亚安斯精子发生过程中的染色体行为。应用该方案的第一个关键步骤是获得解剖后显示低水平形态学改变的睾丸。成功进行睾丸解剖需要了解蚊子解剖学的基本知识,下面给出了该程序的一些指导。在 按蚊 中,成熟的睾丸位于蛹和成虫阶段的第六腹节21。 如图 1 所示, 输精管 将睾丸连接到位于腹部最后一节的男性副腺 (MAG)。MAG连接到一个独特的射精管,该射精管将精子和输送到交配器官和男性生殖器器官的外部21。根据蚊子的生命阶段,可以使用不同的方法解剖整个男性内部生殖器。在蛹期,通过观察第六节附近的腹部腹侧,可以使用立体显微镜在整个浅角质层中轻松识别睾丸(图1)。为了解剖睾丸,可以使用一对针将腹部下部(包括第六节)与身体其他部位隔离,并转移到干净的1x PBS滴中。在移除最后一节后,可以通过用解剖针轻轻施加压力将整个装置从腹部挤压出来。为了从成年男性身上解剖睾丸,第一步是在新鲜的1x PBS滴中分离整个腹部,然后拉出带有扣环的最后一段,这是雄配结构(图1)。此时,MAG的下部应该会出现,并且由于它们的黄色而易于识别。然后,可以在针头或镊子的帮助下在1x PBS滴中缓慢拉出整个男性装置,直到可以看到附着在 输精管 上的一对睾丸。在进行固定之前,重要的是通过在 输精管 下部附近切割睾丸与男性器官的其他部分隔离(图1)。
蛹或成年雄性的年龄是要考虑的重要因素,具体取决于所研究的精子发生阶段。在 冈比亚安 蛹中,精子发生始于蛹早期/中期,并贯穿个体的整个生命24.化蛹后3 h至10 h之间,减数分裂前期和减数分裂阶段在睾丸中更明显(减数分裂前期、减数分裂),精子细胞DNA相对未浓缩,尚未形成成熟精子。晚期蛹和1日龄成虫在减数分裂前期、减数分裂和减数分裂后阶段之间提供了良好的平衡(图2 和 图3)。在超过4天的成年人中,减数分裂前期和精子囊的代表性较少,睾丸主要被精子库中包含的成熟精子占据。
为了研究性染色体在精子发生的不同阶段的行为,对在蛹后期解剖的睾丸进行了WFISH,以确保整个过程的良好表现。为了跟踪这些染色体的行为,使用了专门位于X或Y染色体上的重复序列特异性荧光探针。荧光探针可以使用PCR生成,也可以作为3'末端标记的寡核苷酸在商业上获得。建议使用长度为 >40 bps 的寡核苷酸,以便从荧光寡核苷酸探针进行良好的信号检测。根据我们的经验,3'末端标记的寡核苷酸在信号检测方面优于PCR标记的探针。此外,靶序列的拷贝数是可能影响WFISH疗效的一个因素。如果标记不成功,建议在较长的片段上使用PCR标记方法或设计针对靶区域的几种寡核苷酸。
目前的方法基于使用渗透溶液(1% Triton/0.1 M HCl 在 1x PBST 中的溶液),允许良好的睾丸透化和探针渗透水平,从而实现成功的杂交反应。特异性性染色体重复序列的寡核苷酸探针可以基于 Hall 等人对重复元件的广泛表征进行设计20。此外,可以使用生物信息学平台(如RedKmer管道30)获得特定于X或Y连接重复元件的共识序列。需要注意的是,性染色体探针可以靶向重复元件,如卫星和逆转录转座子,并且它们可以与X或Y染色体具有不同水平的杂交,具体取决于所检查的物种20,31,32。如图 3 所示,探针的良好杂交水平和低背景允许在整个精子发生过程中可视化靶向染色体。标记性染色体的配对可以在减数分裂前期和减数分裂阶段看到。随后检测减数分裂产生的单倍体细胞核染色体中的 X 或 Y 染色体。随后,携带X或Y的精子细胞可以在整个精子发生过程中进行跟踪,其特征是不同程度的DNA凝聚,直到箭形成熟精子的最后一步。在本实验装置中,共聚焦Z-stacks用于在此过程中获取有关细胞3D空间组织的信息(视频1)。
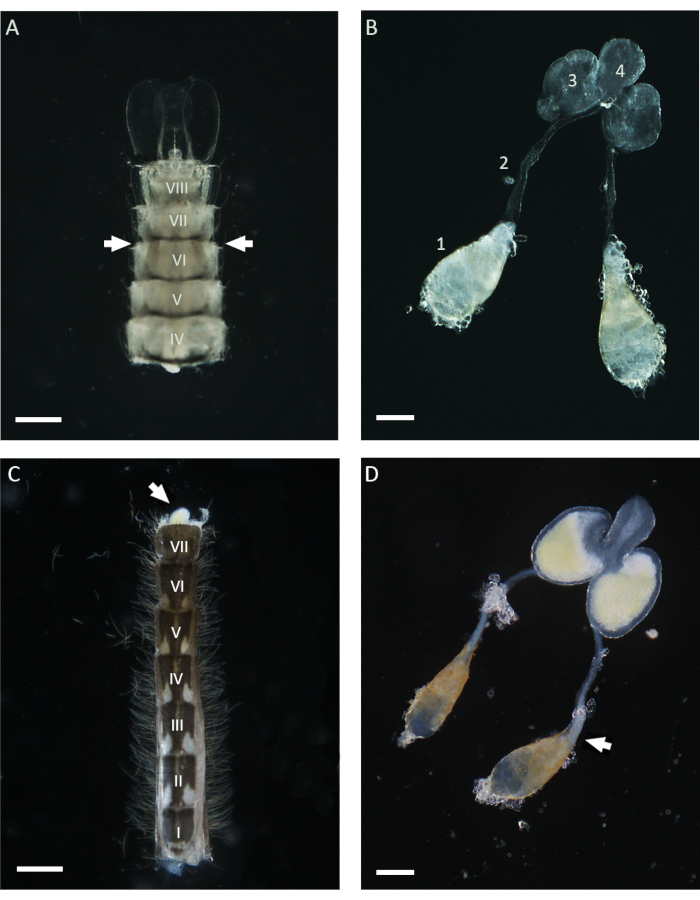
图1:从蛹和1日龄成年冈比亚按蚊雄性解剖的睾丸。 (A) 在蛹后期解剖的腹部,显示睾丸在第六腹节附近的位置。睾丸可以在整个角质层中识别,并在腹部两侧显示为褐色结构(带箭头)。(B) 在蛹期解剖睾丸,显示成熟睾丸 (1)、输精管 (2)、MAG (3) 和射精管 (4)。(C) 从一名 1 日龄成年男性身上解剖的腹部,该腹部在移除基扣段后。MAG可以通过施加轻微的压力(白色箭头)从腹部挤压。(D) 从一名 1 日龄的成年男性身上解剖的男性内生殖器。白色箭头表示成熟精子所占据的位置,精子在睾丸的基极处表现为白色聚集体。比例尺:(A,C)200μm;(B,D)100μm。从I到VIII的罗马数字表示腹部节段。请点击这里查看此图的较大版本.
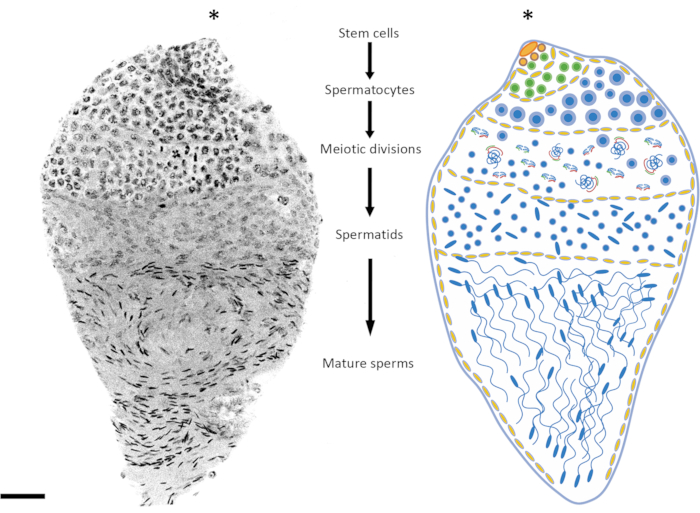
图2:冈比亚按蚊中精子发生的表现。左图显示了整个DAPI染色后的冈比亚蛹晚期睾丸。右边是示意图版本,以便更好地可视化。通过观察细胞核的形状和凝聚水平,相对容易地跟踪从二倍体细胞到单倍体精子的所有精子发生阶段。干细胞生态位位于器官的上极,从那里开始分化为精原细胞。有丝分裂后精原细胞数量增加(绿色细胞),精子囊大小增加(黄色细胞)。精原细胞在多轮有丝分裂后分化为精母细胞(蓝细胞)。精母细胞的特征在于细胞核比该过程其他阶段的细胞相对大,是将经历减数分裂的细胞。经历减数分裂的细胞可以通过观察不同减数分裂阶段染色体的存在来检测;即使在低倍率下也可以检测到交叉和中期染色体。减数分裂前期在早期蛹期解剖的睾丸中比例过高。在第一次和第二次减数分裂之后,产生精子细胞,通常可以发现位于睾丸中间。精子细胞的细胞核在形状上显示出一定程度的变化,从圆形到箭头状。精子细胞进入精子发生过程,在此期间细胞核开始凝结,其结构变为箭头状的点。当蚊子出现后性成熟时,含有成熟精子的精囊可以占据大部分睾丸体积,而牺牲处于不同发育阶段的精子囊。比例尺:20μm。星号(*)表示睾丸的顶端部分。请点击这里查看此图的较大版本.
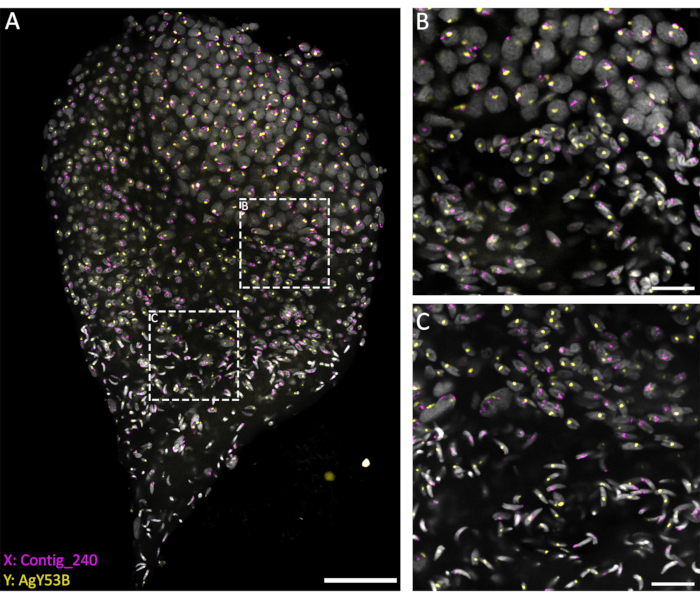
图3:从蛹后期解剖的冈比亚An.gambiae睾丸上的WFISH。 使用对 X (Contig_240) 和 Y(AgY53B 具有特异性的寡核苷酸探针)染色体特异性探针进行 WFISH。(A) WFISH允许跟踪从二倍体细胞到单倍体精子的精子发生过程中性染色体的行为。在这张图片中,可以欣赏到细胞核在精子发生过程中所经历的巨大变化。标记性染色体可以区分二倍体和单倍体细胞。在二倍体细胞中,来自性染色体的信号与相同的细胞核相连。在单倍体细胞(精子细胞和精子)中,由于减数分裂的减少分裂,性染色体的信号是无连接的。(乙,丙)(A)所示的睾丸的较高放大倍率(63倍)图像。它们是在沿 Z 轴的不同位置采集的。白色虚线框表示采集区域。(B)精母细胞和精子细胞之间的过渡阶段,显示单倍体细胞的形成以及性染色体信号分离成单独的细胞核。(C)单倍体精子细胞和成熟精子之间的过渡阶段。该阶段显示了核凝结水平的变化;成熟的精子比精子显示出更浓缩和细长的形状。比例尺:(A),30 μm;(B,C),10μm;灰色:DAPI。请点击这里查看此图的较大版本.
| 靶序列 | 引物序列和寡核苷酸探针一致性 | 参考 |
| Contig_240 (X) | 5'-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3'-[荧光染料] | 19 |
| 银钎53B (Y) | 5'AGAAGAATAGAATCAGAATAGTCGG TTTCTTCATCCTGAAAGCC-3'-[荧光染料] | 本研究 |
| 银477- 银钎53B 结 区域 (Y) | 5'-TTCTAAGTTTCTAGGCTTTAAGGAT GAAGAAACCGACTATTC-3'-[荧光染料] | 19 |
| 18S rDNA (X) | 女:AACTGTGGAAAAGCCAGAGC R:TCCACTTGATCCTTGCAAAA | 19 |
| 银钎53B (Y) | 传真: CCTTTAAACACATGCTCAAATT R:GTTTCTTCATCCTTAAAGCCTAG | 19 |
表 1: 冈比亚 An. gambiae 中 X 或 Y 染色体特异性寡核苷酸探针列表。
视频1:在WFISH上对从蛹后期解剖的 冈比亚An.gambiae 睾丸进行3D堆栈。 为了获得精子发生过程的 3D 表示,可以在显示少量结构改变的睾丸上进行共聚焦 3D 堆栈。在这项研究中,在63倍或40倍油透镜下,在两个光学截片之间以1.25μm的间隔进行堆叠,以免丢失有关细胞3D空间组织的信息。灰色:DAPI,黄色:Contig_240(X),品红色:AgY53B(Y)。 请按此下载此影片。
讨论
通常,FISH方案要求挤压感兴趣的器官以允许染色体染色。这导致有关该器官内细胞空间排列的信息丢失33。该协议描述了如何在原位研究生物过程,例如精子发生,同时保持睾丸的完整天然结构及其内部细胞学组织。靶向不同DNA重复元件的探针,特别是在性染色体20中富集,可以同时用于揭示精子成熟的动力学。根据睾丸解剖的时间,WFISH提供了通过蚊子发育研究精子发生的不同阶段的机会。WFISH可用于研究特定现象,例如杂交不相容性,在按蚊中,这是由于减数分裂缺陷的存在,例如减数分裂前期失败和性染色体不分离19,34,35。除了生物学方面,精子发生是许多遗传策略的目标,这些策略是为了控制按蚊等害虫而开发的。在这种情况下,冈比亚 An. gambiae 的 X 连锁 rDNA 位点已被用作开发合成性别比例扭曲器的靶标,该扭曲器通过破坏携带 X 的精子,使后代偏向雄性 4,8,13。
该技术反映了在包括蚊子在内的几个分类群中发现的自然性别比减数分裂驱动的作用,但仍然知之甚少 28,36,37,38,39,40,41。WFISH提供了研究这种现象的机会,并为改进或改进基于性别扭曲的遗传策略铺平了道路,例如,通过提供有关精子产生的细胞学如何受到用于性染色体切碎的目标位点的选择的影响的信息。尽管根据我们的经验,WFISH显示出很高的成功机会,但失败仍然可能发生。这可能是由于组织通透水平低下,这可以通过增加渗透溶液的孵育时间来克服。或者,蛋白酶K可以在透化步骤中使用。在某些情况下,我们注意到探针穿透水平不均匀,精母细胞核中的信号较高,而减数分裂和精子发生阶段的信号较低或不存在。这可能是由于透化水平因细胞阶段而异。此外,当使用荧光探针设计用于靶向高拷贝数的DNA序列时,WFISH被证明是有价值的。当靶向单拷贝基因时,信号检测可能不够。在这种情况下,信号放大方法,例如酪胺信号放大(TSA),必须集成42。
该方案可以与免疫染色或携带种系特异性荧光标记物16,18的转基因报告菌株偶联,因为这将增加有关蛋白质定位和原位基因表达的信息。在这项工作中,WFISH被描述为一种研究按蚊精子发生的技术;然而,鉴于雄性生殖器官的共同解剖结构,该协议可以应用于在疾病传播中发挥作用的其他蚊子物种。同样,可以使用这种技术研究雌配子发生。此外,可以探索感兴趣的器官或组织的细胞学研究,例如蚊子中肠,这是寄生虫入侵的靶标,或非典型遗传背景,例如杂交蚊子中的遗传背景,可以探索43。此外,这种技术有可能转移到双翅目中的其他生物。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了比尔和梅琳达·盖茨基金会和开放慈善事业的资助。我们感谢伦敦帝国理工学院光学显微镜成像设施(FILM)的显微镜分析。图 2 是使用 Biorender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| Amersham CyDye Fluorescent Nucleotides, Cy3-dUTP | Cytiva | PA53022 | |
| Amersham CyDye Fluorescent Nucleotides, Cy5-dUTP | Cytiva | PA55022 | |
| ART Wide Bore Filtered Pipette Tips | ThermoFisher Scientific | 2079GPK | |
| CytoBond Removable Coverslip Sealant | SciGene | 2020-00-1 | |
| Dextran sulfate sodium salt from Leuconostoc spp. | Sigma-Aldrich | D8906-5G | |
| DNeasy Blood & Tissue Kits | Qiagen | 69504 | |
| Embryo Dishes | VWR | 70543-30 | |
| Ethanol, molecular grade | Sigma-Aldrich | 51976 | |
| Formamide | ThermoFisher Scientific | 17899 | |
| GoTaq G2 DNA Polymerase | Promega | M7841 | |
| Hydrochloric acid, 37% | Sigma-Aldrich | 320331 | |
| Microscope slides, SuperFrost | VWR | 631-0114 | |
| PBS (10x), pH 7.4 | ThermoFisher Scientific | 70011044 | |
| Pierce 16% Formaldehyde (w/v), Methanol-free | ThermoFisher Scientific | 28906 | |
| ProLong Gold Antifade Mountant with DAPI | ThermoFisher Scientific | P36941 | |
| RNase A/T1 Mix | ThermoFisher Scientific | EN0551 | |
| Set of dATP, dCTP, dGTP, dTTP | Promega | U1330 | |
| Sodium Acetate Solution | ThermoFisher Scientific | R1181 | |
| SP8 inverted confocal microscope | Leica | ||
| Triton X-100 | Sigma-Aldrich | 9036-19-5 | |
| TWEEN 20 | Sigma-Aldrich | P1379 | |
| UltraPure Salmon Sperm DNA Solution | ThermoFisher Scientific | 15632011 | |
| UltraPure SSC 20x | ThermoFisher Scientific | 15557044 | |
| Primer sequences | |||
| 5’-CAATAAATTTCCTTTTTAATGATGC AAAATCTACGTCTCTAGC-3’-[Fluorochrome] | Eurofins Genomics | Contig_240 (X) | |
| 5’AGAAGAATAGAATCAGAATAGT CGG TTTCTTCATCCTGAAAGCC-3’-[Fluorochrome] | Eurofins Genomics | AgY53B (Y) | |
| 5’-TTCTAAGTTTCTAGGCTTTAAGGA T GAAGAAACCGACTATTC-3’-[Fluorochrome] | Eurofins Genomics | AgY477- AgY53B junction region (Y) | |
| F: AACTGTGGAAAAGCCAGAGC R: TCCACTTGATCCTTGCAAAA | Eurofins Genomics | 18S rDNA (X) | |
| F: CCTTTAAACACATGCTCAAATT R: GTTTCTTCATCCTTAAAGCCTAG | Eurofins Genomics | AgY53B (Y) |
参考文献
- World Malaria Report. World Health Organization Available from: https://www.who.int/teams/global-malaria-programme/reports/world-malaria-report-2022 (2022)
- Bhatt, S., et al. The effect of malaria control on Plasmodium falciparum in Africa between 2000 and 2015. Nature. 526 (7572), 207-211 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34 (1), 78-83 (2016).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5 (1), 3977 (2014).
- Kyrou, K., et al. A CRISPR-Cas9 gene drive targeting doublesex causes complete population suppression in caged Anopheles gambiae mosquitoes. Nature Biotechnology. 36 (11), 1062-1066 (2018).
- Simoni, A., et al. A male-biased sex-distorter gene drive for the human malaria vector Anopheles gambiae. Nature Biotechnology. 38 (9), 1054-1060 (2020).
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), E6736-E6743 (2015).
- Bernardini, F., Kriezis, A., Galizi, R., Nolan, T., Crisanti, A. Introgression of a synthetic sex ratio distortion system from Anopheles gambiae into Anopheles arabiensis. Scientific Reports. 9 (1), 5158 (2019).
- Hammond, A. M., Galizi, R. Gene drives to fight malaria: Current state and future directions. Pathogens and Global Health. 111 (8), 412-423 (2017).
- Garrood, W. T., et al. Driving down malaria transmission with engineered gene drives. Frontiers in Genetics. 13, 891218 (2022).
- Hoermann, A., et al. Gene drive mosquitoes can aid malaria elimination by retarding Plasmodium sporogonic development. Science Advances. 8 (38), (2022).
- Nash, A., et al. Integral gene drives for population replacement. Biology Open. 8 (1), (2019).
- Galizi, R., et al. A CRISPR-Cas9 sex-ratio distortion system for genetic control. Scientific Reports. 6 (1), 31139 (2016).
- Terradas, G., Hermann, A., James, A. A., McGinnis, W., Bier, E. High-resolution in situ analysis of Cas9 germline transcript distributions in gene-drive Anopheles mosquitoes. G3: Genes, Genomes, Genetics. 12 (1), (2022).
- Durant, A. C., Donini, A. Ammonium transporter expression in sperm of the disease vector Aedes aegypti mosquito influences male fertility. Proceedings of the National Academy of Sciences of the United States of America. 117 (47), 29712-29719 (2020).
- Taxiarchi, C., et al. High-resolution transcriptional profiling of Anopheles gambiae spermatogenesis reveals mechanisms of sex chromosome regulation. Scientific Reports. 9 (1), 14841 (2019).
- Pompon, J., Levashina, E. A. A new role of the mosquito complement-like cascade in male fertility in Anopheles gambiae. PLoS Biology. 13 (9), e1002255 (2015).
- Papathanos, P. A., Windbichler, N., Menichelli, M., Burt, A., Crisanti, A. The vasa regulatory region mediates germline expression and maternal transmission of proteins in the malaria mosquito Anopheles gambiae: A versatile tool for genetic control strategies. BMC Molecular Biology. 10 (1), 13 (2009).
- Liang, J., Sharakhov, I. V. Premeiotic and meiotic failures lead to hybrid male sterility in the Anopheles gambiae complex. Proceedings of the Royal Society B. 286 (1906), 20191080 (2019).
- Hall, A. B., et al. Radical remodeling of the Y chromosome in a recent radiation of malaria mosquitoes. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), E2114-E2123 (2016).
- Clements, A. N. . The Biology of Mosquitoes. Volume 1: Development, Nutrition and Reproduction. , (1992).
- Demarco, R. S., Eikenes, &. #. 1. 9. 7. ;. H., Haglund, K., Jones, D. L. Investigating spermatogenesis in Drosophila melanogaster. Methods. 68 (1), 218-227 (2014).
- Helinski, M. E., Parker, A. G., Knols, B. G. Radiation biology of mosquitoes. Malaria Journal. 8, S6 (2009).
- Huho, B. J., et al. A reliable morphological method to assess the age of male Anopheles gambiae. Malaria Journal. 5 (1), 62 (2006).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis. Spermatogenesis. 2 (3), 197-212 (2012).
- Li, M., et al. Suppressing mosquito populations with precision guided sterile males. Nature Communications. 12 (1), 5374 (2021).
- Thailayil, J., Magnusson, K., Godfray, H. C., Crisanti, A., Catteruccia, F. Spermless males elicit large-scale female responses to mating in the malaria mosquito Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 108 (33), 13677-13681 (2011).
- Haghighat-Khah, R. E., et al. Cellular mechanisms regulating synthetic sex ratio distortion in the Anopheles gambiae germline. Pathogens and Global Health. 114 (7), 370-378 (2020).
- Yamamoto, D. S., et al. A synthetic male-specific sterilization system using the mammalian pro-apoptotic factor in a malaria vector mosquito. Scientific Reports. 9 (1), 8160 (2019).
- Papathanos, P. A., Windbichler, N. Redkmer: An assembly-free pipeline for the identification of abundant and specific X-chromosome target sequences for X-shredding by CRISPR endonucleases. The CRISPR Journal. 1 (1), 88-98 (2018).
- Sharma, A., Kinney, N. A., Timoshevskiy, V. A., Sharakhova, M. V., Sharakhov, I. V. Structural variation of the X chromosome heterochromatin in the Anopheles gambiae complex. Genes. 11 (3), 327 (2020).
- Krzywinski, J., Sangaré, D., Besansky, N. J. Satellite DNA from the Y chromosome of the malaria vector Anopheles gambiae. Genetics. 169 (1), 185-196 (2005).
- Timoshevskiy, V. A., Sharma, A., Sharakhov, I. V., Sharakhova, M. V. Fluorescent in situ hybridization on mitotic chromosomes of mosquitoes. Journal of Visualized Experiments. (67), e4215 (2012).
- Liang, J., Hodge, J. M., Sharakhov, I. V. Asymmetric phenotypes of sterile hybrid males from reciprocal crosses between species of the Anopheles gambiae complex. Frontiers in Ecology and Evolution. 9, 660207 (2021).
- Slotman, M., Torre, A. D., Powell, J. R. The genetics of inviability and male sterility in hybrids between Anopheles gambiae and An. arabiensis. Genetics. 167 (1), 275-287 (2004).
- Wood, R. J., Newton, M. E. Sex-ratio distortion caused by meiotic drive in mosquitoes. The American Naturalist. 137 (3), 379-391 (1991).
- Cazemajor, M., Joly, D., Montchamp-Moreau, C. Sex-ratio meiotic drive in Drosophila simulans is related to equational nondisjunction of the Y chromosome. Genetics. 154 (1), 229-236 (2000).
- Jaenike, J. Sex chromosome meiotic drive. Annual Review of Ecology and Systematics. 32 (1), 25-49 (2001).
- Courret, C., Chang, C. H., Wei, K. H., Montchamp-Moreau, C., Larracuente, A. M. Meiotic drive mechanisms: Lessons from Drosophila. Proceedings of the Royal Society B. 286 (1913), 20191430 (2019).
- Zanders, S. E., Unckless, R. L. Fertility costs of meiotic drivers. Current Biology. 29 (11), R512-R520 (2019).
- Newton, M. E., Wood, R. J., Southern, D. I. A cytogenetic analysis of meiotic drive in the mosquito, Aedes aegypti (L.). Genetica. 46 (3), 297-318 (1976).
- Carabajal Paladino, L. Z., Nguyen, P., Šíchová, J., Marec, F. Mapping of single-copy genes by TSA-FISH in the codling moth, Cydia pomonella. BMC Genomic Data. 15, S15 (2014).
- Bernardini, F., et al. Cross-species Y chromosome function between malaria vectors of the Anopheles gambiae species complex. Genetics. 207 (2), 729-740 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。