需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
在自由移动和头部固定的动物中使用微棱镜对已识别的神经种群进行长期成像
摘要
当与头板和与单光子和双光子显微镜兼容的光学设计集成时,微棱镜透镜在测量不同条件下垂直柱中的神经反应方面具有显着优势,包括头部固定状态下的良好控制实验或自由移动动物的自然行为任务。
摘要
随着多光子显微镜和分子技术的进步,荧光成像正在迅速发展成为研究活体脑组织结构、功能和可塑性的有力方法。与传统的电生理学相比,荧光显微镜可以捕获细胞的神经活动和形态,从而能够以单细胞或亚细胞分辨率长期记录已识别的神经元群。然而,高分辨率成像通常需要一个稳定的、头部固定的设置,以限制动物的运动,并且制备透明玻璃的平面允许在一个或多个水平面上可视化神经元,但在研究跨不同深度的垂直过程方面受到限制。在这里,我们描述了一种将头板固定和微棱镜相结合的程序,该微棱镜可提供多层和多模态成像。这种手术准备不仅可以进入小鼠视觉皮层的整个柱子,而且允许在头部固定位置进行双光子成像,在自由移动的范式中进行单光子成像。使用这种方法,人们可以对不同皮层中已识别的细胞群进行采样,在头部固定和自由移动状态下记录它们的反应,并跟踪几个月的长期变化。因此,该方法提供了对微电路的全面分析,能够直接比较由良好控制的刺激和自然行为范式引起的神经活动。
引言
体内双光子荧光成像1,2的出现,结合了光学系统中的新技术和转基因荧光指示剂,已成为神经科学中研究活体大脑中复杂结构、功能和可塑性的强大技术3,4.特别是,这种成像方式通过捕获神经元的形态和动态活动,提供了比传统电生理学无与伦比的优势,从而促进了对已识别神经元的长期跟踪5,6,7,8。
尽管具有显著的优势,但高分辨率荧光成像的应用通常需要静态的头部固定设置,从而限制动物的活动能力9,10,11。此外,使用透明玻璃表面可视化神经元将观察限制在一个或多个水平面上,限制了对跨越不同皮层深度的垂直过程动力学的探索12。
为了解决这些局限性,本研究概述了一种创新的外科手术,该手术集成了头板固定、微棱镜和微型镜,以创建具有多层和多模态功能的成像模式。微棱镜允许观察沿皮层柱13,14,15,16的垂直处理,这对于理解信息在通过皮层的不同层时如何处理和转换以及垂直处理在塑料变化过程中如何改变至关重要。此外,它允许在头部固定范式和自由移动的环境中对相同的神经群体进行成像,包括多功能实验设置17,18,19:例如,头部固定通常需要用于控制良好的范式,如感觉知觉评估和2光子范式下的稳定记录,而自由移动为行为研究提供了更自然、更灵活的环境。因此,在两种模式下进行直接比较的能力对于进一步了解能够实现灵活功能响应的微电路至关重要。
从本质上讲,在荧光成像中集成头板固定、微棱镜和微型镜为探索大脑结构和功能的复杂性提供了一个很有前途的平台。研究人员可以在跨越所有皮质层的不同深度对已识别的细胞群进行采样,直接比较它们在良好控制和自然范式中的反应,并监测它们在20个月内的长期变化。这种方法为这些神经群体在不同实验条件下如何相互作用和随时间变化提供了宝贵的见解,为了解神经回路的动态性质提供了一个窗口。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有实验均根据 1986 年英国动物(科学程序)法案进行,并经英国内政部批准和颁发的个人和项目许可证,并经过适当的伦理审查。成虫转基因品系CaMKII-TTA;培育了GCaMP6S-TRE21 ,并将其后代用于实验。为了实验人员的安全和维持无菌条件,所有程序均在无菌条件下进行,并配备完整的个人防护设备。
1.术前准备
- 为了尽量减少水肿,手术前12-24小时皮下注射地塞米松(0.2mg / kg)。
- 在高压灭菌器中对所有手术工具进行灭菌,并在手术前用稳定的次氯酸和蒸馏水和 70% 乙醇对手术区域进行灭菌。确保所有手术设备都已打开。
- 使用异氟醚麻醉动物(24周龄,雄性体重31g),诱导剂量为5%,一旦小鼠在立体定位框架上,该剂量降低至1%-2%,O2 保持在1-2L / min之间。皮下注射非甾体抗炎药(卡洛芬,2.5 mg/kg)。
- 检查是否存在脚趾捏反射以评估麻醉深度(如果出现反射,则以 0.5% 的增量增加异氟烷浓度)。
- 使用修剪器将动物的头部从耳朵后面剃到眼睛上方。用酒精湿巾和聚维酮碘溶液清洁该区域,确保避免接触动物的眼睛。
- 将动物安装在装有耳杆和齿杆的恒温加热垫和立体定位框架上,并固定头部。确保头部稳定,因为这对于以下程序的成功至关重要(图1)。
- 在动物的眼睛上涂抹眼药膏,以防止它们在手术过程中变干,并用箔纸覆盖它们以保护它们免受光线照射。用无菌手术罩盖住动物。

图1:术前准备。 将鼠标放置在立体定位框架上,由鼻托和耳杆固定。将鼠标放在温度调节的加热垫上。眼睛上有眼药膏,并用铝箔覆盖。剃光头,露出头骨。在动物上放置无菌盖。 请点击这里查看此图的较大版本.
2. 开颅手术
- 使用手术剪刀,沿着头部剃光区域的中线切开皮肤,露出头骨。
- 使用无菌棉签和稀释的过氧化氢(3% w / v of 35% H2O2 在 97% dH2O 中)清洁颅骨 1-3 秒以去除任何结缔组织(图 2A)。使用滴入70%乙醇和新的无菌棉签擦干颅骨。
- 将颅骨前/后 (AP) 和内侧/外侧 (ML) 对齐,以确保准确的植入部位。为此,测量前粒和 lambda 处颅骨的背腹 (DV) 深度,并确保两者之间的差异为 <0.03 毫米。对于内侧对齐,从中线测量两个顶骨上的等距点,并再次确保 DV 差为 <0.03 mm。
- 以前囂为原点,找到并标记所需的皮质区域;在这里,这些是单眼初级视觉皮层 (V1),AP:-3.5 毫米,ML:-2.5 毫米。
- 使用环钻钻头(直径 1.8 毫米)和牙钻(转速 10,000 rpm)暴露皮层,确保所需皮质区域(单目 V1)的标记位于钻头窗口的底部三分之一内。
- 确保钻头的角度垂直于头骨的曲率。这将确保均匀的开颅手术,并防止对硬脑膜或皮质的损伤。
- 钻孔直到电阻降低,然后停止(图2B)。使用23G针尖小心地去除分离的骨头碎片(图2C)。
- 用浸泡在冷人工脑脊液 (ACSF) 中的手术泡沫清洁暴露的皮质,以清除任何碎屑并止住可能发生的任何出血。
- 在整个手术过程中,始终使用冷 ACSF 保持暴露的皮质水分。
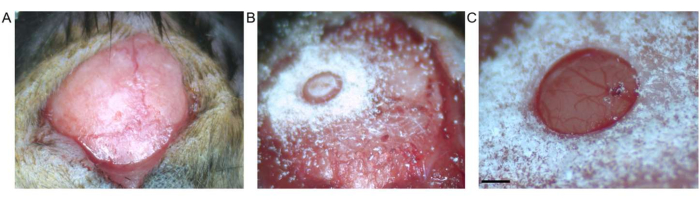
图 2:开颅手术。 (A) 显示了前囂和 lambda 之间的皮肤切口。结缔组织已从暴露表面去除。(B) 在取出骨头碎片之前通过环钻进行开颅手术。(C) 切除骨碎片后开颅手术,显示完整的硬脑膜和皮质(比例尺代表 0.5 毫米)。请点击这里查看此图的较大版本.
3. 预切切口
注意:在进行预切切口时要考虑,切口和微棱镜植入需要位于感兴趣的成像区域 (ROI) 的前面。这是为了提供完整而准确的视野。在该协议的背景下,切口将沿内侧轴线进行,并且微棱镜面向后方(图 3B)。
- 为了帮助插入并减轻微棱镜插入过程中皮层的压力,请做一个切口。
- 将手术刀连接到立体定位臂支架上,并定向刀片或立体定位臂,使其沿 ML 轴切割。
- 将刀移动到所需的AP坐标(AP:-3.4mm);棱镜需要在 ROI 的前面,因此切口在成像 ROI AP 坐标前 100 μm 处 (-3.5mm)。
- 现在将刀移动到开颅手术的内侧边缘,在那里它与头骨相接,慢慢放下刀,直到它到达骨头,然后停止。由于骨厚度为 200 μm,因此将该值计入总插入深度(参见步骤 5.1 计算)。
- 最佳成像位于棱镜的中心,即 500 μm;因此,确保该深度与皮质柱深度一致(ROI DV:- 0.35 mm)。
- 将头骨的厚度纳入深度计算中,使用下面的公式,该公式确定预切切口需要从头骨表面到多深。对于该协议,植入深度计算如下:
骨厚 (200 μm) + 成像 ROI(例如 350 μm)+ 剩余微棱镜深度 (500 μm) = 1,050 μm
- 将头骨的厚度纳入深度计算中,使用下面的公式,该公式确定预切切口需要从头骨表面到多深。对于该协议,植入深度计算如下:
- 确保切口长度大于 1 毫米但不要过长;因此,1.2 mm 的距离是理想的,单眼 ML 坐标位于该距离的中间。
- 当准备进行切口时,去除多余的ACSF,以免视力被遮挡(图3A)。
- 将刀从开颅手术的内侧边缘移动到切口的起始内侧坐标。缓慢(10 μm/s)将刀向下放入皮质。
- 一旦硬脑膜被刺穿并且刀进入皮层,在皮质上滴一滴冷的 ACSF,以在切口过程中保持组织润滑和水分。
- 达到最终深度后,开始沿ML轴移动刀(以10μm / s的速率)。
- 切口时继续观察周围组织。如果纸巾与刀一起拖拽,请上下移动刀几次以确保纸巾被切割,然后横向继续,记住将刀放回其最终深度。
- 完成后,慢慢举起刀。如果切口过程中出现血液,请利用这段时间用 ACSF 浸泡的手术泡沫清洁切口部位,以稀释血液并将切口内的任何血液排出。请记住在暴露的皮质上留下新鲜、饱和的手术泡沫,直到准备好插入微棱镜。

图 3:微棱镜植入。 (A) 预切切口。(B) 集成微棱镜透镜的示意图,显示其在皮层中的位置 (C) 集成微棱镜透镜在插入皮层之前以正确的方向进行预切切口(比例尺表示 0.5 毫米)。(D) 集成晶状体周围水泥堆积的示例,以将其固定在颅骨上。请点击这里查看此图的较大版本.
4. 微棱镜插入和头板植入
- 微棱镜透镜由一个梯度折射率透镜组成,该透镜连接到透镜远端的棱镜上,该棱镜集成在底板中。将微棱镜连接到植入套件上。
- 确保棱镜的成像侧与底板螺钉相对。为了帮助插入和放置微棱镜,将其连接到立体定位框架并定向棱镜,使其与切口对齐(图3C)。
- 缓慢地将微棱镜降低到切口部位(10μm / s)。请记住在最初插入棱镜时取下 ACSF,但一旦进入皮层,请用冷 ACSF 冲洗以润滑插入。
- 当棱镜降低到切口中时,皮层应保持稳定;如果没有,请添加额外的 ACSF 并通过上下移动棱镜来搅动皮层,以使皮层从棱镜上松开。
- 达到最终深度后,使用无菌组织擦干暴露的皮质表面,注意不要触摸棱镜。
- 用硅胶保护层覆盖棱镜和晶状体周围的裸露皮质区域,最大限度地减少周围颅骨和假镜上的多余粘合剂。
- 固化后(5-10分钟),将头板连接到颅骨上,以在头部固定成像期间稳定头部。
- 确保头板足够靠后,以免干扰植入物的放置,并允许充分应用水泥以正确固定植入物。
- 确保头板的中线位于植入镜片的右侧,以确保在进行头固定实验时头板的两侧都可以固定在头台上
- 在头板和头骨上涂上粘性水泥。
- 将 1 勺不透明水泥粉与 4 滴混合介质并涂上一滴催化剂来制备粘性牙科水泥。
- 将水泥放在头板和头骨上,并将头板固定到位直至固化,确保它与耳杆平行(通过目视检查,从动物头部上方和后面检查)。
- 涂上粘性水泥覆盖暴露的头骨和组织的其余部分,包括微棱镜(直至底板底部)和头板。
- 不要在底板、假显微镜或其任何部件上沾上水泥。继续涂抹粘性水泥,直到微棱镜和顶板被覆盖并稳定(图3D)。
- 当水泥固化后,通过缓慢向上移动立体定位臂来分离假显微镜,同时用镊子稳定微棱镜(它们通过磁铁连接,因此在分离过程中可能会感觉到一些阻力)。
- 将保护盖插入镜头并拧紧螺丝以将其固定到位。
- 将动物从立体定位框架中取出,使其在温暖的恢复箱中恢复,并皮下给予温热的无菌0.9%生理盐水(体重的3%)。
- 一旦动物清醒并移动,将其放回干净的单屋笼子中。监测动物并根据当地机构的镇痛政策进行额外的术后镇痛。
- 手术后等待4周,动物应准备好进行成像。
5. 自由移动小鼠皮质层的单光子钙成像
注意:每次都必须利用从原始成像会话中捕获的图像,以确保准确获取预期的成像平面。这些已识别的标志以及神经元在协议第 9 步中详细描述的对齐过程中起着关键作用。在采集单光子数据时,微型镜既是成像系统又是激光源。激励在物镜前表面使用功率范围为 0-2 mW/mm2 的 LED。该激光器使用 455 ± 8nm(蓝光)的激发波长进行 GCaMP 信号传导。镜头对焦滑块可用于调整焦距(Z轴),在界面上表示为0-1000,其中0表示0μm工作距离,1000表示最大300μm工作距离。
- 在获取数据之前,让动物在记录会话前 1 小时适应房间和开放的竞技场。
- 成像前,使用适当的消毒剂(例如,用蒸馏水和 70% 乙醇的稳定次氯酸)对所有物品进行消毒和清洁。
- 通过将DAQ盒连接到计算机并启动数据采集软件来设置DAQ盒。通过以太网电缆建立直接连接,以最大限度地减少丢帧;但是,无线连接模式可能就足够了,具体取决于无线连接的强度。
- 将微型镜在动物的底板上轻轻拉扯。
- 首先,拧下固定螺钉,从底板上取下保护盖。用镊子握住盖子的孔。然后,将微型镜连接到盖子所在的底板上。
- 在安装之前,请检查微型内窥镜相对于底板的方向,使带有螺钉标记的一侧朝向螺钉。
- 安装微型内窥镜后,拧紧固定螺钉以使其稳定。只推进固定螺钉,直到感觉到一些阻力。过度拧紧固定螺钉可能会损坏微型内窥镜,因此应避免。
- 将微型内窥镜连接到DAQ盒,并准备软件进行记录。
- 在数据采集软件中,打开微型内窥镜的流并调整记录参数(成像帧速率、增益、LED 功率、聚焦值)以获得清晰的视野(图 4A)。
- 打开直方图窗口并调整增益和 LED 功率,使记录的强度介于 35% 到 70% 之间。
- 如果进行纵向研究,请参考上一次会话中拍摄的记录或快照,并调整 efocus 值,以便清楚地看到相同的成像平面。
- 开始实验和数据采集。
- 实验完成后,将动物从行为装置中移出。
- 在轻轻的拧干下,松开固定螺钉,然后从动物的底板上取下微型镜。
- 将保护盖放回底板并用固定螺钉将其固定。
- 将动物放回其主笼中(如果要处理单光子数据,请继续执行步骤7)。

图 4:使用软件进行数据采集和处理。 (A) 显示来自微型镜的实时流的图像。建议调整镜头焦距值,以便在流媒体窗口中看到清晰的视图,以及增益和成像激光功率 (B) 示意图图,说明在不同时间点录制的会话的推荐对准工作流程。建议按照数据处理软件的说明从第一次会话生成平均图像。在以下会话的运动校正期间,此图像应用作参考图像。(C) 来自同一最大投影 ΔF/F 图像的四个单元格的示例。在每个单元格上绘制一条橙色线以测量其单元格直径(以像素为单位),其平均值作为单元格识别算法的输入参数(左上:13,右上:11,左下:12,右下:13)。(D) 手动整理后细胞识别算法的输出(图像裁剪)。白色轮廓代表已识别的细胞(比例尺表示 100 μm)。 请点击这里查看此图的较大版本.
6. 头固定小鼠皮质层的双光子钙成像
注意:对于双光子激光扫描显微镜,光源是激发波长为 920 nm 的可调谐超快激光器。在物镜上测得的激发功率通常在100-150 mW之间,并在每个疗程中进行调整,以达到相似的荧光水平。发射光由发射滤光片 (525/70 nm) 过滤,并由独立的光电倍增管 (PMT) 测量,称为绿色通道。图像是用20倍空气浸没物镜(NA = 0.45,6.9-8.2 mm工作距离)采集的。
- 在获取数据之前,让动物在前几天习惯于设备(使动物对行为设置感到满意)。让动物每天花 15-30 分钟,持续 2-3 天,探索设置或直到它们在开始数据采集之前表现出自然行为。
- 打开双光子成像系统,启动采集软件,然后打开激光器。 在继续之前,请确保激光器已关闭并关闭 PMT。
- 用稳定的次氯酸、蒸馏水和 70% 乙醇清洁双光子成像装置。
- 确保调整设备以适合动物的大小。轻轻地将鼠标及其头板连接到头级设置,然后将其拧入到位以稳定鼠标的头部。
- 安装后,取下镜头盖(请参阅步骤 5.4.1),然后对齐物镜,使其位于底板上方。
- 使用落射荧光和 XYZ 载物台对照使皮质组织成为焦点。
- 一旦皮质层可见,切换显微镜以允许双光子成像(将反射镜换成二向色镜,关闭荧光快门,关闭落射荧光激光器和监视器)。确保关闭主灯,以便在成像时保护 PMT。
- 设置参数以优化采集的图像文件。
- 使用共振采集模式进行钙成像,因为它可以捕获 GCaMP 信号的快速发射。
- 调整激光功率、PMT 增益、变焦和查找表 (LUT) 以获得最佳图像,并参考单光子图像以确保成像正确的焦平面。
- 使用具有同步行为监测和刺激输入(如果适用)的双光子系统开始对皮质层进行成像。
- 如果想要随时间推移再现相同的图像,请确保保存这些采集参数和 XYZ 距离。
- 要捕获皮层的 z 堆栈,请按照下面描述的步骤操作。
- 找到要启动 z 堆栈的平面,调整采集参数以优化图像,并在软件上将其标记为起点。
- 接下来,使用 Z 控件,向下移动堆栈,仅调整激光功率以保持堆栈的恒定亮度,并在软件上标记堆栈的末端。
- 关键步骤:使用"激光功率梯度"选项卡下的"相对指数梯度"选项,允许软件计算激光功率在 z 堆栈中移动时的增加。请务必在软件提供的表格中记下端点激光功率值,以便计算梯度。
- 设置 z-stack 参数后,调整步长 (μm)。
注意:步长将决定堆栈所花费的时间、切片数量和细节质量。与较大的步长相比,较小的步长将导致更长的采集时间、切片数量的增加和更好的细节。Z 堆栈用于协助配准单光子和双光子图像,因为它们将突出显示任何解剖标志或特征。
- 要获取神经元中钙变化的时间序列(T 系列),请使用 XYZ 载物台控件找到最佳焦平面并调整激光功率、PMT 增益、变焦和 LUT。
- 在采集软件的 T 系列 选项卡下,定义采集频率参数以匹配使用单光子成像系统采集的数据。
注意:匹配频率将使 1P 和 2P 数据具有可比性,并且更适合数据处理步骤中使用的单元格识别算法。多个触发器和其他采集模式可以集成到 T 系列采集中。
- 在采集软件的 T 系列 选项卡下,定义采集频率参数以匹配使用单光子成像系统采集的数据。
- 开始收购T系列。
7. 处理单光子钙成像数据
- 对于单光子记录电影,请使用微型内窥镜系统附带的数据处理软件。
- 首先,通过空间和时间下采样对电影进行预处理。通常,将电影的空间下采样提高两倍将显著缩短处理时间,而不会严重影响细胞识别的准确性。
- 设置时间下采样因子,使影片的帧率降低到10Hz左右,更适合以下步骤中使用的单元格识别算法。
- 如果在同一天采集多张短片,请在预处理步骤之前将短片合并为一个时间序列,以便将它们一起处理。
- 可选:对短片应用空间带通滤镜以去除较低和较高的空间频率,从而获得更平滑、对比度更高的影片。
- 使用软件的运动校正功能注册电影。这将记录短片并校正由微型镜相对于成像表面的移动引起的运动伪影。
- 关键步骤:如果进行纵向研究,请将电影注册到相同的视野,例如,在第一个成像日拍摄的电影的平均图像(图4B)。
- 使用相应的选项卡计算短片的 ΔF/F 并投影短片以生成 ΔF/F 短片的最大投影图像。该图像将显示显示荧光水平变化的区域,可能是单个神经元,可用于测量神经元的平均直径(图4C)。
- 或者,在运动校正的胶片上测量细胞直径,其中神经元显示出清晰的荧光。
- 使用软件中的算法识别细胞。
- 虽然在此步骤中有两个选项(PCA-ICA 和 CNMF-E),但请使用 CNMF-E 进行本研究。输入平均像元直径(以像素为单位),然后运行该算法以生成包含感兴趣区域 (ROI) 的像元集,这些区域展示了类似像像细胞的活动。
- 从非细胞中手动选择细胞的ROI(具有细胞样形态和活性22,23,并且位于FOV内),并验证精选的细胞集(图4D)。
- 导出每个 ROI 的钙痕量以供进一步分析。
8. 处理双光子钙成像数据
- 对于双光子录制电影,请使用旨在处理双光子钙分析数据的 python 包。
- 首先,将 T 系列中拍摄的图像合并到.tiff堆栈中,如下所述。
- 在 "运行 选项"界面下,调整参数,包括 tau 值和帧速率,使其与使用的 GCaMP 和录制的帧速率相匹配。
- 可选:将do_registration参数设置为 1 以注册短片。这相当于上述运动校正步骤。
- 可选:将 anatomical_only 参数设置为 1,以使用除荧光动力学之外的解剖特征来检测 ROI。这需要输入电池直径,因此请使用图像处理软件进行测量。通常建议这样做,因为它会产生具有更自然形状的 ROI(图 5A-C)。
- 设置所有参数后,运行该算法,以便它一起执行所有计算。请参阅图形用户界面 (GUI) 以检查进度。
- 完成后,返回细胞选择界面,手动整理细胞鉴定结果。
- 将精选单元格的图像保存在影片最大投影的顶部。稍后将用作记录单光子记录数据的参考图像。
- 然后,算法会自动将结果保存在其中。npy 格式,稍后可以使用 Python 访问。或者,将结果保存在其他格式文件中,以便在其他软件中进一步分析。
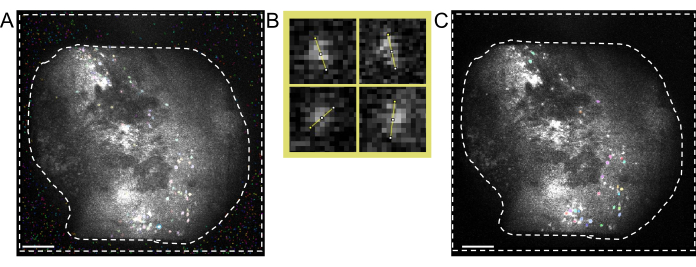
图 5:使用双光子处理软件进行细胞识别。 (A)从双光子处理软件中获取的细胞识别的代表性图像。将 Anatomical_only 参数设置为 0 但保持所有其他参数相同,虚线之间的区域中会存在多个非单元格,这些虚线会干扰实际单元格的手动管理。(B)使用图像处理软件(左上;7.5像素,右上;9,左下;6.5,右下;7.5)从(A)中获取的细胞直径测量示例。(C)细胞识别的代表性图像。当 Anatomical_only 参数设置为 1 并将从 (B) 获取的平均像元直径输入到像元直径算法中时,虚线之间的区域(比例尺表示 200 μm)中不存在像元。 请点击这里查看此图的较大版本.
9. 跨成像模式配准已识别的细胞集
- 使用多模态图像配准和分析算法 (MIRA) 对从单光子和双光子记录中识别的细胞进行配准,该算法可通过单光子成像软件的 Python 界面获得。
- 该算法通过非刚性配准对齐单光子和双光子数据。请参阅网站上用于本研究的一组演示在线笔记本。
注意:笔记本的编写是为了在 1P 软件中完成所有处理,因此与 2P 处理软件不兼容。因此,请仅按照本研究的笔记本中的某些步骤进行操作。
- 该算法通过非刚性配准对齐单光子和双光子数据。请参阅网站上用于本研究的一组演示在线笔记本。
- 按照演示笔记本中描述的步骤进行操作,这些步骤涉及为每种成像模式生成结构图像。默认情况下,这涉及生成双光子 z 堆栈的最大投影和单光子记录的平均图像。或者,使用双光子记录的平均图像。
- 在出现提示时,空间带通会对图像进行过滤,以更好地可视化地标并重新调整它们的方向,使其匹配。
- 在两张图像上选择匹配的地标(图6A)。
- 使用这些来计算对齐两个图像所需的翘曲。一般来说,3 到 5 个地标就足够了。
- 该算法根据地标和图像相似度的组合来计算翘曲。优化给定两个因素的相对权重,直到获得令人满意的结果。
- 扭曲在单光子会话中获取的细胞图,以生成与双光子数据对齐的新细胞图。
- 然后将这个扭曲的细胞图导入到1P处理软件中,以生成一个具有背景中双光子电影最大投影图像的图像。
- 导出此映像以进行注册。
- 在编程软件中,对齐到目前为止生成的两张图像(双光子最大投影图像顶部的双光子单元图),并在双光子最大投影图像顶部扭曲单光子单元图(图6B,C)。
- 为此,在本研究中,使用注册估算器应用程序,该应用程序允许用户比较不同注册技术的结果。鉴于两幅图像具有相同的背景,具有刚性配准的相位相关技术就足够了。
- 注册完成后,扫描现在注册的图像以查找重叠的 ROI。这些是在两个录制会话中都处于活动状态的 ROI,可用于进一步分析。
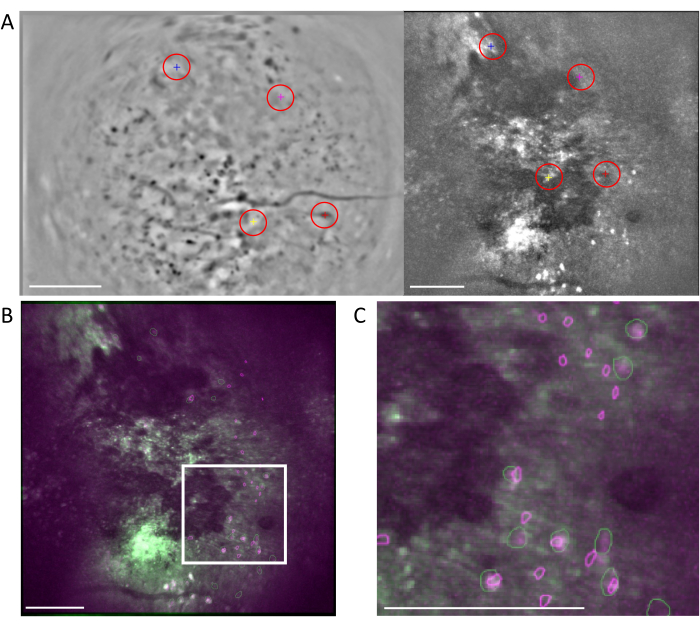
图 6:使用 MIRA 工作流程的跨模态细胞配准。 (A) 细胞对齐工作流程中的代表性图像。来自单光子数据的平均图像显示在左侧,来自双光子数据的平均图像显示在右侧。从两张图像中选择匹配的地标,并在软件中通过随机配色方案(红色圆圈)进行标记。(B) 显示两个已识别单元集(单光子(紫色)和双光子(绿色))的示例对齐图像叠加在双光子数据的平均图像上。(C) 在 (B) 中用白框标记的区域的图像,对齐的单元格在这里表示为重叠的绿色和紫色轮廓。在所有面板中,比例尺表示 200 μm。 请点击这里查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
结果
已经展示了在自由移动和头部固定条件下,使用单光子和双光子成像模式在数周内对同一神经元群进行慢性多层 体内 钙成像的方法。在这里,当动物在黑暗中探索开放的竞技场时,在单光子成像下识别匹配神经元群的能力已经得到证明(图7A)。从鉴定的神经元中提取钙痕迹并进行z评分以进行比较(图7B)。神经元在相隔 3 周的会话中显示出相...
Access restricted. Please log in or start a trial to view this content.
讨论
在这里,我们已经展示了在同一神经群体中观察和直接比较头部固定和自由移动条件下神经元的能力。虽然我们演示了在视觉皮层中的应用,但该协议可以适应许多其他大脑区域,包括皮层区域和深核24,25,26,27,28,以及其他数据采集和行为设置29,30
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明不存在相互竞争的经济利益或利益冲突。
致谢
我们感谢Charu Reddy女士和Matteo Carandini教授(Cortex实验室)对手术方案和转基因小鼠品系共享的建议。我们感谢 Norbert Hogrefe 医生 (Inscopix) 在手术开发过程中的指导和帮助。我们感谢Andreea Aldea女士(Sun Lab)在手术设置和数据处理方面的协助。这项工作得到了Moorfields Eye Charity的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution for infusion (Vetivex 11) 250ml | Dechra | 20091607 | Saline for hydration and drug reconsitution |
| 18004-1 Trephine 1.8mm diameter bur | FST | 18004-18 | Drill bit |
| 1ml syringe | Terumo | MDSS01SE | 1ml syringe |
| 23G x 5/8 inch 6% LUER needle | Terumo | NN-2316R | 23G needle |
| 71000 Automated stereotaxic apparatus w/ built-in software | RWD | - | RWD |
| Absorbable Haemostatic Gelatin Sponge (10x10x10mm) | Surgispon | SSP-101010 | gel-foam |
| Alcohol pads 70% isopropyl alcohol | Braun | 9160612 | Alcohol pads |
| Aluminium foil | Any retailer | - | Foil to cover eyes during surgery |
| Articifical Cerebrospinal Fluid | Tocris Bioscience a Bio-Techne Brand | 3525/25ML | ACSF |
| Automated microinjection pump | WPI | 8091 | |
| Betadine solution (10% iodinated Povidone) 500ml | Videne/Ecolab | 3030440 | Betadine |
| Bruker Ultime 2Pplus (customised) | Bruker | - | Two-photon imaging system |
| Cardiff Aldasorber | Vet-Tech | AN006 | Anaesthesia absorber |
| CFI S Plan Fluor ELWD ADM 20XC | Nikon | MRH48230 | 20x objective lens |
| Compact Anaesthesia system - single gas - isoflurane K/F, with oxygen concentrator model: ZY-5AC and scavenging unit | Vet-Tech | AN001 | Compact anaesthesia system |
| Contec Prochlor | Aston Pharma | AP2111L1 | Disinfectant (hypochlorous acid) |
| Dexamethasone Sodium Phosphate Injection, USP, 4mg/ml, NDC: 0641-6145-25 | Hikma | Covetrus:70789 | Dexamethasone |
| Dissecting Knife, cutting edge 4mm, thickness 0.5mm, stainless steel | Fine Science Tools | 10055-12 | Knife for incisino of cortex |
| Dual-Sided, Non-Puncture Mouse & Neonatal Rat Ear Bars | Stoelting | 51649 | Ear bar |
| Dummy microscope | Inscopix | Dummy microscope | To help with implantation |
| Ethanol (100%) | VWR | 40-1712-25 | Used to make 70% ethanol |
| Fisherbrand Nitrile Indigo Disposable Gloves PPE Cat III | FischerScientific | 17182182 | Gloves |
| Homeothermic Monitor 50-7222-F | Harvard Apparatus | 50-7222-F | Homeothermic monitoring system/heating pad |
| Image processing software | ImageJ | - | Image processing software |
| Inscopix Data Processing Software (IDPS) | Inscopix | - | One-photon calcium imaging processing software |
| Insight Duals-232, S/N 2043 | InSight | Insight Spectra X3 | Two-photon imaging laser |
| IsoFlo 250ml 100% w/w inhalation | Zoetis | WM 42058/4195 | Isoflurane |
| Kwik-Sil Low Toxicity Silicone Adhesive | World Precision Intruments (WPI) | KWIK-SIL | Silicone adhesive |
| MICROMOT mains adapter NG 2/S, w/ Drill unit 60/E | PROXXON | NO 28 515 | Handheld drill |
| nVoke Integrated Imaging and Optogenetics System package | Inscopix | - | One-photon Imaging system and software |
| ProView Implant Kit | Inscopix | ProView Implant Kit | Dummy microscope, stereotaxic arm and attachment |
| ProView Prism Probe | Inscopix | 1050-002203 | Microprism lens |
| Rimadyl (50mg/ml) | Zoetis | VM 42058/4123 | Carprofen |
| Stereotaxis Microscope on Articulated arm with table clamp | WPI | PZMTIII-AAC | Microscope |
| Super-Bond Universal kit, SUN Medical | Prestige-Dental | K058E | Adhesive cement |
| Two-photon calcium image software | Suite2P | - | Two-photon calcium imaging processing software |
| Vapouriser | Vet-Tech | - | Isoflurane vapouriser |
| Xailin Lubricating Eye Ointment 5g | Xailin-Night | MLG/28/1551 | Ophthalmic ointment |
参考文献
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50 (6), 823-839 (2006).
- Dombeck, D. A., Khabbaz, A. N., Collman, F., Adelman, T. L., Tank, D. W. Imaging large-scale neural activity with cellular resolution in awake, mobile mice. Neuron. 56 (1), 43-57 (2007).
- Vaziri, A., Emiliani, V. Reshaping the optical dimension in optogenetics. Curr Opin Neurobiol. 22 (1), 128-137 (2012).
- Holtmaat, A., et al. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nat Protoc. 4 (8), 1128-1144 (2009).
- Sun, Y. J., Sebastian Espinosa, J., Hoseini, M. S., Stryker, M. P. Experience-dependent structural plasticity at pre- and postsynaptic sites of layer 2/3 cells in developing visual cortex. Proc Natl Acad Sci U S A. 116 (43), 21812-21820 (2019).
- Andermann, M. L., Kerlin, A. M., Reid, R. C. Chronic cellular imaging of mouse visual cortex during operant behavior and passive viewing. Front Cell Neurosci. 4, 3(2010).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. Elife. 5, 14472(2016).
- Puścian, A., Benisty, H., Higley, M. J. NMDAR-dependent emergence of behavioral representation in primary visual cortex. Cell Rep. 32 (4), 107970(2020).
- Trachtenberg, J. T., et al. Long-term in vivo. imaging of experience-dependent synaptic plasticity in adult cortex. Nature. 420 (6917), 788-794 (2002).
- Seaton, G., et al. Dual-component structural plasticity mediated by αCaMKII autophosphorylation on basal dendrites of cortical layer 2/3 neurones. J Neurosci. 40 (11), 2228-2245 (2020).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat Methods. 2 (12), 932-940 (2005).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J Neurophysiol. 102 (2), 1310-1314 (2009).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: Imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc Natl Acad Sci U S A. 111 (52), 18739-18744 (2014).
- Buxhoeveden, D. P., Casanova, M. F. The minicolumn hypothesis in neuroscience. Brain. 125, 935-951 (2002).
- Chen, S., et al. Miniature fluorescence microscopy for imaging brain activity in freely-behaving animals. Neurosci Bull. 36 (10), 1182-1190 (2020).
- Gulati, S., Cao, V. Y., Otte, S. Multi-layer cortical Ca2+ imaging in freely moving mice with prism probes and miniaturized fluorescence microscopy. J Vis Exp. (124), e55579(2017).
- Resendez, S. L., et al. Visualization of cortical, subcortical, and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat Protoc. 11 (3), 566-597 (2016).
- Guo, Z. V., et al. Procedures for behavioral experiments in head-fixed mice. PLoS One. 9 (2), 88678(2014).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. J Neurophysiol. 115 (6), 2852-2866 (2016).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728(2018).
- Beckmann, L., et al. Longitudinal deep-brain imaging in mouse using visible-light optical coherence tomography through chronic microprism cranial window. Biomed Opt Express. 10 (10), 5235-5250 (2019).
- Wenzel, M., Hamm, J. P., Peterka, D. S., Yuste, R. Reliable and elastic propagation of cortical seizures in. Cell Rep. 19 (13), 2681-2693 (2017).
- Heys, J. G., Rangarajan, K. V., Dombeck, D. A. The functional micro-organization of grid cells revealed by cellular-resolution imaging. Neuron. 84 (5), 1079-1090 (2014).
- Barson, D., Hamodi, A. S. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nat Methods. 17 (1), 107-113 (2020).
- Paquelet, G. E., et al. Single-cell activity and network properties of dorsal raphe nucleus serotonin neurons during emotionally salient behaviors. Neuron. 110 (16), 2664-2679 (2022).
- Yang, Q., et al. Transparent microelectrode arrays integrated with microprisms for electrophysiology and simultaneous two-photon imaging across cortical layers. bioRxiv. , (2022).
- Priestley, J. B., Bowler, J. C., Rolotti, S. V., Fusi, S., Losonczy, A. Signatures of rapid plasticity in hippocampal CA1 representations during novel experiences. Neuron. 110 (12), 1978-1992 (2022).
- Zong, W., et al. Miniature two-photon microscopy for enlarged field-of-view, multi-plane and long-term brain imaging. Nat Methods. 18 (1), 46-49 (2021).
- Engelbrecht, C. J., et al. Ultra-compact fiber-optic two-photon microscope for functional fluorescence imaging in vivo. Opt Express. 16 (8), 5556-5564 (2008).
- Suzuki, M., Aru, J., Larkum, M. E. Double-μ Periscope, a tool for multilayer optical recordings, optogenetic stimulations or both. Elife. 10, 72894(2021).
- Stibůrek, M., et al. 110 μm thin endo-microscope for deep-brain in vivo observations of neuronal connectivity, activity and blood flow dynamics. Nat Commun. 14 (1), 1897(2023).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。