大肠杆菌重组蛋白填充囊泡的优化生产和分析
摘要
本协议描述了细菌生产重组蛋白的详细方法,包括通常不溶性或含有二硫键的蛋白质,包装在细胞外膜结合的囊泡内。这有可能应用于科学研究的多功能领域,包括应用生物技术和医学。
摘要
这种创新系统使用短肽标签,从 大肠杆菌的膜结合囊泡中输出多种重组蛋白,为与细菌重组蛋白表达相关的一系列问题提供了有效的解决方案。这些重组囊泡在微环境中区隔蛋白质,促进细菌产生具有挑战性的、有毒的、不溶的或含有二硫键的蛋白质。与没有囊泡成核肽标签的典型细菌表达相比,蛋白质产量显着提高。囊泡包装蛋白的释放支持从培养基中分离,并允许长期的活性蛋白质储存。该技术提高了囊泡包装的功能蛋白的产量,简化了从应用生物技术到发现科学和医学的各种应用的下游加工。在本文中和相关视频中,提供了该方法的详细方案,其中重点介绍了该方法中最大化重组蛋白填充囊泡生产的关键步骤。
引言
革兰氏阴性细菌 大肠杆菌 是一种有吸引力的系统,用于工业和学术规模的重组蛋白生产。它不仅具有成本效益且易于分批培养至高密度,而且已经建立了广谱试剂、菌株、工具和启动子来促进 大肠杆菌1 中功能蛋白的产生。此外,合成生物学技术现在正在克服通常与应用翻译后修饰和复杂蛋白质折叠有关的障碍2。将重组蛋白靶向分泌到培养基中的能力对于提高产量和降低制造成本具有吸引力。将用户定义的蛋白质控制包装到膜囊泡中有助于应用生物技术和医疗行业中的产品和技术的开发。到目前为止,一直缺乏广泛适用的方法来分泌 大肠杆菌 3的重组蛋白。
Eastwood等人最近开发了一种基于肽标记的方法,用于从大肠杆菌1中生产和分离含重组蛋白的囊泡。 该囊泡成核肽(VNp)允许产生细胞外细菌膜囊泡,可以选择的重组蛋白靶向其中以简化目标蛋白的纯化和储存,并且允许比摇瓶培养物通常允许的产量显着更高。据报道,每升烧瓶培养物的重组蛋白产量接近 3 g,比使用缺乏 VNp 标签的等效蛋白质获得的产量高 >100 倍。这些富含重组蛋白质的囊泡可以从培养基中快速纯化和浓缩,并提供稳定的储存环境。该技术代表了大肠杆菌重组蛋白生产的重大突破。囊泡以可溶性和功能形式划分有毒和含二硫键的蛋白质,并支持简单、高效和快速纯化囊泡包装的功能蛋白质,以便长期储存或直接加工1。
与当前技术相比,该技术的主要优势是:(1)适用于各种大小(1 kDa至>100 kDa)和蛋白质类型;(2)促进蛋白质间和蛋白质内二硫键的形成;(3)适用于多蛋白复合物;(4)可与一系列启动子和标准实验室 大肠杆菌 菌株一起使用;(5)通常只有发酵培养物才能看到的摇瓶中蛋白质产量的产生;蛋白质被输出并包装成膜结合的囊泡,(6)为活性可溶性蛋白质的储存提供稳定的环境;(7)简化下游加工和蛋白质纯化。这种简单且具有成本效益的重组蛋白工具可能会对生物技术和医疗行业以及发现科学产生积极影响。
在这里,经过数年开发的详细协议描述了使用VNp技术从细菌中生产重组蛋白质填充囊泡的最佳条件。显示了该系统在实践中的示例图像,其中表达荧光蛋白,允许可视化生产,纯化和浓缩的不同阶段囊泡的存在。最后,提供了有关如何使用活细胞成像来验证细菌产生含有VNp融合的囊泡的指导。
研究方案
所进行的细菌工作遵循当地、国家和国际生物安全遏制法规,适合每种菌株的特定生物安全危害水平。
1. 选择不同的VNp
- 识别 VNp 序列。
注意:对于本研究,已经确定了三个VNp序列1 ,这些序列导致迄今为止检查的蛋白质的最大产量和囊泡输出:VNp2,VNp6和VNp15。目前尚不清楚为什么某些VNp变体对某些蛋白质比其他蛋白质更有效地发挥作用;因此,建议在感兴趣的新蛋白质与每个VNp变体(即VNp2,6或15)之间产生融合。
VNp2: MDVFMKGLSKAKEGVVAAAEKTKQGVAEA
AGKTKEGVL
VNp6: MDVFKKGFSIADEGVVGAVEKTDQGVTEA
AEKTKEGVM
VNp15: MDVFKKGFSIADEGVVGAVE
允许通过不同VNp氨基末端融合表达目标蛋白的质粒已经商业化(参见 材料表)。 - 设计一种克隆策略,将目的基因插入编码VNp的cDNA的3'端,或者通过将合成的VNp cDNA整合到编码目标蛋白的基因的第一个ATG密码子的上游来调整现有的质粒。使用1 中所述的方法。
- 对于有毒蛋白,请使用具有可抑制表达启动子的载体或具有最小未诱导表达噪声的促进剂。
- 克隆融合蛋白氨基末端的VNp序列标签。确保亲和标签、蛋白酶切割序列等和目标蛋白位于VNp标签的羧基侧。建议使用柔性接头区域将VNp与下游肽分离,例如-G-G-S-G-G-多肽序列的两个或三个重复序列(图1)。
注意:使用具有不靶向肽聚糖的抗生素选择的质粒,这会削弱细胞表面并降低囊泡产量。卡那霉素和氯霉素(见 材料表)是本研究的首选抗生素。
2. 细菌细胞培养和蛋白质诱导
注意:本协议中通常使用的细菌菌株是大肠杆菌BL21(DE3)或W3110。大肠杆菌细胞在溶原肉汤(LB)(10 g/L胰蛋白胨;10 g/L NaCl;5 g/L酵母提取物)或极好肉汤(TB)(12 g/L胰蛋白胨;24 g/L酵母提取物;4 mL/L 10%甘油;17 mM KH 2 PO 4;72 mM K2HPO 4,盐单独高压灭菌)培养基中培养(参见材料表)。图2显示了蛋白质诱导的每个步骤以及随后的分离和纯化过程的示例图像。
- 从37°C的新鲜细菌转化中培养5 mL LB发酵剂至饱和度,并用它们在500 mL锥形烧瓶中接种25 mL TB,所有这些都有适当的抗生素选择。
- 表面积:体积比是优化该系统的重要因素。使用尽可能大的培养瓶(例如,含有 1 L 培养物的 5 L 烧瓶;对于优化运行,在 500 mL 培养瓶中使用 25 mL 培养基)。
- 将较大的振荡瓶培养物在37°C的培养箱中以200rpm(≥25mm轨道抛出)振荡,直到达到0.8-1.0的600nm光密度值(OD600)。
注意:当细胞在37°C下生长时,精泡是最佳的。 然而,一些重组蛋白需要在较低的温度下表达。如果目标蛋白质是这种情况,则必须使用VNp6标签,因为这可以在低至25°C的温度下高产量囊泡输出。 - 为了诱导T7启动子的重组蛋白表达,加入异丙基β-D-1-硫代吡喃半乳糖苷(IPTG)至终浓度高达20μg/ mL(84μM)(参见 材料表)。重组蛋白表达的诱导必须在对数后期(即,典型的OD600 为0.8-1.0)发生,以产生囊泡。
注意:诱导期的长度可能因蛋白质而异,有些在4小时达到最大产量,有些则在过夜(18小时)时达到最大产量。迄今为止,在过夜培养物中已获得最大的囊泡输出。
3.重组囊泡分离
- 通过在3,000× g (4°C)下离心20分钟来沉淀细胞。
- 要对含囊泡的培养基进行灭菌以进行长期储存,请将清除的培养基通过无菌且不含洗涤剂的0.45μm聚醚砜(PES)过滤器(参见 材料表)。
注意:为了测试从含囊泡的滤液中排除活细胞,请平板到LB琼脂上并在37°C孵育过夜。 - 为了将囊泡浓缩成更小的体积,请将无菌含囊泡的培养基通过无菌且不含洗涤剂的0.1μm混合纤维素酯(MCE)过滤器(参见 材料表)。
- 使用细胞刮刀或塑料撒布器用 0.5-1 mL 无菌 PBS 轻轻清洗膜,小心地去除膜上的囊泡。转移到新鲜的微量离心管中。
注意:纯化的囊泡可以储存在4°C的无菌培养基或磷酸盐缓冲盐水(PBS)中。 有重组蛋白在这些囊泡中储存6个月的例子,以这种方式,酶活性没有损失。
4. 从分离的囊泡中释放可溶性蛋白质
- 一旦将含蛋白质的囊泡分离到无菌培养基/缓冲液中,使用适当的装置时间表(例如,6x 20 s开和关循环)对囊泡脂质膜进行超声处理,并在39,000× g (4°C)下离心20分钟以除去囊泡碎片。
注意:渗透休克或洗涤剂处理可用作打开囊泡的替代方案,但必须考虑对蛋白质功能和/或下游应用的影响。 - 如果VNp融合保持胞质且未释放到培养基中,请使用标准方案分离蛋白质(例如,将细胞沉淀重悬于5 mL适当的提取缓冲液(20 mM tris,500 mM NaCl)中,超声处理,并通过离心去除细胞碎片)。
5. 蛋白质浓度测定
- 通过凝胶密度分析测定蛋白质浓度 一式三份样品1.在考马斯染色的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶上与牛血清白蛋白(BSA)上样标准品一起运行。使用适当的软件(例如,图像J;参见 材料表)扫描和分析凝胶。
6. 通过荧光显微镜可视化囊泡形成和分离囊泡
注意:如果细胞含有荧光标记的VNp融合或膜标志物,则可以使用活细胞成像来跟踪囊泡形成。或者,荧光脂质染料可用于可视化囊泡以确认生产和纯化。
- 电池安装
- 诱导VNp融合表达数小时,然后安装到盖玻片上。
- 琼脂糖垫法(图3A-C):将细胞移液到薄(<1毫米)圆形LB-琼脂糖(2%)垫上,该垫已允许形成并设置在干净的载玻片上。让细胞沉降并平衡,并将50 mm x 25 mm盖玻片放在垫子和电池上。用垫片和胶带将盖玻片固定到位。
- 聚乙烯亚胺(PEI)方法(图3D-F):用移液器吸头将20μL0.05%PEI(dH2O)散布到盖玻片上,静置3-5分钟以结合玻璃而不干燥。加入 50 μL 细胞培养物并放置 5-10 分钟,以确保细菌与 PEI 包被的表面相关联4.在将盖玻片放在载玻片上之前,用 100 μL 培养基清洗盖玻片,并用垫片和胶带将其固定到位。
- 安装囊泡
- 将纯化的囊泡移液到薄(<1 mm)圆形LB-琼脂糖(2%)垫上,该垫已允许形成并设置在干净的载玻片上。液体干燥后,将50 mm x 25 mm盖玻片放在垫子和囊泡上。用垫片和胶带将盖玻片固定到位。
- 荧光脂质染料FM4-64能够染色膜5,因此可用于可视化囊泡。将FM4-64(参见材料表)以终浓度为2μM(来自溶解在二甲基亚砜[DMSO]中的2mM储备液)加入纯化的囊泡中,并在孵育10分钟后成像。这对于识别含有非荧光标记货物的囊泡特别有用5。
- 用用于培养观察到的细胞的相同培养基冲洗盖玻片。
注意:一些复杂介质(例如TB)可能表现出自发荧光,这可能导致背景信号过多。
- 对囊泡进行成像
注意:VNp重组囊泡的示例显微镜图像如图 4所示。- 使用油浸物镜将载玻片安装到倒置显微镜(见 材料表)上,静置2-3分钟,使样品沉降并使温度平衡。
注意:每个样品的所有活细胞成像必须在将细胞安装到盖玻片上后30分钟内完成,以尽量减少光毒性和厌氧应激的影响。因此,单平面图像优先于 z 堆栈。 - 使用适当的光源(例如,发光二极管[LED]或卤素灯泡;见 材料表)和滤光片组合,以用于所使用的荧光蛋白/染料6。
- 使用高放大倍率(即100x或150x)和高数值孔径(即NA ≥1.4)镜头对微生物细胞和囊泡进行成像。
- 确定可视化来自细胞和/或囊泡的荧光信号所需的最小光强度。这可能需要对正在使用的相机的曝光和增益设置进行一些调整。
注意:当前互补金属氧化物半导体(CMOS)相机的典型曝光时间在50-200毫秒之间变化,具体取决于成像系统。 - 对于单帧图像,请使用三图像平均来减少与硬件相关的随机背景噪声。
- 对于延时成像,在各个帧之间留出 3-5 分钟。
注意:根据显微镜设置,在较长的延时实验中可能需要间歇性调整焦点。
- 使用油浸物镜将载玻片安装到倒置显微镜(见 材料表)上,静置2-3分钟,使样品沉降并使温度平衡。
代表性结果
含有VNp6-mNeongreen表达构建体的BL21 DE3大肠杆菌生长到晚期对数期(图2A)。VNp6-mNeongreen表达是通过向培养物中加入IPTG(20μg/ mL或84μM终浓度)诱导的,随后在37°C下剧烈振荡(200rpm,≥25mm轨道抛掷)生长过夜。第二天早上,培养物显示mNeongreen荧光7(图2B),在通过离心去除细菌细胞后,其在培养基中仍然可见(图2C)。SDS-PAGE确认了培养物和清除培养基中VNp-mNeongreen的存在(图2D)。将含有mNeongreen的囊泡分离到0.1μm MCE过滤器上(图2E)并重悬于PBS中(图2F)。随后将纯化的囊泡安装在琼脂糖垫上(图3A-C)并使用宽场荧光显微镜成像(图4A)。使用亲脂性荧光染料FM4-64确认囊泡膜的存在(图4B)。表达与mNeongreen(绿色)和VNp6-mCherry2(品红色)融合的内膜蛋白CydB的大肠杆菌细胞8在活细菌细胞中显示出囊泡产生和货物插入(图4C)。图4A,B使用宽场荧光显微镜捕获,而图4C使用结构照明显微镜(SIM)获取,使用前面描述的方法9,10。
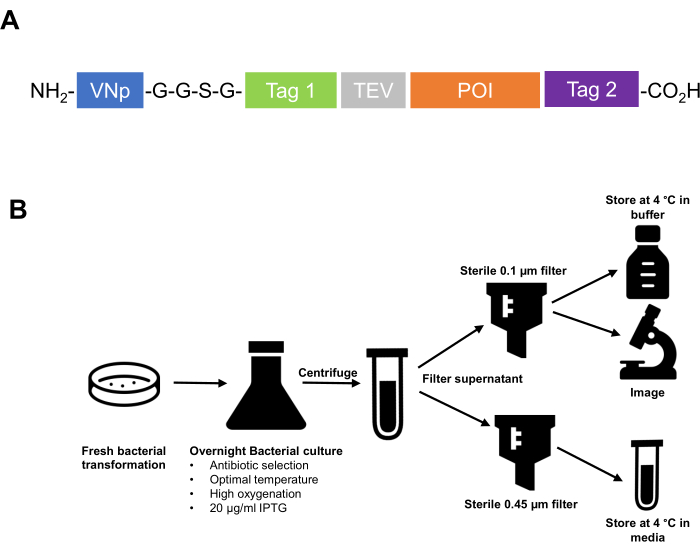
图1:从设计克隆策略到细胞外囊泡纯化和储存的VNp技术摘要 。 (A)典型VNp融合蛋白的示意图。在NH2末端使用VNp,然后是灵活的接头以及亲和力和荧光标签(Tag1,Tag 2,蛋白酶切割位点[例如TEV])和目标蛋白的适当组合。(B)总结了从 大肠杆菌中表达和纯化重组蛋白填充膜囊泡的方案的示意图。 请点击此处查看此图的大图。
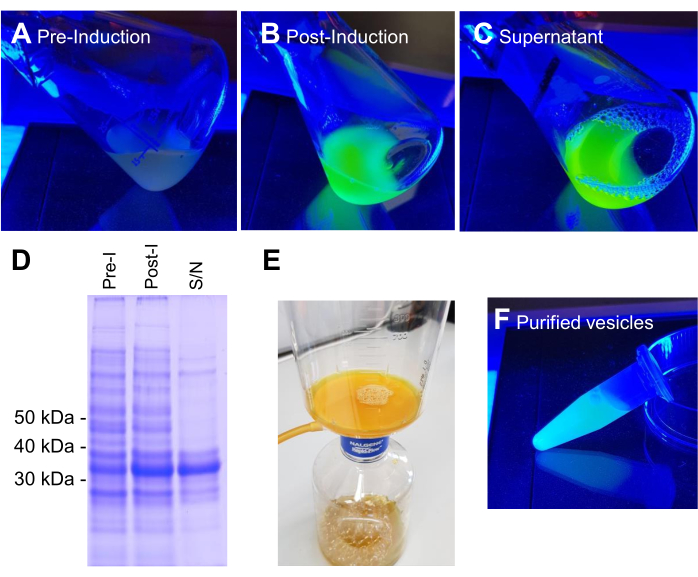
图2:VNp6-mNg囊泡的生产和纯化阶段。含有VNp-mNeongreen表达的大肠杆菌细胞培养物在(A)或(B)IPTG诱导的融合蛋白表达之前或之后在蓝光下构建。通过离心除去(B)中的细胞,在培养基(C)中留下VNp-mNeongreen填充的囊泡。(D)通过SDS-PAGE和考马斯染色分析来自A,B和C的等效样品。将囊泡分离到0.1μm过滤器(E)上,随后洗涤到适当体积的缓冲液(F)中。请点击此处查看此图的大图。
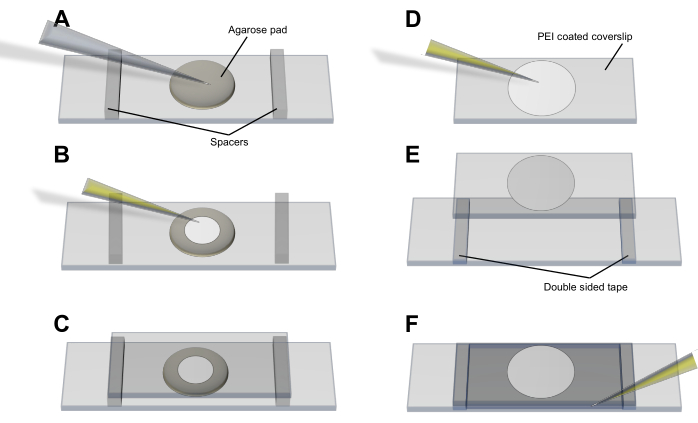
图3:用于成像囊泡和囊泡产生的细胞安装程序。 (A-C)琼脂糖垫法和(D-F)PEI法,用于将大肠杆菌细胞安装到盖玻片上。请点击此处查看此图的大图。
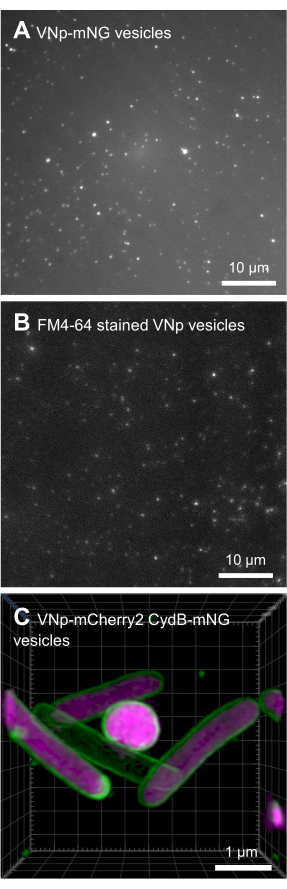
图4:VNp重组囊泡的显微镜图像。 来自安装在琼脂糖垫上的FM4-64标记的VNp6-mNeongreen囊泡的不同场的绿色(A)和红色(B)发射图像。(C)表达与mNeongreen(绿色)和VNp6-mCherry2(洋红色)融合的内膜蛋白CydB的大 肠杆菌 细胞成像显示活细菌细胞中的囊泡产生和货物插入。(A,B)使用宽场荧光显微镜成像,而(C)使用结构照明显微镜(SIM)获取。比例尺: (A,B) = 10 μm;(C) = 1 μm。 请点击此处查看此图的大图。
讨论
用于生产上述重组蛋白的氨基末端肽标记方法是一种简单的过程,其始终如一地产生大量蛋白质,这些蛋白质可以有效地分离和/或储存数月。
重要的是要强调协议中最佳使用该系统所需的关键步骤。首先,VNp标签1 必须位于N末端,然后是感兴趣的蛋白质和任何适当的标签。避免使用针对肽聚糖层的抗生素(如氨苄西林)也很重要。
在生长条件方面,富培养基(例如LB或TB培养基)和高表面积:体积比对于最大化囊泡产量是必要的。产生细胞外囊泡的最佳温度为37°C,但还必须考虑表达目标蛋白通常需要的条件。对于较低的感应温度,必须使用VNp6。至关重要的是,一旦细胞达到0.8-1.0的OD600 ,就必须使用不大于20μg/ mL(84μM)的IPTG来实现T7启动子的诱导。使用该系统表达的蛋白质在4小时或过夜诱导后达到最大囊泡产生。
尽管该协议很简单,但它需要优化。VNp变体融合、表达温度和诱导时间段可能因目标蛋白而异。此外,需要优化培养基中细胞外囊泡的纯化和随后的浓缩。当前过程不可扩展,并且可能很耗时。这些是这种方法的局限性。
与传统方法相比,VNp 技术具有许多优势2.它允许各种蛋白质的囊泡输出,迄今为止成功表达的最大大小为175 kDa(保留在内部的囊泡)和85 kDa(输出的囊泡)。此外,该技术可以显着提高具有一系列物理性质和活性的重组蛋白的产量。含有目标蛋白质的出口囊泡可以通过从预清除的培养基中简单过滤分离出来,随后可以在无菌培养基或缓冲液中在4°C下储存数月。
该系统的应用多种多样,从发现科学到应用生物技术和医学(例如,通过生产功能性疗法)3。易于生产、下游加工和高产量都是这些领域,尤其是工业领域的吸引力。
披露声明
作者声明没有相互竞争的经济利益或其他利益冲突。
致谢
作者感谢不同的Twitter用户,他们对描述VNp技术的论文中提出的协议提出了问题。 图 1A 是使用 flaticon.com 中的图标生成的。这项工作得到了肯特大学的支持和生物技术和生物科学研究理事会的资助(BB/T008/768/1和BB/S005544/1)。
材料
| Name | Company | Catalog Number | Comments |
| Ampicillin | Melford | 69-52-3 | |
| Chloramphenicol | Acros Organics (Thermofisher Scientific) | 56-75-7 | |
| E. coli BL21 (DE3) | Lab Stock | N/A | |
| E. coli DH10β | Lab Stock | N/A | |
| Filters for microscope | Chroma | ||
| FM4-64 | Molecular Probes (Invitrogen) | T-3166 | Dissolved in DMSO, stock concentration 2 mM |
| ImageJ | Open Source | Downloaded from: https://imagej.net/ij/index.html | |
| Inverted microscope | Olympus | ||
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Melford | 367-93-1 | |
| Kanamycin sulphate | Gibco (Thermofisher Scientific) | 11815-024 | |
| LED light source for micrscope | Cairn Research Ltd | ||
| Lysogeny Broth (LB) / LB agar | Lab Stock | N/A | 10 g/L Tryptone; 10 g/L NaCl; 5 g/L Yeast Extract (1.5 g/L agar) |
| Metamorph imaging software | Molecular Devices | ||
| MF-Millipore Membrane filter (0.1 µm, MCE) | Merck | VCWP04700 | |
| Millipore Express PLUS membrane filter (0.45 µm, PES) | Merck | HPWP04700 | |
| Phosphate buffered saline (PBS) | Lab Stock | N/A | |
| Plasmids allowing expression of protein of interest with different VNp amino terminal fusions | Addgene | https://www.addgene.org/Dan_Mulvihill/ | |
| Terrific Broth (TB) | Lab Stock | N/A | 12 g/L Tryptone; 24 g/L Yeast Extract; 4 ml/L 10% glycerol; 17 mM KH2PO4 72 mM K2HPO4 |
参考文献
- Eastwood, T. A., et al. High-yield vesicle-packaged recombinant protein production from E. coli. Cell Reports Methods. 3 (2), 100396 (2023).
- Makino, T., Skretas, G., Georgiou, G. Strain engineering for improved expression of recombinant proteins in bacteria. Microbial Cell Factories. 10, 32 (2011).
- Peng, C., et al. Factors influencing recombinant protein secretion efficiency in gram-positive bacteria: Signal peptide and beyond. Frontiers in Bioengineering and Biotechnology. 7, 139 (2019).
- Lewis, K., Klibanov, A. M. Surpassing nature: rational design of sterile-surface materials. Trends in Biotechnology. 23 (7), 343-348 (2005).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6 (3), 365-371 (1996).
- Mulvihill, D. P. Live cell imaging in fission yeast. Cold Spring Harbor Protocols. 2017 (10), (2017).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10 (5), 407-409 (2013).
- Shen, Y., Chen, Y., Wu, J., Shaner, N. C., Campbell, R. E. Engineering of mCherry variants with long Stokes shift, red-shifted fluorescence, and low cytotoxicity. PloS One. 12 (2), e0171257 (2017).
- Periz, J., et al. A highly dynamic F-actin network regulates transport and recycling of micronemes in Toxoplasma gondii vacuoles. Nature Communications. 10 (1), 4183 (2019).
- Qiu, H., et al. Uniform patchy and hollow rectangular platelet micelles from crystallizable polymer blends. Science. 352 (6286), 697-701 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。