一种适用于表征放线菌噬菌体感染的基于光密度的微孔板测定
摘要
描述了一种基于光密度的微孔板方法,用于量化噬菌体存在下的长期细菌生长,适用于放线菌和其他生长缓慢的细菌。此方法包括减少蒸发和盖冷凝的修改,以及用于计算病毒感染指标的 R 代码,包括曲线下面积、生长最大值和相对毒力。
摘要
噬菌体是自然环境的关键部分,它们具有塑造细菌种群的强大能力。为了了解单个噬菌体如何与缓慢生长的细菌宿主(如放线菌)相互作用,需要一种简单可靠的方法来量化噬菌体存在下的长期细菌生长。分光光度酶标仪可实现高通量重复测量,但长时间孵育小体积可能会带来技术挑战。该程序适应标准的96孔微孔板,以允许噬菌体和细菌的共同培养而无需子采样96小时,每8小时使用分光光度法吸光度值记录细菌生长。使用R分析这些光密度值以产生感染指标,包括生长抑制百分比,相对毒力和Stacy-Ceballos指数。这里概述的方法提供了一种有效的方法来进行和分析延长持续时间的微孔板生长曲线实验,并包括减少蒸发和盖冷凝的修改。这些协议有助于基于微孔板的缓慢生长细菌宿主与其噬菌体之间相互作用的测定。
引言
噬菌体或噬菌体是感染细菌的病毒。它们是地球上数量最多的生物实体1,人们普遍认为噬菌体会影响细菌进化和生态系统过程2,3,4。有几种方法可以描述、测量和分析噬菌体宿主范围8和感染动力学5,6,包括基于琼脂的方法,例如双层琼脂方法7和基于光密度的微孔板方法8,9,10,11,12.每种方法都有自己的优点和缺点。由于其效率,使用双层琼脂法的铺板测试是宿主范围测定的“金标准”,但这种方法是时间和劳动密集型的9。快速微孔板方法可在 24 小时或更短的时间内返回结果,对于快速生长的细菌宿主(例如大肠杆菌9,10,11,12)提供出色的结果,但太短而无法显示生长较慢的细菌宿主(如放线菌7,13,14,15)中的噬菌体感染进展。
专为快速生长的细菌设计的基于光密度的微孔板测定无法运行数天来表征生长缓慢的宿主细菌中的感染动力学,而不会发生蒸发并产生人为的高细菌密度。因此,获得有关缓慢生长细菌物种的噬菌体感染动态的可比高通量数据需要适用于这些细菌的专门技术。
这里介绍的微孔板方法减少了蒸发,从而允许缓慢生长的细菌与噬菌体共培养96小时,并能够研究噬菌体感染动力学和宿主范围。该方法还展示了Stacy-Ceballos指数16,这是一种基于光密度的指标,可以在不同的宿主病毒系统之间进行毒力比较。
研究方案
虽然该协议是为Gordonia terrae编写的,但它也已成功用于Gordonia lacunae,Gordonia rubripertincta和Gordonia westfalica。
1. 细菌制备
- 在生物安全柜中,使用良好的微生物学规范17 将戈 登氏 菌 CAG3 的单个菌落接种到 1 L 无菌挡板烧瓶中,其中装有 200 mL 蛋白胨酵母钙肉汤18(PYCa),含有 0.01 mg/mL 环己酰亚胺(参见 材料表)。
- 将烧瓶在30°C下以250rpm振荡孵育,直到培养物饱和或3天7。
- 在 PYCa 肉汤中连续稀释饱和的 G. terrae 培养物,并在 PYCa 平板19,20 上铺平板 100 μL 10−4、10−5 和 10−6 稀释液。将未稀释的饱和培养物在4°C下冷藏。
- 将倒置的展开板在30°C下孵育3天。
- 孵育后,确定一个“可数板”,即具有20-200个菌落的板。计算该板上的菌落数,并计算每毫升的菌落形成单位(cfu/mL)19,20。
- 用 PYCa 肉汤将饱和培养物稀释至 4.0 x 106 cfu/mL 细菌。
2. 噬菌体制备
注意:报告的代表性结果是用 Gordonia 噬菌体DelRio 21获得的,DelRio21是在 G. terrae上分离的温带噬菌体。这些方法也已成功与其他 戈登菌 体一起使用。
- 从分离的噬菌体开始,将噬菌体样品在噬菌体缓冲液7中连续稀释至1 x 10−8稀释。通过用 10 μL 的每种噬菌体稀释液感染 0.3 mL 饱和 G. terrae 培养物来进行双层琼脂噬菌体滴度测定7。室温孵育5-10分钟后,将细菌-噬菌体混合物与3mL PYCa顶级琼脂混合,倒入PYCa琼脂平板上。
- 将板在30°C下倒置孵育3天或直到形成斑块7。
- 孵育后,确定一个“可数板”,即具有20-200块斑块的板。计算该板上的斑块数量,并计算每毫升的斑块形成单位(pfu/mL)7。
3. 微孔板制备
注意:此方法应使用平底96孔微孔板(参见 材料表)。所有板的制备和装载必须在生物安全柜中完成,并且应使用良好的微生物学规范17。
- 通过混合 100 μL Triton-X 100、40 mL 100% 异丙醇和 160 mL 去离子水制备防雾盖涂层溶液22.搅拌混合,并在室温下储存。
- 在生物安全柜中,将 6 mL 的盖子涂层溶液添加到无菌 96 孔微孔板盖的内表面,握住盖子的边缘并旋转以确保其被溶液覆盖。让溶液在盖子上静置20秒,然后将溶液倒出,并将盖子倒在高压灭菌的纸巾上以一定角度,直到盖子完全干燥,这通常需要35-45分钟。小心握住盖子的边缘。
- 为每个 96 孔微孔板准备 20 mL 0.1% 琼脂糖水溶液,微波融化琼脂糖。
- 琼脂糖冷却至50-60°C后,将100μL的0.1%琼脂糖移液到板孔之间的所有空间中,将200μL琼脂糖移液到A行和H行以及第1列,第2列,第11列和第12列23 的孔中(图1)。
4.用细菌和噬菌体装载板
注意:所有板的制备和装载必须在生物安全柜中完成,并且应使用良好的微生物规范17 。
- 96 孔板每孔中将包含 75 μL 的 2.0 x 106 cfu/mL 细菌9。将 4.0 x 106 cfu/mL 细菌培养物与 2x PYCa 肉汤 1:1 稀释至 2.0 x 106 cfu/mL。每 96 孔板制备 5 mL。
- 使用噬菌体缓冲液7 稀释噬菌体裂解物,制成 2.0 x 106 pfu/mL、2.0 x 105 pfu/mL 和 2.0 x 104 pfu/mL 浓度各 1 mL。这将允许微孔板9 内的感染多重性 (MOI) 为 1、0.1 和 0.01。
- 要加载微孔板,取用防雾溶液和琼脂糖制备的板,并将 75 μL 的 2.0 x 106 cfu /mL 细菌移液到 3-10 列中,如图 1 所示。
- 如图 1所示,向第3列和第4列中加入75 μL无菌噬菌体缓冲液,作为无噬菌体阳性对照,并在每次加入后上下移液混合。向第 5 列和第 6 列中加入 75 μL 2.0 x 106 pfu/mL 噬菌体,向第 7 列和第 8 列中加入 75 μL 2.0 x 105 pfu/mL 噬菌体,向第 9 列和第 10 列中加入 75 μL 2.0 x 104 pfu /mL 噬菌体,每次加入后上下移液混合。
- 用 0.5 英寸的标签胶带将板的两个短边都粘住,以部分密封板,同时允许气体交换。
5. 孵育和吸光度测量
- 一旦板装载细菌和噬菌体,将它们以250rpm的速度放在微孔板振荡器上,并在30°C下孵育。
- 孵育板96小时,从第16小时开始每8小时在酶标仪上以600nm处进行光密度测量。在测量之间将板放回摇床。
注意:从第0小时开始评估4,h 6 h,8 h和12 h的测量周期,并确定从感染后16小时开始的8小时采样周期最好地捕获 了Gordonia-噬菌体相互作用。 - 在整个实验过程中监测盖子是否有冷凝。如果观察到冷凝,请根据步骤3.2用另一个涂覆的盖子更换盖子。
- 按照协议第6节生成对照和感染的生长曲线。
6. 数据分析
- 使用电子表格程序按照 Stacy-Ceballos-Index GitHub 存储库 (https://github.com/eichristenson/Stacy-Ceballos-Index) 中的电子表格布局计算每种噬菌体稀释液的平均值和标准偏差。
- 创建对照和感染生长曲线,并使用 R(请参阅材料表)和 DescTools 24、dplyr 25、ggplot226 和 readxl 27 软件包,并按照 Stacy-Ceballos-Index GitHub 存储库 (https://github.com/eichristenson/Stacy-Ceballos-Index) 中的 R 脚本计算感染指标。
- AUCcon 是未感染对照曲线下的面积,而 AUCinf 是感染曲线16 下的面积。计算AUC,然后使用以下公式根据曲线下面积值PIAUC16计算生长抑制百分比:
(1 - [AUCinf/AUCcon]) × 100 - 每条曲线上的水平虚线显示生长峰值,未感染的生长峰标记为N渐近线(con), 感染的生长峰标记为N渐近线(inf)。 确定 N渐近 线值,然后使用以下公式根据这些峰值生长值 PImax16 计算生长抑制百分比:
(1 - [N 渐近线(inf)/ N渐近线(con)]) × 100 - 根据 PIAUC 和 PI最大值计算 Stacy-Ceballos 指数 I SC 16,如下所示:
(PIAUC ×PI 最大值)0,5
通过整合 Stacy-Ceballos 指数随时间变化来计算相对毒力16.
- AUCcon 是未感染对照曲线下的面积,而 AUCinf 是感染曲线16 下的面积。计算AUC,然后使用以下公式根据曲线下面积值PIAUC16计算生长抑制百分比:
代表性结果
如果所得生长曲线显示阳性对照细菌种群随时间增加且吸光度没有突然波动,则实验成功。在MOI为1的情况下,有和没有生产性噬菌体感染的成功实验示例分别显示在图 2 和 图3中。 MOI 为 0.01 的生产性感染如图 4 所示。在所有三个图中都可以看到的阳性对照生长模式(绿色曲线)表明细菌正在生长,它们在生长过程中没有结块,并且不存在污染物。结块和污染表现为单个时间点异常高的吸光度。标准偏差通常会随着实验的时间过程而增加;然而,对照曲线和感染曲线之间的急剧增加或标准偏差重叠可能表明一个或多个孔中存在污染或结块。
描述生产性噬菌体感染的生长曲线( 如图2所示)显示,添加噬菌体的孔中的细菌吸光度随时间推移而降低。如果细菌超出噬菌体的宿主范围,则不会看到细菌密度的降低,如图 3所示。
显示了所有代表性实验的感染指标,图2和图4中的生产性感染的I SC相对较大,图3中没有有效感染宿主细菌的噬菌体的ISC非常小。
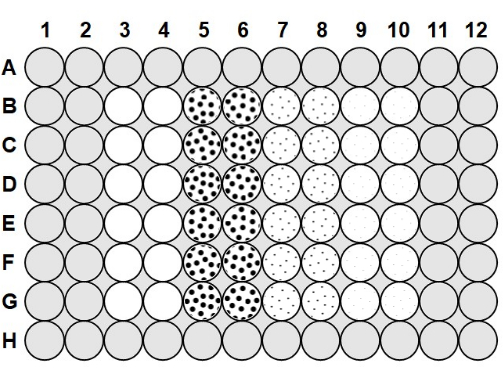
图1:微孔板布局。 灰色区域填充0.1%琼脂糖。第 3 列和第 4 列中的空白孔是仅含有噬菌体缓冲液和 2.0 x 106 cfu/mL 细菌的无噬菌体阳性对照孔。虚线孔含有噬菌体和 2.0 x 106 cfu/mL 细菌;第 5 列和第 6 列中的大点表示 MOI 为 1,2.0 x 106 pfu/mL 噬菌体;第 7 列和第 8 列中的培养基点表示 2.0 x 105 pfu/mL 噬菌体的 MOI 为 0.1;第 9 列和第 10 列中的小点表示 MOI 为 0.01,噬菌体为 2.0 x 104 pfu/mL。 请点击此处查看此图的大图。
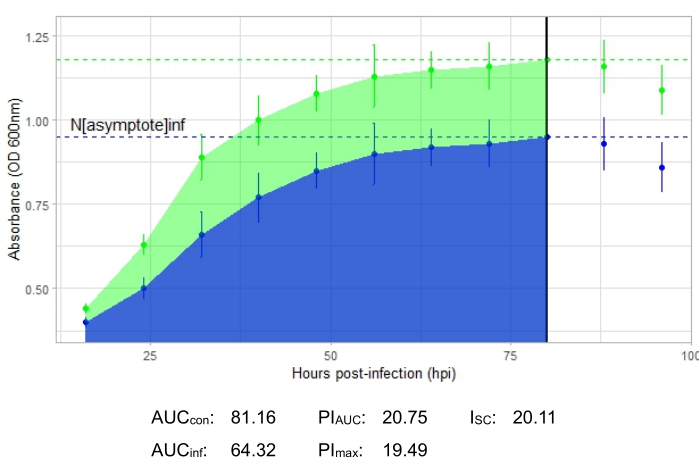
图 2:使用MOI为1的噬菌体进行成功的生长曲线实验,该噬菌体可有效感染宿主细菌。 显示未感染细菌(绿色)和添加噬菌体的细菌(蓝色)的平均吸光度值(±标准偏差)。缩写:AUC = 曲线下的面积;PIAUC = 根据曲线下面积计算的生长抑制百分比;N渐近 线=峰值生长值;PImax = 根据峰值生长值计算的生长抑制百分比;ISC = Stacy-Ceballos 指数。这张图代表了温带 戈登尼亚 噬菌体DelRio感染G . terrae,它是被分离的细菌。 请点击此处查看此图的大图。
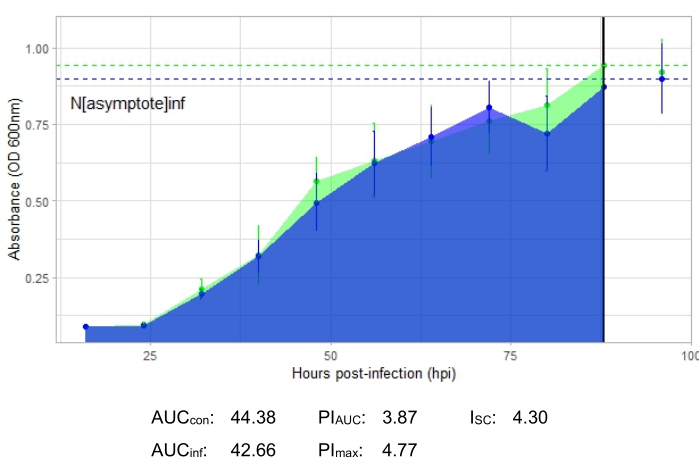
图 3:使用MOI为1的噬菌体进行成功的生长曲线实验,该噬菌体不能有效感染宿主细菌。 显示未感染细菌(绿色)和添加噬菌体的细菌(蓝色)的平均吸光度值(±标准偏差)。缩写:AUC = 曲线下的面积;PIAUC = 根据曲线下面积计算的生长抑制百分比;N渐近 线=峰值生长值;PImax = 根据峰值生长值计算的生长抑制百分比;ISC = Stacy-Ceballos 指数。该图代表DelRio的 G. rubripertincta 感染。 请点击此处查看此图的大图。
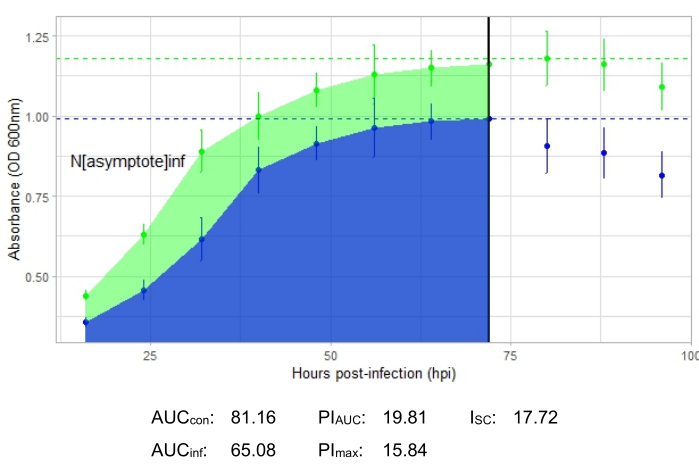
图 4:使用 MOI 为 0.01 的噬菌体进行成功的生长曲线实验。 显示未感染细菌(绿色)和添加噬菌体的细菌(蓝色)的平均吸光度值(±标准偏差)。缩写:AUC = 曲线下的面积;PIAUC = 根据曲线下面积计算的生长抑制百分比;N渐近 线=峰值生长值;PImax = 根据峰值生长值计算的生长抑制百分比;ISC = Stacy-Ceballos 指数。这张图代表DelRio的 G. terrae 感染。 请点击此处查看此图的大图。
讨论
这种基于光密度的微孔板方法允许研究噬菌体宿主范围和感染动力学11,并显示了Stacy-Ceballos指数16作为噬菌体毒力的衡量标准。虽然该方法可以与任何噬菌体宿主系统一起使用,但它专门设计用于适应快速微孔板生长测定9,10,11,以用于生长较慢的细菌,如放线菌。快速微孔板测定不能用于缓慢生长的细菌,除非进行修改以解决蒸发和盖子冷凝。该方法描述了这些必要的修改,并首次证明了使用Stacy-Ceballos指数和相关指标16来描述噬菌体感染。
在多天 96 孔板生长曲线测定中,蒸发可能是一项重大挑战;该方法通过将琼脂糖添加到边界孔和孔之间的空间来解决此问题。琼脂糖边缘与防雾盖处理22相结合,在微孔板内提供必要的湿度,并允许可靠的光密度测量。在不增加湿度的情况下,在所需的漫长孵育期内发生大量的边缘效应蒸发23 ,导致人为的高光密度读数。防雾盖处理是必要的修改,因为盖子冷凝也会人为地提高光密度值。在孵育期间摇动平板是推荐的修改,因为放线菌细菌在生长过程中可能会聚集,从而人为地提供高光密度值并有效降低感染的多重性。
在表征感染动力学的实验中,细菌与噬菌体的比例至关重要,因为必须有足够的噬菌体来显示感染效果,但不能太多,以至于宿主细菌种群立即崩溃9或溶原频率显着增加28。在这种方法中,发现对获得一致结果最有效的比率是MOI为1,但MOI为0.1和0.01时也获得了可用结果。实施该方法时,建议选择一种细菌浓度,并在0.01-19,10,11的MOI范围内测试多种噬菌体浓度。
这里描述的这种技术允许在高通量微孔板测定中评估噬菌体 - 宿主相互作用中生长缓慢的细菌,而不是在每个测量间隔29从较大的培养瓶中子采样。此外,通过演示如何适应微孔板生长测定9,10,11,该技术增加了其他基于微孔板的噬菌体测定对生长较慢的细菌的效用,包括噬菌体表征5,6,12和进化研究30,31。最后,该方法演示了使用Stacy-Ceballos指数16来描述噬菌体感染。该指标最初是使用来自古菌病毒模型系统的数据开发的,并根据光密度值计算得出,因此在不同的病毒系统中具有广泛的实用性。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了NSF DBI生物整合研究所(BII)资助(第2119968号;PI-Ceballos)和阿肯色州INBRE计划,由国家普通医学科学研究所(NIGMS)资助,P20 GM103429来自美国国立卫生研究院。作者还感谢瓦奇塔浸会大学帕特森暑期本科生研究项目的支持。
材料
| Name | Company | Catalog Number | Comments |
| Agarose | Omni-Pur | 2090 | for filling border wells of microplate |
| Costar 96 Well Lid Low Evaporation Corner Notch | Corning | 3931 | replacement microplate lid |
| Isopropanol | Fisher Chemical | A461-4 | for lid coating |
| Microplate reader | Tecan Spark 20M | ||
| Microplate Shaker with 4-Place Platform | Thermo Fisher Scientific | 88-861-023 | to shake plates during incubation |
| Non-Tissue Culture-Treated Plate 96 well | Falcon (a Corning Brand) | 351172 | microplate for growth curve assay |
| Peptone yeast calcium (PYCa) agar | Homemade | 1 g peptone 15 g yeast extract 15 g agar 990 mL dd H2O 4.5 mL 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) broth | Homemade, from Reference 16 | 1 g peptone 15 g yeast extract 990 mL dd H2O 4.5 ml 1 M CaCl2 2.5 mL 40% dextrose 1 mL 10 mg/mL cycloheximide | |
| Peptone yeast calcium (PYCa) top agar | Homemade | 1 g peptone 15 g yeast extract 4 g agar 990 mL dd H2O 4.5 mL 1M CaCl2 2.5 mL 40% dextrose | |
| Petri plates | Thermo Fisher Scientific | FB0875713 | for determination of bacterial concentration and phage titer assay |
| Phage Buffer | Homemade, from Reference 7 | 10 mL 1 M Tris, pH 7.5 10 mL 1 M MgSO4 4 g NaCl 980 ml dd H2O | |
| R software | https://www.r-project.org/ | version 4.3.0 | |
| Sterile Disposable PETG Flask Baffled Bottom w/Vented Closure | Thermo Fisher Scientific | 4116-1000 | for bacterial culture |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | for lid coating |
参考文献
- Mushegian, A. R. Are there 1031 virus particles on Earth, or more, or fewer. Journal of Bacteriology. 202 (9), e00052-e00020 (2020).
- Chevallereau, A., Pons, B. J., van Houte, S., Westra, E. R. Interactions between bacterial and phage communities in natural environments. Nature Reviews Microbiology. 20 (1), 49-62 (2022).
- Olszak, T., Latka, A., Roszniowski, B., Valvano, M. A., Drulis-Kawa, Z. Phage life cycles behind bacterial biodiversity. Current Medicinal Chemistry. 24 (36), 3987-4001 (2017).
- Weitz, J. S., et al. Phage-bacteria infection networks. Trends in Microbiology. 21 (2), 82-91 (2013).
- Turner, P. E., Draghi, J. A., Wilpiszeski, R. High-throughput analysis of growth differences among phage strains. Journal of Microbiological Methods. 88 (1), 117-121 (2012).
- Storms, Z. J., Teel, M. R., Mercurio, K., Sauvageau, D. The virulence index: A metric for quantitative analysis of phage virulence. PHAGE. 1 (1), 27-36 (2020).
- . Phage Discovery Guide Available from: https://seaphagesphagediscoveryguide.helpdocsonline.com/home (2012)
- Martinez-Soto, C. E., et al. PHIDA: A high throughput turbidimetric data analytic tool to compare host range profiles of bacteriophages isolated using different enrichment methods. Viruses. 13 (11), 2120-2137 (2021).
- Rajnovic, D., Muñoz-Berbel, X., Mas, J. Fast phage detection and quantification: An optical density-based approach. PLoS One. 14 (5), e0216292 (2019).
- Xie, Y., Wahab, L., Gill, J. J. Development and validation of a microtiter plate-based assay for determination of bacteriophage host range and virulence. Viruses. 10 (4), 189-204 (2018).
- Sørensen, P. E., et al. Classification of in vitro phage-host population growth dynamics. Microorganisms. 9 (12), 2470-2486 (2021).
- Konopacki, M., Grygorcewicz, B., Dołęgowska, B., Kordas, M., Rakoczy, R. PhageScore: A simple method for comparative evaluation of bacteriophages lytic activity. Biochemical Engineering Journal. 161, 107652 (2020).
- Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T., Williams, S. T. . Bergey's Manual of Determinative Bacteriology., 9th edition. , (1994).
- Fusconi, R., Godinho, M. J. L., Bossolan, N. R. S. Culture and exopolysaccharide production from sugarcane molasses by Gordonia polyisoprenivorans CCT 7137, isolated from contaminated groundwater in Brazil. World Journal of Microbiology and Biotechnology. 24 (7), 937-943 (2007).
- Bujold, A. R., Lani, N. R., Sanz, M. G. Strain-to-strain variation of Rhodococcus equi growth and biofilm formation in vitro. BMC Research Notes. 12 (1), 519 (2019).
- Ceballos, R. M., Stacy, C. L. Quantifying relative virulence: When µmax fails and AUC alone just is not enough. Journal of General Virology. 102 (1), 001515 (2021).
- Siddiquee, S. The basic concept of microbiology. Practical Handbook of the Biology and Molecular Diversity of Trichoderma Species from Tropical Regions. , 1-15 (2017).
- Petrovski, S., Seviour, R. J., Tillett, D. Genome sequence and characterization of the Tsukamurella bacteriophage TPA2. Applied and Environmental Microbiology. 77 (4), 1389-1398 (2011).
- Growth curves: Generating growth curves using colony forming units and optical density measurements. JoVE Science Education Database. Microbiology Available from: https://www.jove.com/v/10511/growth-curvesgenerating-growth-curves-using-colony-forming-units (2023)
- Preparing spread plates protocols. American Society for Microbiology Available from: https://asm.org/ASM/media/Protocol-Images/Preparing-Spread-Plates-Protocols.pdf (2006)
- Mathes, H. N., et al. Complete genome sequences of Chop, DelRio, and GrandSlam, three Gordonia phages isolated from soil in Central Arkansas. Microbiology Resource Announcements. 12 (5), e0002323 (2023).
- Krishnamurthi, V. R., Niyonshuti, I. I., Chen, J., Wang, Y. A new analysis method for evaluating bacterial growth with microplate readers. PLoS One. 16 (1), 0245205 (2021).
- DescTools: Tools for descriptive statistics, R package version 0.99.49. DescTools Available from: https://CRAN.R-project.org/package=DescTools (2023)
- . dplyr: A grammar of data manipulation, R package version 1.1.2 Available from: https://CRAN.R-project.org/package=dplyr (2023)
- . ggplot2: Create elegant data visualisations using the grammar of graphics, R package version 3.4.2 Available from: https://CRAN.R-project.org/package=ggplot2 (2023)
- . readxl: Read excel files, R package version 1.4.2 Available from: https://CRAN.R-project.org/package=readxl (2023)
- Yao, T., Coleman, S., Nguyen, T. V. P., Golding, I., Igoshin, O. A. Bacteriophage self-counting in the presence of viral replication. Proceedings of the National Academy of Sciences of the United States of America. 118 (51), 2104163118 (2021).
- Fang, Q., Feng, Y., McNally, A., Zong, Z. Characterization of phage resistance and phages capable of intestinal decolonization of carbapenem-resistant Klebsiella pneumoniae in mice. Communications Biology. 5, 48 (2022).
- Burrowes, B. H., Molineux, I. J., Fralick, J. A. Directed in vitro evolution of therapeutic bacteriophages: The Appelmans protocol. Viruses. 11 (3), 241 (2019).
- Shapiro, J. W., Williams, E. S. C. P., Turner, P. E. Evolution of parasitism and mutualism between filamentous phage M13 and Escherichia coli. PeerJ. 4, e2060 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。