体外研究 胎儿人体血管芯片模型研究发育机械生物学
摘要
这里描述的是将内皮细胞与人多能干细胞区分开来的简单工作流程,然后是其机械刺激的详细方案。这允许研究内皮细胞的发育机制生物学。该方法与机械刺激后从培养芯片收集的活细胞的下游测定兼容。
摘要
心脏是发育过程中第一个功能建立的器官,因此在妊娠早期就启动了血液循环。除了运输氧气和营养物质以确保胎儿生长外,胎儿循环还通过机械线索控制内皮层内发生的许多关键发育事件。生物力学信号诱导血管结构变化,建立动静脉规范,控制造血干细胞的发育。发育中的组织无法接近限制了对循环在人类早期发育中的作用的理解;因此, 体外 模型是研究船舶机械生物学的关键工具。本文描述了一种将内皮细胞与人诱导的多能干细胞区分开来的方案,并将其随后接种到流体装置中以研究它们对机械线索的反应。这种方法允许在机械刺激下长期培养内皮细胞,然后取回内皮细胞以进行表型和功能表征。这里建立的 体外 模型将有助于阐明细胞内分子机制,这些机制转导由机械线索介导的信号传导,最终协调人类胎儿生命中的血管发育。
引言
在胚胎发育过程中,心脏是第一个建立功能的器官1,从心内膜管形成的最早阶段2 开始就可检测到收缩。循环,以及由血管内血液流动介导的机械线索,控制着早期发育的许多关键方面。在胎儿循环建立之前,脉管系统被组织成一个初级毛细血管丛;心脏功能正常后,该神经丛重组为静脉和动脉脉管系统3。机械线索在动静脉规范中的作用反映在血流开始前动脉和静脉标志物的泛内皮表达4.
血流动力学不仅控制着脉管系统本身的发育,而且在控制血细胞形成中起着基础性作用。造血干细胞和祖细胞 (HSPC) 从称为造血内皮细胞5、6、7、8 的特殊内皮细胞中出现,仅在发育早期存在于胚胎的不同解剖区域。心脏缺陷模型与体外模型一起证明,机械线索指示并增加血液源性内皮细胞 HSPC 的产生 9,10,11,12,13,14。
不同类型的血流动力学已被证明可以差异控制细胞周期15,已知在血源性内皮 16,17 和动脉细胞规范18 中都很重要。总而言之,机械线索是发育过程中细胞身份和功能的关键决定因素。新型体外流体装置使我们能够克服在体内人类血液发育过程中研究发育机械生物学的局限性。
本手稿中方案的总体目标是逐步描述实验管道,以研究剪切应力对 体外 来源于人诱导多能干细胞(hiPSC)的人内皮细胞的影响。该方案包含有关将hiPSC分化为内皮细胞及其随后接种到用于刺激方案的流体芯片中的详细说明。使用这种方法,可以通过分析不同的 体外来源的内皮细胞响应流动的方向来测试它们感知剪切应力的能力。这将使其他实验室能够解决有关剪切应力的响应及其对不同内皮细胞身份的功能影响的问题。
研究方案
注意:所有细胞培养技术必须在无菌条件下在层流罩中进行,并且细胞必须在37°C下在含有5%CO2的腐殖化气氛中孵育。所有用于维持的细胞因子制备 (rhbFGF) 和分化方案(rhBMP4、rhVEGF、rhbFGF、rhIL6、rhFLT3L、rhIGF1、rhIL11、rhSCF、rhEPO、rhTPO、rhIL3)的说明见 补充表 S1。
1. hiPSC的培养 - 细胞的解冻、维持和冷冻
- 制备维持培养基、生长因子和其他试剂
- 通过将全 hESC 无血清培养基补充剂、36 mL 25% 牛血清白蛋白 (BSA) 和 1 mL 55 mM β-巯基乙醇加入 Dulbecco 改良的 Eagle 培养基/F12 (DMEM/F-12) 基础培养基中来制备培养基(参见 材料表)。
- 将 1mgRho激酶抑制剂 (iRock)重悬于1mL DMSO中,制备50μL的等分试样,并将其储存在-20°C。
注意:这些等分试样可以在-20°C下保存1年。解冻后,它们可以在4°C下保存1周。 - 在-80°C储存之前,在冰上解冻玻连蛋白(VTN-N)溶液,每瓶分装60μL。 在涂覆板之前,将 60 μL 原液稀释在 6 mL Dulbecco 磷酸盐缓冲盐水 (DPBS) 中;终浓度为5μg/mL。
- hiPSC细胞系解冻
注:人类多能干细胞系SFCi55以前是内部衍生的,广泛用于分化成各种细胞类型和不同的胚胎谱系19,20,21,22。- 在37°C下用1mL VTN-N溶液包被6孔板的一个孔1小时。
注:孵育后,包被的板可以在4°C下储存长达1周。 - 用吸液管吸出VTN-N溶液,加入1mL补充有20ng / mL rhbFGF的预热培养基(补充表S1)。
- 在水浴中快速解冻含有hiPSC的小瓶,并将细胞转移到5mL预热的培养基中。
- 在室温下以300× g 旋转细胞3分钟。
- 将细胞沉淀重悬于补充有 20 ng/mL rhbFGF 的 0.5 mL 培养基中。
- 将细胞转移到一个已经含有 1 mL 培养基的包被孔中。
- 在总共 1.5 mL 培养基中将 5 μL iRock 加入含有细胞的孔中。
- 在培养箱中培养细胞,在一周内每天更换培养基,并加倍喂养细胞,向细胞中加入两倍于正常体积的培养基,以确保周末喂养。
注意:细胞仅在iRock存在下生长24小时。
- 在37°C下用1mL VTN-N溶液包被6孔板的一个孔1小时。
- hiPSC的维持和传代
- 每天用补充有 20 ng/mL rhbFGF 的新鲜预热培养基更换培养基。
- 当细胞达到大约 80% 的汇合度时,通常每周两次。
- 为了传代细胞,如前面步骤1.2.1和1.2.2所述,用VTN-N包被板。
- 从带有细胞的孔中吸出培养基,并用DPBS洗涤。
- 吸出DPBS,加入1mL解离试剂(参见 材料表)并孵育1分钟。
- 吸出解离试剂并再孵育 3 分钟。用力敲击每侧板 10 次。
注:解离步骤可能需要在孵育时间和敲击程序中进行细胞类型特异性优化。 - 向细胞中加入 1 mL 培养基,并用巴斯德移液管,用培养基洗涤一次,以确保收集大部分菌落。
- 向每个孔中加入 150 μL 细胞悬液,以提供 1 孔到 6 孔的传代比。
注意:解冻新小瓶后,最好立即以较低的比例(例如 1:1 或 1:2)传代细胞一次或两次传代,以使它们在以 1:6 的比例传代之前达到稳定的生长阶段。 - 在培养箱中培养细胞,在一周内每天更换培养基,并在周末对细胞进行两次补料。
- hiPSCs细胞系冷冻
注意:在解冻后的前两次传代中冷冻细胞,以确保保持恒定的低传代批次冷冻小瓶以开始培养。当细胞达到约80%的汇合度时,冷冻细胞。- 将培养基更换为补充有 20 ng/mL rhbFGF 和 5 μL iRock 的新鲜预热培养基,并孵育至少 1 小时。
- 按照步骤 1.3.2.2-1.3.2.5 中的说明分离细胞。
- 将分离的细胞收集在含有 5 mL 培养基的 15 mL 离心管中。
- 在室温下以300× g 离心3分钟。
- 吸出上清液并加入 1 mL 冻存溶液(参见 材料表)。
- 使用巴斯德移液管,轻轻地上下移液细胞,将它们混合在冻存溶液中。
注意:避免过度移液,这可能会导致细胞簇解离。 - 将细胞悬液分成两个冻存小瓶,每个小瓶 0.5 mL。
- 将冻存小瓶转移到预冷于4°C的冻存容器中。
- 将装有细胞的容器转移到-80°C冰箱中24小时,然后将小瓶转移到液氮中进行长期储存。
2. hiPSCs分化为内皮细胞
- 分化培养基、细胞因子和生长因子的制备
- 根据 表1制备无血清分化培养基(SFD)。从分化第 0 天到第 5 天使用该培养基。
- 通过向 34 SFM 基础培养基中加入 34 种营养补充剂和 5 mL L-谷氨酰胺补充剂,制备用于 CD34+ 细胞 (SFM-34) 的无血清培养基(参见 材料表)。从分化第 6 天开始使用这种培养基。
- 将 1 mg CHIR99021重悬于 716 μL DMSO 中,以获得 3 mM 溶液。在室温下孵育直至完全重悬;如果需要,在37°C下快速预热。 制备20μL等分试样,并在-20°C下储存长达6个月。解冻后立即使用,不要再次冷冻或储存。
- 根据 补充表S1中的说明重悬细胞因子。将所有细胞因子的等分试样储存在-80°C。
- 内皮细胞分化
注:对于分化的每一天,根据中描述的细胞因子混合物制备 18 mL(3 mL 培养基/孔)预热的 SFD 培养基 表2.- 第 0 天 - 胚状体 (EB) 的形成
- 为每个 6 孔板(3 mL/孔)制备 18 mL SFD 培养基,根据 表 2 混合 1 细胞因子。
- 在细胞驱避剂 6 孔板的每个孔中加入 2 mL 预热的 SFD 培养基,其中混合 1 细胞因子(参见 材料表)。
- 要形成 EB,请按照步骤 1.3.2.2-1.3.2.4 中描述的步骤操作。
注意:确保 hiPSC 达到 70-80% 的汇合度以开始分化。 - 将 1 mL 预热的 SFD 培养基与混合 1 细胞因子添加到分离细胞簇的每个孔中。
- 使用巴斯德移液管以1:1的比例轻轻地将细胞簇转移到细胞驱避孔的单孔中,以形成EB。
- 将板放入培养箱后,向前和向后、左右移动,使EB均匀地分散在孔中。
- 第 1 天 - EB 的中等变化
注意:只有在分化第 1 天,有许多单细胞与 EB 一起悬浮时,才需要此步骤。- 为每个 6 孔板(3 mL/孔)制备 18 mL SFD 培养基,根据 表 2 混合 1 细胞因子。
- 用 EB 旋转板以将它们移动到中心,并使用巴斯德移液管将它们收集到 15 mL 离心管中。
注意:如果 EB 看起来像成串一样聚集在一起,请在将它们收集到 15 mL 离心管中之前,用 P1000 上下移液将它们分开。 - 等待 5-10 分钟,让 EB 沉淀在管底部。
注意:如果EB太小,则以100× g 离心5分钟以帮助它们沉淀。 - 用无菌水或DPBS清洗细胞驱避板,以去除任何单个细胞或碎片。
- 小心缓慢地从EB中吸出上清液,不要将其移出。
- 将 2 mL 含有混合 1 细胞因子的 SFD 添加到细胞驱避板的每个孔中。
- 使用 1 mL SFD 培养基重悬 EB,每个起始孔混合 1 种细胞因子 - 对于 6 孔板,加入 6 mL 培养基。
- 将EB以每孔1 mL体积转移到细胞排斥板上,其中已经含有2 mL SFD培养基。
- 将板放入培养箱后,向前和向后、左右移动,使EB均匀地分散在孔中。
- 第 2 天 - 添加CHIR99021
- 将EB旋转到板的中心,并根据 孔的侧面根据表2 添加CHIR99021以避免与细胞直接接触。
注意:如果在第 1 天未更换培养基,请更换整个培养基,而不是单独添加 CHIR。根据 表 2 制备 18 mL SFD 培养基,用于每个 6 孔板(3 mL/孔)。 - 将板放入培养箱后,向前和向后、左右移动,使EB均匀地分散在孔中。
- 将EB旋转到板的中心,并根据 孔的侧面根据表2 添加CHIR99021以避免与细胞直接接触。
- 第 3 天 - 培养基改变 EB 并添加 Mix 3 细胞因子
- 为每个 6 孔板(3 mL/孔)制备 18 mL SFD 培养基,根据 表 2 混合 3 种细胞因子。
- 按照步骤 2.2.2.2-2.2.2.4 中所述收集 EB。
- 将预热的 2 mL 含有混合 3 种细胞因子的 SFD 培养基加入细胞驱避板中。
- 小心地从EB中吸出上清液。加入 1 mL/孔的 SFD,混合 3 种细胞因子。
- 按照步骤 2.2.2.8-2.2.2.9 中所述在孔之间分配 EB。
- 第 6 天 - SFM-34 培养基变化和添加 Mix 4 细胞因子
- 为每个 6 孔板(3 mL/孔)制备 18 mL SFD 培养基,根据 表 2 混合 4 种细胞因子。
- 按照步骤 2.2.2.2-2.2.2.4 中所述收集 EB。
- 将 2 mL 预热的 SFM-34 培养基与混合 4 种细胞因子添加到细胞驱避板中。
- 小心地从EB中吸出上清液。加入 1 mL/孔的 SFM-34 和混合 4 种细胞因子。
- 按照步骤 2.2.2.8-2.2.2.9 中所述在孔之间分配 EB。
- 第 0 天 - 胚状体 (EB) 的形成
3. CD34+ 细胞分离并接种到芯片中
注:CD34 + 细胞通过CD34微珠试剂盒(参见 材料表)的阳性分离方法分离,该试剂盒含有与单克隆小鼠抗体抗人CD34抗体和FcR阻断试剂(人IgG)偶联的CD34微珠。通过在分离前后对细胞进行染色来验证柱分离的效率以进行流式细胞术分析非常重要,下面指示了何时需要采集细胞进行此分析。
- 准备材料和试剂。
- 通过加入 5 mL 5% BSA 溶液和 200 μL EDTA 0.5 M 至 45 mL DPBS 制备洗涤缓冲液,以获得 PBS + 0.5% BSA + 2 mM EDTA。每次分离时准备新鲜的,过滤灭菌,并在使用前保持冷藏。
- 用层粘连蛋白溶液涂覆流体芯片,该溶液通过在DPBS Ca2 + Mg2+中稀释rhLaminin 521 1:50制备。用适合正在使用的芯片的体积涂覆每个芯片,并在接种前在培养箱中孵育2小时。
注意:其他基质可用于包被,并应针对特定的细胞类型/实验进行测试。 - 根据 表2 ,通过补充18mL SFM-34培养基和Mix 4细胞因子来制备Mix 4 SFM-34培养基,并将混合物放入培养箱中的50mL管中,盖子稍微拧开以利于气体交换。
- 将选定的灌注装置和任何其他要使用的管道放入培养箱中进行脱气。
- 第 8 天 - EB 解离和 CD34+ 分离
- 按照步骤 2.2.2.2-2.2.2.5 中的说明收集 EB。
- 每个收集的 EB 起始孔添加 1 mL 细胞解离试剂(如果收集了 6 个孔,则添加 6 mL)。
- 将细胞解离试剂中的 1 mL EB 悬浮液转移回细胞驱避板的每个孔中。
- 在培养箱中孵育10分钟。
- 用 P1000 轻轻地将 EB 上下移液到孔中,不超过 10 次。
- 重复步骤 3.2.4-3.2.5.总共 3 次。
注意:如果 EB 难以解离,请重复上述步骤总共 4 次。 - 为解离的 EB 的每个孔添加 5 mL 洗涤缓冲液。
- 通过将细胞通过 40 μm 过滤器,将细胞收集到 50 mL 离心管中。取 10 μL 细胞悬液对细胞进行计数。
注:为了测试分离效率,将 10 个5 个 细胞/管转移到两个不同的试管(未染色的对照和预分拣的测试样品)中,稍后将用于流式细胞术(如步骤 4.3.9-4.3.13 中所述)。对于 6 孔板,过滤后应收集 ~106 个细胞。 - 将细胞以300× g旋转10分钟。
- 将细胞重悬于 300 μL 洗涤缓冲液中,轻轻移液几次以确保不存在团块。继续遵循制造商的协议(参见 材料表)。
- 将 CD34+ 细胞接种到流控芯片中
注:协议中使用的流体芯片的通道高度为0.6 mm,长度为50 mm,总生长面积为2.5 cm2 (补充图S1)。这种类型的芯片接种总体积为150μL的细胞悬液,可以使用不同的芯片,接种量和细胞密度应根据生长区域进行调整。根据所使用的细胞系及其生长情况,可能需要进行额外的优化。- 将分离的 CD34+ 细胞重悬于 300 μL 预热的含有 4 种细胞因子的预热 SFM-34 培养基中。
- 取 10 μL 细胞悬液并计数细胞。
- 重悬 2.5 × 105 个细胞,最终体积为 150 μL 补充的 SFM-34;加入 0.5 μL iRock。
注:为了测试分离的效率,将 10 个5 个 细胞/管转移到稍后将用于流式细胞术的试管(分选后的测试样品)中(如步骤 4.3.9-4.3.13 中所述)。 - 通过将 P200 的尖端放入通道边缘的储液罐内,从流体芯片中缓慢吸出层粘连蛋白。
注意: 如果液体难以收集,请慢慢提起芯片的一侧,以帮助液体移动到对面的储液罐。 - 将细胞悬液稳定地加入通道中,以确保没有形成气泡。
注意: 快速但轻柔地执行步骤 3.3.4-3.3.5,以避免层粘连蛋白变干并在芯片通道中形成气泡。如果形成气泡,提起芯片的一侧并轻轻敲击载玻片以调动气泡;当它们到达水库时,它们将上升到空气接口,并且应该无法进入通道。 - 将芯片转移到培养箱中并放置过夜,使细胞完全附着在通道上并看起来细长。
- 当细胞完全附着时,如步骤3.3.4所示吸出培养基,并用200μL补充细胞因子的SFM-34代替。
- 从现在开始,每天更换培养基,直到细胞达到 90%-100% 汇合度。
4. 连续流动在内皮细胞中的应用 - Aorta-on-a-chip
- 准备材料和试剂。
- 根据 表2 ,用Mix 4细胞因子补充18mL SFM-34培养基,制备Mix 4 SFM-34培养基,并将其置于培养箱中的50mL管中,盖子稍微拧开以利于气体交换。
- 将选定的灌注装置和任何用于流体设置的管道放入培养箱中进行脱气。
- 流体系统总成
- 根据制造商的协议将灌注装置安装到设备中。
注意: 请记住使用夹子amps 在系统中。如果此步骤使用滑动夹具,则需要在连接到芯片之前在管道上滑动。 - 连接新的流控芯片并添加补充细胞因子的 SFM-34 培养基,确保在无菌条件下在通风橱中填充两个储液槽。
- 执行气泡去除程序和校准步骤。
- 从培养箱中取出带有连接装置的流体单元并将其转移到罩中;从培养箱中取出含有细胞的芯片。
- 夹紧测试芯片两侧的管子。
- 从测试芯片上取下管子。
注意: 检查管道末端的鲁尔接头中是否存在气泡。如果可见气泡,请使用 P200 移液器小心地吸出它们,如有必要,添加更多培养基以确保连接器充满培养基。 - 将包含细胞的芯片与管道连接。
- 取下或打开 clamps。
- 将系统转移到培养箱,并将气泵连接到流体单元。
- 使用泵专用软件(补充图S2)启动预选程序,并逐渐增加 表3中描述的剪切应力。
注意:根据所需的特定实验,刺激程序可能需要优化。这里描述的是剪切应力逐渐增加,导致最终值为 5 dyn/cm2,它模拟了在胎儿循环开始时计算出的背主动脉壁所经历的剪切应力 9。与将采用的最终剪切应力无关,有必要随着时间的推移逐渐增加,以使电池适应力,而不会导致电池与芯片分离。如果选择的刺激方案超过 3 天,则应通过添加 1 mL 含有 Mix 4 细胞因子的 SFM-34 将细胞因子补充到系统中,这些细胞因子通常添加到 18 mL 中。为此,泵程序被迅速暂停,并将 500 μL 补充的培养基添加到流体装置中的两个注射器中的每一个。
- 根据制造商的协议将灌注装置安装到设备中。
- 用于分析的细胞采集
- 在水浴中预热解离缓冲液。
- 从培养箱中取出流体单元并将其移入罩中。
- 夹紧两侧芯片两侧的管路,然后从芯片上的储液槽中取出管路。
- 轻轻地从芯片中取出培养基,并用DPBS Ca 2+ Mg2+代替以洗涤细胞。
注意:如果细胞开始分离,可以跳过用PBS洗涤的这一步骤。 - 轻轻加入150μL解离缓冲液,并在37°C下孵育3分钟。
注意:在显微镜下检查细胞是否是单个和分离的;否则,再孵育 2 分钟。在吸出培养基之前,必须将细胞从通道中完全分离,因为芯片不允许通过移液来帮助细胞分离。可以使用其他溶液来分离细胞,例如胰蛋白酶或基于EDTA的缓冲液。 - 从一个储液器中收集含有细胞的解离缓冲液,然后转移到15mL离心管中,并用DPBS洗涤通道一次以收集所有分离的细胞。
- 将 1 mL 洗涤缓冲液加入装有细胞的 15 mL 试管中,并取 10 μL 对细胞进行计数。
- 将流式细胞术管中的细胞悬液分开,使每个试管有105 个细胞。
- 以300 ×g旋转试管5分钟。
- 准备染色溶液,使每个试管有50μL进行染色。分别以 1:100 和 1:200 稀释度加入 CD34 PerCP-efluor710 或 CD34-PE。
- 将细胞重悬于50μL染色溶液中,并在4°C下孵育30分钟。
- 通过加入 2 mL 洗涤缓冲液洗涤细胞并以 300 × g 离心 5 分钟。
- 将沉淀重悬于100μL染色溶液中,并使用流式细胞仪获取数据。
注:细胞也可以直接在芯片中使用 150 μL RNA 裂解缓冲液进行 RNA 提取,或在室温下使用 DPBS 中的 4% 多聚甲醛固定成像 10 分钟。
- 细胞取向分析
- 使用FIJI23 (补充图S3)分析图像以量化细胞取向的变化。
- 从“分析”|”工具 |ROI 管理器菜单。
- 使用 多边形选择工具 手动绘制单元格轮廓,并通过单击 “添加 ”或使用 CTRL+T 快捷方式将其添加到 ROI 管理器中。
- 通过在 “分析”|”设置“测量 ”菜单。
- 通过“更多”将测量应用于所有 ROI ... ROI 管理器中的 Multi measure 命令。
注意:此步骤将为每个 ROI 拟合一个椭圆,并生成一个包含长椭圆轴和短椭圆轴的长度以及角度的表格。 - 将表格导出为 CSV 文件,以导入到其他软件中进行绘图。
注意:用于绘图的脚本可在 https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0ddc。
- 使用FIJI23 (补充图S3)分析图像以量化细胞取向的变化。
代表性结果
我们在这里描述了一种用于分化和机械刺激源自hiPSC的内皮细胞的方案,该方案允许研究它们对机械线索的反应(图1)。该方案导致功能机械敏感内皮细胞的产生。我们在这里提供具有代表性的结果并描述预期的表型,以评估细胞在分化过程中对细胞因子刺激的反应。
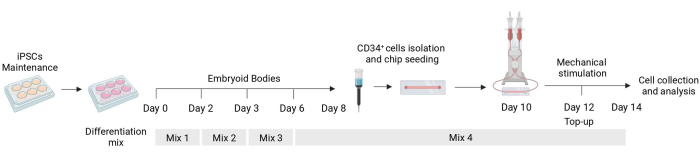
图 1:分化和机械刺激方案的示意图。 分化方案示意图,显示了不同细胞因子混合物的时间、CD34+ 细胞分离、流控芯片接种和机械刺激细胞的最终分析。 请点击这里查看此图的较大版本.
hiPSCs培养
重要的是从在自我更新条件下正确生长的hiPSC开始方案。文化质量的一个很好的指标是它们的生长速度。解冻后,细胞可能需要 2-3 周才能达到正确的生长阶段,以确保良好的分化。当细胞可以每周以 1:6 的比例传代两次,达到几乎完全汇合时,这是它们在需要传代的同一天准备分化的时间。
hiPSCs分化为内皮细胞
分化的第一步,包括胚状体(EBs)的形成,是细胞系依赖性的,可能需要对使用的特定细胞系进行一些优化。方案步骤1.3.2.2-1.3.2.4中描述的解离可以通过减少或延长与解离试剂的孵育以及随后与巴斯德移液管的解离来修饰。此外,除了使用切割工具或P100移液器吸头对菌落进行物理解离外,还可以使用其他解离试剂进行此步骤。质量好的EB在分化的第2天显示出明确的边缘,当使用显微镜观察时,它看起来清晰明亮;较暗的区域可能表明EB内的细胞死亡(图2)。
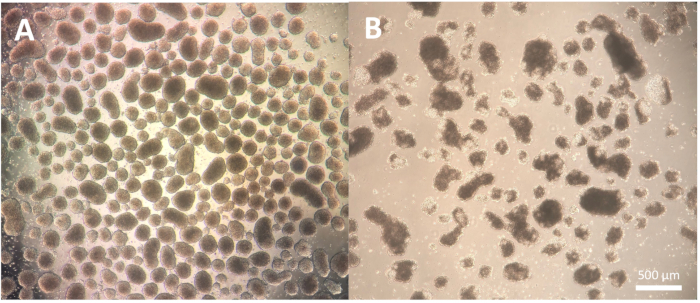
图2:胚状体形态 。 (A) 第 2 天胚状体显示轮廓分明的外缘和一致的大小。(B) 第 2 天,质量较差的胚状体显示广泛的细胞死亡,导致结构分解。比例尺 = 500 μm。 请点击这里查看此图的较大版本.
在第 2 天,向 EB 中添加 CHIR99021 会抑制 GSK-3 蛋白,从而激活 Wnt 通路。不同的细胞系对CHIR处理有不同的反应,这应该通过使用不同的浓度量化第8天获得的CD34 + 细胞的数量来测试(图3)。
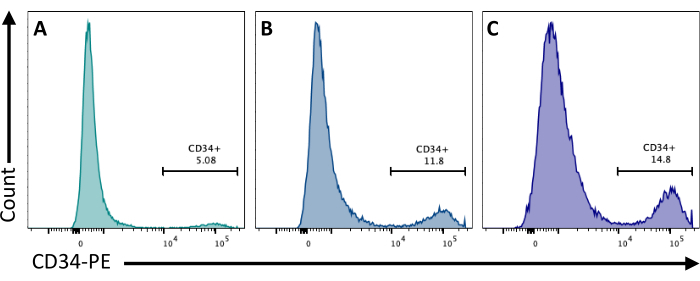
图 3:不同 CHIR 处理下的内皮细胞分化。 在第 2 天以 (A) 3 μM、(B) 5 μM 和 (C) 7 μM 进行 CHIR 处理后,通过流式细胞术在 CD34 膜表达分化第 8 天通过流式细胞术定量内皮细胞承诺。 使用五激光流式细胞仪和专用软件获得流式细胞术数据(参见 材料表)。 请点击这里查看此图的较大版本.
CD34+ 细胞分离
在洗脱色谱柱后,验证使用磁珠富集的CD34+是否至少提供80%的CD34+非常重要。为确保足够的纯度,可以通过流式细胞术分析从磁性分离中获得的细胞等分试样,确保使用与用于磁富集的抗体克隆不同的抗体克隆。在这里,使用4H11克隆,富集后纯度达到~85%(图4)。
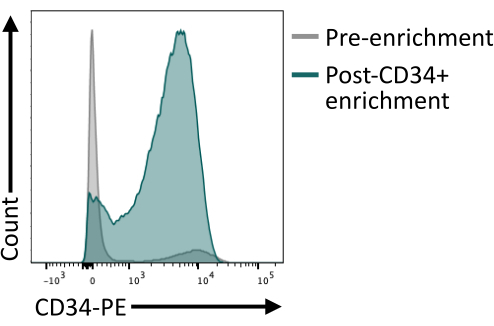
图4:磁分选富集前后CD34的膜表达。 对第 8 天解离的胚状体(灰色)和磁富集后的细胞(绿色)进行 CD34 表达染色,并通过流式细胞术进行分析,显示分选后成功富集。使用五激光流式细胞仪和专用软件获得流式细胞术数据(参见 材料表)。 请点击这里查看此图的较大版本.
将细胞接种到流体通道中
在流体通道中接种细胞时,跟踪内皮细胞的粘附和增殖至关重要。接种后,细胞需要~5小时才能完全粘附在通道上(图5A)。在此阶段,还可以测试替代涂层解决方案以提高附着力。为了确认被测细胞对机械敏感,因此能够对机械刺激做出反应,可以随时间推移测试细胞取向。刺激前的细胞显示随机取向(图5A和图5C),并且它们平行于流动方向重新定向(图5B,C)。这里描述的方案允许从通道中收集细胞以进行下游分析,例如流式细胞术,以研究其膜免疫表型,提供受刺激细胞的内皮特性(图5D,E)。
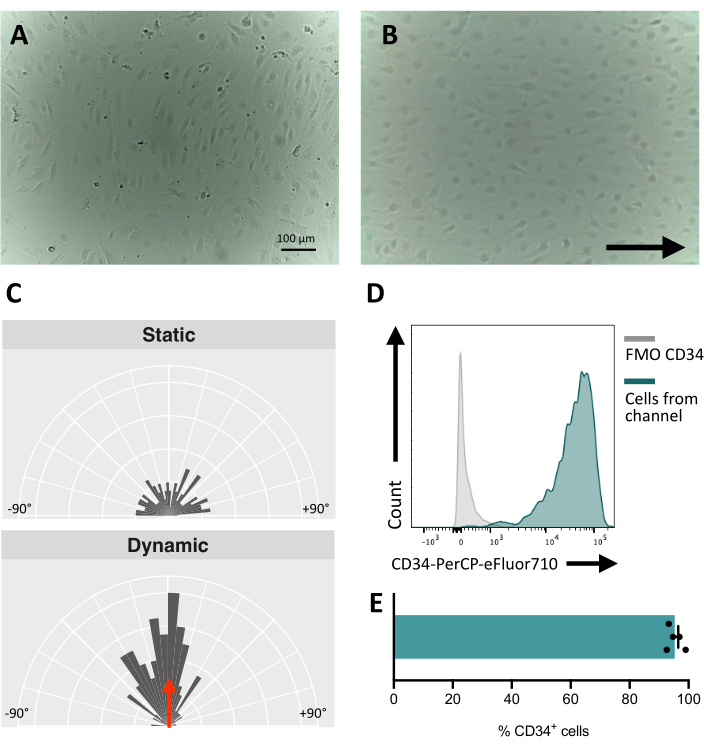
图 5:hiPSCs 衍生的内皮细胞的机械反应性 。 (A) 接种后 48 小时分离的 CD34+ 细胞汇合层。(B) 动态培养 3 天的内皮细胞重新定向层。(C) 动态培养 5 天后内皮细胞的取向分析。(D) 流动培养 5 天的细胞的 CD34 表达谱。(E) 从流体通道中检索到的细胞群中 CD34+ 细胞的百分比。使用倒置培养箱显微镜拍摄图像;使用五激光流式细胞仪和专用软件获得流式细胞术数据(参见 材料表)。比例尺 = 100 μm (A,B)。 请点击这里查看此图的较大版本.
| 试剂 | 库存集中度 | 添加的音量 | 最终浓度 |
| Iscove 改良 Dulbecco 培养基 (IMDM) | - | 333毫升 | - |
| Ham's F-12 营养混合物 (F-12) | - | 167毫升 | - |
| N-2 补充剂 (100x) | 100 倍 | 5毫升 | 1 倍 |
| B-27 补充剂 (50x) | 50 倍 | 10毫升 | 1 倍 |
| 抗坏血酸 | 10毫克/毫升 | 1.25毫升 | 25微克/毫升 |
| α-单硫代甘油 (MTG) | 11.5 米 | 19.5微升 | 448.5微米 |
| 人血清白蛋白 | 100毫克/毫升 | 2.5毫升 | 0.5毫克/毫升 |
| 全转铁蛋白 | 100毫克/毫升 | 0.75毫升 | 150微克/毫升 |
表 1:500 mL 无血清分化 (SFD) 培养基的组成和配方。
| 分化天数 | 细胞因子混合物 | 细胞因子 | 最终浓度 |
| 第 0 - 2 天 | 混合 1 | BMP4型 | 20纳克/毫升 |
| 第2天 | 混合 2 | CHIR99021 | 7微米 |
| 从第 3 天开始 | 混合 3 和 4 | 血管内生长因子(VEGF) | 15纳克/毫升 |
| bFGF系列 | 5纳克/毫升 | ||
| 从第 6 天开始 | 混合 4 | IL6型 | 10纳克/毫升 |
| FLT3L型 | 10纳克/毫升 | ||
| 胰岛素样生长因子1 | 25纳克/毫升 | ||
| IL11型 | 5纳克/毫升 | ||
| 云函数 | 50纳克/毫升 | ||
| 欧洲专利局 | 3 U/毫升 | ||
| 热塑性聚氨酯(TP | 30纳克/毫升 | ||
| IL3型 | 30纳克/毫升 |
表 2:用于内皮细胞分化的细胞因子混合物、将它们添加到 SFD 培养基中的天数和最终浓度。
| 剪切应力 (dyn/cm2) | 时间 (h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | 直到实验结束 |
表 3:动态文化的剪切应力值及其应用时间。
补充图S1:用于该协议的芯片和管路的几何形状和尺寸。请点击这里下载此文件。
补充图 S2:控制气泵的软件的分步指南,并附有每个步骤的说明。请点击这里下载此文件。
补充图S3:使用FIJI进行取向分析的指南,显示了细胞形状的绘制、椭圆拟合和最终测量。请点击这里下载此文件。
补充表S1:分化方案中使用的细胞因子的单位大小、重悬体积和储备液浓度。请点击这里下载此文件。
讨论
我们在这里描述的方案允许从人多能干细胞中产生机械敏感的内皮细胞,并研究它们对由受控剪切应力介导的机械刺激的反应。该方案完全基于细胞因子,与GMP试剂完全兼容,可潜在转化为细胞治疗的细胞生产。
hiPSCs的推导为科学家提供了胚胎发育早期阶段的仪器模型,使研究难以在体内研究的过程成为可能24。事实上,可用于研究的人类胚胎组织是从缺乏循环的胚胎中收集的,这可能对机械线索控制的分子特征产生重大影响。这里描述的方法能够对细胞对剪切应力的反应进行实时成像和实时研究。hiPSCs与流体的结合提供了一种研究模型,该模型克服了循环开始重塑和控制心血管和血液系统建立时发育中的胎儿组织的有限可用性和不可接近性3,9,10,25。
该方案的一个局限性是,从该方案衍生的内皮细胞可能无法反映发育组织中存在的不同内皮细胞的各种身份。为了克服这一局限性,在流体刺激之前的分化过程中可能需要特定的细胞因子组合,以获得所需的身份或组织特异性表型26。在分离步骤中,可以使用更精细的免疫表型获得内皮亚群的分离。该方案仅基于CD34的表达分离内皮细胞,从而允许柱分离而不是荧光激活细胞分选(FACS);这减少了细胞死亡和污染风险。此外,该协议专门用于研究层流介导的剪切应力的作用。必须采用替代流体方法来研究其他机械线索的影响,例如拉伸或压缩,或其他类型的流动,例如扰动或扰动流动。
我们之前已经证明,iPSC 衍生的内皮细胞模仿异质动静脉细胞身份27,类似于在胎儿背主动脉28、29、30 中观察到的身份。这在已知由血液循环控制的血管发育和细胞规格方面尤为重要。不同模型的研究表明,缺乏循环会导致动静脉规格改变11,14,31。将机械线索与细胞规格联系起来的机制仍然未知,这里描述的管道允许进行无法在体内测试的精细功能研究。
该管道描述了使用市售流体通道生产和刺激源自 hiPSC 的内皮细胞,避免了像广泛使用的聚二甲基硅氧烷 (PDMS) 装置那样铸造装置的需要12。此外,PDMS芯片的使用使得刺激细胞的收集特别具有挑战性,而使用该协议,可以很容易地从通道中取出细胞。这显着提高了分析能力,允许后续分析,例如蛋白质组学和转录组学分析、流式细胞术和功能测定,这些可能需要进一步的培养或 体内 测定。
披露声明
作者没有要披露的利益冲突。
致谢
这项工作得到了欧洲血液学协会 2021 年研究高级资助、美国血液学会 2021 年全球研究奖以及欢迎信托基金和爱丁堡大学资助的内部战略支持基金 ISSF3 的支持。我们感谢流式细胞术设施的 Fiona Rossi 在流式细胞术分析方面的支持。出于开放获取的目的,作者已将知识共享署名 (CC BY) 许可应用于本次提交产生的任何作者接受的手稿版本。
材料
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
参考文献
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。