在小鼠模型中使用 Punch-Trephine 技术诱导角膜和角膜缘碱损伤
摘要
该协议描述了一种在小鼠模型中诱导准确且可重复的角膜和角膜缘碱损伤的方法。该协议是有利的,因为它允许对高度弯曲的小鼠角膜和角膜缘均匀分布损伤。
摘要
角膜对视力至关重要,外伤后的角膜愈合是维持其透明度和功能的基础。通过角膜损伤模型的研究,研究人员旨在加强对角膜如何愈合的理解,并制定预防和管理角膜混浊的策略。化学损伤是已在小鼠身上广泛研究的最流行的损伤模型之一。大多数以前的研究人员都使用浸泡在氢氧化钠中的平面纸来诱导角膜损伤。然而,使用扁平滤纸诱导角膜和角膜缘损伤是不可靠的,因为小鼠角膜高度弯曲。在这里,我们提出了一种新仪器,一种改进的活检打孔器,它使研究人员能够对小鼠角膜和角膜缘产生边界明确、局部且均匀分布的碱损伤。这种穿孔-环钻方法使研究人员能够对整个小鼠角膜和角膜缘进行准确且可重复的化学灼伤,同时使其他结构(如眼睑)不受化学物质的影响。此外,本研究引入了一种眼球摘除技术,该技术保留了内侧痈,作为识别地球鼻侧的标志。使用这种技术,延髓和睑结膜以及泪腺也保持完整。在受伤后第 0、1、2、6、8 和 14 天通过裂隙灯生物显微镜和荧光素染色进行眼科检查。临床、组织学和免疫组织化学结果证实,所有实验小鼠均存在角膜缘干细胞缺乏症和眼表再生失败。所提出的碱性角膜损伤模型是研究角膜缘干细胞缺乏症、角膜炎症和纤维化的理想选择。该方法也适用于研究局部眼科药物在小鼠角膜表面的临床前和临床疗效。
引言
角膜对视力至关重要,并表现出独特的特征,包括透明度,这是清晰视力的先决条件。除了起到主要的保护作用外,角膜还占眼睛屈光力的2/31。由于角膜损伤和混浊在视力中的重要作用,角膜损伤和混浊会导致视力严重下降,是全球可预防失明的第二大原因 2,3。在伴有严重角膜缘功能障碍的角膜损伤中,角膜缘的屏障功能下降,导致结膜细胞向角膜表面迁移和角膜结膜形成 4,5,这极大地损害了视力。因此,需要有效的预防和治疗策略来解决角膜盲症和相关残疾的全球负担。
目前对人类角膜伤口愈合过程的理解是基于先前的研究,这些研究调查了角膜对各种损伤的反应。已经采用了几种技术和动物模型来诱导各种化学或机械性角膜损伤 6,7,8,9 并研究角膜伤口愈合过程的各个方面。
碱烧伤模型是一种成熟的损伤模型,其方法是直接在角膜表面施用氢氧化钠 (NaOH) 或使用扁平滤纸10 进行。碱损伤不仅在角膜和眼房中,而且在视网膜中导致促炎介质的释放和多形核细胞的浸润。这会诱导意外的视网膜神经节细胞凋亡和 CD45+ 细胞活化11。因此,使用碱损伤模型精确定位损伤部位以避免过度的意外损伤至关重要。
小鼠眼球的轴长约为3毫米12。由于角膜和视网膜之间的距离很短,因此存在陡峭的角膜曲率以提供高折射力以将光线聚焦在视网膜上(图1A)。正如我们之前报道的 13,使用扁平滤纸对这种高度弯曲的表面造成化学损伤是很困难的,尤其是在角膜缘处(图 1B)。诱发角膜缘损伤需要倾斜滤纸,这有可能对穹窿和邻近结膜造成意外损伤14.另一种方法是将化学试剂作为滴剂直接涂抹在角膜表面。然而,这种方法缺乏对暴露时间的控制,并且由于液体扩散到这些区域,存在诱发结膜、穹窿和眼睑损伤的潜在风险。
为了克服这些局限性,本研究提出了一种新的打孔-环钻诱导损伤的方法。该技术有几个优点,包括 (i) 在小鼠模型中诱导对整个角膜表面和角膜缘的有效化学损伤,(ii) 诱导角膜的局部和边界明确的损伤,(iii) 能够在预定的持续时间内应用任何感兴趣的液体,以及 (iv) 通过选择合适的活检打孔来诱导不同大小的角膜损伤的能力。这种方法对于大鼠和兔子损伤模型也是可行的,它们也表现出弯曲的角膜表面,是用于研究眼表伤口愈合的常见动物模型。
研究方案
所有程序均按照斯坦福大学实验动物护理 APLAC 编号 33420、将动物用于科学目的以及用于眼科和视力研究的动物的 ARVO 声明进行。Irving L. Weissman实验室慷慨地提供了10只年龄在8-12周龄的雄性和雌性C57BL / 6小鼠。使动物适应12小时的光暗循环,并 随意提供水和饲料。动物的一只眼睛受伤。
1. 实验准备
- 材料准备
注意:所有试剂均应保持在室温下。- 准备穿孔钻:准备一个直径为 3.5 毫米的活检穿刺器,并在距离其远端边缘 5 毫米处标记冲头的轴。牢固地固定冲头,并使用双速旋转工具切割其轴的标记远端部分。在此过程中佩戴护目镜。以 3.5 毫米的深度切割轴,并留下最后的 1.5 毫米。将尖端弯曲 90°,如 图 1 所示。
- 通过将 1 g NaOH 溶解在 50 mL 蒸馏水中来制备 0.5 M NaOH 溶液。
- 将 2 mL 100 mg/mL 氯胺酮和 1 mL 20 mg/mL 甲苯噻嗪混合制备 10 mL 麻醉混合物。注射前,用 7 mL 0.9% NaCl(生理盐水)稀释该混合物。
- 通过将 0.1 mL 10% AK-Fluor 荧光液加入 9.9 mL 无菌磷酸盐缓冲盐水 (1x PBS) 中来制备 0.1% 荧光素钠溶液。
- 通过将 8 g NaCl、0.2 g KCl、1.44 g Na2HPO4 和 0.23 g NaH2PO4溶解在 900 mL 蒸馏水中来制备 PBS (1x)。将溶液的pH调节至7.4。通过加入蒸馏水,使溶液的最终体积达到 1 L。
- 准备 4% 多聚甲醛 (PFA) 溶液进行固定。在化学罩下,将 2 g PFA 溶解在 45 mL PBS 中。将混合物加热至65°C,并将其pH滴定至7.4。PFA 溶解后,将溶液的最终体积降至 50 mL。
2. 动物准备
- 称量小鼠以确定注射用可注射麻醉剂混合物的适当体积。在按照Machholz等人15所述正确处理和约束小鼠后,以0.01mL / g 16,17的剂量腹膜内(IP)施用麻醉剂混合物。针对腹下象限进行 IP 注射,以防止器官损伤。
- 由于角膜碱损伤非常痛苦,因此在手术期间和手术后皮下注射丁丙诺啡缓释注射混悬液 (3.25 mg/kg) 以增加镇痛作用。
- 等到达到深度麻醉。检查脚趾捏伤是否缺乏反应,以表明深层麻醉成功。在开始手术之前,在对侧眼上涂抹简单的眼药膏,以防止其干燥。
- 麻醉后,将小鼠放在根据标准啮齿动物手术原理18制备的手术台上。在啮齿动物的头部下方放置一个 5 毫米高的枕头,置于侧卧位。枕头有助于在手术过程中支撑啮齿动物的头部。
- 给予盐酸丁卡因(0.5%)滴眼液以进一步麻醉。用手术眼矛适当擦干眼表并修剪睫毛。
3.碱损伤的诱发
- 在开始手术之前,按照标准啮齿动物手术原则18,19 组织手术台,并在手术期间保持手术区域无菌。放置手术显微镜以正确观察麻醉的小鼠,并将计时器调整至30秒。将扭曲的纸巾放在动物的口吻上,以防止在冲洗过程中意外吸鼻。
- 使用手术显微镜确定角膜缘区域周长,同时使用拇指和食指确保鼠标的眼睑完全张开。轻轻握住干净的环钻,平行于眼睛的轴线,不要施加任何向下的压力。避免旋转仪器,并保持冲床环钻的轴线与地球轴线平行。
- 要求手术助理将 3 滴 NaOH 溶液(等于 40 μL)滴入穿孔孔中,以填充工具并适当覆盖角膜表面。液体的表面张力可防止仪器泄漏(图1)。
注意:我们使用带有 1 毫米注射器的 27G 针头,该针头具有扁平尖端,呈 50° 角,以小心地滴落 NaOH 溶液。 - 30 秒后,立即用 5 mL PBS (1x) 冲洗角膜和穹窿。 视频 1 演示了诱发化学损伤的程序。
- 使用通用的pH指示纸,确保受伤眼睛角膜表面的pH值为7-7.5。然后,将三重抗生素眼膏涂抹在化学损伤的眼表上。
注意:手术期间尾巴运动是麻醉深度低的标志。通过注射麻醉剂 [推注 IP(初始体积的 50%)]来应用额外的麻醉剂混合物(氯胺酮 + 甲苯噻嗪)。 - 手术后,确认小鼠处于稳定状态。如果动物疼痛,给予第二剂丁丙诺啡。使用与 2.2 中相同的处理技术。在动物麻醉时开始术后检查。
- 手术后,用70%乙醇清洗,干燥和消毒穿孔环钻和手术台。
4. 临床评估
- 为了检查,按照步骤2.1中所述的麻醉小鼠。
- 在裂隙灯生物显微镜下检查眼睛(受伤和未受伤)。使用相机拍摄照片(在本研究中,使用电影效果模式下的手机摄像头)。
- 根据 Yoeruek 分级系统对角膜混浊进行评分20:0 = 正常、透明的角膜;1 = 轻度混浊;2 = 更大的不透明度,但虹膜和瞳孔很容易区分;3 = 虹膜和瞳孔几乎无法区分;4 = 角膜完全不透明,瞳孔不可见。
- 涂抹0.1%荧光滴眼液。用棉涂抹器擦干多余的荧光液体,并使用钴蓝滤光片评估是否存在角膜上皮缺损。拍摄照片。
- 监测动物,直到它恢复足够的意识以维持胸骨卧位。在动物完全康复之前,不要将动物重新引入其他动物。
5. 摘除术
- 在3-5秒内通过颈椎脱位诱导化学损伤2周后对小鼠实施安乐死21。
- 按以下顺序摘除眼睛,同时保留内侧痈和整个睑结膜,如 视频 2 所示。
- 在手术显微镜下,仔细解剖痈和皮肤的交界处。使用牙钳,缩回痈,并将睑结膜下方的手术剪刀尖端引导至其与跗板的交界处。
- 沿着粘连线向外眦切开结膜。然后,将手术剪刀转到结膜下平面的结膜和下跗板的交界处。
- 完成结膜清扫术后,用拇指和食指从鼻侧缩回上眼睑和下眼睑。缩回时,将突出的泪腺后面的弯头镊子的尖端引导到视神经。牢牢抓住视神经并取出眼球(图2)。
- 用PBS(1x)冲洗球体并将其转移到固定溶液中。
6. 苏木精和伊红 (H&E) 和高碘酸-希夫 (PAS) 染色
- 在室温下将地球固定在10%福尔马林溶液中过夜。
- 使用浓度为70%乙醇,80%乙醇,90%乙醇和100%乙醇的连续系列分级酒精对组织脱水,每次10-15分钟。随后,将眼睛浸入二甲苯中10分钟。最后,用石蜡包裹眼睛。
- 将石蜡块切成 6 μm 厚的切片,并将它们安装在玻璃显微镜载玻片上,用于苏木精和伊红 (H&E) 和高碘酸-希夫 (PAS) 染色,如 补充文件 1 中所述。
7. 免疫荧光成像与分析
- 对于免疫组织化学研究(IHC),将眼睛固定在1mL含有4%PFA的PBS(1x)中,在4°C下过夜。将样品在 1 mL PBS (1x) 中洗涤 3 次,每次 5 分钟。
- 为了防止冰晶形成并保护蛋白质的分子结构,在PBS中用10%蔗糖,20%蔗糖和30%蔗糖浓度进行连续蔗糖饱和。将地球仪嵌入光学相干断层扫描解决方案(OCT; 图2),并将它们储存在-80°C。
- 将 OCT 块切成 12 μm 厚的切片,并安装在玻璃显微镜载玻片上进行 IHC 染色。
- 在PBS(1x)中,在0.1%Triton X -100中透化显微镜载玻片上的组织切片15分钟。然后,在室温下用 5% BSA 的 PBS (1x) 封闭非特异性抗原 1 小时。
- 将显微镜载玻片上的组织切片在4°C下在含有1%BSA的PBS(1x)中制备的靶向一抗的混合物中孵育过夜。本实验中,一抗为1:100稀释兔抗角蛋白13(K13)和抗角蛋白12(K12)抗体,浓度分别为2.24 μg/mL和1.56 μg/mL。
- 孵育后,用PBS(1x)洗涤显微镜载玻片上的组织切片3x。随后,用 1:500 稀释的驴抗兔 IgG 检测结合的一抗。在4°C下与二抗在黑暗中孵育1小时。然后在 PBS (1x) 中洗涤 3 次,每次 5 分钟。
- 在显微镜上的组织切片上滴一滴含有DAPI的抗褪色荧光封固剂,并用盖玻片盖住。让样品在黑暗中干燥,并在荧光显微镜下对正常和受伤的眼睛使用相同的激光设置进行检查。
代表性结果
通过评估LSCD的临床和组织学体征来评估该方法诱导角膜缘干细胞缺乏症(LSCD)的疗效。通过裂隙灯显微镜和眼前节光学相干断层扫描(AS-OCT)成像进行临床评估(图3 和 图4)。
再上皮化以向心方式发生,与鼻部相比,角膜颞部的再上皮化更快。受伤的眼睛在化学损伤后立即出现 2+-3+ 角膜混浊(图 3)。角膜缘损伤后,上皮细胞从结膜迁移到角膜表面。大角膜上皮缺损在第 12-14 天完全重新上皮化,与大小相似且基底膜和基质完整的角膜上皮损伤相比,这需要更长的时间,后者通常在受伤后 5 天内愈合 8,9。由于LSCD,50%的受伤眼睛在第二周结束时出现持续的上皮缺损(图3)。角膜水肿在最初几天更为突出(图3,图4),而角膜纤维化在第二周显着,导致100%受伤的眼睛出现4+角膜混浊。
如 图 5 所示,在化学损伤诱导后 24 小时,在临床和组织学上观察到新生血管形成 (NV) 的早期迹象,与 Kvanta 等人研究确定的 NV 时间线一致,该研究在损伤后 24 小时显示角膜缘 NV 迹象22。在愈合过程中,新的血管成熟,到受伤后第 14 天,NV 穿过角膜缘并到达中央角膜。定义结膜和角膜之间边界的角膜缘被破坏。
通过PAS+杯状细胞和基质血管的出现观察到角膜缘干细胞缺乏和结膜形成的组织学证据23,24,25,26。在本损伤模型中观察到杯状细胞,并由图 6 中的箭头表示。
结膜和角膜上皮主要表达独特的角蛋白,分别为 K13 和 K1227。角膜缘损伤后,源自结膜的新上皮细胞覆盖剥落的角膜,受伤后 2 周内,K12 未在任何受伤动物的角膜表面表达。这一发现与其他研究一致28,表明完全 LSCD 和角膜表面没有角膜上皮细胞。然而,在 Park 等人 29 的研究中,他们在受伤后 20 周和 32 周检测到 K12 表达,这表明上皮细胞可能存在反式分化。
因此,我们观察到化学损伤破坏了角膜缘和角膜缘干细胞,导致结膜上皮细胞迁移到角膜中心以覆盖剥落的角膜表面。结膜上皮细胞标志物 K13 进一步验证了这一点,该标志物在整个结膜和角膜表面表达,如 图 7 所示。

图 1:正常小鼠右眼和用于诱导角膜和角膜缘损伤的穿孔环钻。 (A) 侧视图显示具有高度弯曲角膜的小鼠眼睛(箭头表示角膜缘)。(B) 图像表明,即使是大滤纸也不足以充分覆盖角膜缘区域。小鼠眼睛的角膜缘到角膜缘直径接近 4 mm,外径为 4.5 mm、内径为 3.5 mm(图 D 和 H)的穿刺活检适当地覆盖角膜和角膜缘表面,如图 (C) 和 (E) 所示。(F) 将穿孔环钻适当地固定在角膜缘区域周围的球体上。(G)为保证打孔环钻边缘无泄漏,将打孔环钻与球体平行轴线适当定位后,用亚甲蓝填充孔。未检测到亚甲蓝泄漏。比例尺 = 1 mm。 请点击这里查看此图的较大版本.
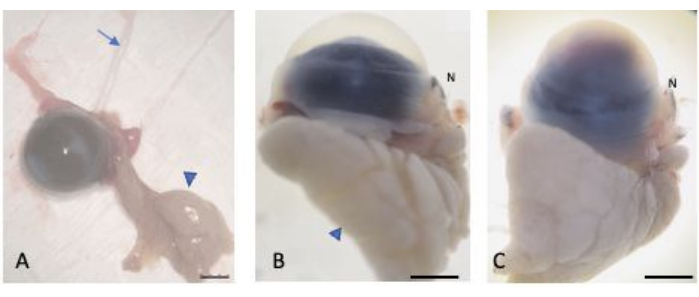
图2:眼睛被摘除。 (A) 眼睛被摘除,同时保留延髓和睑结膜、泪腺(箭头)和视神经(箭头)。正常 (B) 和受伤 (C) 的眼睛被 30% 的蔗糖浸透以防止冰晶形成。眼球的鼻部可通过鼻痈(标记为 N)进行识别。比例尺 = 1 mm。 请点击这里查看此图的较大版本.
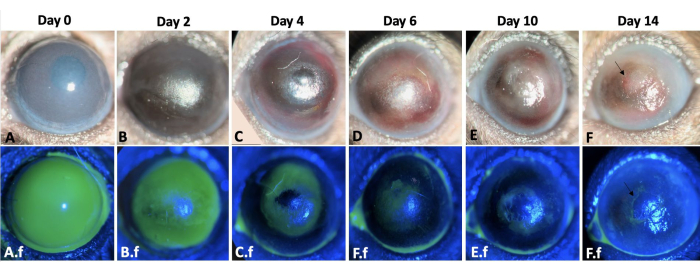
图3:左眼伤口愈合情况。 小鼠模型中角膜和角膜缘碱损伤后 2 周内小鼠左眼的伤口愈合过程如下图所示 (A-F)。裂隙灯检查眼睛。角膜水肿在第 0 天和第 2 天 (A、B) 更为明显,而纤维化在受伤后第二周 (E-F) 更为明显。 A.f-F.f 显示了同一只眼睛的再上皮化过程。在损伤诱导后立即观察到全角膜和角膜缘上皮缺损。结膜上皮细胞以向心方式迁移 12-14 天 (A.f-F.f) 愈合的上皮缺损。然而,50%的受伤眼睛在第二周结束时出现持续的上皮缺损,如F和F.f图像中的箭头所示。比例尺 = 1 mm(面板 C)。 请点击这里查看此图的较大版本.
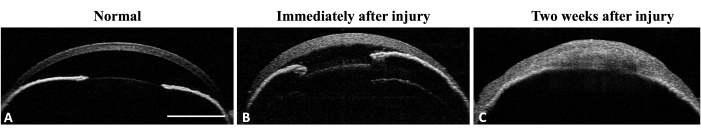
图 4:小鼠眼的前节 OCT。 (A) AS-OCT 说明了正常的角膜曲率和前房。虹膜结构清晰可辨。在虹膜中周缘未检测到虹膜角膜粘连。(B) 受伤后,由于水肿的形成,角膜厚度立即增加,虹膜角膜粘连在虹膜中周形成。(C) 受伤两周后,角膜曲率发生变化,可见虹膜角膜全粘连和前房破坏。比例尺 = 1 mm。 请点击这里查看此图的较大版本.
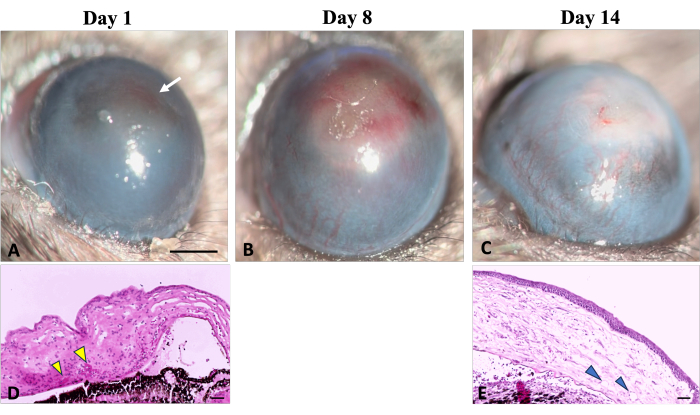
图5:角膜新生血管。 在氢氧化钠 (NaOH) 损伤后的伤口愈合过程中可以观察到角膜新生血管形成的临床和组织学体征。(A) 在受伤后的第一天可以检测到新生血管形成的初始迹象,其特征是角膜呈红色变色(用白色箭头表示)。这种变色是由红细胞在基质中的聚集引起的,如相应的组织学图像(D)所示(由黄色箭头表示)。(B)在再生的第一周,新血管逐渐增加并扩散到整个角膜。(C) 到 2 周结束时,角膜缘区域被破坏,新血管继续进化。(E)角膜的组织学切片进一步说明了深层基质新生血管的存在(箭头所示)。裂隙灯 图像比例尺 = 1 mm,组织学图像比例尺 = 50 μm。 请点击这里查看此图的较大版本.
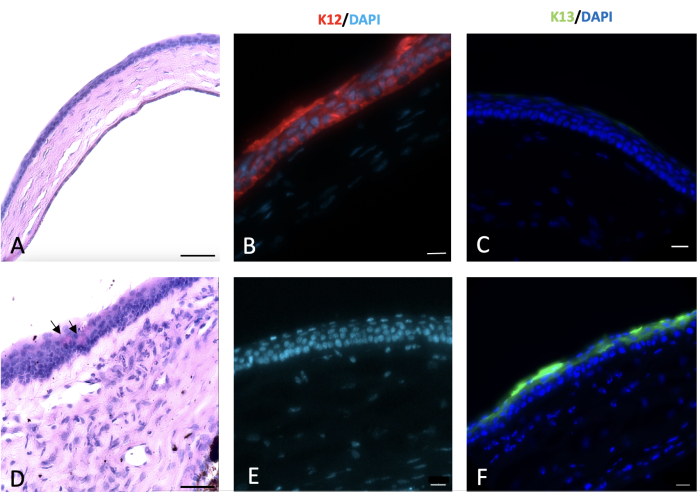
图 6:角膜的高碘酸-希夫和免疫组织化学 (IHC) 染色。 受伤后 2 周对正常和受伤的角膜进行高碘酸-希夫和免疫组织化学染色。正常小鼠角膜上皮由 4-5 层细胞组成 (A)。角膜和角膜缘的碱损伤导致角膜结膜形成,角膜表面出现杯状细胞,如(D)中的黑色箭头所示。正常角膜上皮细胞表达 K12 (B),而覆盖受损角膜的结膜细胞不表达 K12 (B)。K13 是结膜上皮细胞的特征性标志物,在正常角膜上皮细胞上不表达 (C)。然而,它存在于氢氧化钠 (NaOH) 受损的角膜表面,这是角膜结膜形成 (F) 的标志。组织学图像比例尺 = 50 μm,IHC 染色图像比例尺 = 20 μm。 请点击这里查看此图的较大版本.
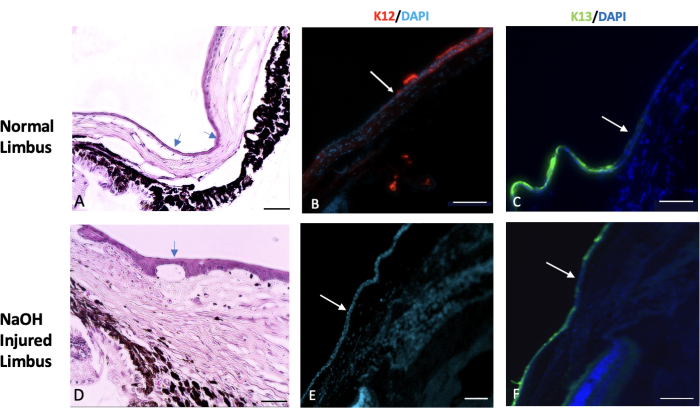
图 7:苏木精和伊红以及免疫组织化学染色。 对正常和受伤的角膜缘组织进行苏木精和伊红 (H&E) 和免疫组织化学染色。(A) 正常角膜缘标志着巩膜末端和角膜起点之间的过渡区域。该区域通常被一层或两层结膜上皮细胞覆盖(由箭头表示)。在健康的眼睛中,一种称为 K12 的特定角膜上皮标志物的表达从角膜缘开始并延伸到角膜表面(如图 B 所示)。另一方面,称为 K13 的结膜标志物的表达仅限于角膜缘,不会超出角膜缘(由图像 C 中的白色箭头表示)。在被氢氧化钠 (NaOH) 损伤的眼睛中,角膜缘的边界被破坏。这导致结膜细胞向受伤角膜迁移。(D) NaOH 损伤角膜缘的图像显示上皮层下方和基质组织内都存在新生血管形成。损伤后,受伤的角膜表面缺乏 K12 (E) 的存在,而 K13 在角膜表面 (F) 上大量表达。组织学图像比例尺 = 50 μm,IHC 染色图像比例尺 = 100 μm。 请点击这里查看此图的较大版本。
补充文件1:染色方案。请点击这里下载此文件。
视频 1:使用环钻的小鼠模型中的 NaOH 角膜和角膜缘损伤。 该视频演示了在小鼠模型中用穿孔钻诱导 NaOH 角膜和角膜缘损伤的过程。将环钻孔保持在与球体平行的轴上,并对角膜缘施加最小的压力至关重要。这种适当的技术对于防止泄漏和获得最佳结果至关重要。 请按此下载此影片。
视频 2:在保留延髓结膜的同时进行剜除术的插图。 为了区分眼球的鼻侧和颞侧,鼻痈与眼球一起被保留下来。从结膜的交界处到跗板开始解剖整个结膜。在最小的压力下,轨道内容物向外突出。通过将镊子引导到眼球的后部,可以抓住视神经并提取组织。去核组织包括眼球、眼眶脂肪和眼眶泪腺。 请按此下载此影片。
讨论
这项研究提出了一种创新设备,即穿孔环钻,可用于在小鼠模型中成功诱导有效且可重复的角膜和角膜缘损伤。这种角膜缘干细胞缺乏模型是研究损伤后角膜伤口愈合和结膜形成动力学的理想选择。
有证据表明,角膜缘生态位和小鼠角膜的中央部分都含有干细胞30。因此,需要有效的角膜和角膜缘损伤来产生干细胞缺陷模型,而这里介绍的损伤模型可以使弯曲的角膜缘在特定时期内暴露于化学试剂。为了确定NaOH损伤的最佳浓度和持续时间,使用了不同NaOH浓度和持续时间的损伤。较高的 NaOH 浓度或较长的暴露时间会导致组织损伤和纤维化增加。因此,研究人员可以根据研究的具体目标和所需的损伤严重程度来调整这些参数。
为了成功重现这种角膜缘和角膜缘损伤模型,应考虑几个关键因素。首先,必须测量目标眼的角膜缘到角膜缘直径,以确定合适的打孔尺寸。建议选择外径比此直径大 0.5 - 1 mm 的活检穿刺器。
如 图1G所示,所用液体的表面张力是防止眼面与冲头环钻边缘界面泄漏的重要因素。因此,无需对穿刺活检的尖端施加压力。
为避免对组织造成机械损伤,关键是要将环钻与眼睛保持在平行轴上,并避免对角膜缘施加压力。冲头环钻轴调整不当会增加泄漏风险,并导致受伤部位偏移和结果不准确。
该技术的一些潜在局限性包括需要选择合适的冲头尺寸、熟练握住冲头环钻以及造成机械损伤的潜在风险。但是,这些限制可以通过实践和遵循本协议中概述的说明来克服。小鼠的品系和年龄范围是影响再上皮化过程的其他因素,必须在研究中考虑。
此外,拟议的方案是有利的,因为它详细介绍了一种保留延髓和睑结膜的剜除方法,并允许在不应用手术缝合线作为标记的情况下确定球的鼻部。先前的研究表明,与角膜的其他区域相比,眼睛的鼻部区域具有最低的神经支配,这使得它更容易受到新生血管形成和再生功效降低的影响31,32。
综上所述,LSCD的临床体征,如角膜混浊(CO)、持续性上皮缺损和角膜新生血管形成(NV),以及观察到的组织学变化,包括杯状细胞化生、角膜表面K13表达和角膜表面K12缺失,证实了LSCD在该模型中的存在。这些发现提供了证据,证明这种新技术可有效诱导LSCD。这种化学损伤模型可用于临床前研究,以研究角膜损伤和再生领域的新药和药物治疗。
披露声明
作者均未在本研究中描述的任何公司或产品中拥有任何经济利益。作者声明没有其他利益冲突。
致谢
我们承认NEI P30-EY026877支持这项研究。我们非常感谢Charlene Wang和斯坦福大学干细胞生物学和再生医学研究所的Irv Weissman博士实验室在提供实验动物方面提供的所有帮助。我们感谢 Hirad Rezaeipoor 在准备和编辑图像方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| Anti-K12 antibody | ABCAM | ab185627 | |
| Anti-K13 antibody | ABCAM | ab92551 | |
| Bovine serum albumin (BSA) | ThermoFisher Scientific | B14 | |
| C57BL/6 mice | Dr Weissman Lab, Stanford University | ||
| Curved forceps | Storz | E1885 | |
| Disposable 90 degree bent needle | |||
| Disposable biopsy punch | Med blades | ||
| Donkey anti-rabbit IgG H&L | ABCAM | ab150073 | |
| Ethanol | ThermoFisher Scientific | T038181000CS | |
| Ethiqa XR (Buprenorphine extended-release injectable suspension) | Fidelis Animal Health | ||
| Heating pad for mouse | |||
| Ketamine hydrochloride | Ambler | ANADA 200-055 | |
| OCT | Tissue-Tek 4583 | ||
| Ophthalmic surgical scissors | |||
| pH Indicator Sticks | Whatman | ||
| Phosphate buffered saline (PBS) | ThermoFisher Scientific | AM9624 | |
| Prolong gold antifade reagent with DAPI | Invitrogen | P36935 | |
| Slit-lamp microscope | NIDEK | SL-450 | |
| Sodium fluorescein AK-fluor 10% | Dailymed | NDC17478-253-10 | |
| Sterile irrigation solution (BSS) | Alcon | 9017036-0119 | |
| Sterile syringe, 1 and 5 ml | |||
| Straight forceps | Katena K5 | 4550- Storz E1684 | |
| Surgical eye spears | American White 17240 Cross | ||
| Surgical microscope | Zeiss S5 microscope | ||
| Tetracaine ophthalmic drop | Alcon | NDC0065-0741-14 | |
| Timer | |||
| Triple antibiotic ophthalmic ointment | Bausch and Lomb | ||
| TritonX -100 | Fisher Scientific | 50-295-34 | |
| Two-speed rotary tool | 200-1/15 Two Speed Rotary Toolkit | ||
| Xylazine | AnaSed | NADA#139-236 |
参考文献
- Sridhar, M. S. Anatomy of cornea and ocular surface. Indian Journal of Ophthalmology. 66 (2), 190-194 (2018).
- Robaei, D., Watson, S. Corneal blindness: a global problem. Clinical & experimental Ophthalmology. 42 (3), 213-214 (2014).
- Lamm, V., Hara, H., Mammen, A., Dhaliwal, D., Cooper, D. K. C. Corneal blindness and xenotransplantation. Xenotransplantation. 21 (2), 99-114 (2014).
- Danjo, S., Friend, J., Thoft, R. A. Conjunctival epithelium in healing of corneal epithelial wounds. Investigative Ophthalmology & Visual Science. 28 (9), 1445-1449 (1987).
- Shapiro, M. S., Friend, J., Thoft, R. A. Corneal re-epithelialization from the conjunctiva. Investigative Ophthalmology & Visual Science. 21 (1 Pt 1), 135-142 (1981).
- Shah, D., Aakalu, V. K., Das, H. Murine Corneal Epithelial Wound Modeling. Wound Regeneration: Methods and Protocols. , 175-181 (2021).
- Rittié, L., Hutcheon, A. E., Zieske, J. D. Mouse models of corneal scarring. Fibrosis: Methods and Protocols. 1627, 117-122 (2017).
- Stepp, M. A., et al. Wounding the cornea to learn how it heals. Experimental Eye Research. 121, 178-193 (2014).
- Akowuah, P. K., De La Cruz, A., Smith, C. W., Rumbaut, R. E., Burns, A. R. An Epithelial Abrasion Model for Studying Corneal Wound Healing. Journal of Visualized Experiments. (178), 63112 (2021).
- Bai, J. Q., Qin, H. F., Zhao, S. H. Research on mouse model of grade II corneal alkali burn. International journal of Ophthalmology. 9 (4), 487-490 (2016).
- Paschalis, E. I., et al. The Role of Microglia and Peripheral Monocytes in Retinal Damage after Corneal Chemical Injury. The American Journal of Pathology. 188 (7), 1580-1596 (2018).
- Jiang, M., et al. Single-Shot Dimension Measurements of the Mouse Eye Using SD-OCT. Ophthalmic Surgery, Lasers and Imaging Retina. 43 (3), 252-256 (2012).
- Shadmani, A., Razmkhah, M., Jalalpoor, M. H., Lari, S. Y., Eghtedari, M. Autologous Activated Omental versus Allogeneic Adipose Tissue-Derived Mesenchymal Stem Cells in Corneal Alkaline Injury: An Experimental Study. Journal of Current Ophthalmology. 33 (2), 136-142 (2021).
- Swarup, A., et al. PNP Hydrogel Prevents Formation of Symblephara in Mice After Ocular Alkali Injury. Translational Vision Science & Technology. 11 (2), 31-31 (2022).
- Machholz, E., Mulder, G., Ruiz, C., Corning, B. F., Pritchett-Corning, K. R. Manual restraint and common compound administration routes in mice and rats. Journal of Visualized Experiments. (67), 2771 (2012).
- Jaber, S. M., et al. Dose Regimens, Variability, and Complications Associated with Using Repeat-Bolus Dosing to Extend a Surgical Plane of Anesthesia in Laboratory Mice. Journal of the American Association for Laboratory Animal Science. 53 (6), 684-691 (2014).
- Navarro, K. L., et al. Mouse Anesthesia: The Art and Science. ILAR Journal. 62 (1-2), 238-273 (2021).
- Hoogstraten-Miller, S. L., Brown, P. A. Techniques in Aseptic Rodent Surgery. Current Protocols in Immunology. 1, 1.12.1-1.12.14 (2008).
- ACLAM Medical Records Committee. Medical Records for Animals Used in Research, Teaching, and Testing: Public Statement from the American College of Laboratory Animal Medicine. ILAR Journal. 48 (1), 37-41 (2007).
- Yoeruek, E., et al. Safety, penetration and efficacy of topically applied bevacizumab: evaluation of eyedrops in corneal neovascularization after chemical burn. Acta Ophthalmologica. 86 (3), 322-328 (2008).
- Shomer, N. H., et al. Review of rodent euthanasia methods. Journal of the American Association for Laboratory Animal Science. 59 (3), 242-253 (2020).
- Kvanta, A., Sarman, S., Fagerholm, P., Seregard, S., Steen, B. Expression of Matrix Metalloproteinase-2 (MMP-2) and Vascular Endothelial Growth Factor (VEGF) in Inflammation-associated Corneal Neovascularization. Experimental Eye Research. 70 (4), 419-428 (2000).
- Tseng, S. C., Hirst, L. W., Farazdaghi, M., Green, W. R. Goblet cell density and vascularization during conjunctival transdifferentiation. Investigative Ophthalmology & Visual Science. 25 (10), 1168-1176 (1984).
- Huang, A. J., Tseng, S. C. Corneal epithelial wound healing in the absence of limbal epithelium. Investigative ophthalmology & visual science. 32 (1), 96-105 (1991).
- Rama, P., et al. Limbal stem-cell therapy and long-term corneal regeneration. New England Journal of Medicine. 363 (2), 147-155 (2010).
- Deng, S. X., et al. Global consensus on the definition, classification, diagnosis and staging of limbal stem cell deficiency. Cornea. 38 (3), 364-375 (2019).
- Wei, Z. G., Wu, R. L., Lavker, R. M., Sun, T. T. In vitro growth and differentiation of rabbit bulbar, fornix, and palpebral conjunctival epithelia: Implications on conjunctival epithelial transdifferentiation and stem cells. Investigative Ophthalmology and Visual Science. 34 (5), 1814-1828 (1993).
- Kao, W. W. Y. Keratin expression by corneal and limbal stem cells during development. Experimental Eye Research. 200, 108206 (2020).
- Park, M., et al. Plasticity of ocular surface epithelia: Using a murine model of limbal stem cell deficiency to delineate metaplasia and transdifferentiation. Stem Cell Reports. 17 (11), 2451-2466 (2022).
- Li, J., et al. Identification for Differential Localization of Putative Corneal Epithelial Stem Cells in Mouse and Human. Scientific Reports. 7 (1), 5169 (2017).
- McKenna, C. C., Lwigale, P. Y. Innervation of the Mouse Cornea during Development. Investigative Ophthalmology & Visual Science. 52 (1), 30-35 (2011).
- He, J., Bazan, H. E. P. Neuroanatomy and Neurochemistry of Mouse Cornea. Investigative Ophthalmology & Visual Science. 57 (2), 664-674 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。