从成年自身免疫性脑脊髓炎小鼠中同时分离主要中枢神经系统驻留细胞类型
* 这些作者具有相同的贡献
摘要
迄今为止,从同一只小鼠中同时分离所有主要中枢神经系统驻留细胞类型的方案尚未满足需求。该方案显示了适用于幼稚和实验性自身免疫性脑脊髓炎小鼠的程序,以研究神经炎症期间的复杂细胞网络,同时减少所需的小鼠数量。
摘要
实验性自身免疫性脑脊髓炎 (EAE) 是多发性硬化症 (MS) 最常见的小鼠模型,经常用于进一步阐明 MS 的未知病因,以开发新的治疗策略。髓鞘少突胶质细胞糖蛋白肽 35-55 (MOG35-55) EAE 模型再现免疫后 10 天内伴有上行麻痹的自限性单相病程。每天使用临床评分系统检查小鼠。多发性硬化症由具有特定时间模式的不同病理机制驱动,因此研究中枢神经系统 (CNS) 驻留细胞类型在疾病进展过程中的作用非常有意义。该协议的独特之处在于同时分离适用于成年EAE和健康小鼠的所有主要CNS驻留细胞类型(小胶质细胞,少突胶质细胞,星形胶质细胞和神经元)。从成年小鼠中分离大脑和脊髓后,进行磁活化细胞分选 (MACS) 以分离小胶质细胞、少突胶质细胞、星形胶质细胞和神经元。流式细胞术用于对纯化的单细胞悬液进行质量分析,确认细胞分离后的活力,并表明每种细胞类型的纯度约为 90%。总之,该协议提供了一种精确而全面的方法来分析健康和EAE小鼠中的复杂细胞网络。此外,由于所有四种细胞类型都是从同一只小鼠中分离出来的,因此所需的小鼠数量可以大大减少。
引言
多发性硬化症 (MS) 是一种中枢神经系统 (CNS) 的慢性炎症性自身免疫性疾病,其特征是脱髓鞘、轴突损伤、神经胶质增生和神经退行性变。尽管该领域有许多研究方法,但 MS 的病理生理学仍未完全了解 1,2,3,4。研究 MS 的最常见动物模型是髓鞘少突胶质细胞糖蛋白肽 35-55 (MOG35-55) 诱导的实验性自身免疫性脑脊髓炎 (EAE),它具有许多临床和病理生理特征 5,6,7,8,9 .它基于免疫系统对导致炎症、脱髓鞘和神经轴突变性的中枢神经系统特异性抗原的反应。实验性自身免疫性脑脊髓炎 (EAE) 是研究 MS 中发现的神经炎症通路和信号级联反应的合适模型。
目前多发性硬化症的治疗方案仅部分有效,主要集中在疾病的初始炎症阶段。然而,多发性硬化症的神经退行性成分似乎是长期治疗方法的主要挑战。因此,需要可重复和精确的细胞分离方案来全面研究自身免疫性疾病的分子和细胞机制。即使存在一些用于分离一种单一细胞类型的方案10,11,12,13,14,15,同时分离多个CNS驻留细胞群的需求仍未得到满足。先前用于分离中枢神经系统驻留细胞的方案缺乏保留细胞功能和纯度的方案,导致与相邻细胞共培养16,17,18或不适合离体细胞内网络的复杂分析19,20,21,22。
该方案的目的是建立一种可重复和全面的方法,用于同时分离适用于成年健康和EAE小鼠的所有主要CNS驻留细胞类型的纯活单细胞悬浮液。使用磁活化细胞分选 (MACS) 23 分离不同的细胞类型。细胞分离可以通过阳性选择(即细胞类型特异性表面标记物的磁性标记)或通过生物素化和所有不需要的细胞的耗竭进行阴性选择来实现。应用流式细胞术以确保纯度高于 90% 和至少 80% 的分离单细胞悬浮液的活力。
总之,主要目标是建立一种同时分离所有主要中枢神经系统驻留细胞类型的方案,作为研究神经炎症途径的多功能工具,提供对复杂细胞网络和生化信号级联的全面精确分析健康和EAE小鼠。
研究方案
所有EAE实验均在10-12周龄的雌性C57BL / 6J小鼠中诱导,并得到地方当局(Landesamt für Natur,Umwelt und Verbraucherschutz Nordrhein-Westfalen)的批准。在实验的任何时候,也确保遵守德国和欧盟的动物保护法。所有小鼠都饲养在单独通风的笼子动物饲养条件下。
注:以下试剂体积是指一个成年鼠脑和脊髓,在下文中称为中枢神经系统细胞悬液,重量约为20mg至500mg。如果计划解离多个中枢神经系统细胞悬液,则必须相应地增加所有试剂体积和材料。建议在整个实验过程中将Dulbecco的磷酸盐缓冲盐水(D-PBS;1x)与钙和镁一起储存,并补充1g/L葡萄糖和36mg/L丙酮酸钠)。如果之后计划进行细胞培养,请使用罩在无菌条件下执行所有步骤。否则,以下协议部分都不需要在后台执行。将缓冲液储存在冰上。仅使用预冷溶液,并在整个实验过程中避免涡旋。有关整体工作流,请参见 图 1 。
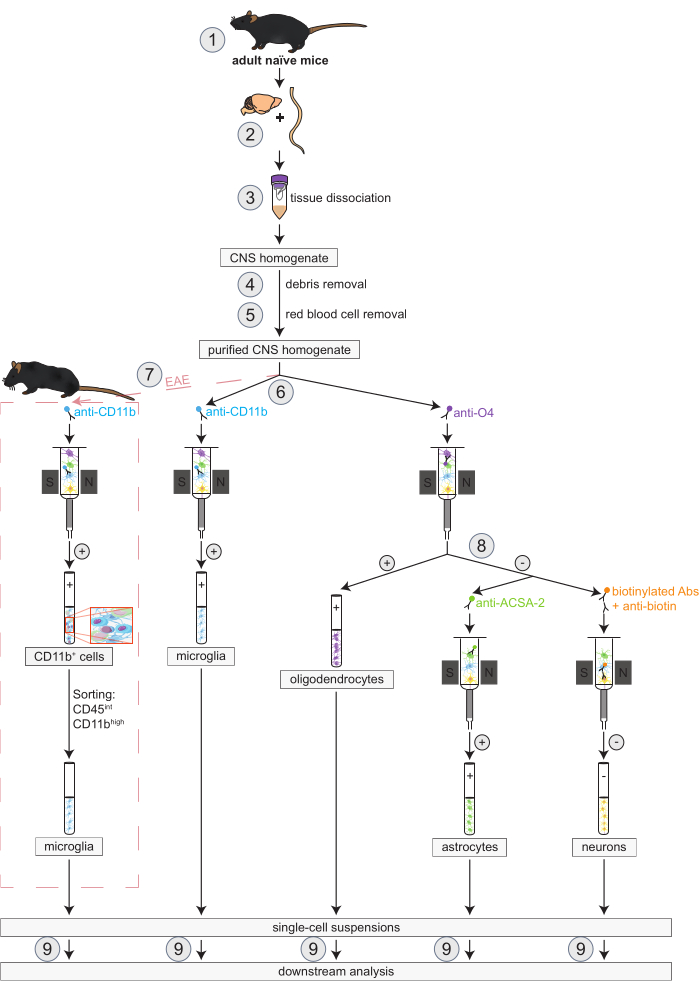
图 1:在幼稚小鼠和 EAE 小鼠中同时分离少突胶质细胞、小胶质细胞、星形胶质细胞和神经元的工作流程。对于幼稚小鼠和 EAE 小鼠,工作流程的第一步是相同的。如果需要使用 EAE 复制品,则必须事先执行 EAE 诱导 (1)。简而言之,该方案从小鼠大脑和脊髓的解剖(2)和解离(3)开始,然后去除碎片(4)和红细胞(5)。随后,将所得纯化的 CNS 细胞悬液分成两部分,以便通过 MACS 同时分离少突胶质细胞和小胶质细胞 (6)。通过抗CD11b微珠检测小胶质细胞,而使用抗O4微珠分离少突胶质细胞(阳性选择)。从少突胶质细胞的负流通 (8) 中,通过抗 ACSA-2 微珠(正选择)分离星形胶质细胞,并通过生物素标记和所有非神经元细胞的耗竭(阴性选择)分离神经元。在 EAE 小鼠中,分离 CD11b+ 细胞后,对 CD45intCD11b高细胞进行荧光激活细胞分选,以消除其他 CD11b+ 免疫细胞,如巨噬细胞、树突状细胞、单核细胞、粒细胞和自然杀伤细胞,这些细胞已知在 EAE 过程中参与神经炎症过程 (7)27,28,48.分离出不同的 CNS 驻留细胞类型后,可以进行纯度分析 (9)。缩写:Abs = 抗体;ACSA-2 = 星形胶质细胞表面抗原-2;CD11b = 细胞周期蛋白依赖性激酶 11B;CD45 = 受体型酪氨酸蛋白磷酸酶 C;CNS = 中枢神经系统;EAE = 实验性自身免疫性脑脊髓炎;MACS = 磁激活细胞分选;O4 = 少突胶质细胞标志物 O4。这个数字是从49修改过来的。请点击这里查看此图的较大版本.
1. 主动EAE的诱导
- 试剂的制备
- 对于细胞分离:制备PB缓冲液并将其储存在2-8°C最多1周。要制备储备溶液,加入 475 mL 不含补充剂的 1x PBS (pH 7.2) + 25 mL 0.5% 牛血清白蛋白 (BSA)。使用 BSA 中制备的 1:20 稀释液。
- 对于流式细胞术和荧光激活细胞分选(FACS):制备FACS缓冲液,PBS,含有2%胎牛血清(FCS)和2mM EDTA,并将其储存在2-8°C。 准备时,加入 500 mL 不含补充剂的 1x PBS 和 10 mL FCS + 2 mL EDTA(来自 0.5 M EDTA 原液)
- 根据 Bittner 等人 5 的方案进行免疫接种。简而言之,通过皮下注射含有200μgMOG 35-55肽和200μL完全弗洛伊德佐剂(包括200μg结核分枝杆菌)的乳剂来诱导EAE。
- 通过使用带有异氟醚蒸发器的麻醉室,用2%异氟醚麻醉小鼠。在动物的眼睛上使用兽医软膏,以防止麻醉时干燥。
- 2小时后,根据Huntemann等人24的方案,腹膜内注射溶解在100μL1x PBS中的100ng百日咳毒素(PTx)。在免疫接种后第 2 天重复注射 PTx。
注意:观察每只动物,直到它恢复足够的意识以保持胸骨卧位。经过注射程序的小鼠在完全康复之前不会返回给其他小鼠的公司。对于 结核分枝杆 菌和PTx:避免吸入、摄入和接触皮肤和眼睛。 结核分枝杆 菌是先天免疫系统的激活剂。PTx具有许多生物学效应。 - 每天监测EAE的进展,由两名盲法研究人员进行,他们监测体重并临床检查小鼠。
- 为此,使用以下评分系统是 0 级 - 无 EAE 临床症状、1 级 - 部分尾部麻痹、2 级完全尾部麻痹、3 级 - 中度后肢无力、4 级完全后肢无力和共济失调步态、5 级轻度截瘫、6 级截瘫、7 级截瘫、8 级四肢瘫痪、9 级四肢瘫痪、 和 10 级死亡。
- 使用以下排除标准进一步参与实验临床评分> 7 或体重减轻超过初始体重的 20%。
- 对于大脑和脊髓的解剖,在EAE诱导后第16天对EAE小鼠实施安乐死,代表疾病最大值。
2.中枢神经系统组织制备(持续时间:每只小鼠约10分钟)
- 用二氧化碳处死小鼠后,开始用20mL1x PBS对每只小鼠进行心内灌注。再次用 20 mL 1x PBS 重复灌注。
- 将鼠标置于仰卧位并用套管固定四肢。在动物的前体上涂抹75%乙醇。在这一点上,没有必要采取进一步的无菌措施。
- 在剪刀的帮助下,通过皮肤和筋膜进行纵向切片,打开腹部和胸部。
- 横向切开肋骨并折叠胸部以自由进入心脏。用套管固定向上折叠的胸部。
- 用剪刀打开右心房。用套管将 20 mL 1x PBS 涂入左心室,以通过切开的右心房冲洗血液。
- 通过纵向切片切开鼠头顶部的皮肤来暴露头骨,并使用镊子将皮肤移到头部周围。用剪刀沿着矢状缝线切开颅骨。
- 将镊子的尖端沿切口线插入,以打开镊子。用镊子取出的剩余部分,使大脑完全暴露。
- 小心地取出大脑并将其放入鼠脑基质中。使用剃须刀片将大脑切成 1 毫米厚的矢状切片。
- 在髂嵴上方的剪刀的帮助下切割脊柱,以便将注射器插入椎管。
注意:切除脊髓的最简单方法是用 PBS 将其从椎管中冲洗出来。否则,必须用剪刀单独打开椎弓,然后才能切除脊髓。 - 使用 20 mL 注射器和含有 1x PBS 的 20G 针头将脊髓从尾部冲洗到颅骨。用手术刀将脊髓切成0.5厘米长的段。
- 将每个由脑和相应脊髓组成的中枢神经系统细胞悬液储存在每只小鼠的一个单独的培养皿中,该培养皿中装满约3mL冷D-PBS。将盘子存放在冰上,直到进一步加工。
3.中枢神经系统组织解离(持续时间:约1-1.5小时,取决于中枢神经系统细胞悬浮液的数量)
注意:通过将机械解离与细胞外基质的酶降解相结合,将成年小鼠的神经组织解离。因此,结构完整性得以保持,细胞悬液可用于进一步的细胞分离程序。
- 制备适当体积的酶混合物 1,包括 50 μL 酶 P 和 1,900 μL 缓冲液 Z,每个 CNS 细胞悬液。两种试剂都属于成人脑解离试剂盒。
- 根据中枢神经系统细胞悬液制备适当体积的酶混合物 2,包括 10 μL 酶 A 和 20 μL 缓冲液 Y。两种试剂都属于成人脑解离试剂盒。
- 将 1,950 μL 酶混合物 1 转移到 C 管中,然后加入一个 CNS 细胞悬液的组织碎片。每只小鼠使用一个C管。
- 向每个 C 管中加入 30 μL 酶混合物 2。拧紧C管,并用加热器将它们倒置连接到细胞解离器的套管上。
- 运行名为 37C_ABDK_01 的相应程序(需要 30 分钟)。至少观察程序的前 5 分钟,以确保所有管子以相同的速度转动。在运行过程中可能会发生错误。然后,继续执行步骤 6。
- 在程序的最后 2 分钟,将一个 70 μm 过滤器放在每个解离的 CNS 细胞悬浮液的 50 mL 管上。用 2 mL D-PBS 预润湿这些过滤器。
- 程序终止后,将C管从解离器上连接起来,并将它们放入离心机中。将样品在300× g 和4°C下离心1分钟,以在管底部收集样品。
- 将样品重新悬浮并涂抹在预润的过滤器上。将 10 mL 冷 D-PBS 加入空 C 管中并关闭。轻轻摇晃,然后将悬浮液涂抹在相应的过滤器上。
- 丢弃过滤器并关闭 50 mL 试管。再次将细胞悬液在300× g 和4°C下离心10分钟。之后,非常小心地吸出整个上清液。
4.碎片清除(持续时间:约1.5-2小时,取决于CNS细胞悬浮液的数量)
注意:组织解离通常会导致髓磷脂和细胞碎片,从而损害下游分析。通过添加碎片清除溶液,可以有效地从中枢神经系统细胞悬浮液中去除这些碎片。
- 对于每个中枢神经系统细胞悬浮液,用 3,100 μL D-PBS 小心地重悬细胞沉淀。不要涡流。
- 如果使用多个 CNS 细胞悬液,则在一个 15 mL 试管中最多汇集两个来自一个条件或实验组的 CNS 细胞悬液。
- 将成人脑解离试剂盒中的 900 μL 碎片去除溶液加入一个 CNS 细胞悬液中,或将 1,800 μL 碎片去除溶液加入两个混合的 CNS 细胞悬浮液中。
- 倒置管子并混合悬浮液。然后,用 4 mL 冷 D-PBS 轻轻覆盖。应该可以看到清晰的梯度(图2A)。
- 在3000× g 和4°C下将管离心10分钟,完全加速且无制动。
- 如果分离按预期发生,则形成三相(图2C)。完全吸出两个顶部相(图2C-1,2)并丢弃它们。重要的是没有髓鞘残留物(图2E)。
注意:如果梯度不起作用并且迫切需要细胞,请不要吸掉两个顶部相。取而代之的是,用冷 D-PBS 填充 15 mL 试管至 15 mL 并倒置数次。在4°C下再次以1000× g 离心10分钟,完全加速且无制动。吸出上清液并重复步骤4.1-4.4。 - 用高达 14 mL 的冷 D-PBS 填充试管并关闭管。在工作台上用力倒置试管,直到细胞沉淀从试管底部分离。不要涡流。
- 再次将样品在1000× g 和4°C下离心10分钟。设置全加速和全制动。小心彻底地吸出上清液。

图 2:清除碎片期间的注意事项。(A) 叠加 4 mL PBS 后梯度的积极示例。由 4 mL PBS 组成的上相与由带有碎屑去除溶液的 CNS 细胞悬浮液组成的下相明显区分开来。 (B) 叠加 4 mL PBS 后梯度的否定示例。梯度在PBS和下面的细胞悬液之间缺乏明确的分离。少量PBS扩散到细胞悬液中。 (C) 离心后梯度的正面例子。可以很容易地区分三个独立的阶段。在梯度的上相(1)或下相(3)中看不到髓鞘残基。中间期包含所有髓鞘 (2)。细胞沉淀在 15 mL 试管的底部可见。(D) 离心后梯度的否定示例。这三个阶段之间不可能有准确的分离。一些髓鞘残基在梯度的上相(1)和下相(3)中可见。 (E) 吸气两个顶相后梯度的正面示例。所得样品仅包含细胞沉淀和上面的透明上清液。没有髓鞘残留物。 (F) 吸气两个顶相后梯度的否定示例。样品中仍含有一些髓鞘残基(黑色箭头)。缩写:CNS = 中枢神经系统;PBS = 磷酸盐缓冲盐水 请点击这里查看此图的较大版本.
5.红细胞去除(持续时间:约1小时,取决于中枢神经系统细胞悬浮液的数量)
注意:此步骤可防止红细胞后期污染,并确保红细胞的最佳裂解,对从中枢神经系统组织分离的其他细胞类型的影响最小。以下体积适用于来源于100mg至1g神经元组织的细胞悬液,对应于两个成年小鼠的大脑和脊髓。如果使用两种以上的中枢神经系统细胞悬浮液,请相应地放大所有试剂和总体积。
- 从红细胞去除液(RBCRS)的制备开始:每两个合并的CNS细胞悬浮液。在 900 μL ddH2O 中将成人脑解离试剂盒中的 100 μL 红细胞去除储备溶液 (10x) 稀释至 1:10 的最终稀释度。
- 将RBCRS储存在2-8°C直至使用。在一天结束时丢弃未使用的遗骸。
- 将最多两个 CNS 细胞悬液的细胞沉淀重悬于 1 mL RBCRS 中。避免涡流。将溶液在4°C孵育10分钟。
- 将 10 mL 冷 PB 缓冲液加入两个混合的细胞悬浮液中。将样品在300× g 和4°C下离心10分钟,然后完全吸出上清液。
- 通过缓慢上下移液,将来自一个 CNS 细胞悬液的每个细胞沉淀重悬于 80 μL PB 缓冲液中。因此,使用 160 μL 重悬来自两种 CNS 细胞悬液的细胞沉淀。
- 当使用来自相同实验条件的几种中枢神经系统细胞悬液时,将所有这些细胞悬液汇集在一起。
- 确定细胞计数,例如,使用改进的计数室。细胞悬液通常在PB缓冲液中以1:50稀释,然后在0.4%台盼蓝溶液中以1:10进一步稀释。
6.幼稚小鼠和EAE小鼠的磁珠方案(持续时间:约1小时)
- 用针对其表面抗原的微珠磁性标记不同的中枢神经系统细胞类型。然后,将细胞悬浮液放入色谱柱中,并用磁性分离保留在色谱柱中的标记细胞和流经的未标记细胞。
- 从磁场中取出色谱柱后,将磁性标记的细胞从色谱柱中冲洗到试管中,作为阳性选择的细胞部分。
注意:磁性标记过程的体积计算最多为 1 x 107 个总细胞。如果获得更多细胞,则相应地放大所有试剂和总体积。建议快速工作,仅使用预冷溶液,以防止抗体在细胞表面加盖和非特异性细胞标记,并确保分离的细胞群具有高活力。同样重要的是,在色谱柱储液槽清空后立即通过添加PB缓冲液来执行洗涤步骤,以免色谱柱变干。 - 将纯化的未稀释的CNS细胞悬液分成两部分,用于以下小胶质细胞和少突胶质细胞的分离。两种组分的比例取决于每种细胞类型的所需细胞计数。
注: 表1中列出了更多详细信息(孵育持续时间,详细方案步骤,体积,试剂和细胞计数方法)。
表 1:从幼稚小鼠和 EAE 小鼠中同时磁性标记和分离少突胶质细胞和小胶质细胞的工作流程。 两种细胞类型都是通过阳性选择分离的。同一行中列出的步骤指示为一次执行。缩写:CD11b = 细胞周期蛋白依赖性激酶 11B;EAE = 实验性自身免疫性脑脊髓炎;FcR = Fc 受体样蛋白;O4 =少突胶质细胞标志物 O4。 请按此下载此表格。
7.方案修订:用于分离EAE小鼠小胶质细胞的额外分选(持续时间:约1.5-2小时)
注意:当使用EAE小鼠时,有必要通过FACS补充基于MACS的细胞分离方案,以从CD11b +细胞组分中去除小胶质细胞以外的CD11b +细胞群(例如,单核细胞,巨噬细胞,自然杀伤细胞,粒细胞或树突状细胞)。否则,可以忽略此步骤。
- 制备含有补充有CD11b FITC(克隆M1 / 70,1:50)和CD45 APC / Cy7(克隆30-F11,1:200)的1x PBS的染色预混液。每 5 x 106 个细胞使用 100 μL 染色预混液。使用前涡旋所有抗体。
- 将小胶质细胞悬浮液在300× g 和4°C下离心10分钟,并小心吸出上清液。
- 每 5 x 106 个细胞用 100 μL 制备的染色预混液重悬细胞沉淀。在室温(RT)下在黑暗中孵育15分钟。
- 通过加入500μLPBS停止反应,并在300× g 和4°C下再次离心样品10分钟。
- 小心吸出上清液,并用补充有10μg/ mL DNAse的1x PBS重悬细胞沉淀,以达到1×107 个细胞/mL的最终浓度。将细胞储存在4°C直至分选开始。
- 在开始分选之前,立即将细胞悬液施加在放置在新FACS管上的100μm过滤器上。
- 将流速设置为每秒 1000 个事件并使用 100 μm 喷嘴。将所需的 CD45intCD11b高 细胞群分选到新的 15 mL 管中,该管在室温下用 1x PBS 制备。
8.制备用于分离神经元和星形胶质细胞的少突胶质细胞负流通(持续时间:约1小时)
注意:收集来自步骤6的少突胶质细胞的负流过,以进一步分离神经元和星形胶质细胞。为此,将细胞悬液分成两部分。由于先前从中枢神经系统细胞悬液中分离出少突胶质细胞,因此 O4+ 细胞的污染被最小化,否则会观察到。
- 将少突胶质细胞的负流过在300× g 和4°C下离心10分钟,并小心吸出上清液。
- 将细胞沉淀重悬于每个混合的CNS细胞悬液的80μLPB缓冲液中,该缓冲液先前用于分离少突胶质细胞阳性部分。
- 计算单元格。在PB缓冲液中以1:50稀释细胞悬液后,使用改进的计数室对假定为O4- 的细胞进行计数,然后在0.4%台盼蓝中进一步以1:10稀释。
- 将纯化的未稀释细胞悬液分成两部分,以便同时分离神经元和星形胶质细胞。两种组分的比例取决于每种细胞类型的首选量。
注: 表2中列出了更多详细信息(孵育持续时间,详细方案步骤,体积,试剂和细胞计数方法)。
表 2:同时磁性标记和分离来自幼稚小鼠和 EAE 小鼠的神经元和星形胶质细胞的工作流程。 两种细胞类型都是从少突胶质细胞的负流通中分离出来的。星形胶质细胞通过抗 ACSA-2 微珠作为阳性选择分离,而神经元通过生物素化和所有非神经元细胞的耗竭作为阴性选择进行纯化。同一行中列出的步骤指示为一次执行。缩写:抗ACSA-2=星形胶质细胞表面抗原-2;EAE = 实验性自身免疫性脑脊髓炎;FcR = Fc 受体样蛋白;MACS = 磁活化细胞分选。 请按此下载此表格。
9. 分离的 CNS 驻留细胞类型的纯度分析(持续时间:约 2 小时)
注意:建议对所有四种分离的 CNS 驻留细胞群进行流式细胞术,以测量和比较它们的纯度和活力。因此,有必要用荧光团标记的抗体对所有细胞类型进行染色。使用可固定的活力染料 (1:10,000) 进行活细胞/死细胞染色。
- 纯度检测组合 - 细胞外染色方案
- 每次染色使用 1 x 105 个溶解在 50 μL PBS 中的细胞。
- 制备溶解在PBS中的染色预混液,其中含有2%FCS / 2 mM EDTA,由以下荧光染料偶联单克隆抗体组成,靶向细胞类型特异性表面标记物:CD11b FITC(克隆1/70,1:100)25,26,27,28,生物素-PE(克隆Bio3-18E7,1:200)29,30,31,32,ACSA-2 PE-Vio615(克隆REA-969,1:200)33, 34,35,O4 APC(克隆REA-576,1:400)和CD45 BV510(克隆30-F11,1:150)36,37。每 1 x 106 个细胞加入 1 μg 抗 CD16/32 以阻断 Fc 受体3 8,39。使用前涡旋所有抗体。
- 将细胞悬液在540× g 和4°C下离心5分钟,并小心吸出上清液。
- 将细胞沉淀重悬于100μL相应的预混液中,并将样品在室温下在黑暗中孵育15分钟。
- 用500μL含有2%FCS / 2mM EDTA的1x PBS洗涤细胞,并将样品在540× g 和4°C下离心5分钟。
- 吸出上清液,并用70μL含2%FCS / 2mM EDTA的1x PBS重悬细胞沉淀。
- 涡旋样品以完全解离细胞沉淀。随后,样品准备好进行流式细胞术分析。
- 纯度检测组合 - NeuN 细胞内染色方案
- 使用每个细胞群的 1 x 105 个细胞对 NeuN 进行细胞内染色,NeuN 是一种神经元特异性核标记物 40,41。这是对活神经元进行染色的另一种方法。
- 将每个细胞群的 1 x 105 个细胞转移到 FACS 管中。每管加入 1 mL 含 2% FCS/2 mM EDTA 的 PBS。将管在540× g 和4°C下离心5分钟。
- 同时,制备溶解在PBS中的预混液,其中含有2%FCS / 2 mM EDTA,由以下荧光染料偶联的单克隆抗体组成,靶向细胞类型特异性表面标记物:CD11b FITC(克隆M1 / 70,1:100)25,26,27,28,生物素-PE(克隆Bio3-18E7,1:200)29,30,31,32,ACSA-2 PE-Vio615(克隆REA-969,1:200)33,34,35 和 CD45 BV510(克隆 30-F11,1:150)36,37。
- 吸出上清液并将细胞重悬于100μL制备的预混液中,并将样品在室温下在黑暗中孵育10分钟。
- 用含有2%FCS / 2mM EDTA的100μLPBS洗涤细胞,并在540× g 和4°C下再次离心5分钟。
- 同时,制备 200 μL 固定/透化溶液:将 50 μL 固定/透化浓缩液的浓缩原液加入 150 μL 固定/透化稀释剂中,以达到 1:4 的最终稀释度。
- 吸出上清液并将细胞重悬于100μL 1x固定/透化溶液中。将样品在4°C孵育30分钟。
- 同时,通过将 100 μL 透化缓冲液加入 900 μL ddH2O 中,制备 1 mL 1x 透化/洗涤缓冲液,以达到 1:10 的最终稀释度。
- 用100μL1x透化/洗涤缓冲液洗涤细胞1x,并将样品在540× g 和4°C下离心5分钟。
- 同时,在仅由NeuN(NeuN AF647,克隆EPR12763,1:200)和每106 个细胞的1μg抗CD16 / 32组成的1x通透/洗涤缓冲液中制备另一种预混液,以阻断Fc受体。
- 吸出上清液。将固定和透化的细胞重悬于50μL第二预混液中,并在4°C下孵育30分钟。
- 用100μL1x透化/洗涤缓冲液洗涤样品,并在540× g 和4°C下离心5分钟。
- 弃去上清液,将细胞沉淀重悬于含有2%FCS / 2mM EDTA的70μLPBS中。随后,样品准备好进行流式细胞术分析。
- 在流式细胞仪上设置面板后,使用流式细胞术分析软件获取细胞进行纯度分析。
10. 统计分析
- 使用图形分析程序执行统计分析和设计图形。数据以 SEM 的平均值±表示。
代表性结果
目前的方案提供了从单个中枢神经系统复制中同时分离所有主要中枢神经系统驻留细胞的可能性,即小胶质细胞、少突胶质细胞、星形胶质细胞和神经元。这对于减少此类实验所需的小鼠数量以及确保细胞水平上分子和生化分析的可比性非常重要。如果从不同的中枢神经系统重复中分离出单个细胞类型,则无法如实绘制细胞相互作用图谱,并且分离过程中潜在的技术偏差可能会进一步偏向下游分析。此外,每种细胞类型的分子和生化发现不会相互比较,因为它们不是来自相同的EAE背景。使用商业系统/试剂盒的预先存在的 MACS 方案经过调整,以实现上述细胞类型的同时分离。
使用抗CD11b微珠分离小胶质细胞,通过抗O4微珠分离少突胶质细胞(表1),使用抗ACSA-2微珠分离星形胶质细胞(表2)。相比之下,神经元的分离代表了一种负选择,并且是通过所有非神经元细胞的生物素化和磁性标记完成的(表2)。除血细胞外,所有非神经元细胞(例如少突胶质细胞、小胶质细胞、星形胶质细胞、内皮细胞和成纤维细胞)都可以通过使用生物素偶联抗体进行磁性标记,特异性针对这些非神经元细胞上表达的表面抗原(表 2)。通过耗尽这些磁性标记的非神经元细胞,可以产生高纯度和活的神经元细胞群30,42,43。
设计了两种新的流式细胞术panel,用于生成的单细胞悬液的纯度分析。在这里,使用了细胞类型特异性表面和核标记物以及活/死细胞区分。
分析了每只小鼠和细胞类型的细胞产量(图3A),平均为8。每只幼稚小鼠 4 x 105 ± 3 x 104 个 小胶质细胞、3.23 x 106 ± 1 x 105 个 少突胶质细胞、8.6 x 105 ± 2 x 104 个 星形胶质细胞和 4.5 x 105 ± 1 x 104 个神经元。
在旨在研究神经炎症疾病模型的背景下,该协议还应用于EAE的小鼠模型。在EAE诱导后的第16天对小鼠实施安乐死,代表疾病最大值。在这种 EAE 环境中,分离了大约 2.9 x 106 ± 6.7 x 105 个少突胶质细胞、5.2 x 105 ± 9 x 104 个星形胶质细胞和 4.4 x 105 ± 4 x 104 个神经元。由于MACS步骤后的额外细胞分选,小胶质细胞产量降低至每只EAE小鼠约1.7×105±4×10.4小胶质细胞(图3A)。
分离后,通过流式细胞术对不同细胞群进行表型表征证明,对于所有主要的中枢神经系统驻留细胞类型,可以实现纯度约为 90% 的活单细胞悬液(图 3B)。小胶质细胞被门控为CD45intCD11b高,如文献44,45,46,47所定义。
在 EAE 中,必须从所有 CD11b+ 细胞中分选小胶质细胞,以将它们与其他 CD11b+ 免疫细胞(如单核细胞、中性粒细胞、自然杀伤细胞、粒细胞和巨噬细胞)区分开来,这些细胞在神经炎症期间迁移到中枢神经系统 27,28,48。因此,小胶质细胞从CD11b+细胞悬液中分选为CD45intCD11高细胞。整个小胶质细胞分选策略如图4所示。在幼稚小鼠中,小胶质细胞群占所有活单细胞的91.16%(占CD11b +总数的96%)(图4A)。在EAE小鼠中,小胶质细胞群体占所有活单细胞的46.85%(占CD11b +总数的55%)(图4B)。尽管MACS和FACS程序都对单细胞施加机械应力,但75.41%±8.63%的分选纯化小胶质细胞是可行的(图3B)。
从初始中枢神经系统细胞悬液中直接分离的星形胶质细胞和神经元显示出少突胶质细胞的相关污染,这导致假设神经元和星形胶质细胞同时从少突胶质细胞的负流中分离可以防止这种污染。流式细胞术分析证实,从少突胶质细胞负流过中分离出的星形胶质细胞纯度分别为89.23%±2.78%,活力分别为80.56%±1.41%。与这些结果类似,从O4细胞 部分分离的神经元纯度为81.25%±3.31%,活力分别为83.90%±2.61%(图3B)。这些发现还证实,仅在分离少突胶质细胞之后同时分离这两种细胞类型对活功能细胞的数量没有影响。
与幼稚小鼠相比,EAE小鼠中分离的单细胞悬浮液的活力和纯度的结果非常相似,这证实了该方案适用于健康小鼠以及EAE的背景(图3B)。
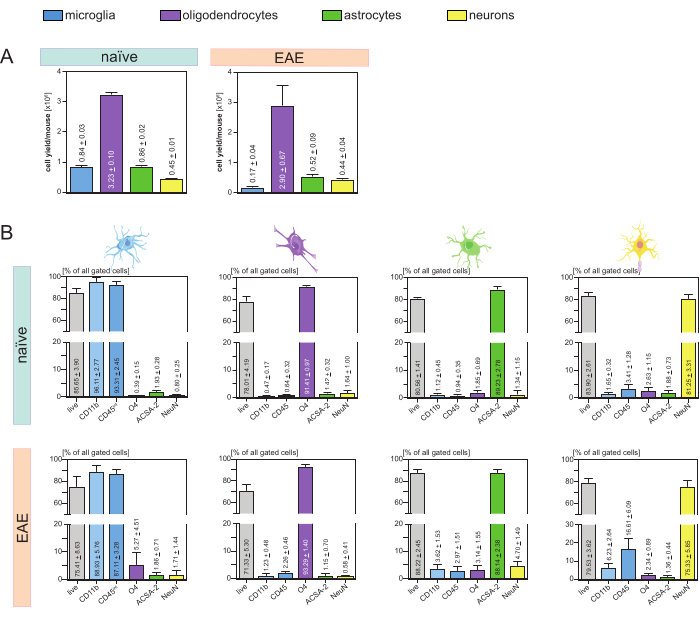
图 3:分离的 CNS 驻留细胞的细胞产量和基于流式细胞术的验证。(A) 在幼稚小鼠和 EAE 小鼠中分离 CNS 驻留细胞后每只小鼠和细胞类型的细胞产量。条形图可视化了实施所提出的方案后每只小鼠和细胞类型的细胞产量。在幼稚小鼠中处理了 5 个生物学重复的结果,并在 EAE 小鼠中分析了 4 个生物学重复。描述了SEMs±各自的手段。(B) 纯化细胞组分的相应纯度和活力分析。条形图根据其细胞类型特异性标记物的表达来指示所得单细胞悬液的活力和纯度。NeuN 被用作神经元的细胞类型特异性核标志物。采集了五个生物学重复,并比较了健康和EAE小鼠每种细胞类型的生物学重复。标明了SEM±各自的手段。缩写:抗ACSA-2=星形胶质细胞表面抗原-2;CD11b = 细胞周期蛋白依赖性激酶 11B;CD45 = 受体型酪氨酸蛋白磷酸酶 C;CNS = 中枢神经系统;EAE = 实验性自身免疫性脑脊髓炎;MACS = 磁激活细胞分选;NeuN =RNA结合蛋白fox-1同源物3;O4 = 少突胶质细胞标志物 O4;SEM = 平均值的标准误差。这个数字是从49修改过来的。 请点击这里查看此图的较大版本.
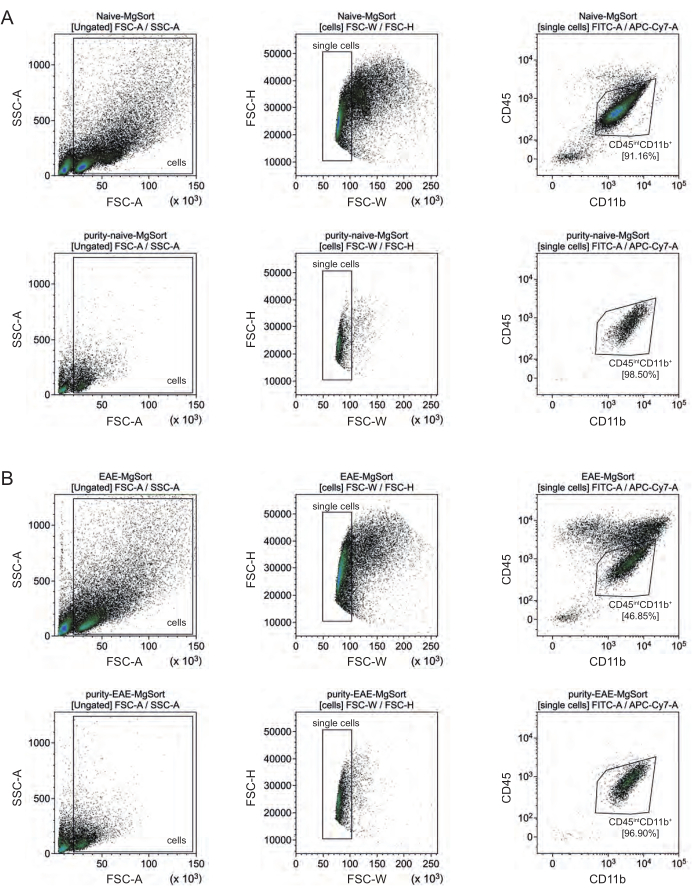
图 4:分离 CD11b+ 细胞后小胶质细胞分选的门控策略。(A) 幼稚小鼠的门控策略和(B)EAE小鼠的门控策略。每个面板的上行显示排序前的点阵图,排序后的下行显示点阵图。选取活细胞(SSC-A/FSC-A)和单细胞(FCS-H/FSC-W)后,将CD45intCD11b+ 细胞群分类为小胶质细胞群。 请点击这里查看此图的较大版本.
讨论
到目前为止,通过结合质谱法和 RNA 测序来绘制 CNS 驻留细胞离体的方法在健康和疾病中提供了非常精确的细胞谱分析,但需要该领域雄心勃勃的技术知识和专业知识50,51。此外,它们不允许进行泛函分析,并且非常昂贵。除此之外,微流控脑芯片系统为疾病机制提供了快速且经济实惠的筛选,并测试了限制细胞生长和迁移的新治疗方法52,53,54,55。CNS类器官也可能在未来代表一种等效的替代方案,用于研究疾病过程中的细胞建模、细胞间连接和相互作用56,57,58,59。然而,荧光和磁激活细胞分选是目前产生纯和活单细胞悬浮液的最有效方法35,60,61。即使其他已建立的用于分离 CNS 驻留细胞类型的制造方案在磁隔离和先前细胞解离的各个步骤方面相似,它们也旨在针对每种细胞类型单独执行。相比之下,目前的方案将每种 CNS 驻留细胞类型的不同分离方法集成到逻辑上下文中,以便它们可以同时从一个单个 CNS 细胞悬液中执行(表 1、表 2)。因此,它能够从单个CNS细胞悬液进行多组学分析,并最终探索复杂的神经元网络。即使不需要混合来自多个动物的多个组织来执行该方案,这种合并也确保了足够数量的分离细胞用于进一步的下游分析。使用不同的小鼠来分离单细胞类型将排除分析潜在细胞相互作用的可能性。除此之外,将不同中枢神经系统细胞类型的单独分离方法(均遵循先前的中枢神经系统解离)相结合,通过将一种解离的中枢神经系统细胞悬浮液用于所有后续磁性分离步骤,可以节省材料成本。此外,由于使用不同的鼠标而引起的潜在技术偏差被最小化。
该协议的一个局限性可能是几乎完全使用雌性C57BL / 6J小鼠。EAE免疫方案是针对雌性小鼠设计和建立的,因此该细胞分离方案也在雌性C57BL / 6J小鼠中实施。然而,在该方案的开发过程中也使用了幼稚的雄性小鼠,没有认识到对所得细胞数量或纯度的任何影响。另一个限制会影响神经元的磁性细胞分离,因为在正选择方面不存在用于分离神经元的特定微珠。假设可以通过生物素标记和所有非神经元细胞的耗竭获得纯单细胞悬浮液(表2)。通过使用 NeuN 作为神经元的特异性核标记物来验证这一假设,该标记物集成在上述流式细胞术纯度面板中。另一个局限性涉及EAE小鼠中小胶质细胞的分离。在这里,与其他细胞类型相比,由于MACS协议之后的额外分选步骤,产生的细胞产量降低。此外,有人可能会争辩说,与其他细胞群相比,分选增加了小胶质细胞的机械应力。单独的分选策略可能导致不同数量的细胞产量。如果分离的细胞数量小于预期或期望,建议调整门控设置和/或改进活/死区分。
协议中的一个关键步骤是清除碎片。梯度必须非常缓慢而温和地分层,以创建三个想要的独立相(图2A)。只有当两个顶相中的髓鞘和其他碎片残留物被完全去除(图2E),才能产生纯单细胞悬浮液,并减少进一步的污染。如果得到的细胞悬浮液缺乏纯度,这可能是方案中应该首先改进的部分,其次是保证所有微珠的正确使用。
在这种类型的实验中,获得高水平的纯度和活力可能具有挑战性。一些故障排除建议包括:
-必须在无菌条件下工作,以防止不同微珠的污染,并允许重复使用,特别是用于后续培养。
-强烈建议在每根管子上贴上标签以防止混淆。
-避免使用未冷却的试剂/缓冲液。在整个实验过程中,将所有细胞悬浮液储存在冰上,以确保高活力。
-保持不同工作步骤之间的时间尽可能短。协议中没有建议暂停实验的特定部分。
-遵守规定的潜伏期非常重要。
总之,目前从一次中枢神经系统复制中同时分离所有主要中枢神经系统驻留细胞类型的方案提供了从一次中枢神经系统细胞悬浮液中分析复杂神经元网络和神经炎症途径 的可能性 。因此,可以在病程的不同阶段研究驻留中枢神经系统细胞,例如,在 EAE 的神经炎症、神经退行性和/或缓解期间。此外,可以在个体水平上研究细胞间相互作用和生化途径,并且可以减少实验组内的变异性。还有机会在单一培养物中培养分离的中枢神经系统细胞的组分,以进行进一步的功能测定和验证。总而言之,该协议提供了可能影响临床前和临床研究方法的重大进展。
披露声明
所有作者均声明没有利益冲突。
致谢
人物是使用 Adobe Illustrator(2023 版)和 Servier Medical Art (https://smart.servier.com)创建的。安东尼娅·赫内斯(Antonia Henes)得到了于尔根·曼肖基金会(Jürgen Manchot Stiftung)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 70 μm cell strainers | Corning, MA, USA | 352350 | CNS tissue dissociation |
| ACSA-2 Antibody, anti-mouse, PE-Vio 615 (clone REA-969) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-116-244 | Flow cytometry, store at 4 °C |
| Adult Brain Dissociation Kit, mouse, and rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-107-677 | Tissue dissociation,contains debris and red blood cell removal solutions; prepare aliquots of enzyme A and P upon arrival and store them at -20 °C; store the remaining kit at 4 °C |
| Anti-ACSA-2 MicroBead Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-097-678 | MACS of astrocytes, store at 4 °C |
| Anti-mouse CD16/32 antibody | BioLegend, London, UK | 101301 | Flow cytometry, store at 4 °C |
| Anti-O4 MicroBeads, human, mouse, rat | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-094-543 | MACS of oligodendrocytes, store at 4 °C |
| AstroMACS Separation buffer | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-221 | MACS of astrocytes, store at 4 °C |
| Biotin Antibody, PE (clone Bio3-18E7) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-113-853 | Flow cytometry, store at 4 °C |
| BRAND Neubauer counting chamber | Thermo Fisher Scientific,Waltham, MA, USA | 10195580 | Cell counting |
| Brilliant Violet 510 anti-mouse CD45 Antibody (clone 30-F11) | BioLegend, London, UK | 103137 | Flow cytometry, store at 4 °C |
| CD11b MicroBeads, human, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-049-601 | MACS of microglia, store at 4 °C |
| DNAse I, recombinant, Rnase-free | Merck KGaA, Darmstadt, Germany | 4716728001 | Flow cytometry, store at -20° C |
| D-PBS with Calcium, Magnesium, Glucose, Pyruvat | Thermo Fisher Scientific,Waltham, MA, USA | 14287080 | Buffer, store at 4 °C |
| D-PBS, without calcium, without magnesium | Thermo Fisher Scientific,Waltham, MA, USA | 14190250 | Buffer, store at 4 °C |
| eBioscience Fixable Viability Dye eFluor 780 | Thermo Fisher Scientific,Waltham, MA, USA | 65-0865-14 | Flow cytometry, store at 4 °C |
| eBioscience Foxp3/Transcription factor staining buffer set | Thermo Fisher Scientific,Waltham, MA, USA | 00-5523-00 | Flow cytometry, store at 4°C |
| Falcon (15 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 11507411 | Cell tube |
| Falcon (50 mL) | Thermo Fisher Scientific,Waltham, MA, USA | 10788561 | Cell tube |
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5 mL | Thermo Fisher Scientific,Waltham, MA, USA | 08-771-23 | Flow cytometry |
| FcR Blocking Reagent, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-092-575 | MACS of oligodendrocytes, store at 4 °C |
| Female C57BL/6J mice | Charles River Laboratories, Sulzfeld, Germany | Active EAE induction | |
| Fetal calf serum (FCS) | Merck KGaA, Darmstadt, Germany | F2442-50ML | Flow cytometry, store at -5 to -20 °C |
| FITC Rat Anti-CD 11b (clone M1/70) | BD Biosciences, San Jose, CA, USA | 553310 | Flow cytometry, store at 4 °C |
| Freund’s Complete adjuvant | Merck KGaA, Darmstadt, Germany | AR001 | Active EAE induction, store at 4 °C |
| GentleMACS C Tubes | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-093-237 | CNS tissue dissociation |
| GentleMACS Octo Dissociator with Heaters | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-096-427 | CNS tissue dissociation |
| Graphpad Prism 8.4.3 | Graphpad by Dotmatics | Graphical Analysis | |
| Isoflurane | AbbVie, North Chicago, IL, USA | Active EAE induction, store at 4 °C | |
| Kaluza Analysis Software V2.1.1 | Beckman Coulter, Indianapolis, IN, USA | Flow cytometry analysis | |
| LS Columns | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-401 | MACS |
| MACS BSA Stock Solution | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-091-376 | PB-buffer |
| MACS MultiStand | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-042-303 | MACS |
| MOG35–55 peptide | Charité, Berlin, Germany; alternatives: Genosphere Biotechnologies (Paris, France) or sb-Peptide (Saint Egrève, France) | Active EAE induction, store at -20 °C | |
| Mycobacterium tuberculosis strain H37 Ra | Becton, Dickinson and Company (BD),Franklin Lakes, NJ, USA | Active EAE induction, store at 4 °C | |
| Neuron Isolation Kit, mouse | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-115-390 | MACS of neurons, store at 4 °C |
| O4 Antibody, anti-human/mouse/rat, APC, (clone REA-576) | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-119-897 | Flow cytometry, store at 4 °C |
| Pertussis toxin in glycerol | Hooke Laboratories Inc., Lawrence, MA, USA | BT-0105 | Active EAE induction; store at -20 °C |
| pluriStrainer Mini 100 μm | pluriSelect Life Science UG, Leipzig, Sachsen, Germany | 43-10100-40 | Flow cytometry |
| QuadroMACS Separator | Miltenyi Biotec, Bergisch Gladbach, NRW, Germany | 130-090-976 | MACS |
| Recombinant Alexa Fluor 647 Anti-NeuN antibody (clone EPR12763) | Abcam, Cambridge, UK | EPR12763 | Flow cytometry, store at -20 °C |
| Stainless Steel Brain Matrices, 1 mm | Ted Pella, Redding, CA, USA | 15067 | CNS tissue dissection |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific,Waltham, MA, USA | 15250061 | Cell counting |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific,Waltham, MA, USA | 15575020 | Flow cytometry, store at room temperature |
参考文献
- Trapp, B. D., Nave, K. A. Multiple Sclerosis: An Immune or Neurodegenerative Disorder. Annu Rev Neurosci. 31 (1), 247-269 (2008).
- Stys, P. K., Zamponi, G. W., van Minnen, J., Geurts, J. J. Will the real multiple sclerosis please stand up. Nat Rev Neurosci. 13 (7), 507-514 (2012).
- Korn, T. Pathophysiology of multiple sclerosis. J Neurol. 255 (Suppl 6), 2-6 (2008).
- Ward, M., Goldman, M. D. Epidemiology and Pathophysiology of Multiple Sclerosis. CONTINUUM. 28 (4), 988-1005 (2022).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin Oligodendrocyte Glycoprotein (MOG35-55) Induced Experimental Autoimmune Encephalomyelitis (EAE) in C57BL/6 Mice. J Vis Exp. (86), 51275 (2014).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp Neurol. 238 (2), 149-155 (2012).
- Göbel, K., et al. Plasma kallikrein modulates immune cell trafficking during neuroinflammation via PAR2 and bradykinin release. Proc Natl Acad Sci U S A. 116 (1), 271-276 (2019).
- Ballerini, C. Experimental Autoimmune Encephalomyelitis. Methods Mol Biol. 2285, 375-384 (2021).
- Birmpili, D., Charmarke Askar, I., Bigaut, K., Bagnard, D. The Translatability of Multiple Sclerosis Animal Models for Biomarkers Discovery and Their Clinical Use. Int J Mol Sci. 23 (19), 11532 (2022).
- Tsatas, O., Ghasemlou, N. Isolation and RNA purification of macrophages/microglia from the adult mouse spinal cord. J Immunol Methods. 477, 112678 (2020).
- Calvo, B., Rubio, F., Fernández, M., Tranque, P. Dissociation of neonatal and adult mice brain for simultaneous analysis of microglia, astrocytes and infiltrating lymphocytes by flow cytometry. IBRO Rep. 8, 36-47 (2020).
- Diaz-Amarilla, P., et al. Isolation and characterization of neurotoxic astrocytes derived from adult triple transgenic Alzheimer's disease mice. Neurochem Int. 159, 105403 (2022).
- Galatro, T. F., Vainchtein, I. D., Brouwer, N., Boddeke, E. W. G. M., Eggen, B. J. L. Isolation of Microglia and Immune Infiltrates from Mouse and Primate Central Nervous System. Methods Mol Biol. 1559, 333-342 (2017).
- Altendorfer, B., et al. Transcriptomic Profiling Identifies CD8+ T Cells in the Brain of Aged and Alzheimer's Disease Transgenic Mice as Tissue-Resident Memory T Cells. J Immunol. 209 (7), 1272-1285 (2022).
- Lanfranco, M. F., Sepulveda, J., Kopetsky, G., Rebeck, G. W. Expression and secretion of apoE isoforms in astrocytes and microglia during inflammation. Glia. 69 (6), 1478-1493 (2021).
- Swire, M., Ffrench-Constant, C. Oligodendrocyte-Neuron Myelinating Coculture. Methods Mol Biol. 1936, 111-128 (2019).
- Park, J., Koito, H., Li, J., Han, A. Microfluidic compartmentalized co-culture platform for CNS axon myelination research. Biomed Microdevices. 11 (6), 1145-1153 (2009).
- Facci, L., Barbierato, M., Skaper, S. D. Astrocyte/Microglia Cocultures as a Model to Study Neuroinflammation. Methods Mol Biol. 1727, 127-137 (2018).
- Speicher, A. M., Wiendl, H., Meuth, S. G., Pawlowski, M. Generating microglia from human pluripotent stem cells: novel in vitro models for the study of neurodegeneration. Mol Neurodegener. 14 (1), 46 (2019).
- Homayouni Moghadam, F., et al. Isolation and Culture of Embryonic Mouse Neural Stem Cells. J Vis Exp. (141), 58874 (2018).
- Santos, R., et al. Differentiation of Inflammation-Responsive Astrocytes from Glial Progenitors Generated from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 8 (6), 1757-1769 (2017).
- Tcw, J., et al. An Efficient Platform for Astrocyte Differentiation from Human Induced Pluripotent Stem Cells. Stem Cell Reports. 9 (2), 600-614 (2017).
- Miltenyi, S., Müller, W., Weichel, W., Radbruch, A. High gradient magnetic cell separation with MACS. Cytometry. 11 (2), 231-238 (1990).
- Huntemann, N., et al. An optimized and validated protocol for inducing chronic experimental autoimmune encephalomyelitis in C57BL/6J mice. J Neurosci Methods. 367, 109443 (2022).
- Martin, E., El-Behi, M., Fontaine, B., Delarasse, C. Analysis of Microglia and Monocyte-derived Macrophages from the Central Nervous System by Flow Cytometry. J Vis Exp. (124), 55781 (2017).
- Sarkar, S., et al. Rapid and Refined CD11b Magnetic Isolation of Primary Microglia with Enhanced Purity and Versatility. J Vis Exp. (122), 55364 (2017).
- Rodríguez Murúa, S., Farez, M. F., Quintana, F. J. The Immune Response in Multiple Sclerosis. Annu Rev Pathol. 17, 121-139 (2021).
- Engelhardt, B., Ransohoff, R. M. Capture, crawl, cross: the T cell code to breach the blood-brain barriers. Trends Immunol. 33 (12), 579-589 (2012).
- Elia, G. Biotinylation reagents for the study of cell surface proteins. Proteomics. 8 (19), 4012-4024 (2008).
- Berl, S., et al. Enrichment and isolation of neurons from adult mouse brain for ex vivo analysis. J Neurosci Methods. 283, 15-22 (2017).
- Turvy, D. N., Blum, J. S. Biotin Labeling and Quantitation of Cell-Surface Proteins. Curr Protoc Immunol. 18 (7), (2001).
- Mao, S. Y. Biotinylation of Antibodies. Methods Mol Biol. 115, 39-41 (1999).
- Kantzer, C. G., et al. Anti-ACSA-2 defines a novel monoclonal antibody for prospective isolation of living neonatal and adult astrocytes. Glia. 65 (6), 990-1004 (2017).
- Batiuk, M. Y., et al. An immunoaffinity-based method for isolating ultrapure adult astrocytes based on ATP1B2 targeting by the ACSA-2 antibody. J Biol Chem. 292 (21), 8874-8891 (2017).
- Pan, J., Wan, J. Methodological comparison of FACS and MACS isolation of enriched microglia and astrocytes from mouse brain. J Immunol Methods. 486, 112834 (2020).
- Donovan, J. A., Koretzky, G. A. CD45 and the immune response. J Am Soc Nephrol. 4 (4), 976-985 (1993).
- Hathcock, K. S., Hirano, H., Hodes, R. J. CD45 expression by murine B cells and T cells: Alteration of CD45 isoforms in subpopulations of activated B cells. Immunol Res. 12 (1), 21-36 (1993).
- Balogh, P., Tew, J. G., Szakal, A. K. Simultaneous blockade of Fc? receptors and indirect labeling of mouse lymphocytes by the selective detection of allotype-restricted epitopes on the kappa chain of rat monoclonal antibodies. Cytometry. 47 (2), 107-110 (2002).
- Becerril-García, M. A., et al. Langerhans Cells From Mice at Birth Express Endocytic- and Pattern Recognition-Receptors, Migrate to Draining Lymph Nodes Ferrying Antigen and Activate Neonatal T Cells in vivo. Front Immunol. 11, 744 (2020).
- Dent, M. A., Segura-Anaya, E., Alva-Medina, J., Aranda-Anzaldo, A. NeuN/Fox-3 is an intrinsic component of the neuronal nuclear matrix. FEBS Lett. 584 (13), 2767-2771 (2010).
- Duan, W., et al. Novel Insights into NeuN: from Neuronal Marker to Splicing Regulator. Mol Neurobiol. 53 (3), 1637-1647 (2016).
- Monteiro, R., Sivasubramanian, M. K., Balasubramanian, P., Subramanian, M. Obesity-Induced Sympathoexcitation is Associated with Glial Senescence in the Brainstem. FASEB J. 34 (S1), 1-1 (2020).
- Li, S., Chang, L., Teissie, J. . Electroporation protocols: mircroorganism, mammalian system, and nanodevice. , (2020).
- Kettenmann, H., Hanisch, U. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiol Rev. 91 (2), 461-553 (2011).
- Haage, V., et al. Comprehensive gene expression meta-analysis identifies signature genes that distinguish microglia from peripheral monocytes/macrophages in health and glioma. Acta Neuropathol Commun. 7 (1), 20 (2019).
- Kosior, N., Petkau, T. L., Connolly, C., Lu, G., Leavitt, B. R. Isolating cells from adult murine brain for validation of cell-type specific cre-mediated deletion. J Neurosci Methods. 328, 108422 (2019).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of General and Discriminating Markers of Differential Microglia Phenotypes. Front Cell Neurosci. 14, 198 (2020).
- Man, S., Ubogu, E. E., Ransohoff, R. M. Inflammatory Cell Migration into the Central Nervous System: A Few New Twists on an Old Tale. Brain Pathol. 17 (2), 243-250 (2007).
- Schroeter, C. B., et al. One Brain-All Cells: A Comprehensive Protocol to Isolate All Principal CNS-Resident Cell Types from Brain and Spinal Cord of Adult Healthy and EAE Mice. Cells. 10 (3), 651 (2021).
- Sankowski, R., et al. Mapping microglia states in the human brain through the integration of high-dimensional techniques. Nate Neurosci. 22 (12), 2098-2110 (2019).
- Brennan, F. H., et al. Microglia coordinate cellular interactions during spinal cord repair in mice. Nat Commun. 13 (1), 4096 (2022).
- Enright, H. A., et al. Functional and transcriptional characterization of complex neuronal co-cultures. Sci Rep. 10 (1), 11007 (2020).
- Mofazzal Jahromi, M. A., et al. Microfluidic Brain-on-a-Chip: Perspectives for Mimicking Neural System Disorders. Mol Neurobiol. 56 (12), 8489-8512 (2019).
- Chin, E., Goh, E. Blood-brain barrier on a chip. Methods Cell Biol. 146, 159-182 (2018).
- Miccoli, B., Braeken, D., Li, Y. E. Brain-on-a-chip Devices for Drug Screening and Disease Modeling Applications. Curr Pharm Des. 24 (45), 5419-5436 (2019).
- Giandomenico, S. L., et al. Cerebral organoids at the air-liquid interface generate diverse nerve tracts with functional output. Nat Neurosci. 22 (4), 669-679 (2019).
- Pellegrini, L., et al. Human CNS barrier-forming organoids with cerebrospinal fluid production. Science. 369 (6500), eaaz5626 (2020).
- Chhibber, T., et al. CNS organoids: an innovative tool for neurological disease modeling and drug neurotoxicity screening. Drug Discov Today. 25 (2), 456-465 (2020).
- Tang, X. Y., et al. Human organoids in basic research and clinical applications. Signal Transduct TargetTher. 7 (1), 168 (2022).
- Sutermaster, B. A., Darling, E. M. Considerations for high-yield, high-throughput cell enrichment: fluorescence versus magnetic sorting. Sci Rep. 9 (1), 227 (2019).
- Doughty, D., et al. Development of a novel purification protocol to isolate and identify brain microglia. Exp Biol Med. 247 (16), 1433-1446 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。