需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
肌腱基因表达水平的空间高分辨率分析
摘要
本文介绍了如何对肌腱执行优化的 原 位方案。该方法讨论了组织制备、切片透化、探针设计和信号放大方法。
摘要
近年来,在许多不同的医学和生物学领域已经开发了许多用于高分辨率转录组学的方案。然而,富含基质的组织,特别是肌腱,由于其细胞数量少、每个细胞的 RNA 量低和基质含量高而被遗忘,这使得它们的分析变得复杂。最近也是最重要的单细胞工具之一是肌腱中基因表达水平的空间分析。这些 RNA 空间工具在肌腱中具有特别高的重要性,可以定位新的和未知群体的特定细胞,验证单细胞 RNA-seq 结果,并为单细胞 RNA-seq 数据添加组织学背景。这些新方法将能够以极高的灵敏度分析细胞中的 RNA,并在单细胞水平上检测单分子 RNA 靶标,这将有助于分子表征肌腱并促进肌腱研究。
在该方法论文中,我们将重点介绍通过使用新型 原位 杂交测定法在单细胞水平上检测完整细胞内的靶 RNA 来分析组织学切片上空间基因表达水平的可用方法。首先,我们将重点介绍如何为不同的可用检测准备肌腱组织,以及如何在没有背景噪音但具有高灵敏度和高特异性的情况下扩增靶标特异性信号。然后,本文将描述特定的透化方法、不同的探针设计以及目前可用的信号放大策略。这些以单细胞分辨率分析不同基因转录水平的独特方法将能够识别和表征各种动物模型的年轻和老年人群和人类肌腱组织中的肌腱组织细胞。该方法还将有助于分析其他富含基质的组织(如骨骼、软骨和韧带)中的基因表达水平。
引言
肌腱是结缔组织,能够在肌肉和骨骼之间传递力1。在发育上,轴向肌腱细胞来源于体节2 硬膜内的间充质细胞;肢体肌腱源自外侧板中胚层;颅肌腱起源于颅神经嵴谱系 3,4。肌腱可以通过巩膜转录因子5 的表达来表征,尽管几种标志物在肌腱发育中也起关键作用,包括肌腱调节素、莫霍克和早期生长反应 1/2 6,7,8,9。
尽管肌腱的已知标志物很少,但总的来说,更深入的表征仍然具有挑战性,因为肌腱包含跨越生物力学特性梯度的细胞。从肌腱交界处、肌腱中体和钙化程度更高的附着点开始,肌腱细胞存在于具有拉伸特性的细胞外基质中。由于肌腱必须承受软组织和硬组织之间机械强度差异所施加的拉伸应力,因此肌腱中细胞的空间组织对其功能尤为重要。然而,人们对这些肌腱亚群知之甚少。
许多高分辨率空间转录组学工具可用于开始阐明细胞亚群,包括但不限于单细胞 RNA Seq 或 原位 杂交。然而,虽然这些空间分析分析有助于揭示显微解剖或切片后组织中 RNA 的表达,但在对肌腱组织进行时,这些方法可能具有挑战性。肌腱是富含基质的组织,由近 86% 的干质量胶原蛋白组成10,因此很难提取细胞进行测序。由于从基质中分离细胞的复杂性、肌腱11 的细胞减少性质以及相对较低的 RNA 计数,肌腱是一种难以分析的组织。
在本文中,我们提出了一种优化新型 原位 杂交测定的方法,通过提供组织制备、透化和探针设计方法将其用于肌腱。结合现有的测序技术,这可能有助于研究人员在空间上表征发育中的、成人或受伤的肌腱亚群,并提高检测灵敏度和特异性。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有动物实验均按照机构动物护理和使用委员会 (IACUC) 和 AAALAC 指南进行。实验是在马萨诸塞州总医院根据批准的方案 #2013N000062 进行的。在本研究中,使用了 C57BL/J6 小鼠 (5 周龄和 P0)。有关本协议中使用的所有材料、试剂和仪器的详细信息,请参阅 材料表 。
1. 样品制备和固定
- 在 CO2 室中对小鼠实施安乐死,然后进行宫颈脱位作为安乐死的次要方法。然后,用剪刀沿着髋关节12 剪断小鼠后肢。在闪烁瓶中,将小鼠后肢浸入足够的 4% 多聚甲醛 (PFA) 溶液中以完全覆盖样品,并固定组织 24 小时。
注:也可以使用 10% 福尔马林代替 4% PFA 进行固定。固定后,样品可以储存在磷酸盐缓冲盐水 (PBS) 中,直到进一步处理。通过固定整个后肢,我们能够保持肌腱的张力,并有机会检查附着点、肌腱中体或肌腱交界处。 - 从闪烁瓶中取出 PFA 后,加入足够的 PBS 以覆盖样品,用 1x PBS 洗涤样品 3 x 10 分钟。然后,将后肢浸入 4 °C 的 0.5 M EDTA 中搅拌 1-2 周,每 2-3 天更换一次新鲜的 EDTA。
- 去除 EDTA 后,用 1x PBS 洗涤样品 3 x 10 分钟,在 70% EtOH 中脱水样品,然后以所需方向将其包埋在石蜡中。使用传统的 FFPE 切片技术将厚度为 3 μm 的组织切片,并将切片转移到经过处理的带电显微镜载玻片上(参见 材料表)13。
注意:在进行下一步之前,切片可以储存在 4 °C 中。 - 脱蜡
- 将载玻片在 60 °C 的热板上烘烤 1 小时,然后让载玻片达到室温 (RT)。要从载玻片上去除石蜡,请将载玻片放在载玻片架上,然后将它们放入装满二甲苯的染色皿中。在新鲜的二甲苯中重复 3 x 5 分钟。
注意:二甲苯是危险的;小心处理。 - 要再水化切片,每次洗涤将载玻片浸入以下物质中 5 分钟,均在 RT 下洗涤:在 100% EtOH 中洗涤 2 次,在 dH2O 中稀释的 75% EtOH 中洗涤 1x,在 PBS 中稀释的 50% EtOH 中洗涤 1x,在 PBS 中稀释的 25% EtOH 中 1x,在 PBS 中稀释 2 次,在 PBS 中洗涤 2 次。
注:所有再水化步骤均使用载玻片架上的载玻片和染色皿中的各种 EtOH 溶液完成。
- 将载玻片在 60 °C 的热板上烘烤 1 小时,然后让载玻片达到室温 (RT)。要从载玻片上去除石蜡,请将载玻片放在载玻片架上,然后将它们放入装满二甲苯的染色皿中。在新鲜的二甲苯中重复 3 x 5 分钟。
2. RNAscope(商业化 ISH)方案14 适应
- 制备溶液和探针
- 通过混合 pH 值为 8 的 25 mM Tris-HCl、10 mM EDTA 和 50 mM 葡萄糖,制备用于切片样品预处理的 TEG 溶液。为所有要处理的样品准备足够的体积或制备过量的样品;过滤灭菌并在 RT 下储存;使用前将溶液适当混合。
- 准备足够的 1x 洗涤缓冲液(参见 材料表)用于所有洗涤,并将其储存在 RT 中。
- 在 40 °C 水浴或培养箱中,将感兴趣的探针加热 10 分钟。然后,根据 ISH 协议14 准备探针。
- 样品预处理
- 不要使用推荐的预处理溶液,而是将载玻片浸入含有 TEG 缓冲液的染色皿中,在 60 °C 下浸泡 4 小时。
注意:如果组织特别致密或目标 RNA 结合基序的抗原修复具有挑战性,则 TEG 缓冲液孵育可延长至 6 小时。在这种情况下,可以在此处添加一个停止点,将载玻片干燥并在 4 °C 冰箱中保存过夜。 - 从缓冲液中取出样品并晾干。然后,用疏水屏障笔在样品周围画出,将它们浸入另一个含有蛋白酶 IV 的染色皿中,并在 40 °C 的烘箱中孵育 45 分钟。
注:我们建议成年小鼠使用蛋白酶 IV。如果使用年轻的小鼠,例如 P0,我们建议使用较温和的酶,例如蛋白酶 III,持续 30 分钟。在对不同年龄进行故障排除时,观察肌腱的完整性并检查是否退化。如果组织解离或降解,请缩短孵育时间或更改使用的蛋白酶。 - 在 TEG 缓冲液中再次洗涤样品 30 分钟,然后根据 ISH 方案14 杂交探针。
- 在样品顶部添加 50-100 μL 封固剂。将盖玻片放在样品顶部进行显微镜检查。成像时,使用高放大倍率(40 倍物镜或更高)查看信号。
- 不要使用推荐的预处理溶液,而是将载玻片浸入含有 TEG 缓冲液的染色皿中,在 60 °C 下浸泡 4 小时。
3. HCR ISH 方案15 适应
- Postfixation (注视后)
- 在 PBS 中制备 4% PFA(在 PBS 中)、PBT 溶液(PBS 中为 0.1% Tween-20)和 PBS 中的蛋白酶 K(储备浓度为 10 mg/mL,终浓度为 5 μg/mL)。
- 要开始第一个后缀步骤,请将载玻片浸入含有 4% PFA 的染色皿中 5 分钟;然后,去除 4% PFA 溶液并储存以备后续步骤使用。在 PBT 溶液中冲洗载玻片 2 x 5 分钟,然后取出 PBT 溶液。将玻片放入含有蛋白酶 K 溶液 (5 μg/mL) 的染色皿中 5 分钟,然后在 PBT 溶液中冲洗 2 x 5 分钟。
- 开始第二个后置步骤,将载玻片浸入 4% PFA 中 5 分钟。
注意:这与步骤 3.1.2 中保存的 4% PFA 相同。 - 在 PBT 溶液中冲洗载玻片 3 x 5 分钟。
注意:所有固定后步骤均使用载玻片架上的载玻片和含有相应溶液的染色皿完成。
- 乙酰化作用
- 制备含有 625 μL 乙酐、3.3 mL 1 M 三乙醇胺 (TEA) 缓冲液和 246 mL ddH2O 的乙酰化溶液。请务必充分混合,并在制备后立即使用。
- 将玻片置于乙酰化溶液中 10 分钟,然后在 PBT 溶液中冲洗 3 x 5 分钟。在 ddH2O 中冲洗载玻片,并让它们风干 30 分钟。然后,用疏水屏障笔在样品周围画画。
注:所有乙酰化步骤均使用载玻片架上的载玻片和含有相应溶液的染色皿完成
- 杂交
- 将杂交缓冲液预热至 37 °C,并将加湿室预热至 37 °C。
注意:缓冲液含有甲酰胺,一种有害物质。如果载玻片不够干燥,请用实验室抹布吸干边缘以去除多余的 dH2O。 - 通过将 0.4 pmol 的每种探针混合物添加到 100 μL 杂交缓冲液中来制备探针溶液。
注意:如果使用 dHCR 成像,请使用更高浓度的探针以提高探针杂交效率。 - 通过混合 3 M NaCl(701.1 g NaCl,终体积为 4 L)和 0.3 M Na3CH6H5O7•2H2O (352.8 g),制备 4 L 氯化钠柠檬酸钠缓冲液(20x SSC),然后通过添加 HCl 或 10 N NaOH 将最终 pH 值调节至 7。加入足够的 H2O 以达到 4 L。通过将 20x SSC 稀释至 5 倍并加入足够的 10% Tween 20 使其占总体积的 0.1% 来制备 5x SSCT。
- 向样品中加入 200 μL 杂交缓冲液,将载玻片放入加湿室中,让载玻片孵育 10 分钟。取出杂交溶液,用实验室抹布吸干边缘,排出载玻片上多余的缓冲液。
- 在样品顶部加入 100 μL 制备好的探针溶液,并在样品上盖上盖玻片。在烘箱中孵育过夜或在用含有 5x SSC 和 50% 甲酰胺的溶液加湿的腔室中孵育约 12-16 小时。将温度设置为 37 °C。
注意:由于孵育过夜,因此添加盖玻片是为了最大限度地减少蒸发。 - 将 5x SSCT 溶液的等分试样留在 37 °C 水浴中,然后在室温下放置第二份等分试样。根据样品编号和下一步的洗涤次数预测所需的这些等分试样的体积。
- 将杂交缓冲液预热至 37 °C,并将加湿室预热至 37 °C。
- 洗涤
- 使用先前预热的 5x SSCT 溶液,制备 75% 洗涤缓冲液/25% 5x SSCT、50% 洗涤缓冲液/50% 5x SSCT 和 25% 洗涤缓冲液/75% 5x SSCT 溶液。
- 为了去除多余的探针,将载玻片在 37 °C 下在 75% 洗涤缓冲液/25% 5x SSCT、50% 洗涤缓冲液/50% 5x SSCT 和 25% 洗涤缓冲液/75% 5x SSCT 中连续浸入 15 分钟。让盖玻片从样品中漂浮出来。
- 将载玻片与 100% 5x SSCT 孵育 2 x 15 分钟,然后在室温下将它们浸入 5x SSCT 中 5 分钟。
注意:洗涤步骤可以使用载玻片架上的载玻片和含有相应溶液的染色皿或以液滴形式添加的溶液来完成。
- 放大
- 通过快速冷却 2 μL 的 3 μM 原液(在 95 °C 加热 90 秒并冷却至 RT),制备 6 pmol 的发夹 h1 和 6 pmol 的发夹 h2。在此过程中,请避光保护发夹。
注意:HCR 发夹 h1 和 h2 在发夹存储缓冲区中提供,可直接进行快速冷却。将 h1 和 h2 发夹放入单独的试管中。 - 用实验室抹布吸干载玻片边缘,使其干燥。然后,在样品顶部加入 200 μL 扩增缓冲液,并在室温下将其置于加湿室中 30 分钟。通过在室温下将快速冷却的 h1 发夹和快速冷却的 h2 发夹添加到 100 μL 扩增缓冲液中来制备发夹混合物。
- 去除扩增缓冲液,用实验室抹布吸干边缘,沥干载玻片上多余的液体。加入 100 μL 先前制备的发夹混合物,并将封口膜放在样品顶部。将载玻片在 RT 的黑暗加湿室中孵育至少 4 小时或过夜。
- 为了去除多余的发夹,将载玻片浸入染色皿中的 5x SSCT 中,并在 RT 下孵育 30 分钟。在新鲜的 5x SSCT 中重复洗涤 30 分钟,第三次重复洗涤 5 分钟。
- 用实验室抹布吸干边缘以干燥载玻片,并在样品顶部添加 50-100 μL 封固剂。将盖玻片放在样品顶部进行显微镜检查。成像时,使用高放大倍率(40 倍物镜或更高)查看信号。
- 通过快速冷却 2 μL 的 3 μM 原液(在 95 °C 加热 90 秒并冷却至 RT),制备 6 pmol 的发夹 h1 和 6 pmol 的发夹 h2。在此过程中,请避光保护发夹。
Access restricted. Please log in or start a trial to view this content.
结果
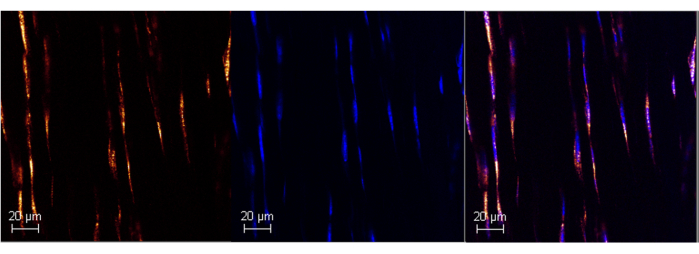
图 1:使用 RNAScope 在成年小鼠跟腱中表达 Poly A RNA。 使用商业化 ISH 检测在小鼠跟腱中成功标记 Poly A 的代表性图像(左图)。与 DAPI 共定位可确认探针的特异性(中间和右侧面板),从而可以控制背景噪声。使用 Leica SPE 共聚焦显微镜以 63 ...
Access restricted. Please log in or start a trial to view this content.
讨论
在本文中,我们描述了为利用现有 ISH 工具所做的修改,以便它们可以以高度特异性和敏感性用于肌腱组织。由于肌腱是基质密度高的组织,因此必须经常进行方案调整以实现相似程度的探针穿透和特异性。这些特定的透化方法和肌腱组织的信号放大策略对于提高所讨论的 ISH 方案的有效性是不可或缺的。如果没有这些步骤,探针很难与肌腱中的 RNA 产生强烈而特异性的相...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有需要披露的利益冲突。
致谢
作者感谢 Jenna Galloway 和 Galloway 实验室的成员对这些协议的开发和故障排除的支持和鼓励。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 1 M triethanolamine buffer | |||
| 10% Formalin solution | |||
| 10% Tween-20 | |||
| 20x Saline Sodium Citrate buffer | |||
| 4% PFA | |||
| ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 | ACD | 323100 | |
| Acetic Anhydride | |||
| Axio Imager Microscope | ZEISS | ||
| C57BL/J6 mice | JAX ID: 000664 | ||
| Coverslips | Fisher | 12-541-042 | |
| ddH2O | |||
| ETDA | Thermofisher | AM9262 | |
| EtOH | |||
| Glucose | VWR Chemicals BDH | BDH9230-500G | |
| HCR RNA-FISH Bundle | Molecular Instruments Inc. | ||
| HybEZ II Hybridization System | ACD | ||
| Immedge Barrier Pen | Vector Laboratories | H4000 | |
| Leica SPE Confocal Microscope | Leica | ||
| Parafilm | Fisher | ||
| Phosphate-buffered saline (PBS, 1x) | Invitrogen | AM9625 | Dilute 10x PBS in milli-Q water to get 1x solution |
| Protease IV | |||
| Proteinase K | Roche | 3115836001 | |
| RNAscope H2O2 and Protease Reagents | ACD | PN 322381 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V3 |
| RNAscope Multiplex Fluorescent Detection Kit | ACD | PN 323110 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V2 |
| RNAscope Target Retrieval reagents | ACD | 322000 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V4 |
| RNAscope Wash Buffer | ACD | PN 310091 | Included in ACD RNAscope Fluorescent Multiplex Fluorescent Reagent Kit V5 |
| RNAscope Probe Diluent | ACD | 300041 | |
| Slide holder | StatLab | 4465A | |
| Staining Dish with Lid | StatLab | LWS20WH | |
| Superfrost Plus Microscope slides | Fisher | 1255015 | treated, charged slides |
| Tris-HCl | |||
| Xylene | Sigma-Aldrich | 534056-4L |
参考文献
- Sharma, P., Maffulli, N. Tendon injury and tendinopathy: healing and repair. Journal of Bone and Joint Surgery. 87 (1), 187-202 (2005).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Noden, D. M. The role of the neural crest in patterning of avian cranial skeletal, connective, and muscle tissues. Developmental Biology. 96 (1), 144-165 (1983).
- Chen, J. W., Galloway, J. L. The development of zebrafish tendon and ligament progenitors. Development. 141 (10), 2035-2045 (2014).
- Schweitzer, R., et al. Analysis of the tendon cell fate using Scleraxis, a specific marker for tendons and ligaments. Development. 128 (19), 3855-3866 (2001).
- Tsai, S., Nödl, M., Galloway, J. Bringing tendon biology to heel: Leveraging mechanisms of tendon development, healing, and regeneration to advance therapeutic strategies. Developmental Dynamics. 250 (3), 393-413 (2021).
- Kannus, P., et al. Location and distribution of non-collagenous matrix proteins in musculoskeletal tissues of rat. The Histochemical Journal. 30 (11), 799-810 (1998).
- Kannus, P. Structure of the tendon connective tissue. Scandinavian Journal of Medicine & Science in Sports. 10 (6), 312-320 (2000).
- Thorpe, C. T., Birch, H. L., Clegg, P. D., Screen, H. R. C. The role of the non-collagenous matrix in tendon function. International Journal of Experimental Pathology. 94 (4), 248-259 (2013).
- Lin, T. W., Cardenas, L., Soslowsky, L. J. Biomechanics of tendon injury and repair. Journal of Biomechanics. 37 (6), 865-877 (2004).
- Grinstein, M., et al. A distinct transition from cell growth to physiological homeostasis in the tendon. eLife. 8, e48689(2019).
- Villaseñor, S., Grinstein, M. Two-photon microscopy for the study of tendons. Journal of Visualized Experiments. , e65853(2023).
- Qin, C., et al. The cutting and floating method for paraffin-embedded tissue for sectioning. Journal of Visualized Experiments. (139), e58288(2018).
- Wang, F., et al. RNAscope®: A Novel In Situ RNA Analysis Platform for Formalin-Fixed Paraffin-Embedded Tissues. Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Choi, H. M. T., et al. Third-generation situ hybridization chain reaction: multiplexed, quantitative, sensitive, versatile, robust. Development. 145 (12), 165753(2018).
- Jackson, D. J., Herlitze, I., Hohagen, J. A whole mount in situ hybridization method for the gastropod mollusc Lymnaea stagnalis. Journal of Visualized Experiments. (109), e53968(2016).
- Young, A. P., Jackson, D. J., Wyeth, R. C. A technical review and guide to RNA fluorescence in situ hybridization. PeerJ. 8, e8806(2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。