远程神经元激活与自动血液采样相结合,以诱导和测量小鼠体内循环黄体生成素
摘要
黄体生成素 (LH) 搏动是生殖功能的标志。我们描述了一种远程激活与连续自动采血相关的特定神经元群的方案。该技术允许定时荷尔蒙调节、多路复用,并最大限度地减少对有意识、自由移动和不受干扰的动物的 LH 水平的操纵影响。
摘要
循环黄体生成素 (LH) 水平是下丘脑-垂体生殖控制功能的重要指标。许多输入和神经元群在调节 LH 释放中的作用仍然未知。测量小鼠LH水平的变化通常是一个挑战,因为它们很容易被环境压力破坏。目前测量LH释放和脉动的技术需要对小鼠进行长期训练,以适应操作压力,一定的约束,研究人员的存在以及在个体动物身上工作,从而降低了其对许多研究问题的有用性。
本文介绍了一种使用设计药物独家激活的设计受体 (DREADD) 技术与在有意识、自由移动和不受干扰的小鼠中自动顺序采血相结合来远程激活特定神经元群的技术。我们首先描述了立体定位手术方案,以将表达 DREADD 的腺相关病毒 (AAV) 载体递送至特定神经元群。接下来,我们描述了颈动脉和颈静脉插管的方案以及术后与 CULEX 自动采血系统的连接。最后,我们描述了用于远程神经元激活和自动采血的氯氮平-N-氧化物静脉注射的方案。该技术允许在给定时间段内每 5 分钟或更长时间进行一次编程自动采样,并在所需的时间点或持续时间内静脉注射物质。总体而言,我们发现这种技术是研究神经内分泌控制的有效方法。
引言
下丘脑-垂体-性腺 (HPG) 轴由促性腺激素释放激素 (GnRH) 脉动释放到垂体门静脉系统中进行中枢调节。在垂体中,GnRH 控制促性腺激素、促黄体生成素 (LH) 和促卵泡激素 (FSH) 向循环系统的脉动释放。LH 搏动释放是中心 HPG 轴功能的标志 1,2,3,4。例如,它显示遗传改变或激素或环境因素变化对轴 5,6,7 神经部分的影响。直到最近,LH搏动模式的测量仅限于大型哺乳动物8和大鼠9,因为识别脉冲所需的采样频率高且血容量大。
检测小鼠的LH脉冲是可取的,因为该物种具有广泛的遗传模型,并且可以使用基因组工程技术轻松操纵,以进一步研究特定基因和细胞群。在过去十年中,使用夹心LH酶联免疫吸附测定法(ELISA)分析小鼠LH浓度方面取得了巨大进展,可以检测微量血液中的LH10。频繁尾尖血液采样技术的发展使得必要的频繁采样成为可能,以检测小鼠中LH脉冲的频率和幅度10,11。然而,尾尖血液采样仅限于在清醒的动物中使用;它需要很长的训练期,让小鼠适应取样过程中的处理和指定研究者的存在。它的成功极易受到环境压力源的影响,可能不适合用于表现出高度焦虑的小鼠品系。心房插管也被用于对自由移动的清醒小鼠进行频繁的血液采样12。然而,这种设置仍然需要重复的手动采样,并限制了动物的移动空间,而心房插管会导致心脏功能的动态变化。因此,希望在有意识、自由移动和不受干扰的小鼠中建立一种在无压力条件下采血的方法,而无需事先训练或人工处理或在场。
自动血液或透析液取样以前曾用于测量不受约束的啮齿动物的不同激素水平(例如褪黑激素13,14)及其脉动分泌物(例如生长激素)15。我们在此提出了一种在有意识和无拘无束的动物中自动长期频繁采样的方案,以及使用化学遗传学技术及时远程激活特定神经元群:由设计药物(DREADD)专门激活的设计受体。我们将描述腺相关病毒 (AAV) 载体的立体定向递送以及通过自动静脉内 (IV) 递送氯氮平-N-氧化物 (CNO) 的远程激活16,17。该协议允许同时在多只动物中连续检测基础水平和诱导的LH搏动变化。化合物的血液采样和静脉注射均通过计算机程序以时间受控的方式进行,从而消除了研究者的实际存在或事先进行小鼠训练的要求。这种方法克服了手动采血的主要局限性。它允许在无压力的条件下进行血液采样,并同时进行静脉注射化合物输送,并结合远程神经元活动控制。我们展示了单独使用自动采血或结合远程神经元激活的代表性结果,并讨论了其优点、局限性和其他用途。
研究方案
所有动物程序均按照国家研究委员会实验动物护理和使用指南18 以及联邦、州和地方法律执行。成年雌性小鼠(3-6个月大)用于该方案演示,包括4只C57BL / 6J雌性和4只Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) 雌性。将小鼠保持在12:12的光:暗循环下,温度控制在22°C,并在低植物雌激素饮食 中随意 喂食。程序和协议已获得密歇根大学机构动物护理和使用委员会(IACUC,动物协议:PRO00010420 和 PRO00010138)的批准。
1. AAV的立体定向递送至特定细胞群
- 手术准备
- 对所有工具进行消毒。准备多包手术工具,以确保每包用于不超过五只动物。准备无菌手套,每只动物至少一副。
- 使用以下设置(参见 材料表)拉动玻璃微量移液器进行注射,用于缓慢稳定注入且不易堵塞的细长微量移液器: 热 1:915,热 2:630,拉力:630。针对每个拉拔器优化这些设置。
- 在指定的手术空间进行手术。用 70% 乙醇对手术表面进行消毒。
- 使用无菌窗帘来保持手术区域的无菌。穿上干净的实验室外套或一次性防护服,戴上口罩。
- 准备吸入麻醉系统。打开供氧,将流速调节至 0.8 L/min。
- 手术
- 将鼠标放入麻醉箱中,将异氟烷打开至2.5%。初始诱导后将异氟醚流量降低至2%;在整个过程中保持流畅。有关麻醉的替代方法,请参阅动物方案和当地伦理委员会指南。
- 按照动物使用委员会的建议和当地法规注射先发制人镇痛药(卡洛芬 5 mg/kg 皮下注射)。
- 用剪刀剃掉鼠标头。
- 将动物安装在立体定位台上,放置耳杆,并确保头部正确固定且稳定。将鼠标的嘴固定在咬嘴上,确保将舌头放在嘴外侧以避免窒息。
- 在开始手术之前,用脚趾捏住动物确认被深度麻醉,并在整个手术过程中监测小鼠的呼吸和颜色。
- 将抬高支架放在鼠标下方,以保持身体和头部水平处于水平位置。用纸盖住的温暖垫子让动物保持温暖。将眼药膏涂抹在双眼上,以免干燥。
- 尽可能保持手术区域清洁。戴上无菌手套。在打开皮肤之前,用碘和酒精对老鼠的头部进行消毒。用手术刀沿着中线切开头部的皮肤,大约从眼睛后面到λ缝合线后面。保持颅骨暴露,并用棉签嵌入无菌的 0.9% NaCl 进行清洁。
- 找到鼻静脉 (RRV) 并用无菌铅笔标记。在程序的其余部分使用立体镜。
注意:我们使用 RRV 作为前后参考获得更好的结果,但使用前嵐作为参考是标准的。 - 使用无菌针头作为参考,在进行立体定位测量之前,确保大脑方向正确。还要确保颅骨表面在RRV和λ处的高度以及侧向倾斜度相同(±0.02毫米)。
注意:侧向倾斜度与注射到更多的外侧大脑结构中变得更加相关。 - 将无菌玻璃移液管装入要注射的病毒溶液。将其带到 RRV 参考值,作为参考值 0 前后 (AP)。沿着矢状缝线前进到选择的 AP 坐标。用无菌铅笔标记这个位置,提起针头,然后进行开颅手术。
- 小心地在标记位置周围钻一个小圆圈,以免破坏矢状窦上窦。将钻头放置在倾斜位置而不是垂直位置,以降低钻孔时的压力。用小镊子取出头骨的碎片。
- 一旦脉管系统暴露,使用上矢状窦的中间作为内侧 (ML) 参考(点 0);这比使用矢状缝合更精确。移动到选择的 ML 位置。降低移液器以接触硬脑膜作为背腹 (DV) 参考(点 0)。轻轻掰开硬脑膜,将移液器下降到所选的DV位置。
- 注射所需量的AAV(50-200nL)并将套管放置3分钟以充分分散液体。小心地将移液管从大脑中取出。
- 将鼠标从耳杆上松开。使用手术夹或任何选择的方法闭合皮肤。将动物放在一个单独的温暖的笼子里进行恢复。监视鼠标唤醒后的恢复、反应和活动。完全恢复后,将鼠标移回原来的笼子。
- 等待至少 3-4 周的病毒表达,然后再进行手术的第二部分。
2.颈静脉和颈动脉插管
- 手术准备
- 在指定的手术空间进行手术。在开始手术之前,用 70% 乙醇对手术表面进行消毒。准备多包手术工具,以确保每包用于不超过五只动物。
- 高压灭菌所有手术器械。然后,用无菌水或生理盐水清洁,并在手术之间用热珠消毒器对工具进行至少 15 秒(根据制造商的说明)。
- 使用无菌窗帘来保持手术区域的无菌。穿上干净的实验室外套或一次性防护服,戴上口罩。
- 准备用于颈动脉和颈静脉插管的微导管。通过将一小段微肾环管(从 0.025 英寸外径 [OD] x 0.012 英寸内径 [ID] 拉伸)与硅橡胶管(0.025 英寸外径 x 0.012 英寸内径)连接来构建动脉导管。仅使用硅橡胶管(外径 0.025 英寸 x 内径 0.012 英寸)构建静脉导管。手术前将所有导管浸泡在 70% 乙醇中过夜。
- 根据动物的体重和长度,将两根导管的切割尖端斜角为 45°,直至预先估计的长度。
- 外科 手术
- 使用台式低流量异氟醚系统麻醉2%以下的动物,以精确控制手术过程中的麻醉阶段和平面。
- 先发制人剂量的镇痛药(卡洛芬 5 mg/kg 皮下注射)并涂抹眼药膏以防止干燥和角膜损伤。
- 剃掉颈部的腹侧和背部区域,并用三种碘磨砂膏与70%乙醇交替清洁皮肤。在肩胛骨之间切开一个垂直的皮肤切口(12 毫米),并用手术纱布覆盖以备后用。将动物置于仰卧位,头部朝向外科医生。
- 在下面描述的大多数程序中使用立体解剖镜。
- 在颈部右侧,锁骨上方做一个垂直小切口(~10 mm),露出右颈动脉和颈静脉。用剪刀剪开皮肤,并使用带有细尖的非齿微镊子进行钝解剖以分离皮下组织,露出右侧颈外静脉和右侧颈总动脉。
- 绑住颈静脉的远端以阻止血流,并使用微型镊子和剪刀在塌陷的静脉上切一个小孔。使用一对微型镊子将静脉导管斜面向下插入近端,使其穿过上腔静脉以达到右心房的水平。对于 10 g 瘦鼠,插入长度为 ~12-30 mm。使用 7-0 丝缝线将导管绑扎以固定在血管上。
注意:将导管放在正确的位置,可以很容易地抽取血液;否则,导管可能会错位到胸外侧静脉中,需要重新插入。 - 仔细解剖结缔组织,露出位于胸骨舌骨肌、胸骨乳突肌和二腹肌包围的三角形区域的右侧颈总动脉。如果需要,使用钢丝牵开器将这些肌肉分开。使用7-0丝缝合线将动脉绑在颈内动脉和颈外动脉分叉的水平。在近端放置两个解开的缝合环。
- 通过拉动预先置换的缝合环暂时停止血流,并使用微型剪刀或 27 G 针在血管壁上切割或打一个小孔。将动脉导管斜面向下插入,并靠近到达主动脉弓的预定长度,但不接触主动脉瓣。对于 9 g 瘦鼠标,插入长度为 ~9-10 mm。使用两条预置缝合线将导管绑扎以固定在血管上。
- 将所有导管皮下穿过,并通过预切切口在颈部后部将其外部化,并将它们连接到由 25 G 针管制成的硅胶涂层管连接器的静脉或动脉端口:改良的 MASA19 使用两根 25 G 针管和两根 4.0 cm 的 PE-20 管,套管有 2.0 cm 的 0.062 英寸内径硅橡胶管,并附有一个小金属线制成的环。包括连接器在内的每根导管的总管腔体积为 6-8 μL(图 1A)。
- 闭合腹侧切口,并用缝合线将连接器皮下固定在背部皮肤闭合处。用肝素盐水 (200 U/mL) 填充两根导管,并用不锈钢手术线将它们紧紧塞住。
- 小鼠在几分钟内从异氟醚麻醉中恢复,并在5天内从手术中完全恢复。手术后24小时将动物置于自动采血室中,并通过将系统的系绳钩连接到连接到植入颈部后部的管道连接器的金属环上将它们连接到系统。在采样开始前24小时,将动脉和静脉导管分别连接到注射和采样管路(图1B)。取样线的总长度为 55 cm,或 40 μL(按流明体积计)。
注:注射和采样线的设置、收集方法的编程以及自动血液采样器系统的笼子平衡机制已详细描述20,21。该系统每 20 分钟自动输送 10 μL 肝素盐水,使导管保持打开状态。 - 通过系统的计算机程序设置注射前取样、注射后和注射后取样时间和频率。有关当前设置,请参阅下面的步骤 3.1。
- 该系统允许动物自由移动,而不会缠绕采样和/或输液线,通过感应鼠标运动,同时以与鼠标运动相反的方向旋转壳室21 (图1)。
- 用化合物重新填充输注或注射管路,并在输注或注射开始前至少 2 小时重新连接到静脉导管。
注意:可能会发生手术并发症,需要密切监测动物的恢复情况和手术后的几天。有关正确的监测、终止要求和程序,请参阅动物协议。
3.自动采血和静脉注射
- 自动采血
- 要遵循此方案,请使用20.0μL的采样体积,并在每次采样之间设置一个间隔(即7.0分钟),使每个样品的采样频率为每10.0分钟一次。最大速率是以 3.0 min/样品的速度连续采样;最小可能的采样体积为 5.0 μL。系统会自动返回等量的生理盐水,以替换采样的血液并维持体液平衡。
- 将 总采样时间 设置为静脉注射CNO前 30 (t = -30-0)分钟和静脉注射CNO后 30 (t = 0-30) 分钟 (0.5mg / kg, 图2)。
- 每个收集的血液样本(20.0μL)在50μL生理盐水(含有10U / mL的肝素)中自动稀释,并单独储存在系统保存在冷藏样品转盘中的微管中。
- 自动静脉注射
- 在血液采样开始前至少2小时,将静脉管路与静脉导管断开以重新填充CNO(按体积单独计算的剂量~50-60μL,0.5mg / kg)。
- 用注射器逆行从管路中手动取出溶液(略大于计算体积),在溶液和管路中现有的盐水之间留下一个小气泡。
- 将注射管重新连接到静脉导管,并在t = 0取样完成后将注射速率设置为500μL / min,将注射开始时间设置为2 min。每只动物的总注射时间为5-6秒。
注意:如果需要,该化合物也可以通过手动腹膜内注射 (IP) 递送,但这需要在采血方案期间或之前干扰动物。我们还在结果中显示了这种替代方案。
4. 动物灌注和脑采集(可选)
注意:仅当需要大脑分析神经元激活或下游反应的大脑部位时,才应遵循此程序。
- 在采集方案结束时断开小鼠与采血系统的连接。静脉注射后两小时,继续用10%中性缓冲福尔马林(NBF)灌注动物,使用优选方法或如其他地方所述22。
- 解剖大脑并将其保存在20%蔗糖的10%NBF中3小时以继续固定。
- 3小时后,将固定脑转移到PBS中的20%蔗糖中,并在4°C下保存,直到准备好切片。
注意:避免过度固定,因为这会掩盖 cFOS 抗原。在20%的蔗糖溶液中,大脑应该沉到容器的底部。 - 使用冷冻切片机或冷冻恒温器进行切片,并使用首选方法观察神经元激活(例如,显示 cFOS 免疫组化)。
注意:用于当前结果的抗体在 材料表中进行了描述。
5. 样品处理与分析
- 实验结束后立即从自动采样器中取出血液样本并将其放在冰上。
- 将样品以 14,000 × g 旋转 30 秒。
- 收集血浆。将其储存在-80°C直至分析。
- 如前所述,通过LH ELISA测定血液样本10,23。
代表性结果
位于下丘脑弓状核中的表达 kisspeptin 的神经元(Kiss1 基因)是 GnRH 的有效刺激物,因此也是垂体释放LH 的有效刺激物 24,25。在本方案演示中,我们使用 kisspeptin 诱导的 LH 分泌来说明自动血液采样技术的功能。 图 2 显示了先前在弓状核中单侧立体定向注射 AAV-hM3Dq-mCherry 的成年 Kiss1-eYFP 雌性的代表性 LH 模式(AP:-4.95,ML:-0.35,DV:-5.7)。ChR2-eYFP 被用作 Kiss1 细胞的荧光报告基因。立体定向手术1个月后,小鼠接受颈动脉和颈静脉插管,并在术后4天连接到自动采血器。第二天以 10 分钟的采样频率(样本间隔 7 分钟和 3 分钟/采样)开始采集以确定基础 LH 水平,然后自动静脉注射 CNO,每 10 分钟继续采血 30 分钟。二氧化叶LH水平通常较低(图2A),但由于其脉动释放,通常会观察到变化(图2B)。在CNO注射(和kisspeptin神经元的激活)之后,LH的上升是急剧的(在10分钟内)。增加的水平和峰值的持续时间取决于许多因素,包括注射部位、激活的神经元数量或目标群体。
图3 显示了 图2A所示的雌性小鼠弓状核中的脑注射部位。Kiss1-eYFP 神经元以绿色标记,而 mCherry 免疫反应性显示 CNO 后 AAV 注射和激活的部位。使用用DAB标记的cFOS免疫反应性检测激活的神经元。大多数 mCherry 神经元与 Kiss1-eYFP 共定位,许多神经元表现出 cFOS 免疫反应性,表明病毒和神经元激活对目标人群具有特异性。
图4显示了双面野生型(C57BL / 6J)小鼠中具有代表性的LH脉动释放模式,随后对IP注射kisspeptin-10的反应。小鼠接受颈动脉插管术,并在手术后4天连接到自动采血系统。第二天早上,检查发情周期,并在第26天进行采血和kisspeptin-10注射。每 7 分钟收集一次血样,持续 2 小时(间隔 4 分钟,加上注射前 3 分钟/采样 120 分钟)以确定基线水平和 LH 脉动度,然后 IP 注射 kisspeptin-10 (65 μg/kg) 并继续每 7 分钟采集一次血液,再采集 30 分钟。观察到雌性 diestrous 的典型清晰 LH 脉冲,显示基础 LH 水平较低,脉冲频率为 ~2 脉冲/小时,脉冲幅度为 ~1 ng/mL27。在kisspeptin给药28的响应中检测到LH的立即和强劲增加。LH分泌模式和刺激后的变化与其他使用手动采血的研究一致10,27,29,30。这些结果表明,自动血液采样方法在无压力条件下捕获典型和刺激的 LH 分泌。
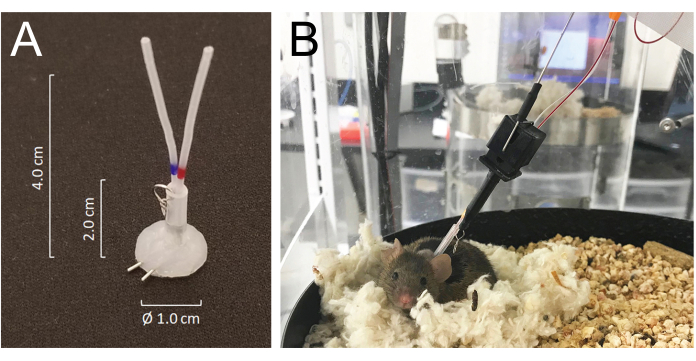
图 1:连接器系统的详细信息以及鼠标与输液和采样系统管道的连接。 (A) 使用两根 25G 针管和两根 PE-20 管制成的硅胶涂层管连接器 (MASA),套管在带有小金属环的硅橡胶管中。(B) 一只连接到采样笼中的输液和采样管的小鼠,在采血过程中在其巢中休息。 请点击这里查看此图的较大版本.
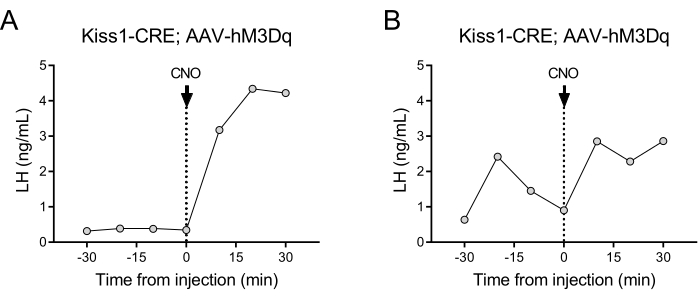
图 2:在弓状核中注射 AAV-hM3Dq 并用 CNO 远程激活的 Kiss1-Cre 雌性小鼠中 LH 脉冲的代表性结果。 每 10 分钟测量一次基础 LH 水平,持续半小时。在采血后的时间 0 时,女性接受静脉注射氯氮平-N-氧化物 (0.5 mg/kg),并继续每 10 分钟从颈动脉采集血液,持续半小时。(A) 显示基础 LH 水平低的女性。(B) 显示显示 LH 脉冲预注射的女性。缩写:Kiss1 = Kisspeptin;AAV = 腺相关病毒;CNO = 氯氮平-N-氧化物;LH = 黄体生成素。 请点击这里查看此图的较大版本.
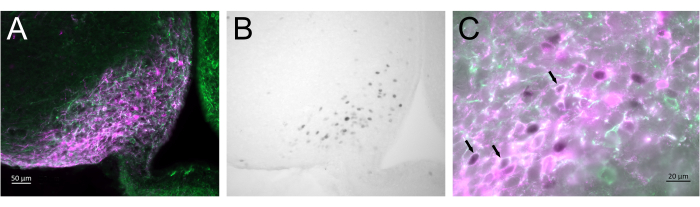
图 3:Kiss1-Cre 弓状核的大脑激活;Chr2-eYFP (Kiss1-eYFP) 雌性如图 2A 所示。ChR2-eYFP 仅用作标记 kiss1 神经元的报告基因。(A) 低倍率荧光图像,显示弓状核中 AAV 注射部位。绿色:eYFP 免疫反应性,品红色:mCherry 免疫反应性。(B)与图3A对应的区域的低倍率明场图像,显示Arcuate核中AAV注射部位的cFOS免疫反应性(黑色)。(C)高倍率荧光和明场图像相结合,显示了图3A,B中神经元的近距离观察。已激活的共表达 AAV-mCherry 的 Kiss1-eYFP 神经元是具有白色细胞质和黑色细胞核(箭头)的神经元。比例尺 = 50 μm (A,B),20 μm (C)。缩写:Kiss1 = Kisspeptin;AAV = 腺相关病毒;eYFP = 增强型黄色荧光蛋白。请点击这里查看此图的较大版本.
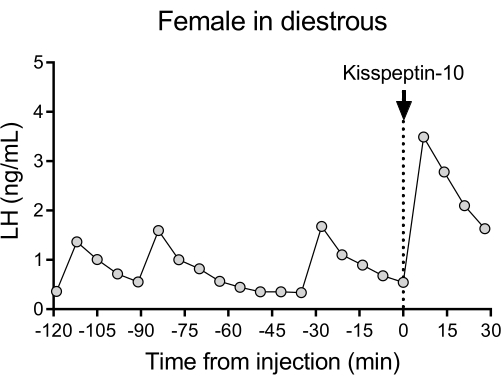
图 4:每 7 分钟测量一次双峰野生型雌性的基础 LH 搏动,持续 2 小时。 然后,女性在时间 0 时接受腹腔注射 kisspeptin-10 (65 μg/kg),每 7 分钟连续采集血样半小时。缩写:LH=促黄体激素。 请点击这里查看此图的较大版本.
讨论
使用该方案,我们能够在刺激神经元群后显示基础LH搏动和LH分泌。该系统的一大优点是进行采样的无压力环境,在采样过程中没有人在场或处理。此外,在实验过程中不需要事先进行艰苦的动物训练和适应人类的存在或处理。以前使用手动血液采样的实验需要大量的时间和精力来最小化压力源7,31,32。然而,单独剪掉尾巴是一个压力源33.在共享动物设施中实施无压力的环境和训练模式,其中中断是不可预测的,也可能是一个限制因素。在一些实验室中,动物通常需要被运送到替代手术室进行血液采样。这些局限性可能使手动方法不适合检测LH水平的细微变化,因此,在这些情况下,不干涉的方法可能会有所帮助。自动采样设置在一个安静的房间内,老鼠提前几天放置以适应新环境。我们之前使用该方案的经验提供了对小鼠皮质酮和脉动生长激素分泌模式的精确检测,在自动采样期间没有显示皮质酮水平升高15。在目前的实验中,所有动物都很好地适应了采样系统,在~24 h后在采样室中筑巢,毛色鲜艳,表明没有压力,整体健康状况良好(图1)。
导致阴性结果的主要困难可能是AAV对所需神经元群的不适当靶向。立体定位注射的精度至关重要,应提前进行培训以验证坐标和注射量。训练可以通过在非恢复手术中将少量 0.5-1% Evans Blue 注射到所需位置来完成,然后使用小鼠脑基质(例如 Ted Pella)取一片新鲜解剖的大脑,以检查注射的部位和大小使用立体镜。
同样重要的是要考虑到,从自动血液采样系统收集的血液和血浆将在肝素化盐水中稀释(例如,在我们的结果中,20 μL 血液在 50 μL 盐水中)20,并且可能需要根据所选分析方法的灵敏度调整稀释比例。我们测试了用 BSA-PBS(推荐用于超灵敏 LH ELISA)10 或生理盐水稀释的全血中的 LH 水平,发现 LH 值没有差异。吐温不能在稀释剂中使用,因为它会循环到血液系统中,通过更换样品液体来提取样品20。根据我们的经验,与1:3.5相比,稀释度低于1:10的LH效果很好,但略微低估了LH水平。这表明如有必要,可以进一步调整稀释度以减少收集的血液量。
自动化合物递送的替代方法是通过静脉导管进行手动注射。在这种情况下,调查员会短暂地出现在房间里进行注射。然而,与动物或其住房和周围环境没有直接接触,并且与腹膜内或皮下注射不同,整个过程通常不会被动物注意到。手动进样的优点是不需要提前设置化合物稀释度,这对于大容量使用成本太高或对随时间降解敏感的化合物可能至关重要;由于操作量比自动输送小,在自动输送中,输液管路和导管需要预先填充更多的复合溶液。
例如,自动血液采样为研究睡眠期间的LH变化提供了独特的机会。我们经常观察到动物在采样期间睡在巢里。可以将此采样与脑电图记录联系起来,以生成对神经活动与 LH 模式之间关系的更详细分析34.如图所示,使用自动血液采样的可能性很多:从基础 LH 采样到测试对内源性或外源性化合物的 LH 反应,或激活或抑制神经元群。神经元操作可以通过化学遗传学或光遗传学急性地实施,也可以永久使用转基因小鼠模型和凋亡或神经元沉默工具来实现。自动血液采样还允许测量具有高度脉动分泌模式的其他激素(例如生长激素15)。在雌性小鼠中,如果需要发情周期的特定阶段,则可以在开始方案26 之前数小时仔细收集阴道涂片,而不会破坏输液和采样线。动物可以连接到采样系统 7-10 天,动脉管路凝血的风险随着时间的推移而增加。
然而,这种技术仅限于用于单胎动物,因此,它可能不适合研究社会互动。它也是侵入性的,需要技术上具有挑战性的手术,因此可能无法在幼年动物或某些疾病模型中实施。最后,由于购买系统的成本对于单个研究实验室来说可能太高,因此建议将其设置在提供上述实验方案作为服务的核心实验室中。
总之,该协议显示了如何结合自动血液采样进行AAV的立体定向递送。该技术实现了精确的空间和时间控制,以及其应用于不同模型、测量方案和激素的灵活性,使其成为研究啮齿动物激素调节的有力方法。最重要的是,该方法通过消除注射和/或取样期间的人类存在和处理以及先前的动物训练来提供无压力的环境。这些优点,加上多路复用的可能性,使这种方法成为研究有意识、自由移动和不受干扰的小鼠激素变化的神经控制的独特工具。
披露声明
作者没有需要披露的利益冲突。
致谢
我们感谢丹尼尔·海森莱德博士在测试不同血液稀释方法方面的帮助。血清激素测定在弗吉尼亚大学生殖配体测定研究中心进行,核心由 Eunice Kennedy Shriver NICHD Grant R24 HD102061 支持。密歇根小鼠代谢表型中心-Live 由 NIH 中心资助 U2C DK135066 提供支持。JF 和 NQ 由 DK020572 (MDRC) 和 DK089503 (MNORC) 赠款支持。CFE 和 CSM 由 NICHD 拨款 R21 HD109485 和 R01 HD096324 支持。
材料
| Name | Company | Catalog Number | Comments |
| AAV8-hSyn-hM3D(Gq)-mCherry | Addgene | 44361 | Not necessarily this virus but this was the one used for representative results |
| Alcohol | Disinfection | ||
| Anesthesia Induction box | Vetequip | ||
| Anesthesia induction machine | Kent Scientific Equipment | SomnoSuite | |
| Anesthesia masks for mice | Kent Scientific Equipment | SOMNO-0801 | |
| Autoclip applier 9 mm | Clay Adams | 427630 | |
| Autoclip remover 9 mm | Clay Adams | 427637 | |
| Autoclips 9 mm | Clay Adams | 427631 | |
| BASi Culex Controller | Culex | SN: 2151, 2152, 2156, 2158 | 4 stations |
| BASi Honey Comb Fraction Collector | Honey Comb | SN: 2105, 2106, 2107, 2108 | 4 stations |
| BASi Ratrun Rotation Control | RATURN 2 | SN: 5680, 5681, 5682, 5683 | 4 stations |
| C57BL/6J mice | JAX # 000664 | ||
| Carprofen | Zoetis | Rimadyl | Analgesic |
| Clippers | Braun | ||
| Clozapine-N-oxide | ENZO | BLM-NS105-0005 | |
| Cotton tipped applicators | |||
| CULEX Automated In Vivo Sampling System | BASi | DS000627 | with CX-4000S Replacement Tubing Sets |
| Curved forceps serrated | FST | 11151-10 | |
| Drill | Dremel | 61100 | |
| Empis control Module | EMPIS CM | SN: 174 | |
| Empis Programmable Infusion System | EMPIS | SN: 2125 , 2126, 2127, 2128 | With CX-7010S 4 BAS-2 Infusion Sets; 4 stations |
| Envigo 2016 diet | low-phytoestrogen diet | ||
| Eye ointment | Dechra | Puralube Vet Ointment | Petrolatum Ophtalmic oinment |
| Glass pipettes | World Precision Instruments | MIB100-6 | |
| Hemostats | Roboz Surgical | RS-7101 | |
| Iodine | Betadine Surgical scrub | ||
| Isoflurane | VetOne | Fluriso | Anesthetic |
| Isoflurane Vaporizer or SomnoSuite Low-Flow Anesthesia System | Surgivet or Kent Scientific Corp | SS-01 | Anesthesia Machine |
| Kiss1-Cre;ChR2-eYFP (Kiss1-eYFP) mice | JAX # 023436 and #024109 | ||
| Kisspeptin-10 | Phoenix Pharmaceuticals | 048-56 | |
| Micro-renathane tubing | Braintree Scientific | MRE025 | Surgical catheterization |
| Micro-Scissors | Roboz Surgical | RS-5606 | |
| Needle Holder | Roboz Surgical | RS-7842 | |
| Picoliter injector | Warner Instruments | PLI-100A | |
| Pipette puller | Sutter Instruments | P30 | |
| Rodent Warmer X2 | Stoelting | 53850 | |
| Scalpel | FST | 10003-12 | |
| Scissors | Roboz Surgical | RS-6808 | |
| Silicon tubing | Liveo Laboratory Tubing | NO.508-001 | 0.012 in I.D x 0.025 in O.D. |
| Stereotaxic table | RWD | E06208 | |
| Sterile 0.9% saline | Baxter | 2F7124 | |
| Sterile towel drapes | Dynarex | 4410 | |
| Surgical blades | SKLAR | 06-3011 | |
| Surgical stereoscope | Zeiss | f-160 | |
| Tweezers | Roboz Surgical | RS-4960 | |
| Tweezers | Roboz Surgical | RS-4972 | |
| Tweezers | Roboz Surgical | RS-5058 | |
| Antibodies | |||
| Anti-cFos | Millipore | ABE457 | Antigen target: N-terminus cFos; Host organism: Rabbit; Dilution used: 1:5,000; RRID: AB_2631318 |
| Anti-GFP | Aves Labs | GFP-1010 | Antigen target: recombinant GFP null; Host organism: Chicken; Dilution used: 1:10,000; RRID: AB_2307313 |
| Biotin-SP-conjugated AffiniPure Donkey Anti-Rabbit IgG | Jackson ImmunoResearch Labs | 711-065-152 | Antigen target: Rabbit IgG (H+L); Host organism: Donkey; Dilution used: 1:1,000; RRID: AB_2340593 |
| Donkey anti-Rat IgG, AlexaFluor 594 | Thermo Fisher Scientific | A-21209 | Antigen target: Rat IgG (H+L); Host organism: Donkey; Dilution used: 1:500; RRID: AB_2535795 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A-11039 | Antigen target: Chicken, IgY (H+L); Host organism: Goat; Dilution used: 1:500; RRID: AB_2534096 |
| mCherry monoclonal (16D7) | Thermo Fisher Scientific | M11217 | Antigen target: mCherry tag; Host organism: Rat; Dilution used: 1:5,000; RRID: AB_2536611 |
参考文献
- Kokoris, G. J., Lam, N. Y., Ferin, M., Silverman, A. J., Gibson, M. J. Transplanted gonadotropin-releasing hormone neurons promote pulsatile luteinizing hormone secretion in congenitally hypogonadal (hpg) male mice. Neuroendocrinology. 48 (1), 45-52 (1988).
- Coquelin, A., Desjardins, C. Luteinizing hormone and testosterone in young and old male mice. American Journal of Physiology - Endocrinology and Metabolism. 243 (3), E257-E263 (1982).
- Carmel, P. W., Araki, S., Ferin, M. Pituitary stalk portal blood collection in rhesus monkeys: Evidence for pulsatile release of gonadotropin-releasing hormone (GnRH). Endocrinology. 99 (1), 243-248 (1976).
- Schuiling, G., Gnodde, H. Site of origin of the pulsatile secretion of luteinizing hormone in long-term ovariectomized rats. Journal of Endocrinology. 70 (1), 97-104 (1976).
- Hackwell, E. C. R., Ladyman, S. R., Brown, R. S. E., Grattan, D. R. Mechanisms of lactation-induced infertility in female mice. Endocrinology. 164 (5), 1-12 (2023).
- Bahougne, T., Kretz, M., Angelopoulou, E., Jeandidier, N., Simonneaux, V. Impact of circadian disruption on female mice reproductive function. Endocrinology. 161 (4), (2020).
- Kreisman, M. J., McCosh, R. B., Tian, K., Song, C. I., Breen, K. M. Estradiol Enables Chronic Corticosterone to Inhibit Pulsatile Luteinizing Hormone Secretion and Suppress Kiss1 Neuronal Activation in Female Mice. Neuroendocrinology. 110 (6), 501-516 (2020).
- Moenter, S. M., Evans, N. P. Gonadotropin-releasing hormone GnRH measurements in pituitary portal blood. Journal of Neuroendocrinology. 34 (5), 13065 (2022).
- Maeda, K. I., et al. The LHRH pulse generator: A mediobasal hypothalamic location. Neuroscience and Biobehavioral Reviews. 19 (3), 427-437 (1995).
- Steyn, F. J., et al. Development of a methodology for and assessment of pulsatile luteinizing hormone secretion in juvenile and adult male mice. Endocrinology. 154 (12), 4939-4945 (2013).
- Steyn, F. J., et al. Development of a method for the determination of pulsatile growth hormone secretion in mice. Endocrinology. 152 (8), 3165-3171 (2011).
- Minabe, S., Uenoyama, Y., Tsukamura, H., Maeda, K. Analysis of pulsatile and surge-like luteinizing hormone secretion with frequent blood sampling in female mice. Journal of Reproduction and Development. 57 (5), 660-664 (2011).
- Perreau-Lenz, S., Kalsbeek, A., Pévet, P., Buijs, R. M. Glutamatergic clock output stimulates melatonin synthesis at night. European Journal of Neuroscience. 19 (2), 318-324 (2004).
- Herwig, A., Pévet, P., Bothorel, B., Steinlechner, S., Saboureau, M. Trans-pineal microdialysis in the Djungarian hamster (Phodopus sungorus): A tool to study seasonal changes of circadian clock activities. Journal of Pineal Research. 40 (2), 177-183 (2006).
- Adams, J. M., Otero-Corchon, V., Hammond, G. L., Veldhuis, J. D., Qi, N., Low, M. J. Somatostatin is essential for the sexual dimorphism of GH secretion, corticosteroid-binding globulin production, and corticosterone levels in mice. Endocrinology. 156 (3), 1052-1065 (2015).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63 (1), 27-39 (2009).
- Krashes, M. J., et al. reversible activation of AgRP neurons drives feeding behavior in mice. Journal of Clinical Investigation. 121 (4), 1424-1428 (2011).
- National Research Council. Guide for the Care and Use of Laboratory Animals. Eighth edition. National Research Council. , (2011).
- Ayala, J. E., et al. Hyperinsulinemic-euglycemic clamps in conscious, unrestrained mice. Journal of Visualized Experiments. (57), e3188 (2011).
- Peters, S., et al. Culex ABS Part I: Introduction to automated blood sampling. Current Separations. 18 (4), 139-145 (2000).
- Bohs, C., Cregor, M., Gunaratna, G., Kissinger, C. Culex Automated blood sampler part II Managing freely-moving animals and monitoring their activity. Current Separations. 18 (4), 147-151 (2000).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Kreisman, M. J., Mccosh, R. B., Breen, K. M. A Modified ultra-sensitive ELISA for measurement of LH in mice. Endocrinology. 163 (9), (2022).
- Pielecka-Fortuna, J., Chu, Z., Moenter, S. M. Kisspeptin acts directly and indirectly to increase gonadotropin-releasing hormone neuron activity and its effects are modulated by estradiol. Endocrinology. 149 (4), 1979-1986 (2008).
- Kumar, D., et al. Specialized subpopulations of kisspeptin neurons communicate with GnRH neurons in female mice. Endocrinology. 156 (1), 32-38 (2015).
- Caligioni, C. S. Assessing reproductive status/stages in mice. Current Protocols in Neuroscience. , 1-8 (2009).
- Czieselsky, K., et al. Pulse and surge profiles of luteinizing hormone secretion in the mouse. Endocrinology. 157 (12), 4794-4802 (2016).
- Wang, L., et al. Genetic dissection of the different roles of hypothalamic kisspeptin neurons in regulating female reproduction. eLife. 8, 43999 (2019).
- McCosh, R. B., Kreisman, M. J., Breen, K. M. Frequent tail-tip blood sampling in mice for the assessment of pulsatile luteinizing hormone secretion. Journal of Visualized Experiments. (137), e57894 (2018).
- Vanacker, C., Defazio, R. A., Sykes, C. M., Moenter, S. M. A role for glial fibrillary acidic protein (Gfap)-expressing cells in the regulation of gonadotropin-releasing hormone (GnRH) but not arcuate kisspeptin neuron output in male mice. eLife. 10, e68205 (2021).
- Dulka, E. A., Defazio, R. A., Moenter, S. M. Chemogenetic suppression of GnRH neurons during pubertal development can alter adult GnRH neuron firing rate and reproductive parameters in female mice. eNeuro. 7 (3), 0223 (2020).
- Talbi, R., et al. Characterization of the Action of Tachykinin Signaling on Pulsatile LH Secretion in Male Mice. Endocrinology. 162 (8), 1-9 (2021).
- Tuli, J., Smith, J., Morton, D. Corticosterone, adrenal and spleen weight in mice after tail bleeding, and its effect on nearby animals. Laboratory Animals. 29 (1), 90-95 (1995).
- Lucien, J. N., Ortega, M. T., Shaw, N. D. Sleep and puberty. Current Opinion in Endocrine and Metabolic Research. 17, 1-7 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。