需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
新型碱木质素微/亚微米颗粒的绿色合成、表征、封装和释放潜力的测量
摘要
我们描述了生物相容性木质素微米和亚微米颗粒的合成和表征的新颖、简单的方法。这些配方为杂质聚合物的利用提供了一种简单的方法,也为合理设计多功能载体基质提供了一种替代方案,在生物医学、制药技术和食品工业中具有潜在的适用性。
摘要
由于生物聚合物基颗粒作为有效载体系统的巨大潜力,生物聚合物微/纳米技术在人类、兽医、制药和食品技术中的适用性正在迅速增长。使用木质素作为碱性杂聚物生物基质,用于设计创新的微/亚微米配方,可以提高生物相容性,并提供各种活性官能团,为定制配方的理化性质和生物活性提供机会,适用于各种应用。本研究的目的是开发一种简单且环保的方法,用于合成微米和亚微米尺寸的木质素颗粒;评估其理化、光谱和结构特性;并检查它们包封生物活性分子的能力以及在模拟胃肠道培养基中体 外释放生物 类黄酮的潜力。所提出的方法适用于廉价和绿色的溶剂;简单、直接、快速和灵敏的过程,只需很少的设备、无毒物质和简单的表征方法,即可测定对水溶性差的生物活性化合物桑酸和槲皮素的包封能力,以及木质素基质的 体外 释放潜力。
引言
如今,由于纤维素、壳聚糖、胶原蛋白、葡聚糖、明胶和木质素等生物聚合物作为设计具有可定制尺寸、物理化学特性和生物功能性的微/亚微米载体的前体,由于它们在组织工程、3D 生物打印、体外的适用性,在生物医学、制药和食品技术行业中有所增加疾病建模平台、包装行业、乳液制备和营养物质输送等 1,2,3.
新颖的研究强调了木质素基水凝胶以及微纳米制剂4 作为用于食品包装材料5、储能6、化妆品7、热/光稳定剂、增强材料和药物载体基质的有利载体8 用于输送疏水分子、改善紫外线阻隔剂9,作为纳米复合材料中的增强剂,以及由于最近的一些安全问题而作为无机纳米颗粒的替代品10,11,12。这种趋势背后的原因是天然生物聚合物的生物相容性、生物降解性和无毒性,以及其已证实的木质素抗氧化潜力和自由基清除、抗增殖和抗菌活性的生物活性 13,14,15,16,17。
科学文献报道了各种合成方法(自组装、抗溶剂沉淀、酸沉淀和溶剂转移)18 以及基于木质素的微/纳米级制剂的表征,包括使用昂贵或有害的溶剂,如四氢呋喃 (THF)、二甲基亚砜 (DMSO)、N,N-二甲基甲酰胺 (DMF) 和丙酮,以及使用大量设备和有毒物质的复杂、间接和繁琐的过程12,19,20.
为了克服后一种缺点,以下协议提出了使用廉价和绿色溶剂合成木质素基微/亚微米颗粒的新方法;简单、直接、快速和灵敏的过程,只需很少的设备、无毒物质和简单的方法来表征和测定对水溶性差的生物活性化合物的包封能力和木质素基质的 体外 释放潜力。所提出的实验室规模生产方法有利于制造功能性木质素载体,这些载体具有可调的尺寸、高封装容量和可持续的 体外 释放行为,利用简单的表征程序和环保化学品,可以在生物医学科学和食品技术的各个领域找到应用。将两种黄酮类化合物作为靶分子封装在木质素颗粒中:桑苷封装在微粒中,槲皮素封装在亚微米颗粒中。两种黄酮类化合物结构的区别只是第二个-OH基团在B-芳环中的位置:-OH基团在桑苷中位于2'位置,在槲皮素中位于3'位置,因此两种有机化合物都是位置异构体。后一个事实假定两种生物活性天然化合物在包封和/或释放过程中具有相似的行为。
研究方案
1.木质素微粒的合成
- 通过在磁力搅拌器上将 2.5 g 碱木质素溶解在 50 mL 超纯水中,制备 50 mg/mL 碱木质素水溶液。
- 通过将 1 mL 吐温 80 溶解在 100 mL 超纯水中来制备 1% 吐温 80 溶液。
- 用超纯水稀释 6.65 mL 的 67% HNO3(密度 = 1.413 g/mL)至最终体积为 50 mL 来制备 2 M 的 HNO3 溶液。
- 缓慢加入 15 mL 的 1% 吐温 80 溶液到 50 mL 的 50 mg/mL 碱木质素溶液中。
- 在磁力搅拌器上以 500 rpm 的速度搅拌混合物 10 分钟,使表面活性剂很好地分散。
- 用注射器以约 150 μL/s 的流速向混合物中滴加 20 mL 2 M HNO3 。
- 当深棕色溶液转化为微粒的浅棕色悬浮液时,继续搅拌混合物30分钟。
- 将悬浮液转移到1.5-2mL试管中,并在10°C的超速离心机中以15,000× g 离心30分钟。
- 收集上清液进行进一步分析,并用超纯水冲洗微粒。
- 重复冲洗/超速离心程序 3 次。
- 在超声波均质化之前,将装有微粒的容器浸入冰浴中。
- 在超声均质器上以93%的强度将微粒均质化4分钟。
- 在冷冻干燥机中在-64°C的温度下冻干微粒,并将它们储存在蒸馏器中以备进一步使用。
2. 木质素亚微米颗粒的合成
- 通过在磁力搅拌器上将 125 mg 碱木质素溶解在 25 mL 超纯水中,制备 5 mg/mL 碱木质素水溶液。
- 缓慢向碱木质素溶液中加入 1 mL 96% EtOH。
- 在磁力搅拌器上以 500 rpm 的速度搅拌混合物 3 分钟。
- 通过将 0.5 g 柠檬酸溶解在超纯水中至最终体积为 50 mL 来制备 50 mL 的 1% 柠檬酸溶液。
- 用注射器以大约 4 mL/min 的流速将 7 mL 1% 柠檬酸滴加到混合物中。
- 继续搅拌混合物 10 分钟,此时棕色透明溶液将转变为亚微米颗粒的混浊浅棕色悬浮液。
- 将悬浮液转移到试管中,并在10°C的超速离心机中以15,000× g 离心30分钟。
- 收集上清液进行进一步分析,并用超纯水冲洗微粒。
- 重复冲洗/超速离心程序 3 次。
- 在超声波均质化之前,将装有微粒的容器浸入冰浴中。
- 在超声均质器中以96%的强度超声均质化微粒两个周期,每个周期4分钟。
- 第一个循环后冷却容器 1 分钟。
- 在冷冻干燥机中在-64°C的温度下冻干微粒,并将它们储存在蒸馏器中以备进一步使用。
3. 天然黄酮包封木质素微/亚微米颗粒的合成
- 对微粒重复步骤1.1-1.5。
- 称取 0.08 g 桑林,将其溶解在 1 mL EtOH 中,然后将该乙醇溶液加入混合物中。
- 在磁力搅拌器上以 500 rpm 的速度搅拌混合物 20 分钟。
- 用注射器以约 150 μL/s 的流速向混合物中滴加 20 mL 2 N HNO3 。
- 继续搅拌混合物 60 分钟。
- 重复步骤 1.8-1.13。
- 对亚微米颗粒重复步骤 2.1。
- 称量 0.04 g 槲皮素,将其溶解在 1 mL EtOH 中,并将该乙醇溶液加入碱木质素水溶液中。
- 在磁力搅拌器上以 500 rpm 的速度搅拌混合物 10 分钟。
- 重复步骤 2.4-2.13。
4. 木质素微粒/超微粒包封效率的测定
- 计算在合成两种类型的类黄酮包封木质素颗粒的过程中添加的生物活性物质的含量。
- 用分光光度法测定在用96%EtOH稀释后在步骤1.9和2.8中获得的上清液中类黄酮的吸收。
- 使用黄酮类化合物的校准曲线计算未包埋的桑素/槲皮素的浓度。
- 使用公式(1)计算木质素微粒对天然黄酮类化合物的包封效率(EE,%):
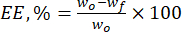 (一)
(一)
其中 wo 是添加的生物活性物质的总量 (mg),wf 是游离非包埋类黄酮的量 (mg)。 - 使用方程(2)计算载药量(DLC,%)-表示载体系统每单位重量颗粒中药物量的重要参数:
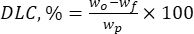 (二)
(二)
其中 wp 是冻干后获得的木质素微米/亚微米颗粒的总量(产量)(mg)。
5. 木质素微米和亚微米颗粒的表征
- 颗粒数量、粒径和粒径分布的测定
- 使用带有微珠计数选项的自动池计数器评估样品的粒径和粒径分布。用微量移液管加入 1 μL 木质素/类黄酮微/亚微米颗粒悬浮液,在超纯水中加入操作所需的计数载玻片孔中。
- 等待 1 mL 悬浮液中的颗粒数量,以及它们的数量和按大小划分的分布显示在自动细胞计数仪的显示屏中。
注意: 该设备允许将数据存储在 USB 闪存上。自动细胞计数仪专用软件允许进一步处理保存的数字和照片文件。
- 通过电位滴定法测定木质素颗粒表面酸性/碱性基团的含量
- 重量 0.04 g 未负载/类黄酮包封的木质素颗粒。
- 将它们转移到锥形瓶中,加入 10 mL 0.1 M HCl,并将烧瓶以 250 rpm 的速度放在磁力搅拌器上。
- 用 0.1 M 滴定剂 NaOH 的标准溶液填充 50 mL 滴定管。
- 在开始滴定之前,用台式 pH 计测量锥形瓶中溶液的初始 pH 值。
- 开始滴定,并在每添加 0.5 mL 滴定剂部分后测量分析溶液的 pH 值。
- 将实验数据存储在包含所应用滴定剂体积和相应 pH 值的表格中。
- 当通过增加滴定剂溶液的体积达到 pH 值的近似恒定值时,停止滴定。
- 将实验数据以零、一阶导数和二阶导数差分滴定曲线的形式绘制出来。
- 确定所用滴定剂的当量点和相应的当量体积。
- 使用公式(3)和(4)计算未负载和类黄酮负载木质素颗粒表面的酸性A,a和A,b碱性基团的含量:
 , mgeq/g (3)
, mgeq/g (3)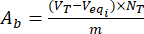 MGEQ/克 (4)
MGEQ/克 (4)
其中 Veqi 是当量体积 (mL);NT , 滴定剂的正态度(mgeqv/mL);VT ,用于测定程序的滴定剂体积 (mL);m 分析样品的重量 (g)。
- 通过固体添加法测定木质素基颗粒的pH零电荷点(pHPZC)。
- 制备 60 mL 0.1 M NaCl 水溶液。
- 在五个带塞的锥形瓶中的每一个中加入 9 mL 的 0.1 M NaCl 溶液,并将 pH 调节至 pHi = 2、4、7、10 和 12(其中 i = 1-5 表示相应溶液的数量),分别通过加入 0.1 M HCl 或 0.1 M NaOH。通过加入相同强度的NaCl溶液,将每个烧瓶中溶液的总体积精确地调节至10mL。
- 向每个烧瓶中加入 40 mg 干燥木质素颗粒(未加载的、类黄酮负载的微/亚微米),并牢固地盖住烧瓶。
- 将烧瓶直立固定在轨道振荡器上,并保持摇动24小时。
- 让平衡 30 分钟,然后测量每个烧瓶中上清液的最终 pH 值 (pHf)。
- 将 pHf 值与相应的初始 pH 值 (pHi) 作图。
- 零电荷点 (pHPZC) 定义为曲线 ΔpH 与 pHi 与直线相交的 pH 值 (pHi; pHi)。
- 木质素颗粒中总酚含量(TPC)的测定
注:微/亚微米木质素颗粒的总酚含量 (TPC) 是通过改进的 Folin-Ciocalteu 比色法测定的。- 将 200 μL 浓度为 500 μg/mL 的颗粒水悬浮液与 600 μL 超纯水和 200 μL Folin-Ciocalteu 试剂 (1:1, v/v) 混合。
- 5分钟后,向混合物中加入1.0mL 8%Na2CO3 和1.0mL Milli-Q水,并在40°C的黑暗中在间歇搅拌的水浴中孵育30分钟。
- 将悬浮液以 5,300 × g 离心 2 分钟。
- 准备一个不含颗粒的空白。
- 在 10 mm 石英比色皿中转移 3.5 mL 上清液,并在 UV/Vis 分光光度计上测量 760 nm 可见区域对空白的吸光度。
- 按照步骤5.3.1-5.3.5制备标准没食子酸的校准曲线;仅使用初始浓度为 10、20、30、40、50、60、70、80、90、100、150 和 200 μg/mL 的没食子酸乙醇溶液,而不是 200 μL 木质素颗粒悬浮液。
- 将微粒的实验数据表示为没食子酸当量的毫克数,单位为毫克/克干样品(mg GAE/g)。
- 使用公式 (5) 计算 TPC:
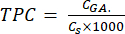 毫克GAE/克 (5)
毫克GAE/克 (5)
式中,CGA 是样品的浓度,相当于从酸的校准图中获得的标准没食子酸的浓度(μg GA/mL);Cs 是样品的浓度,等于干样品质量除以溶剂体积 (μg/mL)。
6.木质素颗粒体外释放能力的测定
- 通过将用0.1M HCl调节标准PBS溶液的pH至pH = 1.2,制备250mL模拟的无酶胃培养基。
- 通过用 0.1 M NaOH/0.1 M HCl 调节标准 PBS 溶液的 pH 值至 pH = 6.8 和 7.4,制备两种模拟肠液溶液中的每一种 250 mL。
- 在配有机械搅拌器的玻璃间歇反应器中,将 25 mg 类黄酮包封的微/亚微米颗粒加入 50 mL 模拟无酶胃培养基中,并将其置于恒定温度为 T = 37 ± 0.2 oC 的热水浴中。
- 将搅拌器浸入液体体积的 2/3 深度,以确保固相和液相完全混合,并确保最大的传质,而不会出现停滞区。
- 每 10 分钟至第 90 分钟从反应器中取出 1 mL 样品,并立即将 1 mL 新鲜模拟流体溶液移液到反应器中,以防止总体积变化并确保下沉条件。
- 重复相同的过程,包括步骤6.3-6.6,分别使用pH = 6.8和7.4的两种模拟肠液溶液,持续200分钟。
- 在三种模拟培养基中对未加载的木质素颗粒进行类似实验,并将样品用作空白,用于将分光光度计归零。
- 过滤样品并用96%EtOH稀释样品对步骤6.7的空白样品后,通过分光光度法测定样品的吸收,并使用在pH = 1.2,6.8和7.4下获得的桑林的相应校准曲线计算相应的类黄酮浓度。
- 使用公式(6)计算生物类黄酮的累积释放量(CR),单位为μg/mL,使用公式(7)计算累积释放百分比(CRP):
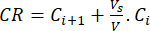 (6)
(6)
其中 Ci 和 Ci+1 是第 i 个 和第 (i+1) 个 样品中桑酸/槲皮素的浓度 (μg/mL);Vs 从间歇式反应器中取出的样品体积 (mL);V 模拟培养基的总体积 (mL)。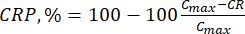 (7)
(7)
其中 Cmax 是载体中生物活性化合物的最大浓度 (μg/mL)。
7. 统计分析
- 将实验数据表示为三个独立测量值的均值±标准差 (SD)。
- 通过执行方差分析检验作为事后检验来确定实验结果的统计显着性。考虑 p 的值< 0.05 具有统计显著性。
结果
执行反溶剂沉淀技术以产生碱木质素微米/亚微米颗粒。将稀释的无机酸-硝酸/有机酸-柠檬酸水溶液分散到碱木质素水溶液中,并富集环保表面活性剂/乙醇,导致生物聚合物溶质逐渐沉淀,超声处理后,最终产生致密的微米/亚微米颗粒悬浮液(图1)。

讨论
用于设计基于生物聚合物的药物载体制剂的现代合成方法的主要关键问题之一是使用有害的有机试剂 - 挥发性和易燃溶剂,如四氢呋喃、丙酮、甲醇,甚至高浓度的DMSO - 由于可能具有毒性作用的表现,这限制了它们在生物医学、制药工业和食品技术中的适用性20, 21,22,23,24.?...
披露声明
作者没有要披露的利益冲突。
致谢
这项研究得到了保加利亚科学基金的支持,合同编号为 KΠ-06 H59/3,并得到了特拉基亚大学科学项目编号 07/2023 FVM 的支持。
材料
| Name | Company | Catalog Number | Comments |
| automatic-cell counter | EVE, NanoEnTek | ||
| Citric acid | Sigma | 251275 | ACS reagent, ≥99.5% |
| digital water bath | Memmert | ||
| Eppendorf tubes, 1.5-2 mL | |||
| Ethanol | Sigma | 34852-M | absolute, suitable for HPLC, ≥99.8% |
| Folin–Ciocalteu’s phenol reagent | Sigma | F9252 | |
| freeze dryer | Biobase | ||
| gallic acid | Sigma- | BCBW7577 | monohydrate |
| HCl | Sigma | 258148 | ACS reagent, 37% |
| HNO3 | Sigma | 438073 | ACS reagent, 70% |
| lignin, alkali | Sigma | 370959 | |
| morin | Sigma | PHL82601 | |
| NaCl | Sigma | S9888 | ACS reagent, ≥99.0% |
| Na2CO3 | Sigma | 223530 | powder, ≥99.5%, ACS reagent |
| NaOH | Sigma | 655104 | reagent grade, 97%, powder |
| orbital shaker | IKA | KS 130 basic | |
| pH-meter | Consort | ||
| phosphate-buffered saline (PBS) | Sigma | RNBH7571 | |
| Quercetin hydrate | Sigma | STBG3815V | |
| statistical software for Excel | Microsoft Corporation | XLSTAT Version 2022.4.5. | |
| Tween 80 | Sigma | P8074 | BioXtra, viscous liquid |
| ultracentrifuge | Hermle | Z 326 K | |
| Ultrapure water system | Adrona | INTEGRITY+ | |
| ultrasound homogenizer | Bandelin Sonopuls | HD 2070 | |
| UV/Vis spectrophotometer | Hach-Lange | DR 5000 |
参考文献
- Yu, X., et al. Lignin nanoparticles with high phenolic content as efficient antioxidant and sun-blocker for food and cosmetics. ACS Sustainable Chem. Eng. 11 (10), 4082-4092 (2023).
- Boarino, A., Klok, H. -. A. Opportunities and challenges for lignin valorization in food packaging, antimicrobial, and agricultural applications. Biomacromolecules. 24 (3), 1065-1077 (2023).
- Aadil, K., Barapatre, A., Jha, H. Synthesis and characterization of Acacia lignin-gelatin film for its possible application in food packaging. Bioresour. Bioprocess. 3 (27), 1-11 (2016).
- Sharma, S., et al. Valorization of lignin into nanoparticles and nanogel: characterization and application. Bioresour. Technol. Reports. 18, 101041 (2022).
- Zadeh, E. M., O'Keefe, S. F., Kim, Y. -. T. Utilization of lignin in biopolymeric packaging films. ACS Omega. 3 (7), 7388-7398 (2018).
- Beaucamp, A., et al. Lignin for energy applications - state of the art, life cycle, technoeconomic analysis and future trends (Critical Review). Green Chem. 24, 8193-8226 (2022).
- Antunes, F., et al. From sugarcane to skin: Lignin as a multifunctional ingredient for cosmetic application. Int J Biol Macromol. 234, 123592 (2023).
- Garg, J., et al. Applications of lignin nanoparticles for cancer drug delivery: An update. Materials Letters. 311, 131573 (2022).
- Anushikha, K. K. Lignin as a UV blocking, antioxidant, and antimicrobial agent for food packaging applications. Biomass Conv. Bioref. , 1-14 (2023).
- Freitas, F. M. C., et al. synthesis of lignin nano- and micro-particles: Physicochemical characterization, bioactive properties and cytotoxicity assessment. Int J Biol Macromol. 163, 1798-1809 (2020).
- Rismawati, R., Nurdin, I. A., Pradiptha, M. N., Maulidiyah, A., Mubarakati, N. J. Preparation and characterization of lignin nanoparticles from rice straw after biosynthesis using Lactobacillus bulgaricus. Journal of Physics: Conference Series. 9th International Seminar on New Paradigm and Innovation of Natural Sciences and its Application. 1524, 012070 (2020).
- Worku, L. A., et al. Synthesis of lignin nanoparticles from Oxytenanthera abyssinica by nanoprecipitation method followed by ultrasonication for the nanocomposite application. Journal of King Saud University - Science. 35 (7), 102793 (2023).
- Gala Morena, A., Tzanov, T. z. Antibacterial lignin-based nanoparticles and their use in composite materials. Nanoscale Adv. 4, 4447-4469 (2022).
- Ivanova, D., Nikolova, G., Karamalakova, Y., Marutsova, V., Yaneva, Z. Water-soluble alkali lignin as a natural radical scavenger and anticancer alternative. Int J Mol Sci. 24 (16), 12705 (2023).
- Ivanova, D., Toneva, M., Simeonov, E., Antov, G., Yaneva, Z. Newly synthesized lignin microparticles as bioinspired oral drug-delivery vehicles: Flavonoid-carrier potential and in vitro radical-scavenging activity. Pharmaceutics. 15 (4), 1067 (2023).
- Yaneva, Z., et al. Antimicrobial potential of conjugated lignin/morin/chitosan combinations as a function of system complexity. Antibiotics. 11, 650 (2022).
- Handral, H. K., Wyrobnik, T. A., Lam, A. T. -. L. Emerging trends in biodegradable microcarriers for therapeutic applications. Polymers. 15 (6), 1487 (2023).
- Figueiredo, P., Lintinen, K., Hirvonen, J. T., Kostiainen, M. A., Santos, H. A. Properties and chemical modifications of lignin: Towards lignin-based nanomaterials for biomedical applications. Prog. Mater. Sci. 93, 233-269 (2018).
- Tang, Q., et al. Lignin-based nanoparticles: a review on their preparations and applications. Polymers. 12 (11), 2471 (2020).
- Zhao, W., Simmons, B., Singh, S., Ragauskas, A., Cheng, G. From lignin association to nano-/micro-particle preparation: extracting higher value of lignin. Green Chemistry. 18 (21), 5693-5700 (2016).
- Stewart, H., Golding, M., Matia-Merino, L., Archer, R., Davies, C. Manufacture of lignin microparticles by anti-solvent precipitation: Effect of preparation temperature and presence of sodium dodecyl sulfate. Food Res Int. 66, 93-99 (2014).
- Beisl, S., Friedl, A., Miltner, A. Lignin from micro- to nanosize: Applications. Int. J. Mol. Sci. 18, 2367 (2017).
- Mishra, P. K., Ekielski, A. A simple method to synthesize lignin nanoparticles. Colloids Interfaces. 3, 52 (2019).
- Qian, Y., Deng, Y., Qiu, X., Li, H., Yang, D. Formation of uniform colloidal spheres from lignin, a renewable resource recovered from pulping spent liquor. Green Chem. 16, 2156-2163 (2014).
- Tardy, B. L., et al. Lignin nano- and microparticles as template for nanostructured materials: formation of hollow metal-phenolic capsules. Green Chem. 20, 1335-1344 (2018).
- Silva, M., et al. Paraquat-loaded alginate/chitosan nanoparticles: preparation, characterization and soil sorption studies. J Haz Mat. 190 (1-3), 366-374 (2011).
- Georgieva, N., Yaneva, Z. Comparative evaluation of natural and acid-modified layered mineral materials as rimifon-carriers using UV/VIS, FTIR, and equilibrium sorption study. Cogent Chem. 1 (1), 1-16 (2015).
- Zhang, P., Chen, D., Li, L., Sun, K. Charge reversal nano-systems for tumor therapy. J Nanobiotechnol. 20, 31 (2022).
- Yaneva, Z. L., Georgieva, N. V. Removal of diazo dye from the aqueous phase by biosorption onto ball-milled maize cob (BMMC) biomass of Zea mays. Maced. J. Chem. Chem. Eng. 32 (1), 133-149 (2013).
- Zatorska, M., et al. Drug-loading capacity of polylactide-based micro- and nanoparticles - Experimental and molecular modeling study. Int J Pharmaceutics. 591, 120031 (2020).
- Yaneva, Z., Georgieva, N., Grumezescu, A. M. Chapter 5 - Physicochemical and morphological characterization of pharmaceutical nanocarriers and mathematical modeling of drug encapsulation/release mass transfer processes. Nanoscale Fabrication, Optimization, Scale-Up and Biological Aspects of Pharmaceutical Nanotechnology. , 173-218 (2018).
- Yaneva, Z., Georgieva, N., Staleva, M. Development of d,l-α-tocopherol acetate/zeolite carrier system: equilibrium study. Monatshefte fur Chemie Chemical Monthly. 147 (7), 1167-1175 (2016).
- Yaneva, Z., Georgieva, N. Study on the physical chemistry, equilibrium, and kinetic mechanism of Azure A biosorption by Zea mays biomass. Journal of Dispersion Science and Technology. 35 (2), 193-204 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。