拟南芥和甘蓝型油菜的毛根转化与再生
摘要
该协议描述了使用 拟南芥 初级花序茎和 甘蓝型油菜 下胚轴的毛根诱导。毛茸茸的根可以培养并用作外植体来再生转基因植物。
摘要
毛根转化是各种物种植物生物技术的多功能工具。携带根诱导 (Ri) 质粒的农杆菌菌株感染在将 T-DNA 从 Ri 质粒转移到植物基因组后,诱导在受伤部位形成毛根。该方案详细描述了在芸苔型油菜DH12075和拟南芥Col-0中基于注射的毛根诱导程序。毛茸茸的根可用于分析感兴趣的转基因或加工用于产生转基因植物。含有细胞分裂素 6-苄氨基嘌呤 (5 mg/L) 和生长素 1-萘乙酸 (8 mg/L) 的再生培养基成功地在两个物种中引起芽的形成。该方案涵盖了再生体和 T1 植物的基因分型和选择,以获得携带目标转基因且不含 Ri 质粒的 T-DNA 的植物。还描述了导致复合材料工厂形成的替代过程。在这种情况下,毛根保留在枝条上(而不是天然根),这使得在整个植物的背景下研究毛根培养物中的转基因成为可能。
引言
植物转化是植物生物学中任何遗传研究的瓶颈。一种土源性细菌,根癌农杆菌,被广泛用作通过花浸或组织培养产生转化物的基因递送手段。根癌弧菌感染伤口部位的植物,由于肿瘤诱导 (Ti) 质粒的 T-DNA 转移和整合到宿主植物基因组中,从而引起肿瘤。具有不含野生型 T-DNA 的修饰 Ti 质粒和具有人工 T-DNA 的二元载体以及用于插入目的基因的克隆位点的工程化根癌根癌杆菌菌株通常用作高效的植物转化系统1。然而,许多模式物种和作物对花浸或体外植物再生不敏感,或者生长周期长,影响了这种转化系统的效率。
根瘤农杆菌在感染寄主植物后,在受伤部位诱导不定根或毛根的形成。与根癌根瘤曲霉类似,根瘤菌将 T-DNA 从根诱导 (Ri) 质粒转移到宿主植物基因组,导致转基因毛根的发育。该过程主要由根致癌位点 (rol) 基因 2,3 控制。使用携带 Ri 质粒和编码目标基因的人工二元载体的农细菌菌株,毛根培养物已被用于生产重组蛋白、分析启动子或基因的功能,或使用成簇规则间隔短回文重复序列 (CRISPR)/CRISPR 相关蛋白 9 (Cas9)4,5,6 编辑基因组。
我们的方案使用携带 Ri 质粒 pRiA4b的转偶联菌株 Ti-less Ti. tumefaciens C58C1 7。Ri 质粒的 T-DNA 由两个区域组成,分别是右 T-DNA 和左 T-DNA(TR-DNA 和 TL-DNA),它们可以独立整合到植物基因组中 8.利用该系统,优化了芸苔型油菜DH12075品种漫长的外植体转化过程9。下面详述的方案允许在大约1年内再生选定的毛茸茸的根系,并获得携带目标转基因且不含rol基因的T1植物。基于注射的毛根转化可用于其他十字花科物种,如转化拟南芥Col-0所示。 下胚轴用于转化甘蓝型油菜,而拟南芥则被注射到初级花序茎中。
研究方案
1. 培养基和溶液的制备
- 准备激素储备溶液。
- 为了制备浓度为 5 mg/mL 的 50 mL 1-萘乙酸 (NAA)、6-苄氨基嘌呤 (BAP) 和吲哚-3-丁酸 (IBA) 储备溶液,将 250 mg 粉末激素溶解在 2 mL 1 M 氢氧化钠 (NaOH) 中,并用超纯水调节体积至 50 mL。
- 要制备浓度为 1 mg/mL 的 50 mL 赤霉酸 (GA3),将 50 mg 粉末状激素溶解在 2 mL 乙醇中,并将体积调节至 50 mL 超纯水。
- 使用孔径为 0.22 μm 的无菌注射器过滤器过滤溶液,并将其分配到无菌 2 mL 管中进行储存。根据制造商的建议,将溶液储存在-20°C或4°C。
- 准备抗生素储备液。对于浓度为 100 mg/mL 的 50 mL 头孢噻肟和替卡西林二钠储备溶液,将 0.5 g 粉末状抗生素溶解在 40 mL 超纯水中,并调节至最终体积 50 mL。使用孔径为 0.22 μm 的无菌注射器过滤器过滤溶液,并将其分配到无菌 2 mL 管中进行储存。将溶液储存在-20°C。
注意:抗生素和激素始终添加到冷却的培养基中。 - 通过在 1 L 量筒中加入 10 g 杆菌胰蛋白胨、5 g 酵母提取物和 5 g 氯化钠 (NaCl) 来制备 1 L Luria 肉汤 (LB) 培养基,并用双蒸水调节体积至 1 L。使用 pH 计将 koh 的 pH 值调节至 7.0(按照制造商的说明进行操作)。将溶液转移到1L瓶中,如果制备了固体培养基,则加入15g细菌琼脂(1.5%)并高压灭菌培养基。如有必要,将适当的抗生素(细菌耐药性在二元载体上携带)添加到冷却的培养基中。
注意:使用高压灭菌器对溶液进行灭菌。将瓶子放入篮子中,盖上盖子,并在121°C和98.9kPa下灭菌20分钟。该协议始终用于后续步骤中的高压灭菌溶液。 - 将 5 g 牛肉提取物、1 g 酵母提取物、5 g 蛋白胨、5 g 蔗糖和 0.5 g 氯化镁 (MgCl2) 混合到双蒸水中,制备 1 L 酵母提取物牛肉 (YEB) 培养基。将体积调节至 1 L,将溶液转移到 1 L 瓶中。高压灭菌培养基。
- 将 2.2 g Murashige 和 Skoog (MS) 粉末、10 g 蔗糖 (1%) 和 0.5 g 2-(N-吗啉基)乙磺酸 (MES) 钠盐混合到双蒸水中,制备 1 L 种子萌发培养基。将体积调节至 1 L,混合,并用 KOH 将 pH 值调节至 5.8。将溶液转移到1L瓶中,加入8g植物琼脂(0.8%)。高压灭菌培养基。
- 将2.2g MS粉末,5g蔗糖(0.5%)和0.5gMES盐混合到双蒸水中,制备1L植物生长培养基。将体积调节至 1 L,混合,并用 KOH 将 pH 值调节至 5.8。将溶液转移到1L瓶中,加入8g植物琼脂(0.8%)。高压灭菌培养基。
- 将 4.4 g MS + B5 维生素粉、30 g 蔗糖 (3%) 和 0.5 g MES 盐混合到双蒸水中,制备 1 L 毛根生长培养基。将体积调节至 1 L,混合,用 KOH 将 pH 调节至 5.8,然后将溶液转移到 1 L 瓶中。加入3g胶凝剂(0.3%)并高压灭菌培养基。加入头孢噻肟和替卡西林二钠,终浓度分别为100-200mg/L和100-500mg/L。如有必要,添加适当的抗生素(耐药性是由于二元载体的T-DNA引起的)。
- 将2.2g MS + B5维生素粉、10g 蔗糖 (1%) 和 0.5 g MES 盐混合到双蒸水中,制备 1 L 复合植物生长培养基。将体积调节至 1 L,混合,用 KOH 将 pH 调节至 5.8,然后将溶液转移到 1 L 瓶中。加入6g胶凝剂(0.6%)并高压灭菌培养基。加入头孢噻肟和替卡西林二钠,终浓度分别为 200 mg/L 和 500 mg/L。如有必要,添加适当的抗生素(耐药性是由于二元载体的T-DNA引起的)。
- 将 4.4 g MS + B5 维生素粉、30 g 蔗糖 (3%) 和 0.5 g MES 盐混合到双蒸水中,制备 1 L 再生培养基。将体积调节至 1 L,混合,并用 KOH 将 pH 值调节至 5.8。将溶液转移到1L瓶中,加入3g胶凝剂(0.3%)。高压灭菌培养基。加入NAA和BAP的终浓度分别为8 mg/L和5 mg/L,替卡西林二钠的终浓度为100 mg/L。
- 将4.4g MS + B5维生素粉、20g 蔗糖(2%)和0.5g MES盐混合到双蒸水中,制备1L枝条伸长培养基。将体积调节至 1 L,混合,并用 KOH 将 pH 值调节至 5.8。将溶液转移到1L瓶中,加入3g植物琼脂(0.3%)。高压灭菌培养基。加入BAP和GA3 ,终浓度分别为0.5 mg/L和0.03 mg/L,头孢噻肟终浓度为100 mg/L。
- 将 2.2 g MS + B5 维生素粉、10 g 蔗糖 (1%) 和 0.5 g MES 盐混合到双蒸水中,制备 1 L 根诱导培养基。将体积调节至 1 L,混合,并用 KOH 将 pH 值调节至 5.8。将溶液转移到1L瓶中,加入3g胶凝剂(0.3%)。高压灭菌培养基。加入IBA和头孢噻肟,终浓度分别为0.5 mg/L和100 mg/L。
- 通过加入 20 g CTAB(2% w/v 最终)、100 mL pH 8.0(100 mM 最终)、40 mL 0.5 M EDTA(pH 8.0(20 mM 最终)、81.8 g NaCl(1.4 M 最终)和 5 g PVP40(0.5% w/v 最终)来制备 1 L 十六烷基三甲基溴化铵 (CTAB) 缓冲液。用双蒸水调节至 1 升。高压灭菌溶液。将溶液在室温下储存长达 1 年。
2. 用二元载体转化农杆菌
- 制备含有T-DNA盒的经过验证的二元质粒的DNA,以整合到植物基因组中。确保质粒DNA含有低盐,以避免在使用电穿孔时产生电火花。建议使用首选的质粒 DNA 提取试剂盒。
- 通过接种 200 mL 预热 (28 °C) YEB 的液体和 8 mL 新鲜过夜培养物,制备含有毛根诱导质粒 pRiA4b 的电感受态根癌农杆菌 C58C1 细胞。在28°C下孵育培养物,同时振荡至600nm处的光密度(OD600)约为0.5,对应于中对数阶段。大约需要 4 - 5 小时。
- 将 农杆菌 培养物分成四个预冷无菌 50 mL 离心管。在4°C下以3,200× g离心15分钟。
注意:从此步骤开始,细胞应保持低温。 - 除去上清液,将沉淀轻轻重悬于(4x)2.5mL冷(4°C)10%甘油中。再加入 47.5 mL 冷 10% 甘油并轻轻混合。
- 在4°C下以3,200× g 沉淀细胞15分钟。 弃去上清液并将细胞重悬于(4x)10 mL冷的10%甘油中。
- 再次沉淀细胞并将其重悬于 (4x) 0.75 mL 冷 10% 甘油中。将所有四个试管的内容物合并为一个(总体积 = 3 mL)。
- 将农杆菌溶液分成预冷无菌 1.5 mL 微管中的 50 μL 等分试样。将等分试样冷冻在干冰或液氮上。将试管储存在-80°C以备将来使用。
- 将一管感受态细胞(50μL)放在冰上,与5μL质粒DNA(总共1μg,来自步骤2.1)混合,将混合物转移到电穿孔比色皿(0.2cm间隙)中,并在冰上孵育5分钟。
- 将比色皿放入电穿孔器中,并使用以下设置对电池进行电穿孔:电容 25 μFD,电阻 400 Ω,电压 2.5 kV,脉冲持续时间 9.7 ms。
- 向细胞中加入950μLLB液体培养基,然后在28°C下以300rpm在热混合器中培养2小时。将 50 μL 细胞培养物铺在含有适当选择性抗生素的固体 LB 培养基上。将平板在28°C下培养2天。
注意:建议每块板铺板一系列细胞培养物(10 μL - 100 μL),以确定适当的培养体积并避免细菌过度生长。 - 在含有抗生素的 5 mL LB 液体培养基中制备来自几个选定菌落的液体培养物。在28°C下摇动细菌过夜。通过混合 0.5 mL 液体细菌培养物和 0.5 mL 40% 甘油,将这些培养物用于甘油储备。
注意:这些菌落通过菌落PCR验证是否存在转基因。为此,将少量来自平板的菌落添加到含有缓冲液、dNTP 和所选 Taq 聚合酶的 PCR 预混液中,以及从二元载体扩增部分 T-DNA 的引物。来自甘油储备的接种物用于植物的转化。
3. 甘蓝型油菜 的毛根转化DH12075
- 将 芸苔型油菜 DH12075的种子放入微管中,并在流箱中消毒。首先,用水和 0.1% 的洗涤剂对种子进行脱脂,同时摇晃 60 秒。然后,用水冲洗种子,然后用70%乙醇冲洗,均为60秒。
- 使用含有次氯酸钠的10%商业漂白剂溶液对种子进行灭菌。在该溶液中摇晃种子20分钟。
- 用无菌水洗涤种子 4 次,每次 60 秒。将它们放在含有种子萌发培养基的培养皿上。将种子在4°C下冷分层过夜,并将平板移至培养室(21°C,16小时光照/8小时黑暗)。
- 将 5 天龄的幼苗转移到装有植物生长培养基的植物培养箱中。
注:18日龄幼苗的转化效率最佳,DH12075。幼苗年龄可以针对当地生长条件或其他品种进行优化。 - 接种带有毛状根诱导质粒pRiA4b的根癌农杆菌C58C1的液体培养物和用于转化的二元载体(从步骤2.11开始)与接种环。使用 5 mL LB 培养基。将该培养物在28°C下培养过夜,直至达到OD600 = 0.9 - 1。
注意:如果产生野生型毛根,则使用仅含有 Ri 质粒的农杆菌。 - 用胰岛素注射器将少量培养物(约50μL)注射到18日龄幼苗的下胚轴中(从步骤3.4开始)。用安装在注射器上的26G针刺穿下胚轴,该针头位于培养基表面上方约1cm处。将液体注入伤口。下胚轴表面的组织也可以被注射器划伤。
注意:接种幼苗的数量必须根据实验者的需要进行调整。 - 将植物送回21°C的栽培室2至4周,直到在受伤部位形成愈伤组织和毛根。
- 从下胚轴上切下带有毛根的愈伤组织,并将其置于含有选择性抗生素(由T-DNA携带)和头孢噻肟(200mg / L)和替卡西林(500mg / L)的毛根生长培养基的培养皿上,以抑制农杆菌的生长。用透气胶带密封培养皿。在黑暗中在24°C下培养毛茸茸的根。
注意:用于功能选择的特定抗生素的适当浓度必须用野生型毛根进行测试。对于对卡那霉素具有抗性的油 菜 DH12075毛根,使用浓度为25mg/L的卡那霉素。
注意:在此步骤中,可以生成由野生型芽和转基因毛根组成的复合植物,以支持这种植物的生长。不是从茎上切断毛茸茸的根,而是去除植物的原生根。将具有新生毛根的植物转移到含有头孢噻肟(200mg / L)和替卡西林(500mg / L)的复合植物生长培养基的植物培养箱中,以抑制农杆菌的生长,以及选择性抗生素(由T-DNA携带)。 - 1-2周后,将培养皿上的毛根从愈伤组织中分离出来,并在具有相同培养基的平板上个体化它们。每 4 至 5 周将培养物转移到新鲜板中。添加 0.25 mg/L IBA 以增加根分枝。
- 每次转移时,将头孢噻肟和替卡西林的浓度逐渐降低100 mg/L(即,第一次转移的培养基含有100 mg/L头孢噻肟和400 mg/L替卡西林;第二次转移时,300 mg/L替卡西林等)。3-4个月后,用100mg / L替卡西林和选择性抗生素在毛根生长培养基上培养毛根。
4. 芸苔型油菜DH12075毛根的再生
- 在无菌条件下,使用镊子将独立的毛根系转移到具有再生培养基的平板上,使用前将其燃烧。每个培养皿转移5-10根,并在21°C下在长日光周期(16小时光照/ 8小时黑暗)中培养它们。用透气胶带密封培养皿。
- 每 3 至 4 周,将毛茸茸的根转移到装有新鲜再生培养基的平板上。请注意,愈伤组织是在大约 2 周后形成的。愈伤组织在2周后开始发芽,直到愈伤组织形成后8-9周。
- 将枝条个性化,并将其转移到装有枝条伸长培养基的植物培养箱中 2 至 3 周,以促进枝条的伸长。
- 将细长的枝条转移到带有根诱导培养基的植物培养箱中。每 3 - 4 周更新一次培养物。DH12075在30天时生根效率为87%,60天后高达100%。
- 去除任何胶凝剂后,将生根植物转移到土壤中,以防止真菌感染。确保植物首先在植物加速器(21°C,长日照周期,150μE)中适应,然后将它们转移到温室开花(21°C / 18°C,长日照周期,150μE)。
5. 再生剂和T1植物的选择
注意:在进入再生过程之前,可以选择毛茸茸的根系。选择的类型取决于转基因携带的内容。可以对毛根进行采样进行DNA提取和基因分型或突变检测,RNA提取并随后进行cDNA合成和RT-qPCR以分析所选基因的表达水平,显微镜检查用于荧光检测,或进行GUS染色处理。
- 转移到土壤后,再次对 T0 再生植物(和 T1 幼苗)进行基因分型,以避免从选择程序中逃脱。T0 植物表现出一种称为 Ri 表型的改变表型:广泛的根生长、卷曲的叶子和矮小的枝条,这是由于插入植物基因组的 Ri 质粒的 TL 和/或 TR-DNA 的存在引起的。
- 为了加快 T1 选择,使用含有绿色成熟胚胎的种子(授DH12075粉后约 21 - 28 天,鱼雷胚胎或更早)来自 T0 再生植物进行胚胎拯救。
- 在无菌流箱中工作。收集硅状物并用70%乙醇对其进行表面灭菌。
- 将它们放在贴在板盖或载玻片上的双面胶带上。
- 使用立体双筒望远镜,用 26G 针沿瓣膜边缘切开 silique。确保切口不会损坏种子。为了便于抓握,将针头安装在 1 mL 注射器上。
- 打开心皮并将它们粘在胶带上。收集未成熟的种子并将它们转移到装有培养基的培养基中进行种子发芽。用透气胶带密封板。
- 将平板置于培养室(21°C,16小时光照/8小时黑暗)中直至发芽。
- 对 T1 幼苗进行基因分型,以确定是否存在目的转基因和 Ri TR/TL(图 1)。收集叶子材料并使用选择的方法提取其DNA。CTAB 方法如下所述:
- 将叶片材料收集到含有两个陶瓷珠的 2 mL 微管中。将试管冷冻在液氮中。
- 使用球磨机研磨材料。或者,可以使用研杵和研钵。
- 快速旋转后,向粉末中加入 400 μL CTAB 缓冲液。短暂涡旋,向下旋转,并在60°C下孵育至少50分钟。
- 将溶液冷却至室温15分钟。加入一体积的氯仿,轻轻混合。
注意: 使用氯仿时,请在化学流动下工作并戴手套进行保护。任何含有氯仿的溶液都应丢弃在适当的垃圾箱中。 - 使用台式离心机以18,400× g 离心5分钟。将 250 - 350 μL 上层水相转移到新的微管中。省略间期。
- 加入一体积的异丙醇,混合均匀,在室温下孵育5分钟。以18,400× g离心40分钟。
- 弃去液体并加入 200 μL 70% 乙醇。洗涤沉淀并以18,400× g离心15分钟。
- 丢弃液体。风干沉淀并加入 50 - 100 μL 超纯水。让DNA在冰箱中溶解1小时过夜。
- 通过PCR对 rolA 基因(TL), aux1 基因(TR)和 virC 基因座(农杆菌)进行基因分型。根据制造商的方案,使用制备的DNA(来自步骤5.3),引物,缓冲液,dNTP和Taq聚合酶制备PCR反应。扩增的片段长 200 - 500 bp。
rolA特异性引物:
前锋: GTTAGGCGTGCAAAGGCCAAG
反转:TGCGTATTAATCCCGTAGGTC
aux1 特异性引物:
前锋: CATAGGATCGCCTCACAGGT
反转:CGTTGCTTGATGTCAGGAGA
对 virC 具有特异性的引物:
转发: AATGCGTCTCTCTCGTGCAT
反转:AAACCGACCACTAACGCGAT
注意:T-DNA转移和整合可能是部分的,只有部分TL和/或TR可以整合到基因组中。因此,建议分析 T1 幼苗中 TL(例如 rolB 和 rolC)和 TR(aux2、 mas1、 ags1)的其他 ORF 的存在。Jedličková 等人 9 中列出了这些位点特异性的引物序列。 - 通过凝胶电泳评估PCR反应。
注意:建议在此分析中包括阳性对照,以确保具有PCR级DNA。 - 根据基于该转基因内容的方案选择转基因的存在(或不存在)。
- 将选定的幼苗转移到土壤中。
6. 拟南芥Col-0的毛根转化与再生
- 使用选择的方法(漂白剂、乙醇或氯气)对 拟南芥 种子进行表面灭菌。
- 将无菌种子铺在培养基上进行种子发芽。冷分层2天后,将平板移至培养室(21°C,长日照周期和50%湿度)。
- 将1周龄的幼苗转移到装有植物生长培养基的植物培养箱中。
- 如步骤3.5所示制备 农杆菌 培养物。
- 用安装在胰岛素注射器上的针头注射少量培养物(约50μL)在1个月龄 拟南芥 小植株的初级花序茎(莲座上方约1-2cm)的基部。主茎表面的组织也可以被注射器划伤。
- 注射后2-4周,切除新生的毛根,用补充有选择性抗生素(由T-DNA携带)和头孢噻肟(200mg / L)和替卡西林(500mg / L)的毛根生长培养基在培养皿上培养,以抑制农杆菌生长。在黑暗中在24°C孵育板。
- 1-2周后,用相同的培养基在平板上个体化毛根。每 4-5 周将选定的毛根系转移到新鲜培养基中。
注意: 拟南芥 毛根比 甘油菜 的根细,转移到新鲜培养基时必须小心。 - 将毛茸茸的根转移到装有再生培养基的平板上以诱导愈伤组织形成。在21°C下培养平板,在长日光周期(16小时光照/ 8小时黑暗)中培养板。
- 栽培18-21天后,嫩芽从愈伤组织中出现。剪下枝条并将其转移到枝条伸长培养基中2-3周,以促进生长和伸长。
- 将细长的枝条转移到根诱导培养基上。
- 将生根植物转移到土壤中。T0 植物也呈现 Ri 表型。进行转基因选择,如油 DH12075型油菜( 步骤5)所述。
代表性结果
我们之前在三个 芸苔型油菜品种(即 DH12075、Topas DH4079 和 Westar9)中优化了基于注射的毛根诱导方案。为了将这种转化方案应用于模式物种 拟南芥,将1个月大的植株的初级花序茎注射农杆菌接种物。2-4周后,注射部位出现毛茸茸的根。毛根被切除并在固体培养基上培养。 图1描述了这两个物种的方法比较。
将选定的毛根系转移到再生培养基中以诱导枝条形成。在拟南芥中,所有10个测试的毛根系在14天内诱导了黄色愈伤组织。在转移到再生培养基后 3 周内,可以看到深绿色斑点的第一个芽原基(图 2)。培养 4 周后,枝条覆盖 10 个毛根系中的 9 个毛根(再生效率 90%)。在某些情况下,从愈伤组织中引出不定根(图2H)。即使在再生培养基上 3 个月后,一条线也没有再生(每 4 周将毛根转移到新鲜培养基中)。因此,拟南芥毛根的再生效率与DH120759的甘油菜的再生效率相似。
甘油菜和拟南芥的毛根再生物显示出矮化表型(图3),这是毛根衍生植物的典型特征2。我们还观察到密集的根系、皱纹的叶子和开花时间的变化。这种所谓的毛根(或 Ri)表型是由插入植物基因组的 Ri 质粒的 rol 基因引起的。Ri T-DNA的插入和二元载体上编码的转基因可以是独立的,也可以是相连的。因此,对自花授粉产生的 T1 后代进行分离分析有助于识别表达目的转基因的无 rol 植物。T1 植物的基因分型通过对 TL 和 TR 的 ORF 以及目标转基因具有特异性的 PCR 引物进行。通过缺少virC引物的PCR产物来验证没有农杆菌污染(图1)。
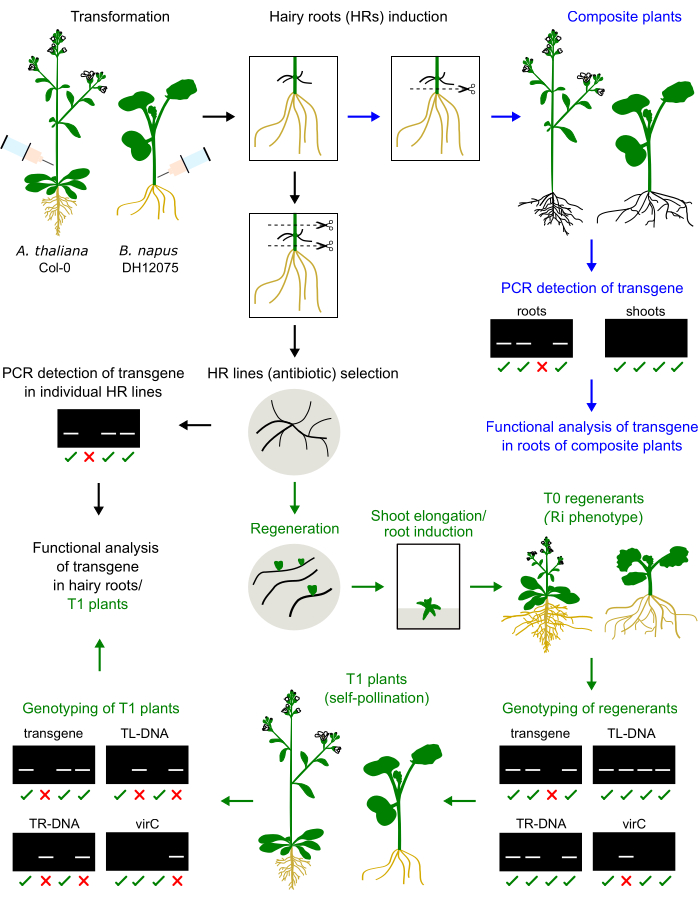
图 1: 拟南芥 和 甘油菜的程序摘要。 在下胚轴或初级花序茎中注射 农杆菌 接种物可诱导毛根的发育。毛茸茸的根可以取代原生根,产生复合植物,该植物将被基因分型和分析(蓝色箭头)。培养的毛根可以再生成 T0 植物,在 T1 植物中繁殖,并进行基因分型(绿色箭头)。毛茸茸的根也可以进行传代培养以进行功能分析(黑色箭头)。给出了基因分型结果的示例。 请点击这里查看此图的较大版本.
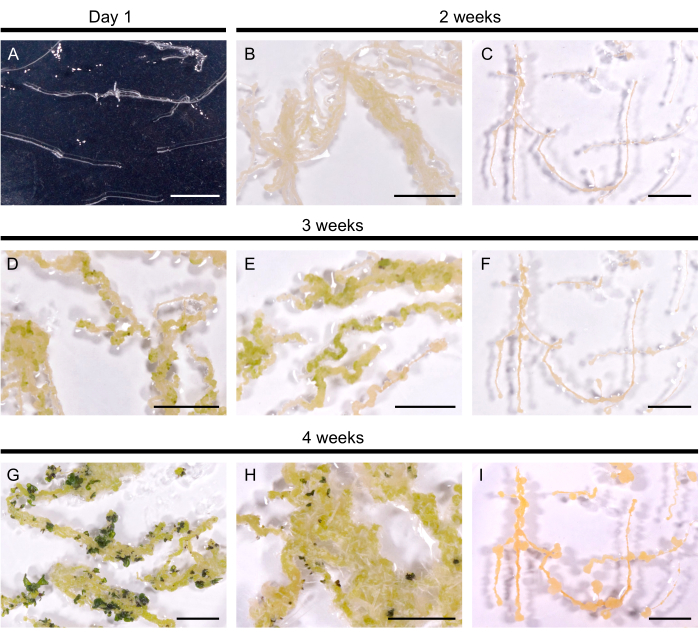
图2: 拟南芥毛根的再生。 (A)毛根培养1天后转移到平板上。(乙、丙)愈伤组织在再生培养基上培养后 2 周内发育。(D、E)芽原基在培养 3 周后出现。(G、H)4周后形成枝条。(H) 从愈伤组织发育而来的不定根。(C、F、I)不可再生的毛茸茸的根系。比例尺代表 1 厘米。 请点击这里查看此图的较大版本.

图3: 甘油菜 和 拟南芥 野生型植物和毛根衍生再生物(T0植物)的代表性照片。 注意再生物的 Ri 表型。比例尺代表 2 厘米。 请点击这里查看此图的较大版本.
讨论
我们开发了一种简单的方案,用于甘油菜和拟南芥的毛根转化和随后的再生。该过程包括在下胚轴(甘油菜)或初级花序茎(拟南芥)中基于注射的毛根诱导。除了本研究中介绍的十字花科成员外,用携带 Ri 质粒的农杆菌菌株 C58C1 注射下胚轴的方法在豆科10,11 中也有效。
基于注射的方法的替代方案是基于浸泡的转化,包括将外植体浸泡在细菌悬浮液中,然后将外植体与农杆菌共培养。与浸泡法相比,基于注射的方法的优点是由于没有一些协议步骤而节省了时间:外植体制备、共培养时间测试以及在含有激素的培养基上培养以诱导毛根。尽管这两种方法对毛根诱导都有效,但与外植体浸泡法相比,使用基于注射的方法在某些物种中观察到更高的转化效率12,13。此外,基于注射的转化也可用于生成复合植物(转基因毛根和野生型芽)。在切断转化植物的原始根后,毛根支持植物生长,并且可以在整个植物的背景下研究转基因。
毛根诱导的关键步骤是将接种物注射到下胚轴或初级花序茎中。 甘油菜 的下胚轴是易碎的,很容易切断整个下胚轴。由于花序茎薄,在 拟南芥 中也可以观察到同样的情况。如果需要比较不同物种/栽培品种的转化效率,我们建议一个人进行所有实验,以避免因操作和注射植物的技巧而造成的错误。
我们开发了一种有效的油菜DH12075和拟南菜Col-0的毛根再生方案。由于再生是一个高度可变的过程,因此可以对所选物种或栽培品种进行一些方案修改。例如,毛茸茸的根衍生芽可以通过不同的生长素/细胞分裂素比例 (1:1) 在 B. oleracea14 中引起。或者,可以使用细胞分裂素噻二氮隆代替BAP,例如在B. campestris毛根15的情况下。
Ri质粒T-DNA多次插入植物基因组代表了毛根转化和再生系统的潜在限制。在这种情况下,在对 T1 幼苗进行分离分析后,未发现不含 Ri 质粒中 TL/TR 的植物。因此,我们建议为每个转基因生成几个独立的毛根系。
毛根培养物是基因功能研究的极其强大的工具,主要是因为它们的快速建立和廉价的维护(培养基中不需要激素)。该协议涵盖了 甘油菜 和 拟南芥的毛根诱导和再生方法,可用于直接在毛根培养物中研究感兴趣的转基因,在使用复合植物的整个植物的背景下,或在转基因植物的再生之后。
披露声明
作者声明,该研究是在没有任何商业或财务关系的情况下进行的,这些关系可能被解释为潜在的利益冲突。
致谢
我们感谢 Jiří Macas(捷克共和国捷克布杰约维采 CAS 生物中心)提供农杆菌菌株。CEITEC MU的核心设施植物科学因其技术支持而受到认可。这项工作得到了捷克共和国教育、青年和体育部的支持,欧洲区域发展基金项目“SINGING PLANT”(编号。CZ.02.1.01/0.0/0.0/16_026/0008446)和INTER-COST项目LTC20004。
材料
| Name | Company | Catalog Number | Comments |
| 1.50 mL tubes | Eppendorf | 125.215 | |
| 10% solution of commercial bleach | SAVO | ||
| 1-naphthaleneacetic acid (NAA) | Duchefa | N0903 | Callus regeneration medium |
| 2.0 mL tubes | Eppendorf | 108.132/108.078 | |
| 3M micropore tape | Micropore | ||
| 6-Benzylaminopurine (BAP) | Duchefa | B0904 | Callus regeneration medium, Shoot elongation medium |
| 70% ethanol | |||
| bacteriological agar | HiMedia | RM201 | LB medium |
| Bacteriological peptone | Oxoid | LP0037 | LB and YEB media |
| Beef extract | Roth | X975.1 | YEB medium |
| Bottles | DURAN | L300025 | |
| Cefotaxime sodium | Duchefa | C0111 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| chloroform | Serva | 3955301 | |
| CTAB Hexadecyltrimethylammonium bromide | Sigma | 52365 | |
| dNTP mix | Thermo Fisher Scientific | R0193 | |
| EDTA - Titriplex III, (Ethylenendinitrilo)tetraacetic Acid, Disodium Salt, Dihydrate | Sigma | ES134-250G | |
| elctroporation cuvette | |||
| electrophesis agar, peqGOLD universal | VWR | 732-2789 | |
| electrophoresis chamber | BIO-RAD | ||
| electrophoresis gel reader | BIO-RAD | ||
| electroporator GenePulser Xcell | BIO-RAD | ||
| ethidium bromide | AppliChem | ||
| Gene Pulser/MicroPulser electroporation cuvettes, 0.2 cm gap | BIO-RAD | 1652082 | |
| Gene Ruler DNA ladder mix | Thermo Fisher Scientific | SM0331 | |
| Gibberellic acid (GA3) | Duchefa | G0907 | Shoot elongation medium |
| glycerol | Sigma | G5516-1L | |
| HEPES (2-(4-(2-hydroxyethyl)-1-pirerazinyl)-ethansulfonique | Merck | 1101100250 | |
| indole-3-butyric acid (IBA) | Duchefa | I0902 | Root induction medium |
| kanamycin monosulfate | Duchefa | K0126 | |
| Magenta GA-7 Plant Culture Box w/ Lid | Plant Media | V8505-100 | |
| Measuring cylinder | |||
| MES monohydrate | Duchefa | M1503 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) | Duchefa | M0237 | Medium for germination, Plant growing medium |
| Murashige and Skoog medium (MS) + B5 vitamins | Duchefa | M0231 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium |
| needle Agani 26G x 1/2 - 0.45 x 13mm | Terumo | ||
| pH meter | |||
| Phytagel | Sigma | P8169 | Callus regeneration medium, Root induction medium, Medium for germination |
| PVP 40 (polyvinylpyrolidone Mr 40000) | Sigma | 9003-39-8 | |
| Redtaq DNA Polymerase,Taq for routine PCR with inert dye, 10X buffer included | Sigma | D4309-250UN | |
| Retsh mill | Qiagen | ||
| sodium chloride | Lachner | 30093-APO | LB medium |
| square Petri Dishes | Corning | GOSSBP124-05 | |
| sucrose | Penta | 24970-31000 | Hairy root growing medium, Callus regeneration medium, Shoot elongation medium, Root induction medium, Medium for germination, Plant growing medium |
| Syringe filter | Carl Roth | P666.1 | Rotylabo syringe filters 0.22 µm pore size |
| thermomixer | Eppendorf | ||
| Ticarcillin disodium | Duchefa | T0180 | Hairy root growing medium |
| Tris(hydroxymethyl)aminomethan | Serva | 3719003 | |
| ultrapure water | Millipore Milli-Q purified water | ||
| Yeast extract | Duchefa | Y1333 | LB medium |
参考文献
- Lee, L. Y., Gelvin, S. B. T-DNA binary vectors and systems. Plant Physiology. 146 (2), 325-332 (2008).
- Christey, M. C. Use of Ri-mediated transformation for production of transgenic plants. In Vitro Cellular & Developmental Biology - Plant. 37 (6), 687-700 (2001).
- Gelvin, S. B. Agrobacterium-Mediated Plant Transformation: the Biology behind the “Gene-Jockeying” Tool. Microbiology and Molecular Biology Reviews. 67 (1), 16-37 (2003).
- Georgiev, M. I., Agostini, E., Ludwig-Müller, J., Xu, J. Genetically transformed roots: from plant disease to biotechnological resource. Trends in Biotechnology. 30 (10), 528-537 (2012).
- Gutierrez-Valdes, N., et al. Hairy root cultures—a versatile tool with multiple applications. Frontiers in Plant Science. 11, 33 (2020).
- Niazian, M., Belzile, F., Torkamaneh, D. CRISPR/Cas9 in planta hairy root transformation: a powerful platform for functional analysis of root traits in Soybean. Plants. 11 (8), 1044 (2022).
- Petit, A., et al. Further extension of the opine concept: plasmids in Agrobacterium rhizogenes cooperate for opine degradation. Molecular and General Genetics MGG. 190 (2), 204-214 (1983).
- Ozyigit, I. I., Dogan, I., Tarhan, E. A. Agrobacterium rhizogenes-mediated transformation and its biotechnological applications in crops. Crop improvement. , (2013).
- Jedličková, V., et al. Hairy root transformation system as a tool for CRISPR/Cas9-directed genome editing in oilseed rape (Brassica napus). Frontiers in Plant Science. 13, 919290 (2022).
- Steinbauerová, V., Neumann, P., Macas, J. Experimental evidence for splicing of intron-containing transcripts of plant LTR retrotransposon Ogre. Molecular Genetics and Genomics. 280 (5), 427-436 (2008).
- Neumann, P., et al. Centromeres off the hook: massive changes in centromere size and structure following duplication of CenH3 gene in Fabeae species. Molecular Biology and Evolution. 32 (7), 1862-1879 (2015).
- Montazeri, M., et al. A Comparative analysis of the hairy root induction methods in Hypericum perforatum. Journal of Plant Molecular Breeding. 7 (1), 67-76 (2019).
- Zhang, X., et al. Peat-based hairy root transformation using Rhizobium rhizogenes as a rapid and efficient tool for easily exploring potential genes related to root-knot nematode parasitism and host response. Plant Methods. 19 (1), 22 (2023).
- Christey, M. C., Sinclair, B. K. Regeneration of transgenic kale (Brassica oleracea var. acephala), rape (B. napus) and turnip (B. campestris var. rapifera) plants via Agrobacterium rhizogenes mediated transformation. Plant Science. 87 (2), 161-169 (1992).
- Christey, M. C., Sinclair, B. K., Braun, R. H., Wyke, L. Regeneration of transgenic vegetable brassicas (Brassica oleracea and B. campestris) via Ri-mediated transformation. Plant Cell Reports. 16 (9), 587-593 (1997).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。