通过多重双报告基因策略分析病毒颗粒上的表面蛋白表位
摘要
在这里,我们描述了一种新开发的多重荧光免疫测定法,它使用双报告流式细胞仪系统同时检测完整的严重急性呼吸系统冠状病毒 2 (SARS-CoV-2) 病毒颗粒上的两个独特的刺突蛋白表位,这些病毒颗粒已被血管紧张素转换酶 2 偶联磁性微球捕获。
摘要
包膜病毒上的膜蛋白在许多生物学功能中起着重要作用,包括病毒附着在靶细胞受体上、病毒颗粒与宿主细胞的融合、宿主-病毒相互作用和疾病发病机制。此外,病毒颗粒上和宿主细胞表面的病毒膜蛋白已被证明是抗病毒药物和疫苗的极好靶标。在这里,我们描述了一种使用双报告细胞术系统研究完整严重急性呼吸系统冠状病毒 2 (SARS-CoV-2) 颗粒表面蛋白的方案。该检测试剂盒利用多重技术,通过三个独立的亲和反应实现病毒颗粒的三重检测。使用与重组人血管紧张素转换酶 2 (ACE2) 偶联的磁珠从感染 SARS-CoV-2 的细胞上清液中捕获病毒颗粒。然后,同时应用两种用 R-藻红蛋白 (PE) 或 Brilliant Violet 421 (BV421) 标记的检测试剂。作为概念验证,使用了靶向 SARS-CoV-2 表面蛋白刺突 (S1) 不同表位的抗体片段。通过三个独立的亲和反应检测病毒颗粒具有很强的特异性,并确认捕获了完整的病毒颗粒。生成 SARS-CoV-2 感染细胞上清液的剂量依赖性曲线,重复系数方差 (mean/SD) ˂14%。在两个通道中的良好检测性能证实,两个病毒表面靶蛋白表位可同时检测到。此处描述的方案可应用于 (i) 包膜病毒上表达的表面蛋白的高多重、高通量分析;ii) 检测活性完整病毒颗粒;(iii) 评估抗体和抗病毒药物对病毒抗原表面表位的特异性和亲和力。该应用可以潜在地扩展到任何类型的细胞外囊泡和生物颗粒,暴露体液或其他液体基质中的表面抗原。
引言
最常见的致病病毒,如流感、HIV、人巨细胞病毒和 SARS-CoV 毒株,是包膜病毒。包膜病毒的细胞感染需要病毒和宿主细胞膜的融合,导致病毒基因组释放到细胞质中。然后病毒 RNA 将在被包装成新的病毒颗粒之前进行复制 1,2。在这些过程中,不仅病毒蛋白,而且宿主膜蛋白也可能被掺入包膜中,成为新病毒颗粒的组成部分。掺入病毒包膜的宿主细胞膜蛋白可能促进病毒进入新的宿主细胞,利用细胞间相互作用、归巢和免疫系统逃逸的机制 3,4。
尽管研究病毒相关蛋白很重要,但目前可用的大多数病毒分析技术 5 不支持病毒表面抗原的高通量和高多重表征。它们也无法检测单个病毒颗粒,也无法区分感染性完整病毒颗粒、非感染性 RNA、病毒蛋白和表达不同抗原的病毒亚群。最近,流式细胞术已被修改并适应为一种分析病毒颗粒的新方法,即流式病毒测定法。流式病毒检测允许研究单个病毒颗粒及其表面抗原。然而,包括低通量、低多重能力、复杂的实验设置和数据分析以及对小尺寸病毒颗粒的有限检测能力在内的局限性仍然存在 6,7。
基于微球的蛋白质和核酸多重定量是一项成熟的技术,应用范围广泛,包括体液中的蛋白质定量、蛋白质-蛋白质相互作用研究和病毒感染的诊断 8,9,10,11,12,13 .最近推出的流式分析仪器具有双报告基因通道,可在同一反应孔中测量两个荧光报告基因分子。这种新功能已被证明对于不同免疫球蛋白同种型的平行分析特别有用14。本文描述了如何使用双报告基因系统来检测完整的病毒颗粒,同时靶向多个表面抗原。
作为概念验证,本报告详细介绍了 SARS-CoV-2 病毒颗粒三重检测系统的开发。SARS-CoV-2 由四种主要蛋白质组成,一种是刺突蛋白 (S),由两个亚基组成。第一个亚基 S1 与人细胞膜中表达的 ACE2 进行初级结合。第二个亚基 S2 促进融合肽进入靶细胞,在靶细胞膜上形成一个孔,病毒粒子可以通过15 进入该孔。SARS-CoV-2 的其余三个组成部分是核衣壳 (N)、膜蛋白 (M) 和包膜蛋白 (E)。核衣壳通过与 RNA 形成核糖核蛋白结构来负责病毒基因组的包装,而膜和包膜蛋白在病毒组装中起着核心作用。
此处描述的检测试剂盒靶向 SARS-CoV-2 包膜表面表达的 S1 亚基的三个独立表位。使用 SARS-CoV-2 感染和未感染的细胞上清液的连续稀释液。通过与病毒上的 S1 亚基结合的 ACE2 偶联微球捕获病毒颗粒。然后,表面病毒 S 蛋白与市售的标记免疫球蛋白单链可变片段 (scFv) 和人单克隆抗 S1 抗体 (胡-anti-S1) 以及内部开发的 FLAG 标记 scFv 平行检测。胡 抗 S1 由橙色 R-藻红蛋白 (PE) 偶联的抗人 IgG-Fc 二抗的双报告系统中的第一通道 (RP1) 检测,scFv 由蓝色亮紫 421 (BV421) 偶联的抗 FLAG 二抗的第二通道 (RP2) 检测。病毒颗粒测定如图 1 所示。
研究方案
1. 中性亲和素和对照抗体与磁性微球的偶联
注:材料 表 中列出的具有不同荧光标记的荧光染色磁珠(直径为 6.5 μm 的聚苯乙烯微球,嵌入磁铁矿)用于生成以下珠子偶联物和对照:(1) 与中性亲和素接头偶联的珠子结合的生物素化重组人 ACE2;(2) 与中性亲和素接头偶联的珠子结合的生物素;(3) 山羊 IgG 直接与磁珠偶联;(4) 未偶联的珠子。要与磁珠偶联的蛋白质应不含叠氮化钠、牛血清白蛋白 (BSA)、甘氨酸、三(羟甲基)氨基甲烷 (Tris)、甘油或含胺添加剂。活化缓冲液为 0.1 M 磷酸二氢钠,无水 (NaH2, PO4),pH 6。2-吗啉代乙磺酸 (MES;50 mM) pH 值为 5 的缓冲液用于稀释偶联物。洗涤缓冲液为 PBS-T(1x PBS [磷酸盐缓冲盐水],pH 7.4 + 0.05 % (v/v) Tween-20)。储存缓冲液为 2.7 mg/mL ELISA 封闭试剂 (BRE) + 0.1% 抗生素(此处为 ProClin 300)。
- 从冰箱中取出磺基-N-羟基磺基琥珀酰亚胺 (NHS) 粉末,并从冰箱中取出 65 mg 预先等分的 1-乙基-3-[3-二甲基氨基丙基]碳二亚胺盐酸盐 (EDC),并使其达到室温 (RT; 18-22 °C) 30 分钟。在此步骤中,将 NHS 和 EDC 储存在含有二氧化硅珠的信封中,以防止大气水分水解。
- 准备用于活化和偶联的微球。
注:微球内的荧光染料对光敏感,不使用时,微球应保存在避光和冰箱温度 (4-8 °C) 下。- 根据产品信息表,通过短暂涡旋、超声处理或旋转(15 分钟,转速为 15-30 rpm),重悬 4 种不同的颜色 ID 编码微球储备液 (12.5 x 106/mL)(材料表)。
- 将 40 μL 每种微珠悬浮液(5 x 105 个微球)转移到半孔、平底、96 孔微量滴定板的指定孔中(材料表)。
- 清洗磁珠。
注:洗涤步骤可以手动执行,也可以使用自动洗板机执行。- 向磁珠中加入 80 μL/孔活化缓冲液,并将磁珠固定在磁板分离器上 30 秒。从微球中吸出上清液,同时将珠子固定在磁板分离器上。
- 从磁板分离器中取出微量滴定板,并将微珠重悬于 50 μL 活化缓冲液中。
- 用 Sulfo-NHS 和 EDC 激活珠子。
- 在 1.5 mL 微量离心管中的活化缓冲液中制备 50 mg/mL 的 Sulfo-NHS 工作溶液。将库存的 NHS 粉末放回冰箱 (4-8 °C),避免受潮。
- 在 1.5 mL 微量离心管中的活化缓冲液中制备 50 mg/mL 的 EDC 工作溶液。将预制的 65 mg 等分试样的 EDC 粉末溶解在 1.3 mL 活化缓冲液中。
注:Sulfo-NHS 和 EDC 在溶解后开始水解并失去活性。避免中断偶联过程,直到 NHS 和 EDC 添加到微珠中。不要保存溶解的 NHS 或 EDC 溶液以备后用。 - 通过体积混合 20% Sulfo-NHS 储备液 (50 mg/mL)、20% EDC 储备液 (50 mg/mL) 和 60% 活化缓冲液来制备用于磁珠活化的活化溶液。每个磁珠活化反应需要 50 μL 的活化液(使用 5 × 10个 5 个磁珠/反应),以及足够的额外体积以适应移液损失。
- 向每个含有洗涤珠子的孔中加入 50 μL 完全活化溶液。在活化缓冲液中预先存在的 50 μL 磁珠悬浮液体积下,每孔 Sulfo-NHS 的最终浓度为 5 mg/mL,EDC 的最终浓度也为 5 mg/mL。
- 用一次性粘性塑料或铝箔板密封剂密封微球反应板,并在室温 (18-22 °C) 下在轨道振荡器 (650 rpm) 上黑暗孵育 20 分钟。
- 从珠子上洗去多余的 Activation Solution。
- 将微量滴定板以 233 × g 离心 1 分钟。
- 将活化的珠子固定在磁板分离器上 30 秒。取下板密封剂,从磁固定的珠子中吸出上清液,微量滴定板仍位于磁性分离器上。
- 从磁性分离器中取出微量滴定板,向每个孔中加入 100 μL MES 缓冲液。
- 再重复步骤 1.4.2-1.4.3 一次,总共洗涤两次。
- 将中性亲和素和山羊 IgG(对照)偶联到适当的微珠组上。准备足够的中性亲和素和山羊 IgG 工作溶液,计划每 100 μL 反应和足够的额外溶液以适应移液损失,如下所示:
注:中性亲和素蛋白粉用超纯水复溶,然后用 PBS 稀释成 1 mg/mL 储备液,然后分装储存/使用(中性亲和素蛋白不直接溶于 PBS,但在水中可溶至 ~10 mg/mL)。- 在 1.5 mL 低蛋白结合微量离心管中的 MES 缓冲液中制备浓度为 125 μg/mL 的中性亲和素工作溶液。
- 在 MES 缓冲液中制备浓度为 17.5 μg/mL 的山羊 IgG 对照抗体工作溶液。
- 准备含有活化珠子的微量滴定板。将珠子固定在磁板分离器上 30 秒。在微量滴定板仍位于磁性分离器上的情况下,从磁固定的珠子中吸出上清液。
- 将 100 μL 中性亲和素工作溶液 (125 μg/mL) 添加到含有微珠的适当孔中(用于中性亲和素-生物素和中性亲和素-ACE2 偶联)。
- 将 100 μL 山羊 IgG 工作溶液 (17.5 μg/mL) 添加到含有指定为仅山羊 IgG 对照的珠子的孔中。
- 将 100 μL MES 缓冲液添加到指定为对照未偶联珠的孔中。
- 密封微量滴定板,并在 RT (18-22 °C) 下在轨道振荡器 (650 rpm) 上黑暗孵育 2 小时。孵育 1 小时后短暂涡旋板,以确保珠子保持悬浮状态。
- 用 PBS-T 洗涤珠子。
- 将微量滴定板以 233 × g 离心 1 分钟。
- 将耦合珠固定在磁板分离器上 30 秒。在微量滴定板仍位于磁性分离器上的情况下,从磁固定的珠子中吸出上清液。
- 从磁性分离器上取下微量滴定板。
- 向每个含有珠子的孔中加入 100 μL PBS-T。
- 重复洗涤步骤 1.6.2-1.6.4 一次,用 PBS-T 总共洗涤两次。
- 准备用于储存的偶联珠子。
- 将耦合珠固定在磁板分离器上 30 秒。在微量滴定板仍位于磁性分离器上的情况下,从磁固定的珠子中吸出上清液。从磁性分离器上取下微量滴定板。
- 向每个微球 ID 中加入 50 μL 储存缓冲液,以淬灭剩余的微珠活性。
- 将微量滴定板在冰箱温度 (4-8 °C) 下避光孵育过夜(16-22 小时)。
- 将未偶联和山羊 IgG 偶联的微珠悬浮液 (50 μL) 转移到适当标记的 1.5 mL 低蛋白结合微量离心管中,并结合孔的两次 100 μL 储存缓冲液冲洗,以确保磁珠回收率最高。
注:未偶联和山羊 IgG 偶联的微珠在最终体积为 250 μL 时均为 5 × 105 (即 2 × 103 个微珠/μL)。将微量离心管储存在冰箱温度 (4-8 °C) 直至使用。
- 将生物素化的 ACE2 和生物素结合到中性亲和素偶联的珠子上。
- 在 10 mM PBS 中制备 18 μg/mL ACE2 的重组人生物素化 ACE2 工作溶液。每个反应需要 100 μL。在 10 mM PBS 中制备 2.4 mg/mL 生物素的生物素工作溶液。每个反应需要 100 μL。
- 准备含有中性亲和素偶联微球的微量滴定板。
- 将微球固定在磁板分离器上 30 秒。在微量滴定板仍位于磁性分离器上的情况下,取下板密封剂并从磁固定的微球中吸出上清液。
- 从磁性分离器中取出微量滴定板,加入 50 μL 10 mM PBS/孔。
- 重复步骤 1.8.2.1-1.8.2.2 一次。
- 将 100 μL 生物素化-ACE2 工作溶液添加到含有中性亲和素偶联微球的适当孔中。将 100 μL 生物素工作溶液添加到含有中性亲和素偶联微球的适当孔中。
- 密封微量滴定板,并在 RT (18-22 °C) 下在轨道振荡器 (650 rpm) 上黑暗孵育 1 小时。
- 如步骤 1.6.1-1.6.5 中所述洗涤微球。
- 如步骤 1.7.1-1.7.4 所述,准备并储存 ACE 2 和生物素缀合的微球。
注:生物素化的 ACE2 和生物素偶联的微珠在最终体积为 250 μL时( 即 2 × 103 个微珠/μL),编号均为 5 × 10 5。
2. 偶联试验
- 通过混合第 1 节中创建的所有四种类型的微球(即中性亲和素偶联的生物素化 ACE2、中性亲和素偶联的生物素、山羊 IgG 偶联的和未偶联的)来制备微珠混合物。
注:将储备微球以 2 × 103 个微球/μL 的浓度储存,并混合,使工作微球混合物中的最终微球浓度为每组 40 个微球/μL。- 计算测试所需的工作微珠混合物的体积(5 μL/反应),允许额外的体积容纳移液损失。短暂涡旋每个试管,并将相等计算体积的每种珠子悬浮液混合在新的低蛋白结合微量离心管中。现在,磁珠浓度为每组 400 个磁珠/μL。
- 用储存缓冲液(每组 40 支/μL 工作浓度)将混合的微珠悬浮液再稀释 10 倍,以制备工作磁珠混合物。
注:首先制备少量工作磁珠混合物,以估计每个 ID 的微球数/μL。
- 将微球与山羊抗 ACE2 抗体一起孵育。
- 将 5 μL 工作磁珠混合物移液到平底半孔 96 孔微量滴定板的 3 个孔中。
- 将 50 μL 山羊抗 ACE2(0.4 μg/mL 在 PBS-T 中稀释,材料 表)添加到微量滴定板中含有珠子的 3 个孔中。密封微量滴定板,涡旋,并在 RT (18-22 °C) 下在轨道振荡器 (650 rpm) 上避光孵育 1 小时。
- 将微量滴定板以 233 × g 脉冲 1 分钟,并按照 1.6.2-1.6.4 中的说明用 PBS-T 洗涤微球 3 次。
- 用检测抗体孵育微球。
- 将 5 μL 工作磁珠混合物移液到微量滴定板的 6 个新孔中。
- 使用 PBS-T 作为稀释剂,在 3 个单独的 1.5 mL 试管中制备 1 μg/mL 每种工作检测混合物:抗山羊 IgG PE、抗小鼠 IgG PE 和抗兔 IgG PE。
- 将 50 μL 检测混合物添加到每个孔中的 3 个孔中,然后将抗山羊 IgG 添加到与步骤 2.2 中的抗 ACE2 相同的孔中。
- 密封、涡旋并在 RT (650-18 °C) 的轨道振荡器 (18 rpm) 上孵育 30 分钟。
- 以 233 × g 的速度脉冲板 1 分钟,并按照 1.6.2-1.6.4 中的说明用 PBS-T 洗涤微球 3 次。
- 加入 100 μL PBS-T 并在双报告流式分析仪器上使用以下设置运行:
模式:双报告器;超时:45 秒;DD 门控:7500-17500;最小微球计数:100 个微球/组(最低 QC 临界值:35 个微球/组)。
3. SARS-CoV-2 感染细胞上清液的产生
SARS-CoV-2 病毒在宿主 Vero E6 细胞(猴肾上皮细胞系;ATCC; 材料表)。将 Vero E6 细胞在 37°C、5% CO2 和 95% 相对湿度环境中在 Modified Eagles 培养基 (MEM) 中培养。每升 MEM 补充有 10 mL L-谷氨酰胺 (200 mM)、38 mL NaHCO3 (7.5%)、5 mL 青霉素/链霉素溶液和 50 mL 胎牛血清 (FCS); 材料表。
注意:处理 SARS-CoV-2 时,请使用适当的生物安全程序和设备。
- Vero E6 细胞在两个 150 cm2 组织培养瓶中生长至汇合。用 SARS-CoV-2 病毒感染一个培养瓶,并使用另一个假感染的培养瓶作为对照。
- 将大约 100,000 个野生型 (WT) SARS-CoV-2 感染性颗粒与 5 mL Eagles MEM 培养基混合。
- 从一个 150 cm2 烧瓶中吸出培养基,并加入 55 mL 完整 MEM 以生成未感染的对照上清液。从另一个 150 cm2 培养瓶中吸出培养基,并将病毒混合物添加到细胞中。将细胞在 37 °C 下孵育 1 小时。 每 15 分钟轻轻摇动培养瓶以分散病毒。
- 向添加 SARS-CoV-2 的培养瓶中加入 50 mL 完全 MEM 培养基,孵育细胞直至观察到细胞病变效应,每 24 小时目视评估一次培养瓶。
注意:感染后大约需要 3-4 天才会发生细胞病变。根据国际标准化组织 体外细胞毒性 测试指南,通过使用倒置光学显微镜观察细胞来定性评估细胞病变对 Vero E6 细胞单层结构的影响(例如,细胞回缩、创建、舍圆、脱粘、细胞质内颗粒丢失、明显裂解)16。 - 从两个培养瓶中收集细胞上清液,并以 253 × g 离心 6 分钟以沉淀细胞碎片。
- 紫外线灭活细胞上清液中的 SARS-CoV-2 病毒
- 将每孔 0.5 mL 上清液移液至 24 孔微量滴定板中的 12 个孔中。在合适的紫外线灯下,不带盖子,对微量滴定板进行紫外线照射 30 秒(材料表)。
注:应通过尝试在 Vero E6 细胞培养物中繁殖来确定细胞上清液中的病毒灭活。
- 将每孔 0.5 mL 上清液移液至 24 孔微量滴定板中的 12 个孔中。在合适的紫外线灯下,不带盖子,对微量滴定板进行紫外线照射 30 秒(材料表)。
- 将细胞上清液分装到 1.5 mL 试管中,并在 -20 °C 下储存直至进一步使用。
注意:细胞上清液可以储存在 -80 °C。
4. 检测方法:检测细胞上清液中的 SARS-CoV-2 病毒颗粒
- 通过混合 0.1% 酪蛋白、0.5% 聚乙烯醇、0.8% 聚乙烯吡咯烷酮和 1% BSA(均为 w/v)来制备检测缓冲液 (pH 7)。通过在检测缓冲液中制备 10% 兔 IgG 来制备样品稀释缓冲液。
- 计算并制备测试所需的工作微珠混合物(步骤 2.1)的体积(5 μL/反应),允许多余的体积以适应移液损失。
- 制备上清液稀释系列。计算所需的上清液体积。对于五个 scFv 中的每一个,在一式三份的孔中测定每个稀释点,每个稀释点和样品类型 15 个孔。在每个孔中使用 45 μL 稀释的上清液,总共需要 675 μL;用于 SARS-CoV-2 和对照上清液的单个 1.5 mL 微量离心管就足够了。
- 将 SARS-CoV-2 上清液和对照上清液在 4 °C 下解冻至少 1 小时。将上清液及其稀释液保持低温 (2-8 °C) 直至使用。标记并排列 8 个 1.5 mL 微量离心管,分别用于 SARS-CoV-2 和对照上清液。
注:测定的最高浓度为 1:1(2 倍)上清液稀释液,其中将使用样品稀释缓冲液进行一系列 1:2(3 倍)稀释,最高稀释度为 1:1458 稀释。含有样品稀释缓冲液的空白板仅用作无上清液对照。因此,每种上清液类型(SARS-CoV-2 或对照)的测试稀释度将为 2、6、18、54、162、486 和 1458 倍,仅使用缓冲液对照。 - 将样品稀释缓冲液添加到标记的微量离心管中。1:1(2 倍)稀释管需要 600 μL 缓冲液,其余试管需要 800 μL 缓冲液。将 600 μL 上清液与 600 μL 样品稀释缓冲液混合在适当标记的试管中,然后短暂涡旋试管以混合,从而制备每种上清液的最高稀释度(1:1;2 倍)。
- 依次将 400 μL 1:1(2 倍)稀释的上清液转移到下一个稀释管中(即 6 倍稀释),然后继续 3 倍稀释,直到产生最低稀释度(1458 倍)。在进行下一次稀释之前,短暂涡旋每个稀释的上清液。
- 将 SARS-CoV-2 上清液和对照上清液在 4 °C 下解冻至少 1 小时。将上清液及其稀释液保持低温 (2-8 °C) 直至使用。标记并排列 8 个 1.5 mL 微量离心管,分别用于 SARS-CoV-2 和对照上清液。
- 将微球与上清液一起孵育。
- 将预先准备好的工作珠混合物涡旋 30 秒以重悬微球,并将 5 μL 珠混合物添加到平底 384 孔微量滴定板的每个指定孔中。
注意:也可以使用 96 孔板。 - 将 45 μL 制备的上清液稀释液添加到 384 孔板中含有微球的指定孔中。密封板,并在 RT (18-22°C) 下在轨道振荡器 (650 rpm) 上避光孵育过夜 (16-22 h)。
- 将预先准备好的工作珠混合物涡旋 30 秒以重悬微球,并将 5 μL 珠混合物添加到平底 384 孔微量滴定板的每个指定孔中。
- 从珠子上洗掉多余的上清液。
- 从轨道摇床上取下微量滴定板,然后取下板密封剂。将板以 931 x g 离心 1 分钟。
- 将微量滴定板放在磁板分离器上 30 秒,固定珠子。在微量滴定板仍位于磁性分离器上的情况下,取下微孔板密封剂并从磁固定的微珠中吸出上清液。
- 从磁性分离器上取下微量滴定板。
- 向每个含有珠子的孔中加入 60 μL PBS-T。
- 重复洗涤步骤 4.5.2-4.5.4 两次,总共 PBS-T 洗涤 3 次。
- 在单独的 1.5 mL 试管中制备不同的检测混合物。每种检测混合物由一种市售人单克隆抗 S1 (胡-anti-S1) 抗体 (1 μg/mL) 和五种不同的 FLAG 标记 scFv (1 μg/mL) 之一(补充文件 1、补充表 1 和 补充表 2)组成,靶向 SARS-CoV-2 颗粒上的刺突蛋白,在检测缓冲液中稀释(步骤 4.1),总共得到五种不同的检测混合物。
- 重复步骤 4.5.2-4.5.3。将洗涤后的微球重悬于 50 μL/孔的适当 scFv 特异性加标检测混合物中。密封微量滴定板,并在 RT (18-22 °C) 下在轨道振荡器 (650 rpm) 上黑暗孵育 1 小时。
- 将微量滴定板以 931 × g 离心 1 分钟。从磁珠上洗涤过量的 Spike Detection Reagent。根据步骤 4.5.2-4.5.5,用 60 μL PBS-T 执行三个洗涤步骤。
- 将微球与荧光检测抗体混合物一起孵育。
- 制备荧光溶液混合物,由市售的 PE 偶联的抗人 IgG 和在检测缓冲液中稀释的 BV421 偶联的抗 FLAG 抗体组成,工作浓度分别为 0.2 μg/mL 和 1 μg/mL。每个反应需要 50 μL 荧光检测试剂。
- 重复步骤 4.5.2-4.5.3。将微球重悬于 50 μL/孔的荧光溶液混合物中。密封微量滴定板,并在 RT (18-22 °C) 下在轨道振荡器 (650 rpm) 上黑暗孵育 30 分钟。
- 将微量滴定板以 931 × g 离心 1 分钟。从微球中洗去多余的荧光溶液混合物。根据步骤 4.5.2-4.5.5,用 60 μL PBS-T 执行三个洗涤步骤。
- 将微球悬浮在最后一个洗涤步骤的 60 μL PBS-T 中。使用步骤 2.6 中描述的设置在双报告器流动分析系统上分析板。
代表性结果
偶联试验
偶联试验显示,山羊 IgG 和中性亲和素生物素化的 ACE2 成功偶联到微球上。通过用不同动物物种中产生的 PE 标记的二抗探测 ACE2 偶联的微球来确认测定检测特异性(图 2)。未观察到不同检测抗体之间的交叉反应性。当用山羊抗 ACE2 + 抗山羊 IgG PE 探测磁珠混合物时,ACE2 和山羊 IgG 偶联微球的中位荧光强度(MFI;任意单位)值高于背景,但未检测到未偶联微球(裸)或生物素包被的微球。使用抗小鼠 IgG PE 和抗兔 IgG PE 作为阴性对照,以检查假阳性信号。与微球孵育时产生的荧光信号可以忽略不计,表明 ACE2 和山羊 IgG 的阳性信号是特异性的。
细胞上清液中的病毒颗粒检测能力
使用与重组人 ACE2 偶联的磁珠从感染和对照(无病毒)VeroE6 细胞培养上清液中捕获 SARS-CoV-2 病毒颗粒,然后使用单克隆抗体和五种不同的 scFv 之一同时探测两个不同的病毒刺突区域。在两个报告通道(RP1 和 RP2)中观察到 SARS-Cov-2 感染的细胞上清液稀释液中的浓度依赖性信号(图 3),表明商业 胡 抗 S1 抗体和不同的 scFv 都检测到与 ACE2 偶联微球结合的病毒颗粒。对于五分之三的 scFv,可在低至 1:18 的稀释度(scFv2、scFv3、scFv5)中检测到病毒;对于其余两种 scFv(scFv7 和 scFv9),可在低至 1:6 稀释度下检测到。这可能是由于对目标的不同亲和力造成的。如图 3 和 表 1 所示,scFv3 提供最高的 MFI 强度,其次分别是 scFv5、scFv2、scFv7 和 scFv9。
在全球范围内,与 胡 抗 S1 相比,scFvs 检测导致较低的 MFI。这可能表明亲和力较低,但也可能是由于使用不同的荧光染料(PE 和 BV421)进行标记而导致的伪影。scFv7 和 scFv9 的另一个趋势是,与其他三种配置相比,RP1 通道(抗尖峰)的 MFI 值也略低。这可能表明 scFvs 正在交叉反应或以另一种方式干扰 ACE2-胡-抗 S1 相互作用,这也可以解释 RP2 通道中的信号较低。在 RP1 或 RP2 通道中未在未感染的 Vero E6 细胞的上清液中检测到病毒颗粒。
中性亲和素-生物素偶联的微球、山羊-IgG 微球和未偶联的微球用作阴性对照珠。用与 ACE2 偶联的磁性微球捕获病毒颗粒,并在 RP1 报告通道中用商业人抗刺突试验和 RP2 报告通道中的不同 scFv 进行测试(scFv 在每个面板的左上角表示)。在任何感染和未感染的样品中均未检测到病毒颗粒。
分析精度和稳定性
为了评估检测精度,所有条件一式三份运行。计算每个稀释点的 ACE2 微球的方差系数 (CV)。该测定的所有计算 CV 均低于 15%,其中最高测得的 CV 为 13%,最低 CV 为 1%(表 2)。从RP1通道的密度图(图4)中可以看出,市售胡抗S1的PE检测显示出更高的精度,主要集中在3%的CV附近。RP2 通道(scFV 的 BV 检测)显示更高的 CV。然而,从 表 2 中可以看出,较高的 CV 范围是由病毒颗粒浓度低的样品(例如空白样品)驱动的。为了测试方案的稳健性,由不同的操作员重复测定两次,使用在不同日期生成的微珠混合物和较低的样品量(降低 72%)。在 RP1 和 RP2 通道中观察到非常好的 Pearson 相关性,范围在 0.98 和 1 之间(p 值< 0.01),证实了检测的稳健性以及在可用样品较少时应用检测的可能性(图 5)。这种流式分析技术遵循“环境分析物理论”17,使分析对浓度敏感,但对体积不敏感。
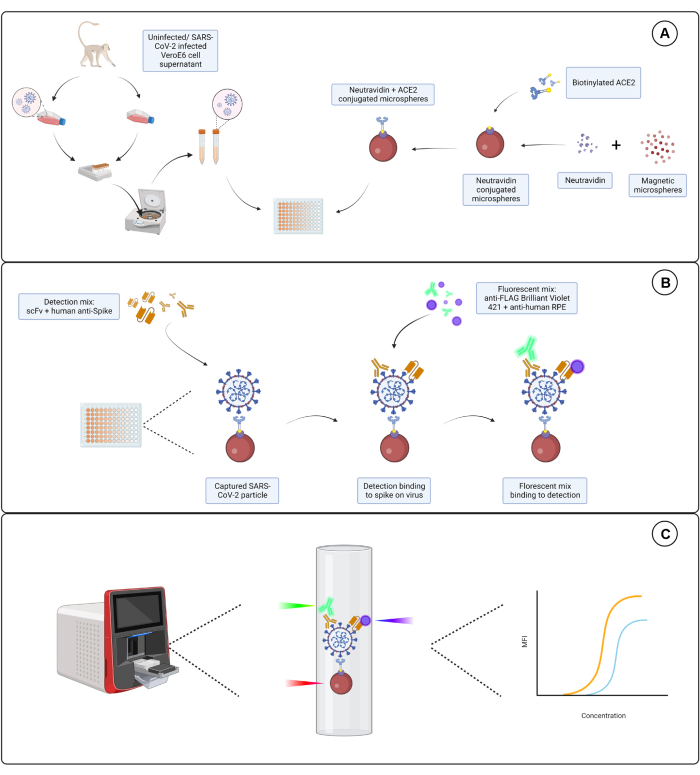
图 1:病毒颗粒测定。 (A) 将来自感染和未感染的 Vero E6 细胞的细胞上清液以连续稀释液的形式添加到 96 孔板或 384 孔板中,并与中性亲和素偶联的磁性微球,然后与生物素化的人 ACE2 或生物素偶联。与山羊 IgG 偶联的未偶联微球和裸微球与中性亲和素 - 生物素偶联的微球一起用作阴性对照。(B) 用由 胡 抗 S1 和带有 FLAG 标签的不同 scFv 之一组成的检测混合物检测已形成的微球 - 病毒颗粒复合物。然后加入靶向 胡 抗 S1 的抗人 IgG PE 和靶向 scFvs 的抗 FLAG 亮紫 421 的荧光混合物。(C) 三激光双检测系统发射红色、绿色和紫色激光来检测微粒复合物。红色激光检测微球染料标记,而绿色和紫色激光分别检测抗 S1 和 scFvs。然后分析生成的数据。 请单击此处查看此图的较大版本。
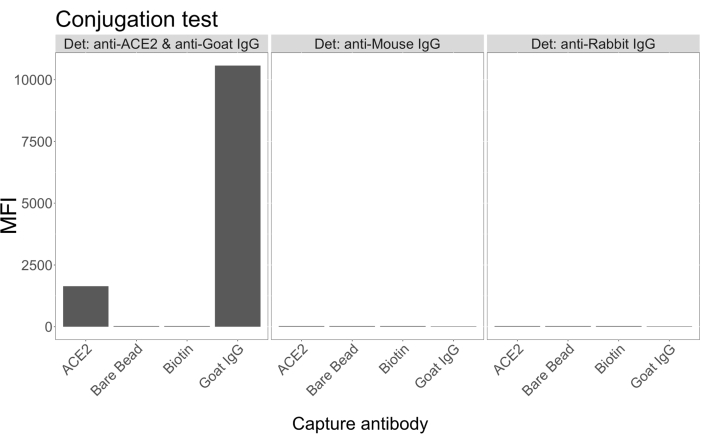
图 2:偶联确认图。 微珠混合物由四种不同的微球 ID 组成,每种微球 ID 与不同的蛋白质偶联:中性亲和素-生物素-ACE2 (ACE2)、未偶联微球 (Bare Bead)、中性亲和素-生物素 (Biotin) 和山羊 IgG (山羊 IgG)。在偶联试验中,使用了三种不同配置的检测荧光基团。即山羊抗 ACE2 + 抗山羊 IgG PE、抗小鼠 IgG PE 和抗兔 IgG PE。Y 轴显示在三种不同条件下每个微球的平均测量 MFI(中位荧光强度;任意单位)信号。X 轴显示应用的不同捕获抗体。 请单击此处查看此图的较大版本。
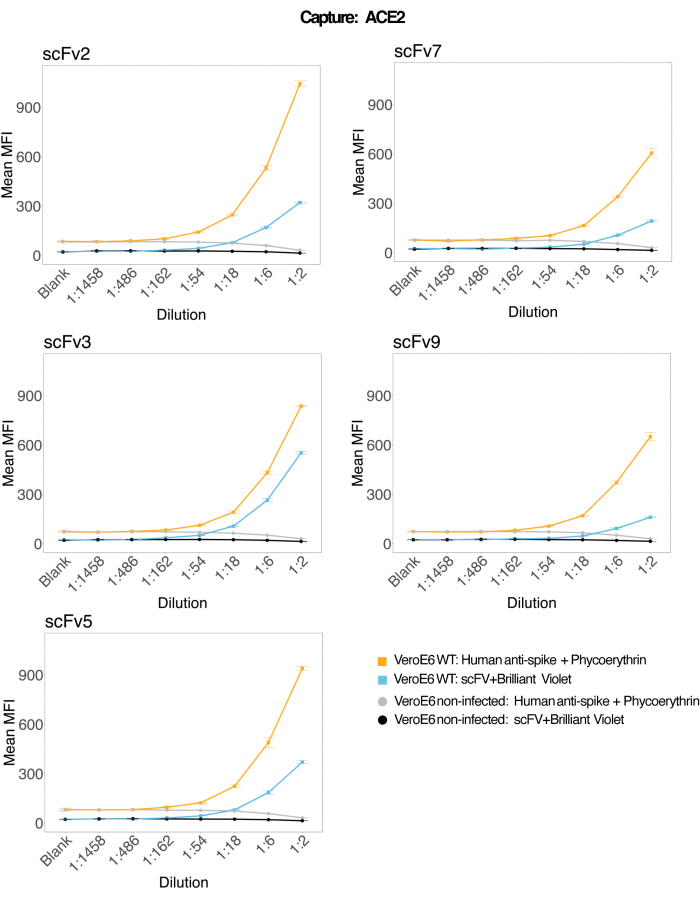
图 3:表面蛋白的多重检测。 Y 轴:每个样品的平均 MFI(中位荧光强度;标准差±任意单位),每个条件一式三份分析。X 轴:细胞上清液的连续稀释点。橙色:用人抗刺突蛋白 + 抗人 PE(藻红蛋白)检测到感染 SARS-CoV-2 WT 的 Vero E6 上清液中的病毒颗粒。蓝色:用不同的 scFvs + 抗 FLAG Brilliant Violet 421 检测到感染 SARS-CoV-2 WT 的 Vero E6 的上清液。灰色:用人抗刺突 + 抗人 PE 检测到的非感染细胞上清液。黑色:用五种不同的 scFvs + 抗 FLAG Brilliant Violet 421 检测的非感染细胞上清液。用与 ACE2 偶联的磁性微球捕获病毒颗粒,并在 RP1 报告通道中用商业人抗刺突抗体和 RP2 报告通道中的不同 scFv 进行测试(scFv 显示在每个面板的左上角)。在任何未感染的样本中均未检测到病毒颗粒。scFv3 靶向的表位具有最高的亲和力。 请单击此处查看此图的较大版本。
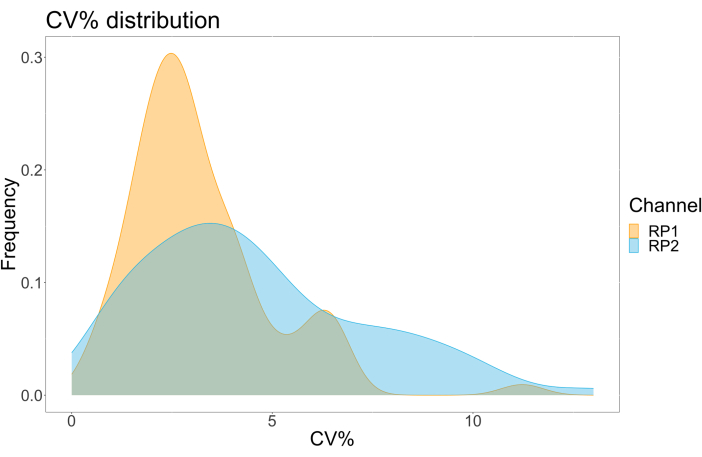
图 4:变异色散图。 Y 轴是事件的频率,X 轴显示不同样本的每个仿行的方差系数 (CV) 百分比。RP1 和 RP2 是分别检测藻红蛋白和 Brilliant Violet 421 相关荧光的第一和第二报告通道。 请单击此处查看此图的较大版本。
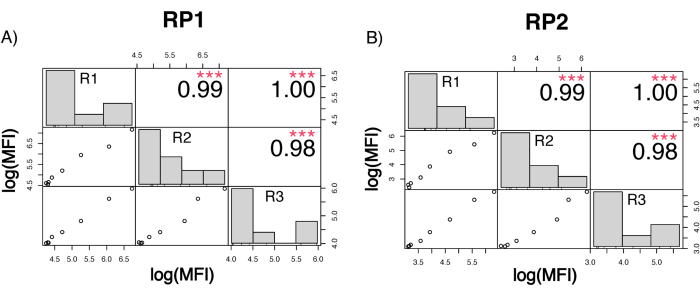
图 5:运行相关矩阵。(A,B) Y 轴:由三个不同的操作员使用不同的磁珠混合物运行的三个单独运行之间的 log10 比例的 Pearson 相关矩阵。在第三次运行中应用了较低的样品体积。直方图显示了基于测量的 MFI 的不同变量聚类的分布。(A) 不同运行之间 RP1 报告基因通道的相关性。(B) 不同运行之间 RP2 报告基因通道的相关性。MFI=以任意单位表示的中位荧光强度。p < 0.001。请单击此处查看此图的较大版本。
| 检波 | 反应 |
| scFv2 | ++ |
| scFv3 | +++ |
| scFv5 | ++ |
| scFv7 | + |
| scFv9 | + |
| 人抗刺突 IgG | ++++ |
表 1:基于标准曲线中获得的 MFI 强度的检测中 scFvs 的排名。
| RP1 (PE) | RP2 (BV421) | |
| 样品稀释 | CV 范围 [%] | CV 范围 [%] |
| 空白 | 3–11 | 2–13 |
| 1:1458 | 1–7 | 2–7 |
| 1:456 | 4–6 | 3–8 |
| 1:162 | 3–6 | 3–7 |
| 1:54 | 2–4 | 2–4 |
| 1:18 | 2–4 | 1–4 |
| 1:6 | 2–6 | 1–6 |
| 1:2 | 1–5 | 1–3 |
表 2:RP1 和 RP2 报告基因通道的 SARS-CoV-2 感染上清液的每个稀释点的 CV%(平均值/标准差× 100)范围。
补充文件 1:免疫球蛋白单链可变片段 (scFv) 生成。请点击此处下载此文件。
补充表 1:与 Fab 配对筛选 scFv 对重组刺突 (RBD) 的连续稀释。 为了评估不同检测肽的性能,使用刺突蛋白 Fab 的 12 种组合作为加标重组 RBD 缓冲液中的捕获。采用十 (10) 个靶向刺突蛋白不同表位的 scFv 作为检测。根据捕获-检测对的性能,它们被标记为失败 (-) 或成功 (+)。 请点击此处下载此文件。
补充表 2:与 Fabs 配对筛选 scFvs 对抗 SARS-Cov-2 感染的 Calu-3 细胞上清液的连续稀释。 为了评估不同的检测肽性能,使用 SARS-Cov-2 感染的 Calu-3 细胞上清液中的 12 种刺突蛋白 Fab 组合作为捕获。采用十 (10) 个靶向刺突蛋白不同表位的 scFv 作为检测。根据捕获-检测对的性能,它们被标记为失败 (-) 或成功 (+)。 请点击此处下载此文件。
讨论
基于微珠的多重技术已被证明是许多临床应用中高通量病原体检测的宝贵平台。该平台基于流式细胞术原理,具有高度灵活性,可靶向抗体、蛋白质和核酸18、19、20、21、22,同时对数百种分析物进行多重检测。然而,据我们所知,这项技术以前从未用于检测完整的病毒颗粒。在本报告中,该技术通过靶向 SARS-CoV-2 的三个独立表面表位来检测完整的病毒颗粒。
包膜 RNA 病毒与细胞外囊泡 (EV) 具有高度结构相似性,细胞外囊泡是携带病毒 RNA 和蛋白质以及宿主蛋白的小磷脂膜23。夹心免疫测定以前已应用于 EV 的检测,使用靶向两种不同表面蛋白的抗体对24,25。夹心分析只能同时检测两种蛋白质的限制,通过多重方法可以消除每个反应同时检测两种以上蛋白质的局限性。
这里描述的三激光双报告基因检测系统是迄今为止最先进的基于微珠的流量分析仪器。对于单报告基因读出系统,双报告基因(RP1 和 RP2 通道)允许并行检测三个表面蛋白/表位。靶向多种病毒表面蛋白和表位可以更准确地表示病毒蛋白载量,这除了确认病毒实际上是完整的之外,还为进一步研究病毒表面抗原以及病毒和宿主蛋白相互作用的机制提供了机会。
在 COVID-19 大流行期间,及时识别携带活性病毒颗粒的个体对于遏制病毒传播非常重要。基因组 RNA 通过定量 RT-PCR 检测,无论其来源如何(完整病毒颗粒或游离病毒颗粒)。然而,只有具有可接近 S 蛋白的完整包膜才能介导细胞进入和随后的病毒复制。先前在患者样本中使用微流控芯片的研究表明,检测完整的病毒颗粒与即时检测相结合将如何实现频繁检测和加强对疾病传播的监测,包括更明智地选择被隔离的个体26。基于多重微球的测定的应用将允许设计旨在筛选多种病毒及其表面抗原变体的测定,从而获得病毒在人群中传播的更准确图片。
流式病毒测定法是流式细胞术的最新发展,旨在分析病毒颗粒。尽管能够检测离散的病毒颗粒,但小病毒的分析构成了流式病毒测定法的当前问题27,28。与此处描述的方法类似,流式病毒测定法涉及通过与抗体偶联的金纳米颗粒捕获完整的病毒粒子。两种方法的局限性包括 (i) 微球或纳米颗粒靶向表面表达抗原对高亲和力捕获和检测试剂的依赖性,(ii) 区分病毒颗粒和细胞外囊泡的能力有限,以及 (iii) 缺乏正确颗粒定量的标准。
细胞将 EV 分泌到周围环境中,当被病毒感染时,它们还可能分泌与 EV 大小相似的病毒粒子,并最终可能表达相同的抗原29。由于 EV 具有与病毒相似的膜组成,因此仅使用基于亲和力的方法(例如双激光单报告基因方法)可能很难将它们彼此区分开来。然而,此处描述的策略具有更高的多重能力,能够更广泛、更深入地研究颗粒的蛋白质组成。基于流式的方法允许跟踪离散颗粒,为数字量化提供了机会。解决我们方法中定量问题的一种策略是使用表征良好的合成囊泡,将目标抗原表达为病毒样颗粒 (VLP) 来制备标准曲线。
SARS-CoV-2 从宿主细胞进出的常见途径是通过病毒和宿主细胞膜的相互作用 2,15。在这个过程中,宿主膜蛋白掺入病毒表面的可能性很高。通过筛选掺入的宿主蛋白,可以追踪感染途径,并可能预测不同风险患者的病程,从而尽早做出治疗决策。它还允许在研究实验室的不同样品批次中对病毒进行表征。这可以通过测试不同的特征是否与不同水平的病毒感染性有关以及筛选靶向病毒表面蛋白的抗体和药物分子来进一步探索。
关于所描述方法的一个重要方面是,它依赖于捕获和检测试剂对病毒上靶蛋白的亲和力。因此,亲和试剂的选择是分析性能的决定因素。可能应该筛选和测试多种亲和试剂以进行捕获和检测,以选择具有最高亲和力的试剂。在这里,使用重组 RBD 和来自 SARS-Cov-2 感染的 Calu-3 肺上皮细胞上清液的病毒颗粒初步评估了 10 个 scFvs 和 12 个 Fab 片段的性能(在所有后续研究中,VeroE6 细胞用于培养/评估细胞毒性)。Anti-FLAG PE 用于检测 FLAG 标记的 scFv (补充表 1 和 补充表 2)。然后选择表现最佳的 5 种 scFv 与商业 胡 抗 S1 (表 1) 一起应用于感染的 VeroE6 非洲绿猴肾上皮细胞的上清液的双报告基因测定。
该方案成功的另一个关键因素是选择用于微球偶联的程序。偶联方法应该是有效的,同时保持参与蛋白质结合的构象表位或氨基酸残基完整且未修饰。在这里,EDC-NHS 反应用于将中性亲和素直接偶联到微球上,采用先前描述的方案30 和中性亲和素 + 生物素系统,以将重组 ACE2 结合到偶联微球上。可以测试和比较替代耦合方法及其效率。最后,观察到不同的荧光标记检测试剂(例如,抗 FLAG PE(藻红蛋白)和抗 FLAG Brilliant Violet 421)可能导致不同的 MFI 水平,从而影响检测灵敏度。
总之,所描述的方法允许检测溶液中的完整病毒颗粒,应用双报告基因策略。同时分析三个表面决定簇提供了一种更具体的工具来表征病毒颗粒并最终将它们与其他 EV 区分开来(例如,不包含病毒抗原)。该策略是流式病毒测定法的替代方法。尽管目前的方法不区分粒径,但使用颜色编码微球的磁珠策略通过高多重和高通量分析在表面抗原分析和实验设计方面提供了更广泛的能力。该检测显示出高精度和稳定性,可扩展到分析任何类型的细胞外囊泡和在体液或其他液体基质中暴露表面抗原的任何其他类型的生物颗粒。这是一项概念验证研究,证明了在病毒颗粒上多个蛋白质表位的多重分析中使用 scFvs 作为一种检测试剂的实用性。如果 scFv 要用于定量或临床目的,则需要进一步的研究来确定 scFv 的具体特征(例如,结合亲和力、与其他试剂和靶标的交叉反应性)。
披露声明
作者声明没有利益冲突。
致谢
我们感谢瑞典 SciLifeLab、亲和蛋白质组学-斯德哥尔摩 Scilifelab 部门团队开发和应用此处描述的方法,人类抗体治疗部门提供 scFvs 和 Fab 试剂,以及 Jonas Klingström 负责感染临床样本中 SARS-CoV-2 分离株的 VeroE6 细胞。作者感谢 Luminex Corporation(德克萨斯州奥斯汀)的 Sherry Dunbar 博士和 MBA 的研究支持,以及生物医学出版解决方案(佛罗里达州巴拿马城;mattsilver@yahoo.com)的 Matt Silverman MSci 博士提供的科学和写作帮助。这项工作得到了 Knut 和 Alice Wallenberg 基金会以及生命科学实验室 (SciLifeLab)(Claudia Fredolini 和 Francesca Chiodi 的 VC2020-0015 以及 Claudia Fredolini 的 VC-2022-0028)的资金支持。
材料
| Name | Company | Catalog Number | Comments |
| ACE2-Biotin | Acro Biosystems (Newark, DE) | AC2-H82E6-25 ug | Conc: 340 µg/mL, LOT#BV35376-203HFI-2128 |
| Anti-Goat IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 705-116-147 | Host species: Donkey |
| Anti-Human IgG R-PE | Life Technologies/Thermo Fisher (Waltham, MA) | H10104 | Conc: 0.15 mg/mL, LOT#2079224, Host species: Goat |
| Anti-Mouse IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 115-116-146 | Host species: Goat |
| Anti-Rabbit IgG, PE-conjugated | Jackson ImmunoResearch (West Grove, PA) | 111-116-144 | Host species: Goat |
| Biotin | Thermo-Fisher Scientific (Waltham, MA) | 20RUO | 100 mM, pH 10 Conc. 1 mg/mL |
| Blocker Casein in PBS | Thermo-Fisher Scientific (Waltham, MA) | 37528 | LOT#VD301372 |
| Blocker reagent for ELISA (BRE) | Roche (Basel, Switzerland) | 11112589001 | |
| Brilliant Violet 421 anti-DYKDDDDK Tag Antibody (Anti-FLAG) 0.2 mg/ml, rat IgG2a, λ | BioLegend (Amsterdam, The Netherlands) | 637321 | |
| Bovine serum albumin (BSA) | Saveen & Werner (Limhamn, Sweden) | B2000-500 | LOT#04D5865 |
| EDC (1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride) | Proteochem (Hurricane, UT) | C1100-custom (65 mg) | LOT# MK3857 |
| Fetal calf serum (FCS) | Gibco/Thermo Fisher (Waltham, MA) | 10270-106 | |
| Goat anti-ACE2 polyclonal antibody | R&D Systems/Bio-Techne (Minneapolis, MN) | AF933 | Host species: Goat |
| Goat IgG | Bethyl Labs (Montgomery, TX) | P50-200 | LOT#P50-200-6 |
| L-glutamine | Thermo-Fisher Scientific (Waltham, MA) | 25030024 | |
| Low-bind 1.5 mL microfuge tubes | VWR (Radnor, PA) | 525-0133 | |
| MagPlex-C Microspheres | Luminex Corporation (Austin, TX) | MC10XXX-01 | |
| MEM tissue cuture media | Gibco/Thermo Fisher (Waltham, MA) | 21430-020 | |
| Microplate, 96-Well, Polystyrene, Half-area, Clear | Greiner Bio-One (Kremsmünster, Austria) | 675101 | |
| NaHCO3 | Gibco/Thermo Fisher (Waltham, MA) | 25080-060 | |
| Neutravidin | Thermo-Fisher Scientific (Waltham, MA) | 31000 | LOT#UK292857 |
| PBS tablets | Medicago AB (Uppsala, Sweden) | 09-9400-100 | LOT#272320-01 |
| Penicillin/Streptomycin | Gibco/Thermo Fisher (Waltham, MA) | 15140122 | |
| Poly(vinyl alcohol) | Sigma-Aldrich (St. Louis, MO) | 360627 | |
| Polyvinylpyrrolidone | Sigma-Aldrich (St. Louis, MO) | 437190 | |
| ProClin 300 | Sigma-Aldrich (St. Louis, MO) | 48915-U | |
| Rabbit IgG | Bethyl Labs (Montgomery, TX) | P120-301 | LOT#12 |
| scFv-FAb1 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.12 mg/mL. | |
| scFv-FAb2 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc batch1: 0.38 mg/mL. Conc batch2: 0.45 mg/mL | |
| scFv-FAb3 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 0.34 mg/mL. | |
| scFv-FAb4 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc: 2.85 mg/mL. | |
| scFv-FAb5 | In-house production | Human Antibody Therapeutics Unit, Scilifelab, Sweden. Monoclonal scFv. Conc:2.7mg/mL. | |
| SARS-CoV-2 infectious particles, Swedish isolate | In-house production | The Public Health Agency of Sweden | |
| SARS-CoV-2 Spike Antibody (Hu-anti-S1) | Novus Biologicals (Centennial, CO) | NBP2-90980 | Monoclonal antibody. Conc: 1 mg/mL. Host: Human. Clone: CR3022. Isotype: IgG1 Kappa. LOT#T201B06 |
| Sodium phosphate monobasic, anhydrous | Sigma-Aldrich (St. Louis, MO) | S3139 | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo-Fisher Scientific (Waltham, MA) | 24510 | LOT# XH321563 |
| Tween | Thermo-Fisher Scientific (Waltham, MA) | BP337-50 | LOT#194435 |
| Ultraviolet lamp | Vilber Lourmat GmbH (Eberhardzell, Germany) | VL-215.G | Wavelength = 254 nm; 2 × 15-watt bulbs |
| Vero E6 cells | ATCC (Manassus, VA) | CRL-1586 | |
| xMAP INTELLIFLEX DR-SE (dual-reporter flow instrument) | Luminex Corporation (Austin, TX) | INTELLIFLEX-DRSE-RUO |
参考文献
- Rey, F. A., Lok, S. M. Common features of enveloped viruses and implications for immunogen design for next-generation vaccines. Cell. 172 (6), 1319-1334 (2018).
- V'kovski, P., Kratzel, A., Steiner, S., Stalder, H., Thiel, V. Coronavirus biology and replication: implications for SARS-CoV-2. Nature Reviews Microbiology. 19 (3), 155-170 (2021).
- Burnie, J., et al. Flow virometry quantification of host proteins on the surface of HIV-1 pseudovirus particles. Viruses. 12 (11), 1296 (2020).
- Gentili, M., et al. Transmission of innate immune signaling by packaging of cGAMP in viral particles. Science. 349 (6253), 1232-1236 (2015).
- Modrow, S., Falke, D., Truyen, U., Schätzl, H. . Viruses: Definition, Structure, Classification. In Molecular Virology. , 163-181 (2013).
- Trinh, K. T. L., Do, H. D. K., Lee, N. Y. Recent advances in molecular and immunological diagnostic platform for virus detection: A review. Biosensors. 13 (4), 490 (2023).
- Zamora, J. L. R., Aguilar, H. C. Flow virometry as a tool to study viruses. Methods. 134-135, 87-97 (2018).
- Graham, H., Chandler, D. J., Dunbar, S. A. The genesis and evolution of bead-based multiplexing. Methods. 158, 2-11 (2019).
- Byström, S., et al. Affinity proteomic profiling of plasma for proteins associated to area-based mammographic breast density. Breast Cancer Research. 20 (1), 14 (2018).
- Rudberg, A. -. S., et al. SARS-CoV-2 exposure, symptoms and seroprevalence in healthcare workers in Sweden. Nature Communications. 11 (1), 5064 (2020).
- Liu, J., et al. Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis. Journal of Clinical Virology. 50 (4), 308-313 (2011).
- Gadsby, N. J., Hardie, A., Claas, E. C. J., Templeton, K. E. Comparison of the Luminex respiratory virus panel fast assay with in-house real-time PCR for respiratory viral infection diagnosis. Journal of Clinical Microbiology. 48 (6), 2213-2216 (2010).
- Lorenzen, E., et al. Multiplexed analysis of the secretin-like GPCR-RAMP interactome. Science Advances. 5 (9), (2019).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments: JoVE. (170), e62487 (2021).
- Jackson, C. B., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews Molecular Cell Biology. 23 (1), 3-20 (2022).
- ISO10993-5 Biological evaluation of medical devices - Part 5: Tests for in vitro cytotoxicity. International Standardization Organization Available from: https://nhiso.com/wp-content/uploads/2018/05/ISO-10993-5-2009.pdf (2009)
- Poetz, O., et al. Sequential multiplex analyte capturing for phosphoprotein profiling. Molecular & Cellular Proteomics. 9 (11), 2474-2481 (2010).
- Dunbar, S. A., Vander Zee, C. A., Oliver, K. G., Karem, K. L., Jacobson, J. W. Quantitative, multiplexed detection of bacterial pathogens: DNA and protein applications of the Luminex LabMAP system. Journal of Microbiological Methods. 53 (2), 245-252 (2003).
- Taniuchi, M., et al. Multiplex polymerase chain reaction method to detect Cyclospora, Cystoisospora, and Microsporidia in stool samples. Diagnostic Microbiology and Infectious Disease. 71 (4), 386-390 (2011).
- Wu, M., et al. High-throughput Luminex xMAP assay for simultaneous detection of antibodies against rabbit hemorrhagic disease virus, Sendai virus, and rabbit rotavirus. Archives of Virology. 164 (6), 1639-1646 (2019).
- Dias, D., et al. Optimization and validation of a multiplexed Luminex assay to quantify antibodies to neutralizing epitopes on human papillomaviruses 6, 11, 16, and 18. Clinical and Vaccine Immunology. 12 (8), 959-969 (2005).
- Opalka, D., et al. Simultaneous quantitation of antibodies to neutralizing epitopes on virus-like particles for human papillomavirus types 6, 11, 16, and 18 by a multiplexes lumina assay. Clinical and Diagnostic Laboratory Immunology. 10 (1), 108-115 (2003).
- Nolte-'T Hoen, E., Cremer, T., Gallo, R. C., Margolis, L. B. Extracellular vesicles and viruses: Are they close relatives. Proceedings of the National Academy of Sciences. 113 (33), 9155-9161 (2016).
- Ohmichi, T., et al. Quantification of brain-derived extracellular vesicles in plasma as a biomarker to diagnose Parkinson's and related diseases. Parkinsonism & Related Disorders. 61, 82-87 (2019).
- Ter-Ovanesyan, D., et al. Framework for rapid comparison of extracellular vesicle isolation methods. Elife. 10, e70725 (2021).
- Gamage, S. S. T., et al. Microfluidic affinity selection of active SARS-CoV-2 virus particles. Science Advances. 8 (39), (2022).
- Renner, T. M., Tang, V. A., Burger, D., Langlois, M. -. A. Intact viral particle counts measured by flow virometry provide insight into the infectivity and genome packaging efficiency of moloney murine leukemia virus. Journal of Virology. 94 (2), e01600-01619 (2020).
- Niraja, S., et al. A flow virometry process proposed for detection of SARS-CoV-2 and large-scale screening of COVID-19 cases. Future Virology. 15 (8), 525-532 (2020).
- Lippé, R. Flow virometry: A powerful tool to functionally characterize viruses. Journal of Virology. 92 (3), e01765 (2018).
- Drobin, K., Nilsson, P., Schwenk, J. M. Highly multiplexed antibody suspension bead arrays for plasma protein profiling. Methods in Molecular Biology. 1023, 137-145 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。