使用呼吸测定法测量厌氧共消化的食物残渣与废物活性污泥共消化的生物甲烷潜力
摘要
该协议描述了使用呼吸测定法确定甲烷产生和微生物动力学参数的最佳实践,用于厌氧微生物群共消化食物残渣废物和废物活性污泥。
摘要
在过去的几十年中,使用呼吸测定法来研究微生物群处理废水或消化废水污泥的生物动力学变得越来越普遍。使用呼吸测定法检查厌氧微生物群共消化有机废物流(如废水污泥和食物残渣)的生物动力学是一个活跃的研究领域。迄今为止,尚未发布关于该主题的可视化协议。因此,在该协议中,我们配置了一个呼吸计,以使用三种不同的食物与微生物(F:M)比率和食物残渣废物和废物活性污泥作为基质来测量甲烷的产生和流速。所得数据与底物利用率测量值相结合,为理解不同底物浓度如何影响厌氧微生物群产生甲烷的速率提供了基础。此外,该协议提出了一种开发生物动力学参数(例如,甲烷生产率常数和产量)的方法。其他人可以使用这种呼吸测量方案来检查厌氧条件下的有机降解并开发微生物参数。
引言
研究人员使用各种方法在实验室规模上研究微生物活动,包括批量研究、微观世界和呼吸测量等。呼吸计可用于通过观察受控条件下的底物消耗和最终产品生产来测量微生物群落生长和/或衰变阶段的细胞呼吸1.小规模呼吸计研究的结果也可用于估计过程模型构建的生物动力学参数2。呼吸计已用于检查需氧和厌氧微生物活动;然而,使用呼吸计测量生物甲烷电位 (BMP) 的研究,尤其是混合有机底物的生物甲烷电位 (BMP),是一个正在进行的研究领域 3,4。
生活废水中的有机物被认为是一种可行的可再生能源化学能 5.一个多世纪以来,废水污泥(即初级污泥和废物活性污泥,WAS)的厌氧消化已被用于在废水处理厂 (WWTP) 生产富含甲烷的沼气6.然而,多种有机废物流的消化,例如用WAS消化食物残渣,直到最近几年才变得普遍,并且仍然是一个活跃的研究领域。食物残渣是许多发达国家持续的高密度有机材料废物流,在美国约占垃圾填埋场质量的 25%7.除了将一部分食物残渣从垃圾填埋场的处置中转移出去外,由于产生的沼气量增加(相对于单一有机废物流),食物残渣和WAS在共消化情况下的结合是有利的。沼气通常含有 60%-70% 的甲烷、30%-40% 的二氧化碳和微量的其他气体(例如硫化氢)8。沼气可以在污水处理厂现场使用热电联产技术进行清洁和燃烧,以抵消一些电能和热能需求9.
几项研究检查了厌氧微生物群共消化有机废物的生物甲烷化潜力和生物动力学参数1.文献中的现有研究在血清瓶中使用了批量测定,其中甲烷产量是在整个实验过程中在离散点测量的,而其他研究则使用直接连接到实验室或中试规模生物反应器的流量计来测量甲烷产量2,10,11。使用呼吸计连续测量甲烷生产,例如本协议中描述的呼吸计,可以从各种实验条件下运行的大量样品中提供连续和精确的甲烷测量值1,12。虽然有几项研究已经测量了 WAS 与其他有机底物(如生物废物、脂肪、油、油脂和农业废物)耦合产生的甲烷 10,13,14,但从各种共消化情景中确定甲烷产生率仍有大量工作要做。此外,迄今为止,还没有可用的协议提供一种深入的、循序渐进的方法,使用视觉描述来测量食物残渣和WAS的共同消化产生的甲烷。因此,本研究提出了一种呼吸计协议,用于测量甲烷产量并使用稀废水、WAS 和食物残渣废物的混合物作为底物得出生物动力学参数。使用不同的食物与微生物比率(F:M)来帮助阐明甲烷产生的变化。其他测量包括挥发性悬浮固体 (VSS)、化学需氧量 (COD) 和每个样品的 pH 值。该协议描述了呼吸计设置、样本创建和关键测量。
研究方案
1.基材的制备
- 收集 ~1.5 L 初级流出物,~1 L 废物活性污泥 (WAS)。
注意:WAS样品应在实验前立即采集;然而,在实验之前,WAS可以在4°C下储存长达48小时,而对其作为底物的使用没有明显的影响15,16,17。 - 在实验前立即获得2L厌氧培养物,并将培养物保持在35°C。 在从厌氧消化池转移到收集瓶的过程中,尽可能限制与空气的接触。
注:本研究中使用的厌氧培养物是从污水处理厂获得的,该污水处理厂处理 8.5 MGD (38,640 m3/d) 废水初级污泥的厌氧消化。最佳做法是在获得厌氧培养物13 之前用氮气冲洗收集瓶,并在运输和储存过程中保持厌氧条件,以保持厌氧条件。 - 收集食物残渣并在实验前在4°C下储存长达48小时。
注意:根据实验设计,应注意识别具有碳水化合物、蛋白质等目标比例的食物残渣。食物垃圾中有机物的目标比例可能因实验而异。收集的食物中碳水化合物、蛋白质和脂肪的比例可以从已发表的文献中估计出来,也可以使用既定的方案(例如气相色谱法)进行评估。
2. 营养补充剂的制备
- 通过将 800 mL 去离子 (DI) 水与 CoCl2·6H2O (0.25 g)、FeCl3·6H2O(5 g),MnCl2·4H2O(0.05 g),NaMoO4·2H2O(0.005 g),NiCl2·6H2O(0.025 g),CuCl2·2H2O(0.007g),ZnCl2 (0.025g),H3BO3 (0.025g)和Na2SeO4 (0.025g)。用去离子 (DI) 水稀释至 1 L。
- 通过将 800 mL 去离子水与 CaCl2 (27.7 g) 和 MgCl2·4H2O(101 克)。用去离子水稀释至 1 L。
- 通过将 800 mL 去离子水与 NH4Cl (38.2 g) 和 Na2SO4 (15 g) 混合来制备营养碱。在去离子水中使用 3.64 N NaOH 将 pH 调节至 7.0,并用去离子水稀释至 1 L。
3. 样品制备
- 在搅拌机(图1)中混合食物残渣(表2)以形成混合物。确保混合物不含大颗粒食物残渣。用去离子水稀释食物残渣以帮助混合。注释在计算化学需氧量 (COD) 测量值时使用的稀释水量。这种稀释的食物垃圾被称为“工作垃圾”。将工作废物放入1升塑料瓶中,并在4°C下储存。
- 根据 表 1 标记四个 2 L 烧杯。将烧杯放在搅拌板上,然后加入一个大搅拌棒。根据 表 1 将食物残渣、WAS 和稀释液(用于控制的去离子水和用于处理的主要流出物)混合在 2 L 烧杯中。
- 加入矿物质基础溶液 #1、矿物基础溶液 #2 和营养基础各 12 mL。
- 向每个烧杯中加入 2.4 g NaHCO3 (粉末),搅拌 30 秒。根据 表1 标记8个呼吸测量瓶,并添加磁力搅拌棒。
注意:这将在不同的 F:M 比率下创建对照和三种处理的副本。 - 根据 表1 向每个2L烧杯中加入厌氧培养物并搅拌。立即用量筒从烧杯中测量 500 mL 混合物,并将其转移到贴有标签的呼吸计瓶中,用氮气冲洗,然后立即盖上盖子。
注意:应注意限制厌氧微生物群与大气氧的接触(如果有,应使用厌氧室进行转移)。
4. 初始条件的量化
- 使用第 3 部分的剩余样品 (~200 mL) 测量每个样品的 pH、总 COD (tCOD)、可溶性 COD (sCOD)、总悬浮固体 (TSS) 和挥发性悬浮固体 (VSS)18。
- 如有必要,根据测量设备的检测限用去离子水稀释样品。
注意:制造商的程序用于 COD 测量。
- 如有必要,根据测量设备的检测限用去离子水稀释样品。
5. 呼吸计设置
- 将呼吸计(图 2)设置为低厌氧设置。
- 同时按下复位按钮和开机按钮。
注意:这是特定于本研究中使用的模型的。 - 将冷却器(图3)设置为35.5°C。
- 在中心用 50/50 的 CaSO4 和 KOH 颗粒混合物填充每个 CO4 和湿气洗涤器(图 4 和图 5),每侧都用玻璃棉包围。
- 将样品瓶的管子和针头连接到洗涤器,然后从洗涤器连接到气体入口(图 6)。
- 在呼吸计笔记本电脑上,运行呼吸计程序 RSA-8-v2.0。
注意:此步骤特定于本研究中使用的模型。 - 选择程序中的所有瓶子,然后选择 编辑>数据标签。说出所有瓶子的名字。
注意:此步骤特定于本研究中使用的模型。 - 通过激活程序中的 “开始”按钮 开始测量气体产量。将程序设置为每半小时结束时测量数据。通过选择 “速率图 ”或 “体积图”来监控气体产量。
注意:此步骤特定于本研究中使用的模型。 - 实验结束后(~7 天),停止程序中的运行,关闭冷水机组,并关闭 RSPF 模块。将数据文件另存为 CSV 文件,然后将其转换为 MS Excel 文档。
注意:此步骤特定于本研究中使用的模型。
6. 呼吸后测量
- 按照第 4 节中所述的操作,测量最终样品的 pH、TSS、VSS 和 COD。
代表性结果
食物垃圾成分
这项研究中使用的食物垃圾包括五种不同的食物类型,通常在大学餐饮设施中供应。每种食物样本的脂肪、碳水化合物和蛋白质含量各不相同,如 表2所示。19 混合的食物残渣是44%的碳水化合物,36%的蛋白质,16%的脂肪和4%的其他材料。每种食物类型(56 g 至 86 g)的质量大致相等,用于提供用于厌氧共消化的代表性餐饮设施有机底物。随后对食物残渣的质量进行改变,以达到所检查的每种情景(0.3、0.7 和 1.1)所需的 F:M。
挥发性悬浮固体和有机物测量
初始和最终VSS以及初始和最终需氧量的结果见 表3。需氧量以 BOD5 表示,它是使用公认的转换率 (COD = 1.6BOD5)8 从 COD 转换而来的。如图所示,初始VSS浓度( 在表3中也按质量表示)从对照增加到最大F:M比(1.1)。每个被检查的F:M都表现出VSS破坏,或有机物厌氧转化为甲烷和二氧化碳的气态终产物。由于转换,VSS的浓度从初始测量值下降到实验结束时的最终测量值。VSS破坏量从对照增加到更大的F:M比。出乎意料的是,F:M = 0.7 情景的 VSS 破坏超过了 F:M = 1.1 情景,这可能是由于 F:M 1.1 情景的抑制。
测得的初始需氧量浓度遵循与VSS相同的趋势,即从对照增加到最大的F:M比值(表3)。与VSS破坏类似,BOD5 浓度在初始浓度和最终浓度之间下降,但对照组除外。对照组的需氧量增加,可能是由于内源性腐烂所致。与VSS破坏不同,从初始测量到最终测量,每个样品的需氧量减少相对较低,范围在1%至3%之间,并且F:M比没有变化趋势。造成这种趋势的一个可能原因是颗粒有机物向可溶性有机物的转化,这发生在很长的时间范围内,并且通常是厌氧微生物联盟20代谢中的限速步骤。
甲烷生产
在 190 小时的研究期间,甲烷产生的数量和速率在 F:M 比范围内变化。实验结果表明,较高的F:M比可增加甲烷的总体积(图7)。未添加底物的对照组产生少量甲烷(~72 mL),这可能是由于污泥中可溶性BOD5的含量相对较少和/或内源性腐烂所致。正如预期的那样,在其他情况下添加底物相对于对照组增加了甲烷的产生。F:M 为 0.3 情景产生的甲烷(按体积计)(~354 mL)是对照组的 5 倍。将 F:M 比增加到 0.7 产生的甲烷 (~574 mL) 是 F:M 为 0.3 情景的 1.6 倍。同样,将 F:M 比增加到 1.1 产生的甲烷 (~1098 mL) 是 F:M 为 0.7 情景的 1.9 倍。表4列出了每个F:M比的最大观测体积甲烷产量值(Y最大值)。随着时间的推移,甲烷的产生率也随着F:M比的检查而变化。如图 8 所示,甲烷产生率以及研究期间产生甲烷的时间长度随着 F:M 的增加而增加。例如,在 F:M 为 0.3 的情景中,研究 129 小时后(最大为 354 mL)没有观察到甲烷产生,而 F:M 为 1.1 的情景在研究结束时仍产生少量甲烷。在所有情况下,由于基质可用性降低,甲烷的产生率随着时间的推移而下降。虽然在研究结束时仍然有丰富的需氧量(表3),但它可能不是生物可利用的形式,或者厌氧微生物群的剩余电子受体(例如二氧化碳)可能有限。最后,对每次观察到的VSS销毁产生的甲烷(mL)(mg)的比较表明,F:M的值为0.3和0.7,范围为1.3至1.6 mL/mg,而F:M为1.1,每单位VSS销毁产生的甲烷(3.7 mL/mg)(表4)。Tchobanoglous 等人(2014 年)提供了常见原料每单位固体破坏的气体产量的典型范围,包括脂肪 (~1.4 mL/mg)、油脂 (~1.1 mL/mg) 和蛋白质 (~0.7 mL/mg)8。Mata-Alvarez等人(2014年)回顾了在实验室规模和中试规模生物反应器中,将废水污泥与各种基质和不同基质比例(例如,WAS和FOG的不同比例)共同消化的研究10。他们发现,报告的每单位VSS销毁的甲烷产量与共同消化的底物以及底物的比例有很大差异,范围从每mg VS销毁的0.2 mL至1.1 mL沼气不等。该研究的代表性结果,特别是 F:M 为 0.3 和 0.7 的结果与比较研究的结果相比具有优势。
生物动力学参数
甲烷随时间推移的产生可用于确定几个重要的生物动力学参数。这些生物动力学参数可以进一步用于预测类似情况下的甲烷产生,而无需使用呼吸计。甲烷产生率常数 k 可以使用对数最小二乘拟合来得出每个检查的 F:M 比值(即图 8 中所示的那些)的观测呼吸计数据。F:M 为 0.3 情景的代表性对数函数为 y = 93.465ln(X) - 175.91。在这里,值 93.465 以小时为单位,必须将其转换为天,然后反转,得出 k = 0.257。表4列出了所检查的每个F:M比值的速率常数(k)和决定系数(R2)。
然后,可以利用速率常数来确定每个 F:M 比在任何给定时间的甲烷产量。有机基质随时间推移产生的甲烷速率可以使用以下公式 [1]21 进行建模:
(1)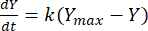
将上述方程在极限 t = 0 到 t = t 之间进行积分,得到以下 [2]:
(2)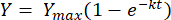
式中,Y = 任何时间的甲烷产量 [mL];Ymax = 呼吸计研究观察到的最大甲烷产量 [mL]; k = 甲烷生产率常数 [d-1];t = 时间 [d]
虽然上述用于开发生物动力学参数的一阶方法为实验数据提供了非常合理的拟合(如表 4 中的 R2 值所示),但其他研究报告了使用其他模型来拟合甲烷生产数据,包括改进的 Gompertz 模型、双底物模型和锥体模型2。

图 1:食物垃圾搅拌机。用于混合食物垃圾的标准搅拌机。请点击这里查看此图的较大版本.

图 2:呼吸计。 完整的呼吸计设置,用于测量甲烷的产生。 请点击这里查看此图的较大版本.

图 3:呼吸计冷却器中的样品瓶。 带有八个样品瓶的呼吸计冷却器内部视图。 请点击这里查看此图的较大版本.

图 4:呼吸计洗涤器。 近距离 view 呼吸计洗涤器。 请点击这里查看此图的较大版本.
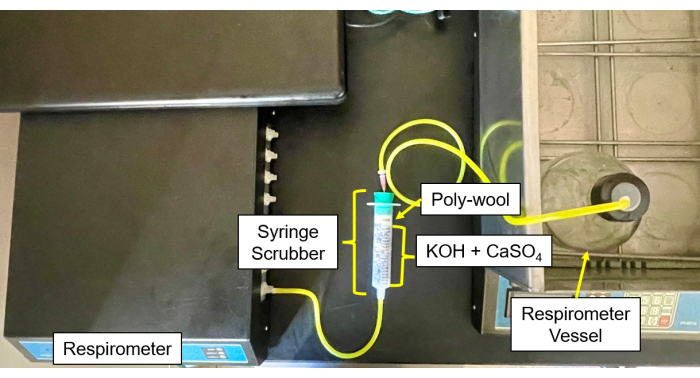
图 5:呼吸计洗涤器到控制模块。 控制模块和洗涤器设置的呼吸计图像。 请点击这里查看此图的较大版本.

图 6:呼吸计洗涤器管路设置。 近距离观察样品瓶和呼吸计之间的洗涤器管路设置。 请点击这里查看此图的较大版本.
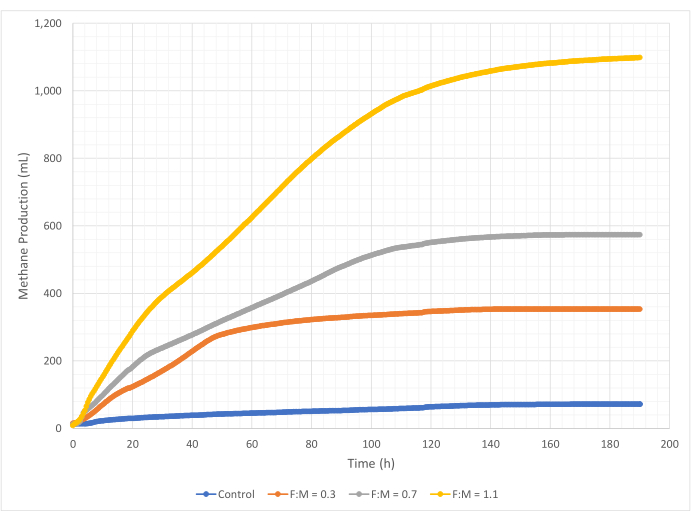
图 7:使用不同 F:M 比的甲烷总产量。 每F:M(0.3,0.7,1.1)的甲烷产量随时间(0小时至190小时)而变化。 请点击这里查看此图的较大版本.
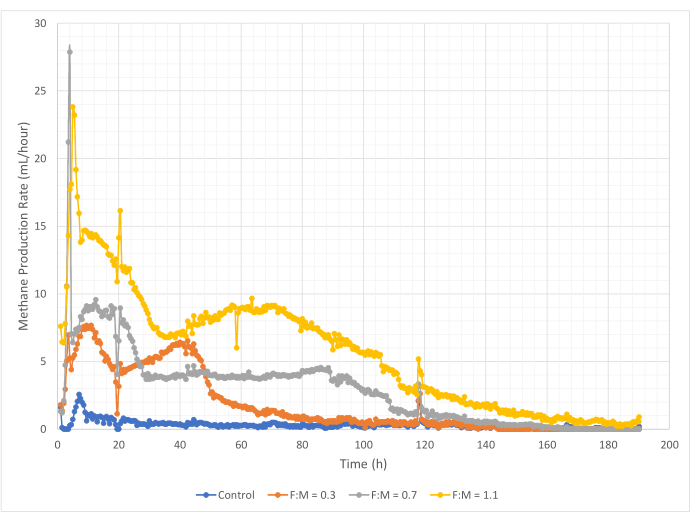
图 8:使用不同 F:M 比的甲烷生产率。 每F:M(0.3,0.7,1.1)的甲烷产生率随时间(0 h至190 h)而变化。 请点击这里查看此图的较大版本.
表 1:具有食品与微生物比率的样品瓶成分。 每个 F:M (0.3, 0.7, 1.1) 和空白瓶的组成质量、浓度和体积。 请按此下载此表格。
表2:样品有机底物组成。 食物垃圾的质量和百分比,按食物和碳水化合物、蛋白质和脂肪的比例划分。 请按此下载此表格。
表 3:样品挥发性悬浮固体和需氧量结果(±标准差)。 每个F:M的VSS和COD(0.3,0.7,1.1)。 请按此下载此表格。
表 4:样品动力学参数。 基于甲烷产量计算的动力学参数。 请按此下载此表格。
讨论
该协议中提供的方法可以帮助研究人员和从业人员使用呼吸测定法确定厌氧消化有机废物流的生物甲烷潜力。在该协议中,我们展示了典型食物残渣废物流的共同消化产生的甲烷与污水处理厂的WAS在F−M比范围内产生的甲烷。该协议通过提供一种逐步的呼吸测量方法,用于连续测量甲烷产生和使用一阶动力学建模确定生物动力学参数,从而增加了文献。其他几项研究采用了微观实验,测量离散时间点的甲烷产量10,22,而其他研究则使用连接到长时间运行的连续流动台式或中试规模生物反应器的流量计测量甲烷14,23。呼吸测量法具有在各种实验条件下连续测量甲烷产量的优势。由于呼吸测量实验不需要建造生物反应器,因此与一些实验室规模或中试规模的实验相比,可以相对频率地修改实验条件。由于这一优点,呼吸测量实验可用于确定在相对较短的时间内共消化多种有机废物组合产生的甲烷。例如,作为本研究中提出的协议的下一步,脂肪、油和油脂的化学能相对于WAS非常密集,可以与食物残渣共同消化,以量化甲烷产生随着时间的推移可能增加。这种方法的应用可以继续构建有关共消化方案中多种底物组合的甲烷生成速率和生物动力学参数的文献体系。此外,除了确定最佳底物组合外,甲烷生产结果和生物动力学参数还可用于为现有程序(例如为废水处理设计的程序)中的性能建模提供信息,或预测共消化方案在从实验室或中试规模扩大到全面规模时将如何执行24,25。
此外,该协议可以进行修改,以应用为厌氧微生物联盟定制的底物进料。例如,如果研究人员想要检查仅向厌氧微生物群提供碳水化合物或仅提供蛋白质的影响,那么该协议中的原料可以相应地改变。或者,如果研究人员想要测试添加特定部分的 COD(例如,仅可溶性 COD 或仅颗粒 COD)或高浓度的特定底物(例如,乙酸盐、挥发性脂肪酸和厌氧代谢的中间产物)对甲烷产生的影响,可以使用该协议的变体。在修饰底物或交替特定底物的 F:M 时,观察到的最佳实践是保持每个样品的厌氧微生物群质量相同,同时仅调整底物的质量(应采用质量比)。除了修改底物外,研究人员还可以将此协议与其他分析一起使用,以更好地了解底物的使用和甲烷的产生。例如,研究人员可以将该协议与微生物群落分析(例如,16S rRNA基因测序或宏基因组学)结合使用,以更好地将群落结构与功能联系起来。
尽管这种方法很有用,但也存在一些局限性。呼吸计和生物甲烷电位测试最常配置为间歇式反应器;然而,全尺寸厌氧共消化池通常作为连续流系统运行,污泥保留时间超过 10 天1。因此,从呼吸测量实验中收集的数据可用于估计甲烷生成率和开发生物动力学参数,但在可行的情况下,应使用随时间推移运行的更大规模的消化器在现场验证这些数据。
此外,在进行呼吸测量之前,必须小心选择和制备样本。大的食物残渣颗粒会扭曲 VSS 和 COD 测量值,并可能提供不准确的结果。如果使用食物残渣作为基质,则混合物应充分浸渍并且没有大的食物颗粒 - 这种方法类似于在全尺寸消化池的食物残渣接收坑中浸渍。用去离子水稀释可以帮助混合过程,类似于在食物残渣大规模浸渍时通常使用的加水。但是,应尽一切努力确保正确测量稀释度并达到目标水份含量。稀释很容易成为错误的根源,特别是如果没有经验的学生正在执行此协议。
由于共消化中存在的微生物联盟含有专性厌氧菌,因此必须特别注意在转移和样品制备过程中消除(或大大减少)氧气暴露。可以通过氮气冲洗从样品瓶中去除氧气。此外,如果有的话,在收集瓶和呼吸计样品瓶之间转移厌氧培养物的工作应在厌氧室中进行。由于呼吸计提供一致的结果(甲烷产量和速率),因此在测试开始时可以很容易地识别出与预期结果的任何偏差,例如,无法生存的微生物联盟。使用重复或一式三份的样本可以进一步帮助识别错误的测试。
披露声明
作者没有什么可透露的。
致谢
我们感谢 Respirometer Systems and Applications 的 Jim Young 博士就该协议的开发进行讨论。
材料
| Name | Company | Catalog Number | Comments |
| 103 °C Oven Isotemp | Fisher Scientific | 13-247-737F | Model: 737F, Force Air Oven |
| 550 °C Vulcan Oven | Neytech (Manufacturer) / Cole Palmer (Vendor) | 9493308 | Model: 3-550 |
| Aerobic/Anaerobic Respirometer | Respirometer System and Applications (RSA) | PF-8000 | Model: PF-8000 |
| Analytical Balance | Mettler Toledo | 30029075 | Model: ME204E, Detection Limit: 0.1 mg |
| Smoothie Blender with 56 oz Plastic Jar | Hamilton Beach | 50190F | Model: 50190F |
| COD Vials TNT Plus Vial Test | HACH | TNT821 | TNT 821, 3–150 mg/L COD |
| COD Vials TNT Plus Vial Test | HACH | TNT822 | TNT 822, 20–1500 mg/L COD |
| Dessicator | SP Bel-Art | 942070050 | Model: SP Scienceware |
| Dionized Water System | Milli-Q | ZIQ7010T0C | IQ 7010 Pure & Ultrapure Water Purification System |
| Anhydrous CaSO4 | W.A. Hammond Drierite Company | 13001 | 8 Mesh, 1 lb |
| Glass Fiber Filters | Whatman (Manufacturer) / Cole-Parmer (Vendor) | 1827-150 | Model: 934-AH |
| Heat Digestor Block | HACH | DRB200-02 | DRB 200 |
| Hot Plate Stirrer | Corning | 6795-620D | Model: PC-620D |
| Industrial-Grade Nitrogen (Compressed Cylinder) | Air Gas | NI UHP300 | 300 cubic feet |
| Pellets (KOH) | Fisher Scientific | AC134062500 | 500 g |
| pH Meter | Fisher Scientific | 13-636-AP115 | AP115, Accumet pH meter |
| UV Spectrophotometer | HACH | LPV400.99.00012 | DR 3900 |
| Vaccum Pump | GAST | 1HAB-25-M100X |
参考文献
- Mainardis, M., Buttazzoni, M., Cottes, M., Moretti, A., Goi, D. Respirometry tests in wastewater treatment: Why and how? A critical review. Sci Total Environ. 793, 148607 (2021).
- Pan, Y., et al. Synergistic effect and biodegradation kinetics of sewage sludge and food waste mesophilic anaerobic co-digestion and the underlying stimulation mechanisms. Fuel. 253, 40-49 (2019).
- Argiz, L., et al. Assessment of a fast method to predict the biochemical methane potential based on biodegradable COD obtained by fractionation respirometric tests. J Environ Manage. 269, 110695 (2020).
- Carucci, A., et al. Aerobic storage by activated sludge on real wastewater. Water Res. 35 (16), 3833-3844 (2001).
- McCarty, P. L., Bae, J., Kim, J. Domestic wastewater treatment as a net energy producer-Can this be achieved. Environ Sci Technol. 45 (17), 7100-7106 (2011).
- McCarty, P. The development of anaerobic treatment and its future. Water Sci Technol. 44 (8), 149-156 (2001).
- From farm to kitchen: The environmental impacts of U.S. food waste Part 1. United States Environmental Protection Agency Available from: https://www.epa.gov/system/files/documents/2021-11/from-farm-to-kitchen-the-environmental-impacts-of-u.s.-food-waste_508-tagged.pdf (2021)
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . WastewaterEngineering:TreatmentandReuse. 5th ed. , (2014).
- Pfluger, A., et al. Anaerobic digestion and biogas beneficial use at municipal wastewater treatment facilities in Colorado: A case study examining barriers to widespread implementation. J Clean Prod. 206, 97-107 (2019).
- Mata-Alvarez, J., Dosta, J., Romero-Güiza, M. S., Fonoll, X., Peces, M., Astals, S. A critical review on anaerobic co-digestion achievements between 2010 and 2013. Renew Sust Energ Rev. 36, 412-427 (2014).
- Pfluger, A. R., Hahn, M. J., Hering, A. S., Munakata-Marr, J., Figueroa, L. Statistical exposé of a multiple-compartment anaerobic reactor treating domestic wastewater. Water Environ Res. 90 (6), 530-542 (2018).
- Razaviarani, V., Buchanan, I. D. Calibration of the Anaerobic Digestion Model No. 1 (ADM1) for steady-state anaerobic co-digestion of municipal wastewater sludge with restaurant grease trap waste. Chem Eng J. 266, 91-99 (2015).
- Zhu, H., et al. Biohydrogen production by anaerobic co-digestion of municipal food waste and sewage sludges. Int J Hydrog Energy. 33 (14), 3651-3659 (2008).
- Serna-García, R., Ruiz-Barriga, P., Noriega-Hevia, G., Serralta, J., Pachés, M., Bouzas, A. Maximising resource recovery from wastewater grown microalgae and primary sludge in an anaerobic membrane co-digestion pilot plant coupled to a composting process. J Environ Manage. 281, 111890 (2021).
- Gossett, J. M., Belser, R. L. Anaerobic digestion of waste activated sludge. J Environ. 108 (6), 1101-1120 (1982).
- Yi, H., Han, Y., Zhuo, Y. Effect of combined pretreatment of waste activated sludge for anaerobic digestion process. Procedia Environ Sci. 18, 716-721 (2013).
- Nah, I. W., Kang, Y. W., Hwang, K. Y., Song, W. K. Mechanical pretreatment of waste activated sludge for anaerobic digestion process. Water Res. 34 (8), 2362-2368 (2000).
- American Public Health Association. . Standard Methods for the Examination of Water and Wastewater. Vol. 10. American Public Health Association. , (2012).
- Food Data Central. US Department of Agriculture Available from: https://fdc.nal.usda.gov/ (2024)
- Vanzin, G., Pfluger, A., Almstrand, R., Figueroa, L., Munakata-Marr, J. Succession of founding microbiota in an anaerobic baffled bioreactor treating low-temperature raw domestic wastewater. Environ Sci Water Res Technol. 8 (4), 792-806 (2022).
- Negi, S., Dhar, H., Hussain, A., Kumar, S. Biomethanation potential for co-digestion of municipal solid waste and rice straw: a batch study. Bioresour Technol. 254, 139-144 (2018).
- Rostkowski, K. H., Pfluger, A. R., Criddle, C. S. Stoichiometry and kinetics of the PHB-producing Type II methanotrophs Methylosinus trichosporium OB3b and Methylocystis parvus OBBP. Bioresour Technol. 132, 71-77 (2014).
- Pfluger, A., Vanzin, G., Munakata-Marr, J., Figueroa, L. An anaerobic hybrid bioreactor for biologically enhanced primary treatment of domestic wastewater under low temperatures. Environ Sci Water Res Technol. 4 (11), 1851-1866 (2018).
- Callahan, J. L., Pfluger, A. R., Figueroa, L. A., Munakata-Marr, J. BioWin® modeling of anaerobic sludge blanket treatment of domestic wastewater. Bioresour Technol Rep. 20, 101231 (2022).
- Linvill, C., Butkus, M., Bennett, E., Wait, M., Pytlar, A., Pfluger, A. Energy balances for proposed complete full-scale anaerobic wastewater treatment facilities. Environ Eng Sci. 40 (11), 482-493 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。