微流控方法解决单个多功能细胞的同时和连续细胞因子分泌
* 这些作者具有相同的贡献
摘要
该协议描述了一种先进的微流体平台,用于定量测量单个人外周血单核细胞的细胞因子分泌动力学。例如,该平台可同时测量脂多糖刺激的每个细胞的多达三种细胞因子(IL-6、TNFα 和 IL-1β)。
摘要
感染、自身免疫性疾病、对治疗的期望和不良免疫反应可导致 体内复杂而动态的细胞因子反应。这种反应涉及许多免疫细胞分泌各种细胞因子来协调免疫反应。然而,由于缺乏适当的研究工具,各种细胞亚型对不同细胞因子的分泌动力学、数量和共现仍然知之甚少。在这里,我们描述了一种使用微流体液滴平台的方案,该平台允许在单细胞水平上并行对几种细胞因子的分泌动力学进行时间分辨定量测量。这是通过将单个细胞封装成微流控液滴以及用于细胞因子浓度平行定量的多重免疫测定、用于动态荧光成像的固定以及分析相应图像以获得分泌量和动力学来实现的。该方案描述了功能化磁性纳米颗粒的制备、校准实验、细胞制备以及将细胞和纳米颗粒封装成液滴,用于荧光成像和随后的图像和数据分析,使用脂多糖刺激的人外周血单核细胞的例子。所提出的平台确定了单个细胞和共分泌细胞的不同细胞因子分泌行为,表征了测量细胞样品中预期的表型异质性。此外,该检测的模块化特性使其能够适应和应用于研究各种蛋白质、细胞因子和细胞样品,从而有可能更深入地了解不同免疫细胞类型之间的相互作用以及动态分泌的不同细胞因子在塑造严格调节的免疫反应中的作用。这些新见解在免疫失调的研究或确定治疗和药物开发中的目标人群时可能特别有趣。
引言
感染通常会引起复杂的宿主反应,涉及先天免疫系统和适应性免疫系统 1,2。在感染或识别感染源后,宿主细胞可以产生多种化疗因子和细胞因子,这些小蛋白被称为关键通讯器和免疫系统的调节剂3。促炎细胞因子在感染早期释放以启动免疫反应,随后是抗炎细胞因子,这对于防止组织损伤和随后的慢性或自身炎症性疾病至关重要。威胁消除和组织保护之间的这种平衡表现为广泛的细胞因子在感染过程中发挥不同的功能,从而允许对反应进行微调 4,5。在这种混合物中,根据病原体及其诱导的信号、组织位置以及它们来源的免疫细胞,可以观察到独特的特征。然而,细胞因子的释放似乎也构成了每个细胞群独有的多功能生物过程,在分泌动力学和个体反应方面各不相同。这种异质性已在文献中描述多年,例如,在 T 细胞亚群中 6,7,其中对自身炎症性疾病和严重 COVID-19 感染的研究显示,患者内部和患者之间炎症标志物的功能多样性很大 8,9.最近,单细胞测序的出现凸显了免疫微环境中亚群之间的高可塑性和串扰,这在以前并不明显,这表明单细胞方法对于捕获这种异质性是必要的10,11。虽然正在开发新的方法来分析转录组,但表型分析仍然具有挑战性,因为这需要在单细胞水平上同时、定量和时间分辨地测量蛋白质分泌。此类测量使我们能够研究一组或一组细胞因子的分泌细胞身份、动力学和分泌模式(慢/快、早/晚、同时/顺序)。通过能够定量和时间分辨率地研究免疫反应期间细胞因子释放的动力学,由此产生的见解可能有助于了解细胞集合和诱导反应。
在标准方案中,通常使用酶联免疫吸附测定 (ELISA) 检测细胞悬液和血清上清液中的细胞因子,产生大量分泌物。批量测量无法定量每个细胞产生的细胞因子量,这一问题在异质细胞样品中尤为突出。细胞内细胞因子染色、酶联免疫斑点 (ELISpot) 测定或微雕刻测定(例如 Isoplexis)等替代方法可检测单个细胞表达的细胞因子,但仅提供终点测量值12,13。这意味着细胞分泌模式在孵育时间内可能发生的分泌动力学和变化将被忽略。此外,终点测量无法区分同时和连续的细胞因子分泌,因此使用这些方法仍不清楚免疫细胞在细胞因子分泌中同时多功能的真实程度。
使用液滴微流体生成和处理皮升大小的物理隔室可以实现单细胞分辨率,以便在单细胞水平上研究免疫细胞独特的细胞因子分泌表型14,15。这些隔室由油包水乳液组成,可以使用微流控芯片产生16,17。事实上,基于液滴的微流控检测在单细胞水平上分析不同的生物样品和库以及它们与上游(细胞和试剂处理)和下游工艺(单细胞分选、蛋白质组学或测序)的整合方面表现出极高的多功能性18,19,20,21,22.特别是,允许液滴固定的设置允许测量单细胞功能随时间的变化,这对于分析蛋白质分泌很有价值18。此外,整合多重定量分析有助于在以前无法触及的维度中进行更多研究,例如共分泌和多功能免疫细胞的鉴定等过程23,24。
在该协议中,我们描述了一种基于固定化液滴的单细胞工作流程,用于检测、量化和时间测量单个细胞平行分泌多达三种细胞因子17,23。该技术能够并行监测超过 20,000 个细胞的细胞因子反应。
所提出的工作流程包括将单个免疫细胞和功能化纳米颗粒微流体封装成 60 pL 油包水液滴。将 >100,000 个液滴固定在观察室中和时间分辨荧光显微镜可以测量每个液滴和每个细胞因子内的细胞因子分泌动力学(图 1A)。对于液滴中的每个细胞,通过夹心免疫测定法测量细胞因子的分泌,其中用特异性捕获抗体功能化的磁性纳米颗粒结合分泌的细胞因子,导致荧光标记的检测抗体随后重新定位和结合(图 1B、C)。通过对齐磁性纳米颗粒形成珠线,在细胞因子存在下可以量化荧光重新定位。在这里,荧光重定位定义为在珠条上发现的平均荧光强度除以剩余液滴的平均荧光强度。通过混合不同功能化的纳米颗粒批次和在不同荧光通道中标记的相应检测抗体,该测定可以针对多种细胞因子进行多重检测23,从而在不同通道中产生特异性荧光重新定位。借助定制的分析脚本,可以提取荧光重新定位值,并将图像转换为每个细胞和细胞因子的分泌动态图谱。因此,所得数据集会产生大量读数,例如随时间推移的定量分泌测量、共分泌亚群的鉴定以及根据细胞因子的分泌量、速率和组合的细胞分布。
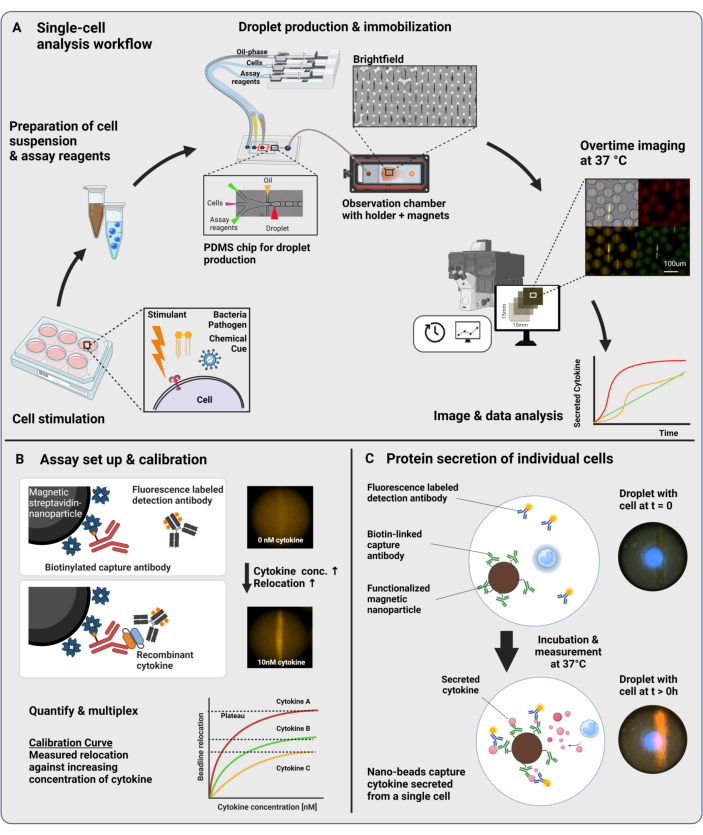
图 1:工作流程和检测原理。 (A) 刺激后分析细胞因子分泌细胞的工作流程概述。制备单细胞悬液和磁性纳米颗粒,并将其封装到 60 pL 体积的油/水乳液(液滴)中。在测量之前,将液滴固定并在磁场内对齐纳米颗粒,每 30 分钟长达 4 小时。最后,分析图像,并提取每个液滴、时间点和荧光通道的参数。这个数字是从17 修改而来的。(B) 液滴夹心生物测定的原理。功能化的纳米颗粒与分泌的细胞因子结合,这导致荧光标记的检测抗体随后重新定位到纳米颗粒上。这种荧光的重新定位通过用重组细胞因子进行的校准实验进行定量和验证。混合不同的功能化纳米颗粒可同时对多达三种细胞因子进行多重测量。(C) 在基于细胞的实验中,在测量时间内跟踪液滴,并通过荧光重新定位到纳米颗粒上的加班时间增加来识别分泌细胞。Schematics 未达到比例。使用 BioRender.com 创建的图窗。 请单击此处查看此图的较大版本。
研究方案
所有实验均根据伦理协议 EK202-N-56 进行,并经苏黎世联邦理工学院伦理委员会批准。人类细胞的处理是在生物安全 2 级实验室的层流柜中进行的。
注:以下部分详细介绍了在单细胞水平上测量时间分辨细胞因子分泌的方案。此处概述的程序适用于用脂多糖 (LPS) 刺激外周血单核细胞 (PBMC) 以及细胞因子 IL-6、TNFα 和 IL-1β 的平行测量。但是,如果需要,该方案可以适用于其他细胞类型、兴奋剂和细胞因子。
1. 观察室的制作
注:为避免液滴在成像过程中移动,准备了一个高度比液滴直径小约 10% 的观察室。
- 切割双面胶带和顶部载玻片的准备
- 在切割软件的 Design 选项卡中绘制或加载所需的腔室切口设计。有关此处使用的具体尺寸,请参见 图 2E。
- 用胶带将 32 μm 厚的双面胶带固定在胶粘剂切割垫上,然后将切割垫放入自动切割机中。
- 在步骤 1.3 中,将腔室设计从胶带中剪下来,同时注意沿同一方向切割腔室的长边,以便于分离。
- 将胶带切口存放在室温下以便长期储存。对于短期储存,请将它们储存在 -20 °C,并在步骤 1.3 之前不久将其取出。以便于操作。
- 在一个标准显微镜载玻片 (76 mm x 26 mm x 1 mm) 的中间钻两个直径约为 1 mm 的孔,两个孔之间的距离约为 3.5 cm。
- 载玻片的清洁和等离子活化
- 使用肥皂清洁一张有孔的载玻片和一张无孔的载玻片。用蒸馏水冲洗干净,并使用无绒精密湿巾擦干。
- 将载玻片放入等离子清洗剂中,以 55 W 的功率对顶部表面进行等离子处理 10 分钟。取下载玻片并继续执行步骤 1.3。
- 腔室组件
- 将带孔的载玻片放在干净的表面上,等离子体活化面朝上,不要接触活化表面。
- 沿相同的切割方向从双面胶带的一侧去除保护层。在不接触的情况下,将胶带切口与载玻片的边缘和钻孔对齐,然后从短边开始慢慢将胶带与载玻片接触。
注意:注意不要在胶带中产生任何拉伸或折叠,因为这会导致腔室高度不正确。由于此步骤容易出错并且需要一些实践经验,因此建议同时准备多个载玻片。 - 再次沿切割方向从胶带上取下第二个保护层,然后放置第二个无孔的载玻片,激活表面朝下。将一块平板放在顶部,然后用上半身的力量向下按压约 10 秒,将两张载玻片的整个表面压在一起。
- 组装好两个载玻片后,翻转腔室,使两个孔面向您。将少量 UV 固化胶水放入端口下方的环中,然后将端口放在载玻片孔的顶部,将纳米端口粘到两个孔上。在端口周围添加一圈 UV 固化胶水,然后用 UV 灯固化胶水。腔室现在应如图 2E 所示。立即执行步骤 1.4。
注意:紫外线会伤害眼睛和皮肤。穿戴适当的防护装备。
- 腔室表面的亲氟涂层
注意:此步骤应在载玻片等离子处理后 1 小时内进行(步骤 1.2.2),以确保良好的涂层效率。- 在氟化油 (HFE-7500) 中新鲜制备 1 mL 1% 氟硅烷溶液(1H、1H、2H、2H-全氟癸基三氯硅烷),并将其填充到注射器中。将涂层溶液通过 PTFE 针式过滤器和连接到 0.3 mm x 0.76 mm PTFE 微管的 27G x 0.75 英寸针头推入观察室。
- 孵育 1 分钟后,在通风橱下使用氮气压力将包被溶液冲出腔室。使用另一个注射器组件用氟化油(仅限 HFE-7500)冲洗腔室。
- 在室温 (RT) 下储存装满氟化油且入口封闭的腔室。每次实验后,直接洗掉细胞和液滴,以确保涂层得到良好的保存。
注意:该方案可以在此处暂停,并且腔室可以储存和重复使用数月。
- 带磁铁的腔室支架
- 为了对准磁性纳米颗粒,在液滴封装和成像过程中向观察室施加静磁场。为此,将腔室放在定制的 3D 打印显微镜支架中(参见 图 2D 和 Bounab 等人 17 补充数据 4 中的文件),该支架沿腔室的长边放置两个钕磁铁。
2. 纳米颗粒功能化
注:每种细胞因子的纳米颗粒功能化过程相似,唯一的区别是添加了细胞因子特异性捕获抗体。每种细胞因子的功能化在不同的、单独的反应管中平行进行。在此方案之前,TNFα 捕获抗体和 IL-1β 检测抗体分别在内部用生物素和 Alexa Fluor 647 标记。根据供应商网站上找到的制造商方案进行偶联(参见 材料表中的链接),将抗体分装并储存在 -20 °C 下。
- 将 50 μL 链霉亲和素官能化纳米颗粒(直径 (Ø) 300 nm)加入用于 TNFα 检测的试管中,50 μL 用于 IL-1β,100 μL 用于 IL-6。在磷酸盐缓冲盐水 (PBS) 中以 1:1 (v/v) 稀释纳米颗粒溶液。
- 向每管中加入 1/20 (v/v) 相应体积的生物素化捕获抗体(储备浓度为 0.5 mg/mL),并在室温下孵育 30 分钟。
注:向纳米颗粒溶液中加入小体积时,将体积沉积在管的顶部,并用大部分溶液多次冲洗。这确保了适当的混合并防止聚集体的形成。 - 向试管中加入 1/100 (v/v) 的 1 mM D-生物素溶液,并在室温下孵育 5 分钟。这导致最终生物素浓度为 10 μM。
注:过量的生物素会阻断纳米颗粒上的自由结合面,并减少不需要的聚集体形成。 - 通过将钕磁铁靠近管子来收集颗粒。等到上清液澄清后弃去上清液。
注:整个分析过程中使用的磁体表现出非常强的吸引力,如果两个磁体意外卡在一起,可能会造成物理伤害。 - 为了减少对纳米颗粒表面的非特异性吸附,立即将纳米颗粒重悬于Pluronic F-127步骤2.1最终体积的0.5倍(10%)和PBS体积的0.5倍中。将溶液在 RT 下孵育 30 分钟。
- 使用磁铁收集颗粒,弃去上清液,并重悬于 1 倍体积的储存缓冲液(RPMI 1640,5% 敲除血清替代物,1% Pen/Strep,1% 重组人血清白蛋白 (HSA),25 mM HEPES,0.1% Pluronic F-127)。将溶液在 RT 下孵育 30 分钟。
注意:该方案可以在此处暂停,并且颗粒现在可以在 4 °C 下储存长达 1 周。 - 在封装之前,立即通过移液重悬颗粒,并以 2:1:1 (v/v) 的比例分别混合 IL-6:TNFα:IL-1β 的共轭纳米颗粒。
注:功能化纳米颗粒的不同比例取决于每种细胞因子使用的抗体对,并且已通过校准样品通过实验确定以获得最佳动态范围。 - 用磁铁收集颗粒,弃去上清液并重悬,用完全培养基(RPMI 1640、10% FBS、1% Pen/Strep、25 mM HEPES)洗涤。重复此步骤,但仅重悬于步骤 2.7 中完整培养基体积的 0.5 倍中。
- 向溶液中加入不同标记的 IL-6、TNFα 和 IL-1β 检测抗体,使每种抗体的最终浓度达到 10 nM。该解决方案现在已准备好用于液滴实验。
3. 细胞制备
注:PBMC 是从苏黎世血库收到的血沉棕黄层中分离出来的。将细胞冷冻并储存在冻存管(1 x 107 个细胞/小瓶)中的液氮中数月。
- 细胞解冻
- 在实验开始前 1 小时,将完全培养基和 MACS 缓冲液(2 mM EDTA,0.5% BSA 在 DPBS 中,无菌过滤)在 RT 中预热。通过将 9 mL 完全培养基加入 15 mL 试管中并将其保持在 37 °C 的水浴中,制备含有细胞的试管。
- 从液氮中储存的 PBMC 冻存管(包含 ~1 x 107 个细胞)中取出。在 37 °C 的水浴中旋转冻存管,直到只剩下少量冰。
- 用 70% EtOH 擦拭管子,然后将其转移到层流柜中。向冻存管中加入 1 mL 预热的完全培养基,轻轻混合,然后将所有细胞转移到含有温热完全培养基的试管中。冷冻管可以用 1 mL 温热的完全培养基洗涤,以回收最大数量的细胞。
- 在 RT 下以 500 x g 离心细胞 5 分钟,弃去上清液,用移液管轻轻重悬含有 1 mL 完全培养基的细胞沉淀。加入 9 mL 完全培养基。
- 在 RT 下以 500 x g 离心细胞 5 分钟。弃去上清液,并像以前一样重悬于 1 mL 完全培养基中。
- 使用可用的细胞计数器对细胞进行计数。在这种情况下,使用了自动细胞计数仪。将 10 μL 细胞悬液与 10 μL 台盼蓝混合,并将 10 μL 混合物转移至细胞计数载玻片中,对细胞进行计数。
- 染色和 FcR 封闭
- 计算细胞总数和以 2 x 106 个活细胞/mL 重悬细胞所需的体积。通过在 PBS(工作浓度为 5 μM)中稀释原液 (5mM) 1000 倍来制备细胞染色溶液 (CellTrace Violet)。
- 在 RT 下以 500 x g 旋转细胞 5 分钟。弃去上清液,并将细胞重悬于步骤 3.2.1 中制备的计算体积的细胞染色溶液中。将细胞在 37 °C 下孵育 5 分钟。
- 在孵育结束时,通过添加完全培养基(至少 2 倍染料溶液体积)来淬灭溶液中剩余的染料。在 RT 下以 500 x g 旋转细胞 5 分钟。
- 弃去上清液,将细胞沉淀重悬于 60 μL MACS 缓冲液中,每 1 x 107 个细胞加入 20 μL 人 FcR 块。将细胞在 RT 下孵育 10 分钟。
- 用 MACS 缓冲液将试管填充至 10 mL,并在室温下以 500 x g 离心细胞 5 分钟。
- 弃去上清液,将细胞重悬于 1mL 完全培养基中按照步骤 3.1.6 中的说明对细胞进行计数。
- 用 LPS 刺激细胞
- 使用细胞计数,以 1 x 106 个细胞/mL 的浓度稀释细胞,并将 2 mL 细胞转移到超低结合力 6 孔板中的每个孔中。
- 在完全培养基中稀释 LPS,并将其加入含有细胞的孔中,使 LPS 的最终浓度为 1 μg/mL。将细胞在 37 °C 下孵育 6 小时。
- 封装准备
- 在刺激时间结束时,将细胞悬液转移到新的 15 mL 试管中。
- 将 1 mL 完全培养基加入空孔中。使用细胞刮刀,分离剩余的细胞。将细胞转移到新的 15 mL 试管中。用 1 mL 完全培养基洗涤孔,然后转移到另一个 15 mL 试管中。
- 在 RT 下以 500 x g 旋转两根试管 5 分钟,并将 1 mL 未稀释的上清液溶液(来自包含未洗涤细胞的第一管)转移到新试管中,以便在需要时进行进一步分析(例如,ELISA)。
- 丢弃其余的上清液。
- 将沉淀重悬于 0.5 mL 完全培养基中,混合来自同一孔的细胞,然后将它们转移到离心管中。如步骤 3.1.6 中所述对细胞进行计数。
- 在 RT 下以 500 x g 离心细胞 5 分钟,并丢弃大部分上清液(留下约 100 μL)。在不重悬沉淀的情况下,非常小心地加入 200 μL 完全培养基。
- 丢弃上清液。将细胞重悬于浓度为 6.6 至 13.3 x 106 个细胞/mL 的完全培养基中,以达到每液滴的平均细胞数 λ = 0.2-0.4 用于封装,如步骤 8.6 中所定义。
注:步骤 3.4.6 和 3.4.7 应在封装前立即执行,以避免细胞因子分泌到上清液中。每个液滴的细胞数遵循泊松分布: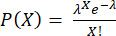 ,其中 P 表示包含 X 个细胞的液滴的分数,λ 是每个液滴的平均细胞数。
,其中 P 表示包含 X 个细胞的液滴的分数,λ 是每个液滴的平均细胞数。
4. 包埋和液滴生产
注意:微流体液滴发生器芯片实现了细胞在液滴中的封装,其制造在其他地方有非常详细的描述17。替代品是市售的(参见 材料表中的示例)。合适的液滴发生器芯片设计具有两个用于水相的入口,一个用于油相的入口,以及一个用于生成的液滴的出口。此外,合适的商用液滴发生芯片应能够在 40-60 pL 体积的氟化油液滴中产生水。此处描述的方案产生直径为 50 μm 的水/油乳液(液滴)。使用各种选项来更改方案可能会导致更大或更小的液滴。
- 注射泵的准备(图 2A)
- 在 1 mL 注射器中加入 500 μL 由 2% 008-氟表面活性剂在 HFE-7500 氟化油中组成的连续相。将 27G x 0.75 英寸针头连接到 0.30 mm x 0.76 mm PTFE 微管,并将组件安装在注射器上,然后安装到注射泵上。
注意:确保注射器或套管中没有空气残留,因为这会妨碍一致的流速。 - 为水相准备两个定制的移液器吸头连接器(图 2B):用 Ø0.75 mm 活检打孔器在 Ø6 mm 的 ~5 mm 高的 PDMS 切口中间打一个孔。将 ~3 cm 的 PTFE 管(内径 0.56 mm,外径 1.07 mm)拉入 PDMS 切口上的孔中,然后将组件推入 200 μL 移液器吸头的顶部。将管子的另一侧连接到 23Gx 1.25 英寸针头。通过在移液器顶部涂抹 UV 固化胶水来密封连接器,然后用 UV 光固化。
注意:由于紫外线对眼睛有害,因此请佩戴防紫外线护目镜进行保护。 - 用 500 μL 轻质矿物油填充两个 1 mL 注射器,用定制的附件连接两个 23G 针头,然后将这两个针头都安装到注射泵上。
- 使用注射泵控制软件将 30 μL 纳米颗粒和 30 μL 细胞溶液吸入水相的移液器吸头中。
- 用水清洁表面以去除污垢和灰尘,然后用精密湿巾擦干,以准备观察室。将腔室夹入装有两个钕磁铁的打印腔室支架中。
注意:确保磁铁指向正确的方向(相互吸引)以形成细长的聚集体。 - 稍微倾斜腔室 (30°)。打开两个端口,并在上端口塞上纸巾,以吸收填充过程中多余的外相。
- 在 1 mL 注射器中加入 500 μL 由 2% 008-氟表面活性剂在 HFE-7500 氟化油中组成的连续相。将 27G x 0.75 英寸针头连接到 0.30 mm x 0.76 mm PTFE 微管,并将组件安装在注射器上,然后安装到注射泵上。
- 液滴生产和腔室填充
- 通过管道将连续相连接到微流体芯片的顶部入口(图 2A、C、F)。使用 1800 μL/h 的流速用连续相冲洗芯片约 30 秒。
- 将水溶液的移液器吸头连接到两个中间入口(图 2A、C、F)。
- 以 200 μL/h 的速度开始水溶液的流动,让通道和出口充满液体。使用磁性纳米颗粒时,应有均匀的棕红色溶液从芯片出口流出。
- 一旦液体出现在出口处,就以 800 μL/h 的速度开始氟化油相流,并等待建立稳定的液滴产生,从出口处流出的均匀、灰色、有光泽的溶液中得到证实。
- 一旦建立了稳定的液滴生产,通过将 PTFE 微管(0.3 mm 内径 x 0.76 mm 外径)连接到出口来收集产生的液滴,并通过将微管穿过手紧一体式接头的套圈模块将它们引导到观察室中(图 2A)。
- 如果发生适当的液滴产生,均匀、有光泽的液体应从下到上以笔直的前端充满腔室。
- 腔室装满后,停止液流并使用手紧压力用端口塞关闭端口。
注意: 注意不要将腔室关闭得太紧。空气的捕获或流入会导致液滴移动,从而影响测量过程中的跟踪。 - 液滴产生后,用氟化油冲洗切屑,并用氮气吹掉任何液体提醒物,以保持其功能。薯片可以多次重复使用,只要不堵塞即可存放数月。
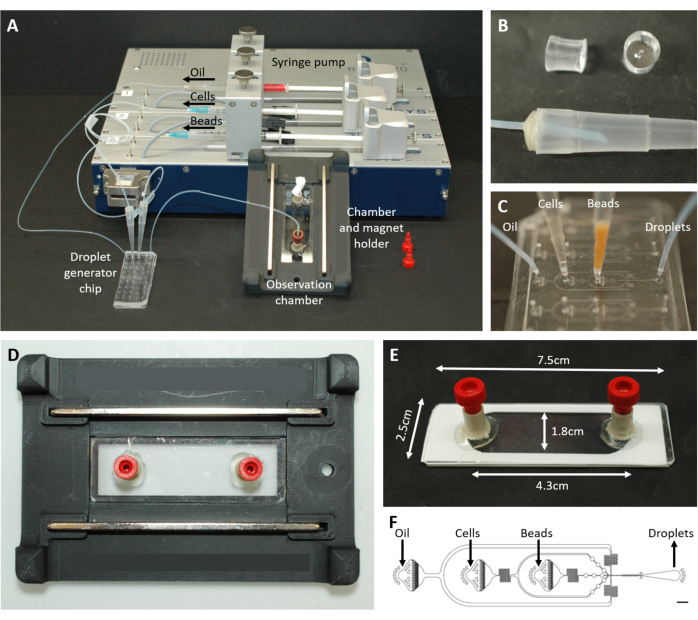
图 2:微流体设置概述。 (A) 使用注射泵、液滴发生芯片以及观察室和显微镜支架进行液滴封装的设置。(B) 如图方案步骤 4.1.2 所述,穿孔 PDMS 插头(顶部)形成 200 μL 移液器吸头(底部)的连接器。(C) 管道和移液器吸头与液滴发生芯片的连接图像。(D) 放置在定制 3D 打印显微镜支架内的腔室图片,顶部和底部有两个磁铁。(E) 观察室的照片(用白色胶带说明)。(F) 用于液滴产生的微流体芯片的布局(比例尺:750 μm)。这个数字是从17 修改而来的。 请单击此处查看此图的较大版本。
5. 图像采集和测量
注:图像采集在封闭在培养箱中的标准倒置落射荧光显微镜上进行,允许在 37 °C 下进行测量。 此处描述的设置特定于使用配备 Orca Fusion 相机的 NIS Elements 软件 (V. 5.30.04) 运行的 Nikon Eclipse Ti2 显微镜,但通常适用于任何其他荧光显微镜和相机。
- 设置测量参数
- 要设置图像的大小,请选择 10 x 10 图像的数组大小。该数组将包含大约 50,000-70,000 个液滴。使用 1% 重叠并激活混合以进行图像拼接。
- 要设置测量通道的数量,请选择用于细胞检测的 DAPI 通道、用于细胞因子检测的 FITC、TRITC、Cy5 通道(珠状线)和用于液滴检测的 BF 通道。使用 2 x 2 和 16 位像素合并来实现位深度。调整相机设置以实现液滴内强度像素值,该值不会达到每个荧光通道的相机最大值。
注意:每个通道的确切曝光时间和灯强度取决于所使用的模型和试剂,并在生成校准曲线之前确定(步骤 7)。在校准和样品池测量中使用相同的采集设置对于准确定量非常重要。 - 要设置时间分辨测量,请选择每 30 分钟一次测量,总共 9 次测量。
注:使用过的细胞、兴奋剂、试剂、测得的细胞因子、孵育温度和显微镜模型的测量参数可能不同。
- 开始测量
- 将腔室支架安装到带有孔板格式载物台的显微镜上(图 2D),并使用 10 倍物镜切换到明场 (BF) 通道。
- 专注于 BF 中固定的液滴,并通过平移和调整(如有必要)确保组件安装在完美的平面上。移动到腔室的中间进行后续步骤。
- 激活自动对焦系统 (PFS) 并将其设置为 BF 通道上的最佳测量平面,使液滴边缘显示为黑色、尖锐的圆圈,可以很容易地与油相和背景区分开来。
注意:也可以在没有自动对焦系统的情况下进行测量,但如果显微镜配备了自动对焦系统,我们强烈建议您使用它。这可以提高大型和大量拼接图像的测量质量。 - 遍历所有荧光通道并为每个通道设置最佳测量平面。对于 FITC、TRITC 和 Cy5 通道上的重定位测量,确保纳米颗粒聚集体处于完美聚焦状态,对于 DAPI 通道,确保细胞处于聚焦状态。
注意:所有测量通道的最佳焦平面和 z 值可能不同。确保为每个通道保存单独的 PFS 偏移量。 - 在开始测量之前,请遍历所有通道以仔细检查各个焦点并等待 5 分钟以平衡,因为在溶液预热时最初可能会发生移动。
- 开始测量。生成第一张图像后,检查是否有任何不规则性(焦点、移动液滴、错误通道等)。如果需要,重新启动采集,或者在有空气的情况下,重新填充腔室(从步骤 4.1.4 开始)。让组件在 4 小时内对液滴进行成像。
6. 图像分析
- 在 MatLab (https://github.com/ESPCI-LCMD/MiMB) 中安装图像分析软件 (DropMap Analyzer App v 4.023) 并将生成的 .nd2 文件从实验传输到分析计算机。
- 打开应用程序。选择指定的设置,否则保留默认值:CH1:DAPI、WD(整个液滴)处于选中状态;CH2:选择 FITC、BL(珠状线);CH3:TRITC,选择 BL;CH4: Cy5, BL 已选;最大液滴直径 (μm):70;跌落检测:满;跟踪: 是的。按下 Start( 开始 )按钮(水果图标)选择 .nd2 文件位置并开始分析。
- 几分钟后,程序将显示图像的示例部分(图 3A)。按 空格键 ,直到找到适合液滴检测的按钮,然后按 Enter。在同一图像部分中,在代表性区域中绘制一个矩形,以查找阈值参数以检测液滴。
- 几分钟后,将打开另一个窗口,显示 DAPI 通道的强度分布。拖放滑块以仅检测来自染色细胞的信号,然后单击右上角的 Done 。
- 将图像分割成直径小于最大液滴直径 (μm) 的单个液滴后,程序现在将对每个液滴、时间点和荧光通道执行以下步骤,而无需进一步的用户输入(参见 图 3)。
- 软件会计算时间点之间移动的液滴像素(移动超过 40 个像素的液滴将被自动排除)。
- 该软件测量整个液滴的平均荧光值,通过在水平线上找到最亮的像素,并在垂直线上从液滴的顶部到底部平均所有像素强度,来检测和测量平均珠线强度。这是自动完成的,用于根据以下公式计算平均珠状线重新定位值(图 3B):
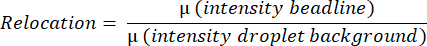
- 软件将计算 DAPI 通道上设置的阈值以上的快捷批处理区域中总像素的百分比。
- 生成的 .xslx 文件将包含以下感兴趣的列以供进一步分析:DropIdX(随时间跟踪的液滴的 ID)、TrueCentroid_ t*2-1 和 t+2(时间点 t 的液滴中心的 x 和 y 坐标)、DiameterMicrons(液滴直径,以 μm 为单位)、TrackingMove(在整个测量时间内移动的像素数)、FluoChannel_BL_Ratio_t(FluoChannel 在时间点 t 的重新定位值)、 DAPI_WD_PosPxlCount_t(时间点 t 处 DAPI 通道中整个液滴中高于阈值的像素数)。
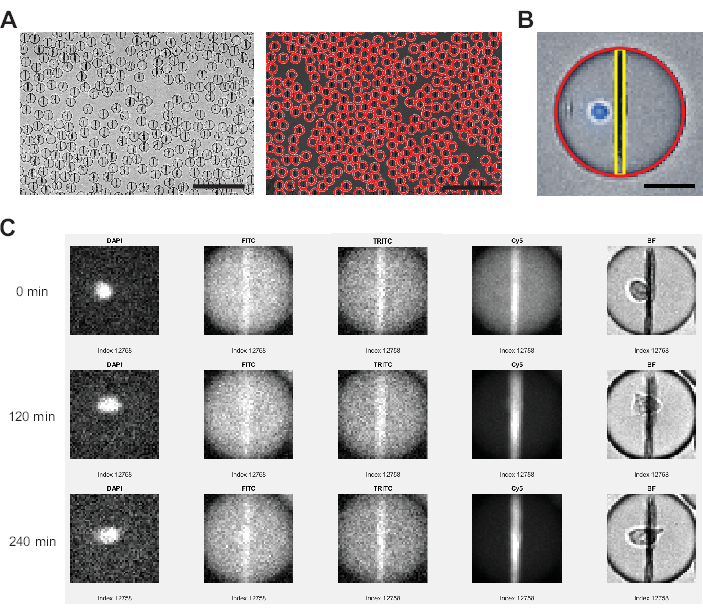
图 3:图像分析软件执行的图像分析。 (A) 使用霍夫变换在明场 (BF) 通道中检测液滴,用红色圆圈标记每个液滴。比例尺:200 μm。(B) 在每个液滴中,通过水平面上最亮的像素和从液滴顶部到底部的所有像素的平均荧光强度来识别纳米颗粒珠线。此外,通过整个液滴区域的阈值以上 >0 的像素百分比来识别细胞。比例尺:20 μm。(C) 分析仪软件将纳米颗粒上的荧光强度与每个液滴的所有测量时间点上 FITC、TRITC 和 Cy5 通道的液滴背景进行比较。显示的是时间点 0、4(120 分钟)和 9(240 分钟)。要手动检查液滴和细胞检测是否正确,还会显示 DAPI 和 BF 通道。 请单击此处查看此图的较大版本。
7. 校准
注:对于定量读数,需要将细胞因子浓度校准为荧光重新定位值一次,因为不同的实验设置之间可能会出现差异。所有必需的步骤都在前面的协议部分中进行了详细说明。
- 按照步骤 2 中的说明准备纳米颗粒。
- 根据制造商的说明重构人 IL-6、TNFα 和 IL-1β 重组蛋白。
注意:确保冷冻等分试样仅解冻一次并立即使用。 - 使用完全培养基(10% FBS、1% Pen/Strep、25 mM HEPES)为所有三种蛋白质制备 2 倍稀释系列,起始浓度为 80 nM 至 0.625 nM。
- 按照步骤 4 中的说明进行封装,在第一个水相中使用功能化纳米颗粒,仅在第二个水相中使用 RPMI。此测量值用作空白,测得的标准差稍后用于数据分析。
- 等待 5 分钟,然后按照步骤 5 中的说明对液滴进行成像。在相应的荧光通道中拍摄 3 张阵列尺寸为 2 x 2 的图像。
- 对所有准备好的校准溶液重复步骤 7.4 和 7.5,从最低浓度开始,到最高浓度结束。
- 按照步骤 6 中的说明分析图像。不要将 WD 选项用于 DAPI 通道,并将 Tracking (跟踪) 设置为 No (否)。
- 分析在一张图像中输出每个测量液滴的荧光重定位值。提取每个荧光通道的中位数和标准差。平均每个浓度的每个测量图像的中值和标准偏差。
- 通过绘制平均中位重新定位与每种重组蛋白的测量浓度的关系来生成校准曲线。
- 使用单阶段关联拟合曲线:
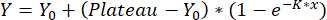 ,
,
其中 Y = 在 x 处重新定位,Y0 = 空白测量值的重新定位,x 为使用的浓度。获得的校准曲线用于量化重定位值,如步骤 8 中所述。
注:仅拟合最高测量的重新定位值,并排除测量重新定位较低的较高浓度的值。在较高浓度下测得的重定位值会降低是意料之中的,这是由于 Hook 效应和纳米颗粒的结合能力有限而发生的。
8. 数据分析
- 排除 TrackingMove 值大于 10 的液滴,即在测量的时间过程中移动了 10 个以上的像素。
- 通过在列 DAPI_WD_PosPxlPercent_1 中对值大于 0 的液滴进行排序,在第一个时间点识别包含染色细胞(DAPI 通道)的液滴。
- 通过将以下 3 个标准应用于每个荧光通道(FluoChannel_BL_Ratio_t 列)的荧光重新定位,鉴定含有分泌细胞的液滴。
- 通过对测量时间内的正斜率进行排序,识别重新定位值增加的液滴。
- 识别重定位值达到检测限 (LOD) 的液滴。当测量时间内的最大荧光重新定位优于LOD时,选择液滴,如其他地方所述25:
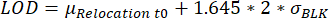 ,其中μ重新定位t0 是时间点0处所有重新定位值的中位数,σBLK 是校准期间测量的空白的标准偏差,每个都是细胞因子特异性的。
,其中μ重新定位t0 是时间点0处所有重新定位值的中位数,σBLK 是校准期间测量的空白的标准偏差,每个都是细胞因子特异性的。 - 通过检查测量时间内测得的最大和最小荧光重新定位之间的变化是否优于:来验证重新定位值的增加是否显著。
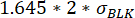
- 通过满足步骤 8.3 中描述的标准来识别共分泌细胞。同时用于多个荧光通道。
- 重复步骤 8.3。对于不包含细胞的所有液滴 (DAPI_WD_PosPxlPercent_1 = 0)。使用这些液滴计算假阳性百分比。
- 通过随机选择 200 - 500 个液滴并使用图像分析软件的验证和排序功能对其进行检查,确定测量的准确 λ 值。计算这些液滴中的细胞数并计算:
λ = 计数细胞数 / 分析的液滴数 - 通过以下方式计算用于测量的封装单元总数:
总细胞计数 = λ ×分析的液滴数 - 使用确定的细胞计数计算分泌细胞的百分比。此外,计算每种细胞因子的假阳性百分比(相对于每个通道的真实阳性数通常小于 3%-5%),并将其用作实验一致性和可重复性的内部对照。
- 为了计算分泌的细胞因子浓度,使用步骤 7.10 中建立的校准方程将重新定位值转换为浓度。
- 使用以下等式计算时间点之间的分泌率 (SR)。
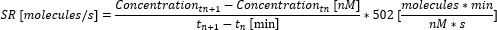
- 通过平均时间点之间的单个分泌率来计算测量的平均分泌率。如果在测量结束前达到最大可测量重新定位,请将浓度设置为最大可测量浓度(该值是细胞因子特异性的,对应于步骤 6.10 中校准曲线中测量和使用的最大浓度),并且不要计算进一步的浓度。计算分泌速率并仅取到此时间点的平均值。
注:如果在一个荧光通道中检测到少于 50 个分泌细胞,则应通过验证和排序功能目视检查液滴,并且可以从分析中排除具有荧光或纳米颗粒聚集体的液滴。 - 要从每个细胞的分泌曲线中提取更多参数,请使用自定义 Python 脚本(可根据要求提供)对每个细胞和细胞因子的时间-浓度曲线进行最小二乘拟合。拟合函数是遵循下述公式的 S 形曲线(与 R2<0.95 拟合不包括在以下步骤中):
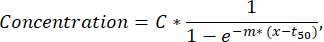
其中 C 对应于浓度平台 [nM],t50 对应于半最大值 [s] 的偏移,m 对应于希尔斜率 [min-1]。从这些参数中,将提取以下曲线描述符,如下所述。- Cmax [nM]:最大测量浓度。
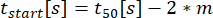 :分泌开始时间,合身达到 C 的 10%。
:分泌开始时间,合身达到 C 的 10%。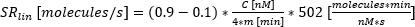 :分泌率作为时间浓度曲线的 10% 和 90% 之间的曲线的近似线性斜率。
:分泌率作为时间浓度曲线的 10% 和 90% 之间的曲线的近似线性斜率。
结果
所提出的功能性单细胞平台允许测量多个参数。首先,与标准技术类似,在测量结束时描述了分泌细胞的频率(图 4A)。用 1 μg/mL 脂多糖 (LPS) 刺激外周血单核细胞 (PBMC) 6 小时后,5.81% 的细胞分泌 IL-6 (n= 1270),4.55% TNFα (n= 995) 和 6.06% IL-1β (n= 1326)。
为了定量细胞因子分泌,使用已知浓度的重组细胞因子生成校准曲线(图 4B)。这些校准曲线允许随时间定量液滴内细胞因子浓度。例如,对于 LPS 刺激的 PBMC,平均液滴内 IL-6 浓度在 90 分钟后达到平台,而平均液滴内 IL-1β 从 90 分钟开始增加得更快,显示了平台的动态分辨率和提取分泌特定细胞因子的细胞亚群的可能性(图 4C)。由于测量点之间的浓度变化,可以计算每个细胞因子的动态分泌率。考虑到每种细胞因子的平均分泌速率(图 4D),分泌 IL-6 的细胞表现出平均分泌速率的恒定降低,而 TNFα 和 IL-1β 分泌细胞在 90 分钟测量时间后均表现出分泌速率增加,150 分钟后第二次降低。
此外,可以根据分泌和共同分泌的细胞因子将细胞聚集成亚群(图 4E)。在这里,IL-6 和 TNFα 分别由 30.2% 和 26.4% 的分泌 IL-6 或 TNFα 的细胞单独分泌,而单一分泌的 IL-1β 细胞占所有 IL-1β 分泌细胞的 68.8%。此外,可以解决共分泌对分泌浓度和分泌速率的影响(图 4F)。通过观察分泌 IL-6 的细胞,如果细胞还产生 TNFα 或 IL-1β,则会分泌不同量的 IL-6。同样,在仅分泌 IL-6 或 IL-6 以及 TNFα (较高分泌率) 和 IL-1β (较低 IL-6 分泌率) 的细胞之间,平均分泌率的分布在测量中存在统计学差异。
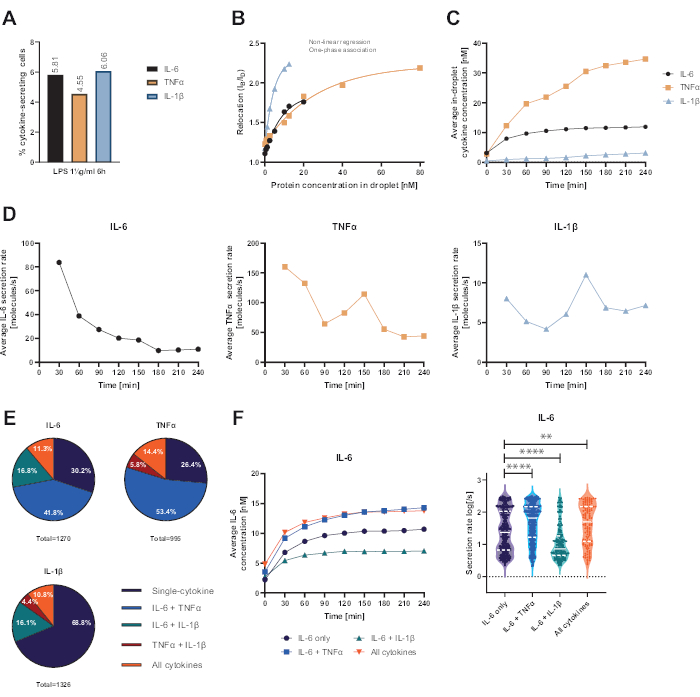
图 4:用 1 μg/mL LPS 刺激 6 小时后 IL-6、TNFα 和 IL-1β 分泌 PBMC 的代表性结果。 (A) 4 小时测量结束时 PBMC 分泌 IL-6、TNFα 和 IL-1β 的百分比。(B) 使用已知浓度的重组细胞因子生成多重细胞因子校准曲线。这允许通过从重新定位值计算液滴内的细胞因子浓度来定量细胞实验。使用非线性单相关联曲线拟合拟合点,r2=0.9926 (IL-6)、0.9901 (TNFα)、0.9990 (IL-1β)。(C) 在 4 h 测量时间内通过分泌 PBMC 释放的 IL-6、TNFα 和 IL-1β 的平均分泌浓度。(D) 4 小时测量时间内 IL-6、TNFα 和 IL-1β 的平均分泌率。(E) 分泌 IL-6、TNFα 或 IL-1β 及其组合的共分泌细胞的相对百分比。归一化为每种细胞因子检测到的所有分泌细胞。(F) 具有共分泌分辨率的 IL-6 分泌细胞在测量时间内的平均 IL-6 浓度和平均分泌率 (log) 分布(仅 IL-6 为 n=383,IL-6 + TNFα 为 n=531,IL-6 + IL-1β 为 n=213,IL-6+TNFα+IL-1β 为 n=143)。使用双侧、未配对、非参数 Kolmogorov-Smirnov 检验评估分泌率分布的统计差异,置信度为 95%,p 值表示。** (p <0.002) 和 **** (p <0.0001)。整线表示中位数,虚线表示四分位数。n个总细胞 = 21 866。 请单击此处查看此图的较大版本。
为了提取单细胞水平的附加信息,可以将 sigmoid 函数拟合到每个细胞和细胞因子的浓度时间点(图 5)。 图 5A 描述了一个细胞的示例浓度随时间变化的数据集和相应的 S 形拟合。在这里,最小二乘拟合过程产生以下参数:C,对应于曲线的上部平台值,t50 量化曲线从零开始的时间偏移,以及希尔斜率 m,描述 S 形曲线上升部分的陡峭程度,在整个测量过程中达到 10% 和 90% 的浓度值。从这些拟合参数中,可以提取一些曲线描述符,如步骤 7.12 中所述。产生 Cmax,数据的最高浓度值,t开始,分泌开始时间,定义为达到上部平台浓度值的 10%,以及 SRlin,曲线上升部分的分泌速率。
为了对细胞亚群进行分类,从所有单细胞拟合中获得的曲线描述符分别分为三类: C最大值分为低、中和高,从 t开始到早期、中等和晚期,SRlin 分为慢、中和快速分泌。为了说明这种分类,显示了四个示例性单细胞分泌曲线及其相应的曲线描述符(图 5A-D),其中曲线 A 表现出中等速率的早期低分泌者的特征,曲线 B 是早期、缓慢和高分泌者,曲线 C 是早期快速高分泌者,曲线 D 显示晚期低分泌。需要注意的是,这些标准的临界值是特定于细胞、细胞因子和检测参数的,需要针对每个研究问题进行调整。此外,这里仅考虑了 1 μg/mL LPS 刺激 6 小时后 PBMC 的 IL-6 分泌,这意味着大多数细胞是早期和高分泌者,分别为 80% 和 79%(图 5E-F)。关于分泌率,观察到双极反应,55% 的 IL-6 分泌细胞是慢分泌细胞,39% 是快速分泌细胞(图 5G)。
为了进一步表征分泌行为,将每个细胞的曲线描述符相互绘制并提取不同的簇(图 5H-J)。t起始和 Cmax 之间没有给出明确的相关性(图 5H):两个最大的种群是早期低分泌者和高分泌者,与分泌开始无关。考虑到 tstart 和 SRlin 之间的关系(图 5I),大多数细胞是早期慢分泌者,具有明显的早期高分泌者和很少慢/中至晚期分泌者。关于 SRlin 和 Cmax (图 5J) 相关性,几乎没有快速低到中等分泌蛋白,只有更多的快速低分泌蛋白。此外,有大量不依赖于最大测量浓度的快速分泌者,以及两个高分泌者群体分泌慢速或快速。总之,可以得出结论,研究单个细胞的曲线描述符之间的关系会产生更详细的分析,并且有可能从单细胞分泌测量中提取新的生物学发现。
通过上面介绍的分析,我们提取了共分泌细胞的分泌动力学(图 6)。两个示例曲线显示了两个单细胞共分泌 IL-6 和 TNFα 的不同动力学,两种细胞因子同时开始(图 6A),或顺序分泌开始,首先分泌 IL-6(图 6B)。为了对所有共分泌细胞进行分类,定义了 60 分钟的分泌延迟,其中在此范围内开始分泌的所有细胞都被认为是同时分泌的细胞,所有具有较长延迟的细胞被认为是顺序分泌者。该分析还允许观察首先分泌哪种细胞因子。对于 IL-6 和 TNFα,主要在 76% 的细胞中观察到同时共分泌(图 6C),而对于 IL-6 和 IL-1β,在 86% 的细胞中观察到连续共分泌,其中 IL-6 是大多数情况下第一个分泌的细胞因子(图 6D)。
观察所有单个共分泌细胞的不同细胞因子的分泌开始时间,在进行的实验中没有观察到分泌开始时间之间的明确相关性。对于 IL-6 和 TNFα 的共分泌 (图 6E),在 0 分钟左右存在一个更大的垂直簇,对应于从 IL-6 开始更普遍的共分泌细胞。对于 IL-6 和 IL-1β 的共分泌(图 6F),大多数细胞在测量开始时开始分泌 IL-6,而 IL-1β 主要在较晚后分泌。总之,这里介绍的分析能够识别不同的分泌子亚群和复杂的细胞因子共分泌动力学。
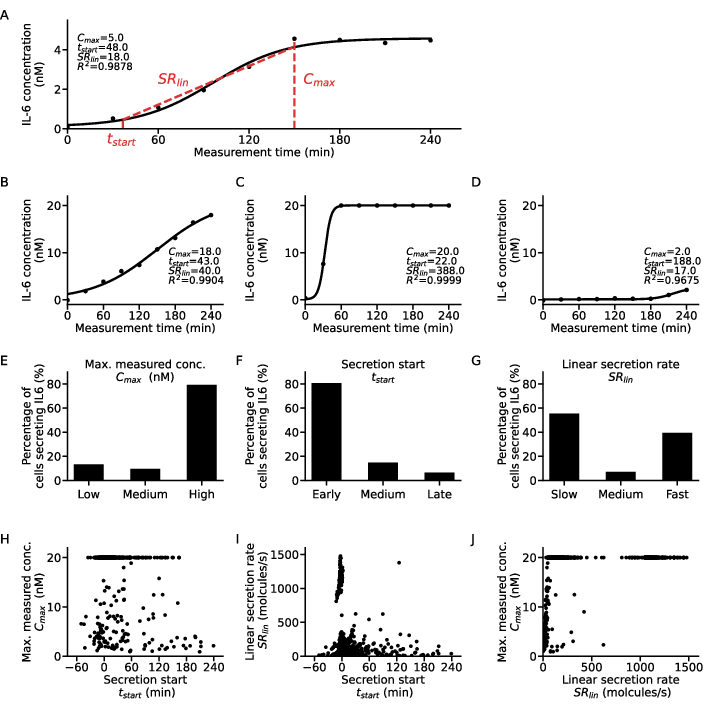
图 5:单个 IL-6 分泌细胞曲线的不同分泌动态模式的详细分析。 (A) 使用拟合的 S 形曲线和提取的参数,在测量时间内具有代表性的单细胞细胞因子浓度数据。(B - D)LPS 刺激后发现的 IL-6 分泌不同细胞因子分泌剂类型的三个示例性单细胞细胞因子浓度曲线。(E-G)根据以下标准分为不同分泌细胞类型的 IL-6 分泌细胞的百分比 (n=633):ECmax:低 <5 nM,高 >19.5 nM,FT开始:早期 <30 分钟,晚期 >120 分钟,G. SRlin:慢速 <250 分子/秒,快速 >750 分子/秒。(H-J) 三个分泌曲线描述符 C之间的关系最大值, 每个单独细胞的 tstart 和 SRlin (n=633)。Cmax=20 nM 的大群体是由于达到测定的检测上限所致。 请单击此处查看此图的较大版本。
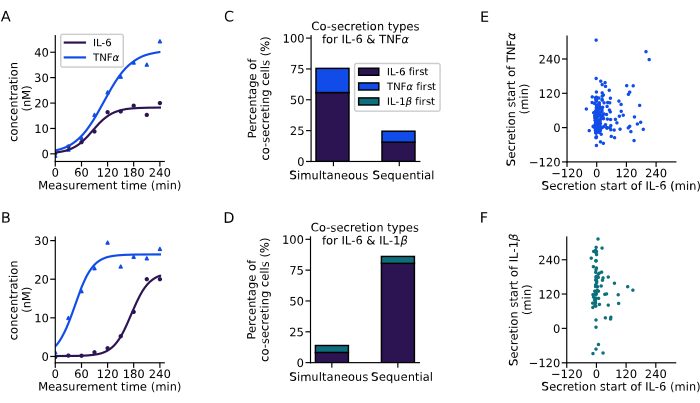
图 6:从单细胞浓度曲线中提取共分泌模式。 (AB) 分别同时和 (B) 依次共分泌 IL-6 和 TNFα (A) 的单细胞的代表性浓度曲线。(C-D)分别表现出 IL-6 和 TNFα (n=249) 或 IL-6 和 IL-1β (n=72) 同时和连续共分泌的细胞百分比。顺序分泌定义为细胞因子分泌开始之间的延迟超过 60 分钟。颜色表示哪些细胞因子首先开始分泌。(E-F)每个分泌细胞的不同细胞因子的分泌开始时间之间的关系 (nIL6-TNFα=249,nIL6-IL1β=72)。 请单击此处查看此图的较大版本。
讨论
细胞因子的释放和分泌在免疫学和临床医学中经常被研究3。不平衡的细胞因子分泌会对感染患者以及神经系统疾病、炎症或癌症患者产生不利影响 26,27,28。尽管它们在健康和疾病中的重要性已得到充分证实,但研究细胞因子及其分泌细胞仍然具有挑战性,因为目前的方法无法以时间分辨方式准确检测和定量源自单个细胞的细胞因子。对于此处介绍的工作流程,使用了 PBMC 的既定刺激方案,并测量了它们对 IL-6、TNF-α 和 IL-1β 的分泌。选择使用 PBMC 而不是单个纯化的亚群源于之前研究细胞因子释放综合征 (CRS) 的应用23,该病症的特征是血浆促炎细胞因子(包括 IL-6、TNF-α 和 IL-1β)浓度高度升高29。由于 CRS 通常不仅与一个群体有关,因此我们使用了 PBMC,因为它们会存在于体内。然而,如果科学问题需要此步骤,则可以单独纯化和评估细胞亚群。优化孵育时间、刺激条件和动态检测范围,以测量三种目标细胞因子的分泌。此处介绍的工作流程和数据演示了如何设置、校准、定量、测量和分析多种细胞因子的时间分辨单细胞分泌。该协议为细胞因子分泌的多功能分析如何实现患者分泌的细胞因子的巨大功能和动态多样性提供了蓝图。
所描述的检测方案的几个关键方面实现了独特的生物学读数。首先,微流体液滴中的单细胞封装允许提取每个细胞的数据。根据研究问题,可以通过图像分析来检测和分类多个细胞包埋的事件。其次,包含几种独立的液滴内荧光免疫测定和功能化纳米颗粒的对齐允许同时定量测量多达三种细胞因子浓度。这种多重分析能够在单细胞水平上分析细胞因子共分泌模式。第三,液滴的固定允许对每个分泌细胞的细胞因子分泌进行时间测量和相关性,并允许区分共流和顺序分泌。时间分辨率独特地提供了有关不同分泌体类型的分泌模式和亚群的数据。最后,并行图像分析能够从超过 20,000 个单个细胞的测量中高效提取和跟踪大量数据。从单个分泌曲线中提取进一步允许发现表型亚群和功能。
除了其独特的读数外,该检测试剂盒还比标准细胞因子分析具有技术优势。由于包封室尺寸小,约为 60 pL,因此可以直接从生物来源检测到分泌的细胞因子的绝对量,检测限适合细胞分泌。检测小型化还使用少量昂贵的生物试剂。此外,该装置只需要很少的专用设备,而生物学和生物工程实验室通常已经有了这些设备。荧光显微镜广泛可用,注射泵经常用于生物工程实验室,或者可以以相对较低的成本购买。如果存在细胞培养物,则运行实验所需的全部设备成本约为 148,000 欧元,其中大部分来自自动落射荧光显微镜(130,000 欧元)。然而,这种仪器通常可以在生物实验室中找到,其余费用分配给注射泵(13,000 欧元,但有更便宜的替代品)和较小的设备。液滴芯片和观察室的制造描述得非常好17 并且可以在具有必要基础设施的洁净室环境之外进行,例如大多数生物工程实验室中的烘箱和等离子清洗机。或者,不同的供应商可以为感兴趣的实验室提供液滴发生芯片。由于所需的体积小,该检测具有成本效益且易于设置。
为了确保最高程度的可重复性,我们确定了一些方案成功的关键步骤。初次使用的用户的一个常见问题是测量过程中的液滴移动。虽然分析软件可以在一定程度上跟踪单个液滴,但过度移动会导致单细胞分辨率损失和结果不准确。通过使用适当的气密测量室、正确的液滴大小和腔室大小、开始测量前的短平衡期以及适当的表面活性剂浓度,可以避免移动。另一个关键步骤是在开始测量之前准确对焦。聚焦不当导致荧光重定位值显著降低,并且低估了分泌的细胞因子的量。最后,根据手头的问题和方案,不同步骤之间的正确时间对于可重复性至关重要。特别是填充腔室和开始测量之间的等待时间应保持一致,否则可能会错过分泌的细胞因子的测量窗口。
所提出技术的局限性包括封装后进一步操纵细胞的能力受限。因此,目前无法添加或去除兴奋剂、抗体或其他试剂。此外,由于细胞被封装在分离的生物反应器中,因此在测量过程中不会发生细胞之间的相互作用(基于接触或旁分泌信号)。这种限制可以通过事先进行批量孵育来部分克服。此外,分泌的细胞因子的增强自分泌效应也是可能的,并且这些效应不能被确定地量化或排除,因为仅测量抗体检测到的分泌细胞因子。因此,关于细胞因子分泌的孤立观点必须始终在相应问题和应用的上下文中进行描述。然而,如果感兴趣,这个限制也可以用于封装倍数、双峰和三元组的详细研究。这将提供一个有趣的设置,可用于研究细胞间接触或基于旁分泌的问题。最后,该检测的动态范围也是有限的,需要根据具体应用进行调整。在这里,我们已将测定的动态范围调整为测量细胞因子的预期分泌量。
为了进一步提高该检测的能力和适用性,未来可以在生物、技术和数据分析方面解决一些发展问题。在生物学方面,可以通过调整测定来整合其他细胞因子、其他分泌蛋白、代谢或细胞表面标志物的测量。此外,该检测可以与其他基于细胞的检测一起集成到工作流程中,以扩大读数范围(例如,流式细胞术染色或测序)。此外,可以简化该检测的可用性,例如,通过创建一个集成的微流体芯片来产生和观察液滴,从而有可能在生物工程实验室之外的临床环境中实现更广泛的应用。关于数据分析,可以通过增强自动化和使用机器学习方法来扩展从图像中提取和跟踪信息,例如,在没有荧光标记的情况下检测每个液滴中细胞和珠线的存在和位置。这样做会打开可用于免疫测定的额外荧光通道,从而同时测量更多的细胞因子。
所提出的测定以及相关的方案和分析可应用于与细胞因子分泌动力学相关的各种潜在用例。更具体地说,该测定可能解决基本的免疫学问题,例如识别细胞类型和激活特异性细胞因子分泌谱、细胞因子分泌细胞的多功能性或细胞因子平衡的时间性和维持机制。此外,在临床应用中,该平台可能有助于揭示细胞因子在活动性或慢性炎症反应中的作用,如 COVID-1930 中观察到的那样,或者提供一种工具,用于根据独特的特征对患者进行分层和个性化治疗,例如自身炎症31。总之,对单个细胞分泌的细胞因子进行定量时间分辨评估是一种急需的方法,因为它阐明了特定药物、感染、遗传改变或 离体 刺激如何诱导特定反应。
披露声明
特定方面,例如细胞的珠线测量已获得专利。
致谢
该项目得到了 ETH 领域(瑞士联邦理工学院)个性化健康和相关技术 (PHRT) 战略重点领域 #2021-349 的资助、欧洲研究委员会启动资助(资助 #803,336)和瑞士国家科学基金会(资助 #310030_197619)。此外,我们还要感谢 Guilhem Chenon 和 Jean Baudry 为初始 DropMap 分析器所做的工作和开发。
材料
| Name | Company | Catalog Number | Comments |
| 008-FluoroSurfactant | RAN Biotechnologies | 008-FluoroSurfactant-10G | |
| 2-Stream flow-focusing droplet maker, 30 µm nozzle, PFOS hydrophobic surface treatment | Wunderli chips | ||
| Alexa Fluor 647 NHS Ester | ThermoFisher | A20006 | https://www.thermofisher.com/ch/en/home/references/protocols/cell-and-tissue-analysis/labeling-chemistry-protocols/fluorescent-amine-reactive-alexa-fluor-dye-labeling-of-igm-antibodies.html |
| Anti-Human IL-1β (Monoclonal Mouse), AF647 labelled in-house | PeproTech | 500-M01B | |
| ARcare92524 double-sided adhesive tape | Adhesvies Reasearch | ARcare92524 | |
| Bio-Adembeads Streptavidin plus 300nm | Ademtech | Cat#03233 | |
| Biotinylated Goat Anti-Human IL-1β | PeproTech | 500-P21BGBT | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A3059 | |
| Cell Scraper | TPP | 99002 | |
| CellTrace Violet Cell Proliferation Kit | Invitrogen | C34557 | Cell staining solution |
| Chromafil Xtra PTFE-45/25 syringe filters | Macherey-Nagel | 729205 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment | Corning | 3471 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10283 | |
| D-Biotin | Fluorochem | M02926 | |
| DPBS, no calcium, no magnesium | Gibco | 14196-094 | |
| epT.I.P.S. Standard 2-200 µl | Eppendorf | 30000889 | |
| Ethylenediaminetetraacetic acid disodium salt solution | Sigma-Aldrich | 3690 | |
| EZ-LINK-NHS-PEG4-Biotin | ThermoFisher | A39259 | https://www.thermofisher.com/order/catalog/product/20217 |
| FcR Blocking Reagent, human | Miltenyi Biotec | 130-059-901 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| Handy dish soap | Migros | 5.01002E+11 | |
| HEPES (1 M) | Gibco | 15630-080 | |
| HFE-7500 Oil 3M TM Novec | Fluorochem | B40045191 | |
| Idex F-120 Fingertight One-Piece Fitting, Standard Knurl, Natural PEEK, 1/16" OD Tubing, 10-32 Coned | Cole-Parmer | GZ-02014-15 | |
| IL-6 Monoclonal Antibody (MQ2-13A5 - Rat), FITC | ThermoFisher | 11-7069-81 | |
| IL-6 Monoclonal Antibody (MQ2-39C3), Biotin | ThermoFisher | 13-7068-85 | |
| KnockOut Serum Replacement | ThermoFisher | 10828-010 | |
| Loctite AA 3491 curable UV glue | Henkel AG & Co | 3491 | |
| Microscope slides (76x26x1mm, clear white) | Menzel Gläser | ||
| Mineral oil light | Sigma-Aldrich | 330779 | |
| NanoPort Assembly Headless, 10-32 Coned, for 1/16" OD | Idex | N-333 | |
| Neodymium block magnet | K&J Magnetics | BZX082 | |
| Omnifix-F Spritze, 1 ml, LS | Braun | 9161406V | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | |
| Phosphate buffered saline | Sigma-Aldrich | P4417 | |
| Pluronic F-127, 0.2 µm filtered (10% Solution in Water) | ThermoFisher | P6866 | |
| Precision wipes | Kimtech Science | 5511 | |
| PTFE microtubing 0.30 × 0.76 mm | FisherScientific | 1191-9445 | |
| PTFE microtubing 0.56 × 1.07 mm | FisherScientific | 1192-9445 | |
| Recombinant Human IL-1β | Peprotech | Cat#200-01B | |
| Recombinant Human IL-6 | Peprotech | Cat#200-06 | |
| Recombinant human serum albumine (HSA) | Sigma-Aldrich | A9731 | |
| Recombinant Human TNF-α | Peprotech | Cat#300-01A | |
| Reusable biopsy punch diameter 0.75 mm and 6 mm | Stiefel | 504529 and 504532 | |
| RPMI 1640 Medium, no phenol red | Gibco | 11835-030 | |
| Standard LPS, E. coli K12 | InvivoGen | tlrl-eklps | |
| Sterican needles 23 G for 0.56 mm diameter microtubing | FisherScientific | 15351547 | |
| Sterican needles 27 G for 0.30mm diameter microtubing | FisherScientific | 15341557 | |
| TNF alpha Monoclonal Antibody (MAb11), PE | ThermoFisher | 12-7349-81 | |
| TNF-alpha Monoclonal Antibody (MAb1), biotinylated in-house | ThermoFisher | 14-7348-85 | |
| Trypan Blue Stain (0.4%) for use with the Countess Automated Cell Counter | Invitrogen | T10282 | |
| Vacuum Filtration "rapid"-Filtermax | TPP | 99500 | |
| Devices | |||
| Cameo 4 automatic cutting machine | Silhouette | ||
| Cetoni Base 120 + 3x NEMESYS Low Pressure Syringe Pumps | Cetoni | NEM-B101-03 A | |
| Countess II Automated Cell Counter | ThermoFisher | ||
| Inverted Epi-fluorescence microscope Ti2 | Nikon | ECLIPSE Ti2-E, Ti2-E/B*1 | |
| OKO Lab Cage Incubator, dark panels | OKO Lab | ||
| ORCA-Fusion Digital CMOS camera | Hammatsu | C14440 | |
| SOLA Light Engine | Lumencor | sola 80-10247 |
参考文献
- Chen, L., et al. Inflammatory responses and inflammation-associated diseases in organs. Oncotarget. 9 (6), 7204-7218 (2017).
- Cicchese, J. M., et al. Dynamic balance of pro- and anti-inflammatory signals controls disease and limits pathology. Immunol Rev. 285 (1), 147-167 (2018).
- Liu, C., et al. Cytokines: From clinical significance to quantification. Adv Sci. 8 (15), e2004433 (2021).
- Rojas, J. M., Avia, M., Martín, V., Sevilla, N. IL-10: A multifunctional cytokine in viral infections. J Immunol Res. 2017, 6104054 (2017).
- Kohanawa, Y. M. A regulatory effect of the balance between TNF-α and IL-6 in the granulomatous and inflammatory response to Rhodococcus aurantiacus infection in mice. J Immunol. 177 (1), 642-650 (2006).
- Geginat, J., et al. Plasticity of human CD4 T cell subsets. Front Immunol. 5, 630 (2014).
- Sallusto, F. Heterogeneity of human CD4+ T cells against microbes. Ann Rev Immunol. 34 (1), 317-334 (2016).
- Chetaille Nézondet, A. L., Poubelle, P. E., Pelletier, M. The evaluation of cytokines to help establish diagnosis and guide treatment of autoinflammatory and autoimmune diseases. J Leukocyte Biol. 108 (2), 647-657 (2020).
- Sims, J. T., et al. Characterization of the cytokine storm reflects hyperinflammatory endothelial dysfunction in COVID-19. J Allergy Clin Immunol. 147 (1), 107-111 (2021).
- Yasen, A., et al. Single-cell RNA sequencing reveals the heterogeneity of infiltrating immune cell profiles in the hepatic cystic echinococcosis microenvironment. Infection and Immunity. 89 (12), (2021).
- Jiang, Y., et al. Single-cell RNA sequencing highlights intratumor heterogeneity and intercellular network featured in adamantinomatous craniopharyngioma. Sci Adv. 9 (15), (2023).
- Tanguay, S., Killion, J. J. Direct comparison of ELISPOT and ELISA-based assays for detection of individual cytokine-secreting cells. Lymphokine Cytokine Res. 13 (4), 259-263 (1994).
- Bucheli, O. T. M., Sigvaldadóttir, I., Eyer, K. Measuring single-cell protein secretion in immunology: Technologies, advances, and applications. Eur J Immunol. 51 (6), 1334-1347 (2021).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab Chip. 20 (12), 2062-2074 (2020).
- Brower, K. K., et al. Double emulsion picoreactors for high-throughput single-cell encapsulation and phenotyping via FACS. Anal Chem. 92 (19), 13262-13270 (2020).
- Luo, X., Chen, J. Y., Ataei, M., Lee, A. Microfluidic compartmentalization platforms for single cell analysis. Biosensors. 12 (2), 58 (2022).
- Bounab, Y., et al. Dynamic single-cell phenotyping of immune cells using the microfluidic platform DropMap. Nat Protoc. 15 (9), 2920-2955 (2020).
- Eyer, K., et al. Single-cell deep phenotyping of IgG-secreting cells for high-resolution immune monitoring. Nat Biotechnol. 35 (10), 977-982 (2017).
- Gaa, R., et al. Versatile and rapid microfluidics-assisted antibody discovery. mAbs. 13 (1), 198130 (2021).
- Gerard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nat Biotechnol. 38 (6), 715-721 (2020).
- De Jonghe, J., et al. spinDrop: a droplet microfluidic platform to maximise single-cell sequencing information content. Nat Comm. 14 (1), 4788 (2023).
- Wheeler, M. A., et al. Droplet-based forward genetic screening of astrocyte-microglia cross-talk. Science. 379 (6636), 1023-1030 (2023).
- Portmann, K., Linder, A., Oelgarth, N., Eyer, K. Single-cell deep phenotyping of cytokine release unmasks stimulation-specific biological signatures and distinct secretion dynamics. Cell Rep Meth. 3 (7), 100502 (2023).
- Portmann, K., Linder, A., Eyer, K. Stimulation-induced cytokine polyfunctionality as a dynamic concept. eLife. 12, 89781 (2023).
- Armbruster, D. A., Pry, T. Limit of blank, limit of detection and limit of quantitation. Clin Biochem Rev. 29, S49-S52 (2008).
- Yang, J., et al. New insight into neurological degeneration: Inflammatory cytokines and blood-brain barrier. Front Mol Neurosci. 15, 1013933 (2022).
- Kim, P. S., Ahmed, R. Features of responding T cells in cancer and chronic infection. Curr Opin Immunol. 22 (2), 223-230 (2010).
- Becher, B., Spath, S., Goverman, J. Cytokine networks in neuroinflammation. Nat Rev Immunol. 17 (1), 49-59 (2017).
- Cosenza, M., Sacchi, S., Pozzi, S. Cytokine release syndrome associated with T-cell-based therapies for hematological malignancies: Pathophysiology, clinical presentation, and treatment. Int J Mol Sci. 22 (14), 7652 (2021).
- Hu, B., Huang, S., Yin, L. The cytokine storm and COVID-19. J Med Virol. 93 (1), 250-256 (2021).
- Marcuzzi, A., et al. Autoinflammatory diseases and cytokine storms-Imbalances of innate and adaptative immunity. Int J Mol Sci. 22 (20), 11241 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。