实时评估隔离、加压淋巴管中的绝对、胞质、游离 Ca2+ 和相应的收缩力
摘要
该协议描述了一种同时实时测量收缩淋巴管中的细胞溶质,游离钙[Ca2 + ]i 和血管直径的方法,然后计算绝对Ca2 + 浓度以及收缩性/节律性参数。该协议可用于在各种实验条件下研究Ca2+ 和收缩动力学。
摘要
淋巴管系统,现在通常被称为“第三循环”,位于许多重要器官系统中。淋巴管系统的主要机械功能是将液体从细胞外空间返回中央静脉导管。淋巴转运是由淋巴管 (LV) 的自发节律性收缩介导的。左心室收缩很大程度上受胞质游离钙 ([Ca2+]i) 的周期性上升和下降调节。
本文提出了一种在分离的加压左心室中同时计算[Ca2+]i 绝对浓度变化和血管收缩力/节律性的方法。 使用分离的大鼠肠系膜左心室,我们研究了[Ca2+]i 和收缩力/节律性响应药物添加的变化。隔离的 LV 加载比例 Ca2+ 传感指示器 Fura-2AM,并使用视频显微镜与边缘检测软件相结合,实时连续捕获 [Ca2+]i 和直径测量值。
将每个 LV 的 Fura-2AM 信号校准为每个容器的最小和最大信号,并用于计算绝对值 [Ca2+]i。直径测量用于计算收缩参数(振幅、舒张末期直径、收缩末期直径、计算流量)和节律性(频率、收缩时间、弛豫时间),并与绝对 [Ca2+]i 测量值相关。
引言
淋巴管系统存在于许多器官系统中,包括脑、心脏、肺、肾脏和肠系膜 1,2,3,4,5,6,并通过将液体(淋巴)从间质空间推进到中央静脉管来维持液体稳态 7,8,9,10 .它始于血管毛细血管床内的盲端淋巴毛细血管,这些毛细血管排入集合淋巴管 (LV)。收集左心室由两层细胞组成:一层内皮细胞被一层淋巴肌细胞 (LMC) 包围10,11。淋巴液运输是通过外在力(例如新淋巴形成、动脉搏动、中心静脉压波动)和内力来实现的12.
淋巴转运的内在力是收集左心室的自发节律性收缩,这是大多数研究淋巴功能研究的重点。这种内在淋巴泵主要受细胞质游离 Ca2+ ([Ca2+]i) 的循环上升和下降调节。LMCs中质膜的自发去极化激活电压门控的“L型”Ca2+(Cav1.x)通道,触发Ca2+内流和随后的左心室节律性收缩8,9,10。用特定药物(如硝苯地平)阻断 Cav1.x 证实了这种作用,该药物可抑制左心室收缩并引起血管扩张13,14。由 Cav1.x 通道介导的 LMC 中 [Ca2+]i 或“Ca2+ 尖峰”的瞬时升高也可能通过激活肌醇三磷酸 (IP3) 受体和肌浆网 (SR) 上的兰尼定受体 (RyRs) 来动员细胞内 Ca2+ 储存15,16,17,18。目前的证据表明,与 RyRs15、16、19、20、21 相比,IP3 受体贡献了更多 Ca2+ 用于正常左心室收缩;然而,RyR 可能在病理学期间或对药物干预的反应中发挥作用17,18。此外,Ca2+ 激活的 K+ 通道22 和 ATP 敏感钾 (KATP) 通道23,24 的激活可以使 LMC 膜超极化并抑制自发收缩活动。
利用方法实时研究Ca2+的变化和血管收缩对药理学试剂的反应对于理解这些潜在的调节因子非常重要。使用 Fura-2 测量 LV [Ca2+]i 相对变化的早期方法已被描述过 25。由于 Fura-2 和 Ca2+ 的解离常数已知为26,因此可以计算 Ca2+ 的实际浓度,这扩大了该方法的应用范围,并为 Ca2+ 信号传导、膜兴奋性和收缩机制提供了额外的见解27,并允许在实验组之间进行基线比较。后一种方法已用于心肌细胞28,因此可以适应左心室。本文提出了一种改进的方法,该方法将这两种方法相结合,以实时测量和计算绝对 [Ca2+]i 的变化以及在隔离的加压左心室中连续连续的血管收缩力/节律性。我们还为接受硝苯地平治疗的左心室患者提供具有代表性的结果。
研究方案
9至13周龄的雄性Sprague-Dawley大鼠是从商业供应商处购买的。到达后,所有大鼠都以标准实验室饮食在阿肯色大学医学部(UAMS)实验室动物医学(DLAM)设施中饲养和维护,并暴露于25 °C的12小时光照:黑暗循环中。所有程序均按照UAMS机构动物护理和使用委员会(IACUC)批准的动物使用协议#4127执行。
1.肠系膜左心室的解剖和插管
注意:在分离肠系膜左心室之前设置灌注室非常重要,以确保没有会干扰实验的流动或泄漏中断。
- 灌注浴制备
- 从商业供应商处购买硼硅酸盐玻璃微量移液器(外径 1.2 mm,内径 0.68 mm,拉至外尖端直径 75-100 μm)。将微量移液器(又名套管)切割并抛光至约 1-2 cm 长,以便安装到隔离的血管灌注室中。
- 将容器灌注室中每个安装的玻璃套管连接到独立的压力传感器,该压力传感器与使用聚乙烯管的独立重力进料压力调节器对齐。
注意:这允许根据研究设计独立操纵流入和流出压力。 图 1 详细介绍了此设置。 - 回填灌注室(5mL),玻璃微量移液器和独立的重力进料压力调节器以及带有生理盐溶液(PSS;119mM NaCl;24mM NaHCO3;1.17mM NaH2PO4;4.7mM KCl;1.17mM MgSO4;5.5mM C6H12O6 (葡萄糖);0.026 mM C10H16N2O8 (EDTA);和1.6 mM CaCl2) 没有任何气泡。然后,夹紧压力,使插管不受压力。
注意:该溶液的 pH 值为 ~7.5。如步骤1.3.7所述,在灌注浴中利用CO2 鼓泡作用于PSS内的碳酸氢盐缓冲系统,使pH值保持在7.4。EDTA在这里用于螯合过量的Ca2+ 离子。
- 打结的准备
- 在显微镜下使用编织丝线(8-0 号)打两个反手结。关键步骤如图 2 所示。
- 分离单根细丝。
- 使用两个带有微钝尖端的 Dumont #5 镊子,并使用一个镊子在另一个镊子的尖端周围形成双环。
- 使用环形镊子,抓住缝合线的松散端并将其拉过两个环,确保不要将结完全拉合并留下一个小开口。
- 使用 Vanna 弹簧剪刀从两侧剪下多余的缝合线。稍后使用这些结将 LV 固定在套管上。
注意:请勿使用您将用于解剖或插管的相同镊子,因为在打结过程中更有可能损坏镊子尖端。
- 在显微镜下使用编织丝线(8-0 号)打两个反手结。关键步骤如图 2 所示。
- 肠系膜左心室的分离和插管
- 通过给予1.5L / min O2 过量的5%异氟醚对动物进行深度麻醉,并通过斩首放血。
- 首先沿腹壁中线纵向切开整个肠系膜以解剖肠系膜左心室,将肠系膜外切开,然后剪断幽门括约肌下方和盲肠上方~2-3cm的连接以及与直肠的连接,从而分离出肠系膜左心室。
- 在 200 mL 冰冷的 PSS 中洗涤解剖的整个肠系膜,然后转移到含有冰冷 PSS 的硅胶衬里 (8-10 mm) 培养皿 (100 mm) 中并固定在其中。
- 使用立体显微镜从周围脂肪和结缔组织中解剖二级肠系膜左心室,解剖 Dumont #5 Inox 细镊子和 Vanna 弹簧剪刀。为了帮助识别从组织中取出左心室的末端,请在左心室的近端留下一小块脂肪。
- 将解剖的左心室转移到血管灌注室,以便在玻璃套管上插管。
- 使用两个预磨尖的 Dumont #5 Inox 细镊子,直尖端 (0.05 x 0.01 mm) 插管左心室,左心室的远端位于 P1 套管(流入)上,血管近端位于 P2 套管(流出)上,以模拟淋巴流动的方向。
注意: P1 和 P2 套管是相同的,只是 LV 的连接端不同。重要的是,使用在尖端完全配合且不会损坏的镊子,以便于抓住薄血管壁。- 将一个预打结滑到每个玻璃套管上,然后将容器固定在套管上。
- 使用一小块脂肪来帮助定向左心室方向,首先将远端套管到 P1 上。
- 将结滑下套管并拧紧以固定 LV。 确保不要过度拧紧并折断套管尖端。
- 在灌注室中将左心室加压至 4-5 mm Hg。
注意:出于我们的目的,我们将 P1 和 P2 压力设置为相等;然而,根据实验条件,可以调整每个套管处的压力以引起剪切应力或回流。 - 重复步骤 1.3.6.1-1.3.6.4 将左心室的近端插管到 P2 上。
- 将装有 7% 二氧化碳 (CO2)/93% 氧气 (O2) 的冒泡石放入浴室中,以保持生理 pH 值。
- 将腔室连接到温度调节器,并将其设置为 37 °C,以使 LV 平衡并产生稳定的自发收缩(约 30 分钟)。
注意: 图 1 详细显示了此设置。
2. 左心室中 [Ca2+]i 绝对浓度的测量
- 空管左心室的 Fura-2AM 染色
- 在自发收缩发生后(从步骤1.3.8开始),将LVs与Fura-2-乙酰氧基甲酯(Fura-2AM;2μM或10μL/ 5mL)和pluronic acid(PA;0.02%W / V或5μL / 5mL 20%PA)在黑暗中孵育30分钟。
注意:添加 Fura-2AM 后,所有剩余步骤必须在黑暗中执行。 - 30分钟后,通过用负压真空排空整个浴体积,用温度匹配(37 °C)无试剂PSS替换灌注室中的溶液3x。
注意: 这应该快速完成,以尽量减少 LV 悬浮在空气中的时间。例如,使用双手,右手用于真空吸尘,左手用于更换新的无试剂 PSS。 - 洗涤后,将 LVs 在黑暗中孵育 15 分钟,以去除多余的指示剂并允许去酯化。
- 在自发收缩发生后(从步骤1.3.8开始),将LVs与Fura-2-乙酰氧基甲酯(Fura-2AM;2μM或10μL/ 5mL)和pluronic acid(PA;0.02%W / V或5μL / 5mL 20%PA)在黑暗中孵育30分钟。
- 捕获钙2+ 荧光和血管直径
- 将腔室转移到配备有 LED 光源、20x S Fluor 物镜、细胞取景适配器和快速 CMOS 摄像机系统的倒置荧光显微镜载物台上,该系统可实现 15 Hz 的逐帧荧光捕获。
注意: 图 3 显示了此工作流设置的示意图。可以使用至少 15 fps 的 CCD 相机捕获 Ca2+ 信号。 - 将显微镜连接到配备成像软件的计算机,以记录荧光和边缘检测。
注意: 引用的软件还可以同时记录压力;但是,此处不包括这一点。 - 打开 LED 光源和荧光系统接口。
注意:此处描述的软件说明适用于引用的软件,但可以使用其他软件来获取此数据。 - 打开软件 (IonWizard)。
- 在 “文件 ”选项卡下,选择“ 新建”。
- 在 “收集 ”选项卡下,选择 “实验”。
- 加载所需的实验模板,然后单击 “确定”。
注意:您需要设置一个包含要测量的参数的实验模板。有关模板设置的说明,请参阅软件手册29。 - 调整屏幕上的迹线,按降序查看 血管直径、分子 (340 信号)、 分母 (380 信号)和 比率 。
- 根据需要调整 y 轴刻度,以帮助可视化迹线。
- 在 “跟踪”下,选择 “编辑用户限制”。确保未选中“自动限制”。
- 选择要调整的参数,输入轴的最小值和最大值,然后选择“ 确定”。
- 要开始实验,请单击“ 开始 ”(位于屏幕底部)。
- 要同时测量左心室直径,请使用成像系统中附带的边缘检测软件,该软件可在 3 Hz 下生成左心室的收缩迹线。 使用这些测量值来分析第 3 节中描述的收缩和节律性参数,如图 4 所示。
- 请务必调整照明,使 LV 墙显示为暗线。
- 选择一个没有脂肪和碎屑的感兴趣区域 (ROI)。实验开始后,请勿移动此 ROI。
- 确保设置阈值,以便在整个收缩周期中都能检测到血管壁边缘。
- 对于荧光测量,请打开光电倍增管 (PMT)。
- 通过使用 LED 照明器在 50 ms 曝光中交替使用 340 和 380 nm 波长来激发 Fura-2,并在整个成像场中以 15 Hz 捕获 510 nm 的发射光谱。
注意:对于整个系列实验,保持所有光学参数(激发设置、发射滤光片、物镜和二向色镜)相同非常重要,以获得可重复的 Ca2+ 测量值。 - 通过首先获得 340 和 380 荧光来测量信噪比,LV 位于视野(信号)的中间,然后使用载物台操纵器将视野移动到没有容器的浴槽边缘(注意避开硅胶衬里边缘和/或从浴液中去除任何碎屑)以捕获背景。
注意:每次进行 Ca2+ 测量时,务必导航回容器的原始部分。 - 用温度匹配的无试剂 PSS 交换浴液,以去除浴液中多余的指示剂。可能需要几次浴交换才能去除多余的 Fura-2,因此请重复此交换,直到信号与背景比约为 10:1。
- 记录基线 Fura-2 荧光信号和自发收缩约 30 分钟,然后是硝苯地平 (NIF; 0.1-100 nM) 的累积浓度反应,硝苯地平是一种电压依赖性 Cav1.x 拮抗剂。获得每种药物浓度的背景测量值。
- 在每个实验结束时,用温度匹配的 Ca2+ 无 PSS 洗涤 LV,以获得在没有 Ca2+ 的情况下的最小 Fura-2 荧光信号 (Rmin) 和 LV 的最大直径。一定要测量背景。
注:不含 Ca2+ 的 PSS 与 PSS 具有相同的成分,但不含 CaCl2,EDTA 被 1 mM EGTA (C14H24N2O10) (pH ~7.5) 取代。 - 将浴溶液与含有 10 mM Ca2+ 和离子霉素 (10 μM IONO)(一种 Ca2+ 离子载体)的温度匹配的 PSS 交换,以获得在饱和 Ca2+ 条件下的最大 Fura-2 荧光信号 (Rmax) 和 LV 的最小直径。一定要测量背景。
- 将腔室转移到配备有 LED 光源、20x S Fluor 物镜、细胞取景适配器和快速 CMOS 摄像机系统的倒置荧光显微镜载物台上,该系统可实现 15 Hz 的逐帧荧光捕获。
- 测量绝对值的公式 [Ca2+]i
- 使用 Rmin 和 Rmax 校准 340 和 380 nm 波长的比率,并计算绝对胞质游离 Ca2+ 浓度 ([Ca2+]i)。
- 使用公式 (1)26 计算绝对胞质游离 Ca2+ 浓度 ([Ca2+]i):
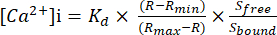 (一)
(一)
其中 Kd = 225 nM(Fura-2 的解离常数)26,R = 340/380 比率,在没有 Ca2+ 的情况下,Rmin = 340/380 比率,在饱和 Ca2+ 条件下,Rmax = 340/380 比率,在没有 Ca2+ 的情况下,S 自由 = 380 信号,在饱和 Ca2+ 条件下,S结合 = 380 信号
注:所有荧光信号均已针对背景荧光进行了校正。 - 图 5 是一个 Ca2+ 迹线示例,详细说明了要记录的参数。将基线 Ca2+ 定义为 Ca2+ 峰值之前的最低静息 Ca2+,将峰值 Ca2+ 定义为 Ca2+ 峰值期间达到的最高 Ca2+。振幅是峰值和基线 Ca2+ 之间的差值。直接从成像软件导出所有参数,但 Ca2+ 尖峰的频率除外,该频率将离线计算为 Ca2+ 尖峰/秒的数量。以下是参考软件中获取这些参数的关键步骤。
注意:整个轨迹可以导出为.txt文件,所有参数都可以在您选择的软件中进行分析或计算。 - 对于 Rmin,突出显示在无 Ca2+ 的 PSS 期间与背景对应的分子迹线部分。将打开一个对话框,并提供此部分跟踪的值。
- 在 “操作”下,选择 “常量”。
- 选择 Calcium-Numeric 背景, 然后输入上一步中分子和分母的背景数字。单击“ 确定”。
- 突出显示 Ratio 迹线中对应于 Ca2+ 无 Psa 期间最低比率的部分。这是 R最小值。另请注意此部分的分母值;这是 S免费。
- 重复步骤 2.3.4 到 2.3.7,将 Rmax 和 S 与对应于高 Ca、2+ 游离 PSS 和最高比率的迹线部分绑定。
- 在 “操作”下,选择 “常量”。
- 选择 Calcium-Calcium Calibration 并输入 公式 1 中列出的值。单击“ 确定”。
- 按照步骤 2.2.8 中所述调整屏幕上的一条迹线,以便您可以看到 Calcium-Numeric 减去的 Calcium。
- 执行单调瞬态分析以获取其余参数。有关此操作的说明,请参阅软件手册30。
- 或者,在 “导出”下,选择 “当前跟踪”。
- 选择要将 .txt 文件导出到的位置,然后单击“ 确定”。
注意:请确保单击要导出的单个跟踪。您可以导出整个跟踪或跟踪的选定部分。
3. 左心室收缩力和节律性的测量
- 如上所述,集成在成像系统中的边缘检测软件可生成用于 LV 直径测量的收缩迹线。使用这些测量值来分析收缩和节律性参数。 图 4 是一个收缩跟踪示例,详细说明了要记录哪些收缩参数。在 Diameter trace30 上使用单调瞬态分析功能直接从成像软件导出所有参数,但收缩频率、计算的流量和间隔除外,这些参数将离线计算。
注意:整个迹线可以导出到.txt文件中,所有参数都可以在您选择的软件中使用以下公式进行分析或计算。 - EDD、ESD、幅度、频率和计算出的流量测量值
- 测量左心室在节律性和自主收缩期间可以达到的最大和最小直径(分别为舒张末期直径 [EDD] 和收缩末期直径 [ESD]。
- 计算收缩幅度 (AMP) 作为 EDD 和 ESD 之间的差值。
- 将频率计算为每个测量周期的收缩次数(以秒为单位)。
- 使用公式 (2) 计算出的每 μm 流量:
计算流量 = π/4(EDD2- ESD2)F (2)
其中 EDD2 = 松弛状态下的血管横截面积,ESD2 = 收缩期间血管横截面积的测量值,F = 收缩频率/秒
- 节奏性: 收缩和放松时间:
- 左心室节律性的其他指标是收缩时间和放松时间。
- 将收缩时间定义为 LV 每次收缩达到 ESD 所需的时间。
- 将松弛时间定义为左心室每次松弛达到 EDD 所花费的时间,这将给出在特定时间范围内与绝对 [Ca2+]i 相关的节律性的总体指示。
- 根据公式 (3) 计算间隔时间 (ΔT)。
Δt = t2 (ESD2)-t1 (ESD1) (3)
结果
在暴露于不同浓度的硝苯地平(NIF; 0.1-100 nM)时,在分离的大鼠肠系膜左心室中评估了 LVs 的收缩力和胞质游离 Ca2+ ([Ca2+]i) 的相应改变(图 6)。参数,包括 Ca2+ 尖峰振幅、基线 Ca2+ 和峰值 Ca2+,随着 NIF 逐渐添加到灌注室,表现出浓度依赖性降低(图 7A)。同时,收缩幅度和计算流量等收缩参数也显示出逐步下降(图7B)。NIF的EDD直径略有增加(图7B)。Ca2+ 尖峰频率和收缩频率似乎是全有或全无的响应。然而,对于一个 LV,这种效应发生在 10 nM 处,而所有 LV 都停止了 100 nM 的收缩。因此,合并的数据会生成类似于分级浓度响应的图形。这种效果与早期在其他制剂中使用 NIF 治疗 LV 的出版物一致(金属丝和压肌摄影13,14)。曼哈顿图显示了节律性测量的个体左心室反应,包括间歇、收缩时间和放松时间(图 7C)。这种类型的数据表示使研究人员能够梳理出这些全有或全无的反应或收缩节律的可变性,以提供对潜在机制的更多见解。最终,收缩幅度和频率的降低导致通过这些分离的左心室的计算流量减少,这可作为体内功能的替代指标。总体而言,左心室收缩力的下降与[Ca2+]i的降低相关。我们的研究结果提供了直接证据,表明在 100 nM 范围内,NIF 通过拮抗淋巴肌细胞 (LMC) 中存在的 Cav1.x 通道,有效地停止了左心室的收缩和 [Ca2+]i 振荡。
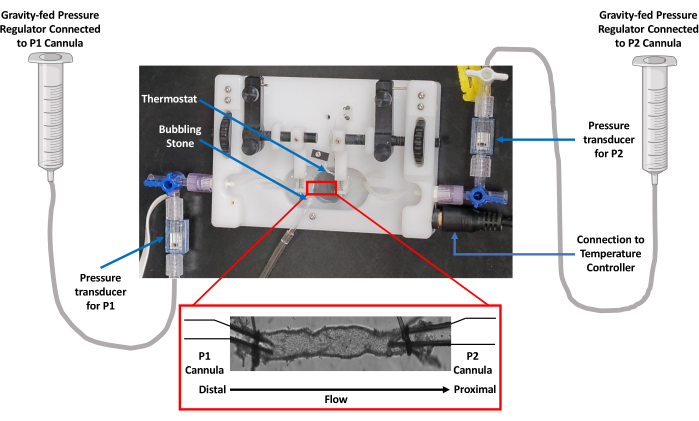
图 1:隔离容器室设置的图像。 血管灌注研究使用配备温度调节剂的隔离血管室。重力用于通过 PSS 储罐控制压力。压力通过连接到流入 (P1) 和流出 (P2) 套管的传感器进行监测。缩写:PSS=生理盐溶液。 请点击这里查看此图的较大版本.

图 2:打结的准备工作一目了然。(A) 在解剖显微镜下使用单丝 3 层丝缝合线进行双环准备, (B) 抓住松散的一端并将其拉过两个环, (C) 从两端拉结以保持一个小开口, 以及 (D) 从两侧切开多余的细丝和蓝色盒子,显示一个即用型完整的双反手结。比例尺 = 1.5 mm. 请点击这里查看此图的较大版本.
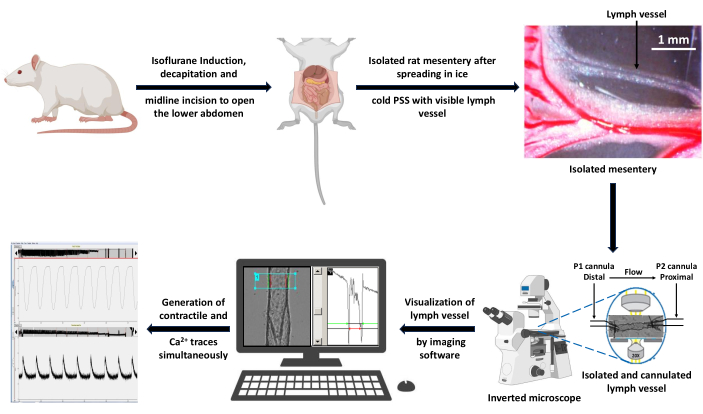
图 3:数据采集的实验工作流程示意图。 用5%异氟烷诱导麻醉健康大鼠,并进行斩首以去除躯干血。进行中线切口以暴露和分离肠系膜。将分离的肠系膜在冰冷的 PSS 溶液中展开,并解剖出不含脂肪的左心室,以便在隔离的血管灌注室中插管。使用20倍物镜将浴液放置在倒置显微镜的载物台上。用 340 nm 和 380 nm 波长的光交替激发容器,并使用 510 nm 的 CCD 相机收集发射荧光光谱。连接到显微镜的计算机使用荧光捕获和边缘检测成像软件生成收缩线和Ca2+ 迹线。比例尺 = 1 毫米。缩写:PSS=生理盐溶液;LV = 淋巴管;CCD = 电荷耦合器件。 请点击这里查看此图的较大版本.
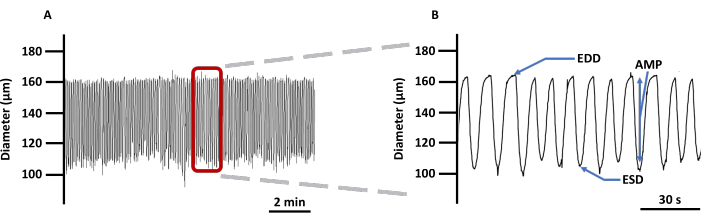
图 4:代表性左心室收缩痕迹。 (A) 在 PSS 中加载 Ca2+ 成像指示剂 Fura 2 AM 的空心左室直径变化记录示例和 (B) 放大轨迹,以显示与血管收缩力相关的所有参数:EDD、ESD、AMP 和频率。这些值用于计算节奏和流量。缩写:PSS=生理盐溶液;LV = 淋巴管;EDD = 舒张末期直径;ESD = 收缩末期直径;AMP = 振幅。 请点击这里查看此图的较大版本.
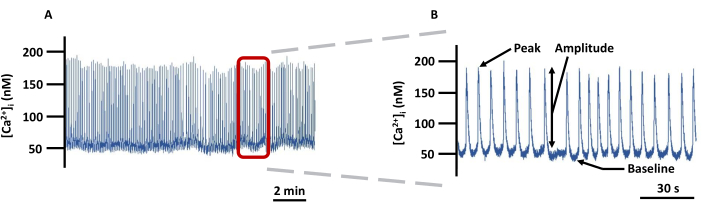
图 5:代表性的 LV Ca2+ 成像轨迹。 (A) 在 PSS 中加载有 Fura-2 的空心左心室中绝对 [Ca2+]i 变化的记录示例,以及 (B) 放大轨迹,以显示与 [Ca2+]i 相关的所有参数(峰值、幅度和基线)(未进行背景校正)。缩写:PSS=生理盐溶液。 请点击这里查看此图的较大版本.
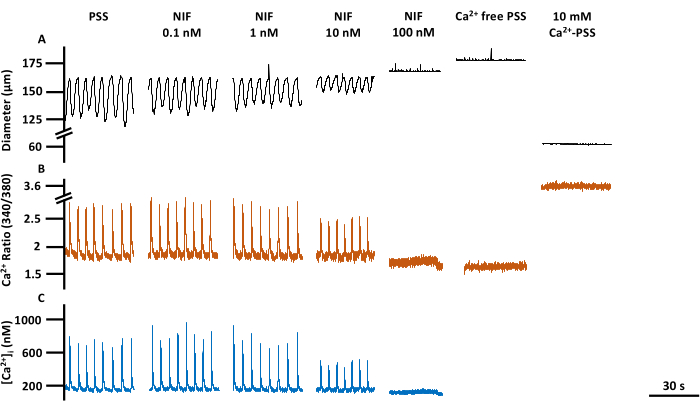
图 6:左心室收缩力和 Ca2+ 成像一目了然。 对应于 PSS 基线的 (A) 直径、(B) 340/380 比率和 (C) 绝对 [Ca2+]i 、硝苯地平、Cav1.x (Ca2+) 通道拮抗剂、浓度响应的代表性迹线,包括 Rmin 和 Rmax。缩写:PSS=生理盐溶液;LV = 淋巴管;NIF = 硝苯地平;Rmin = 最小 Fura-2 荧光信号;Rmax = 最大 Fura-2 荧光信号。 请点击这里查看此图的较大版本.
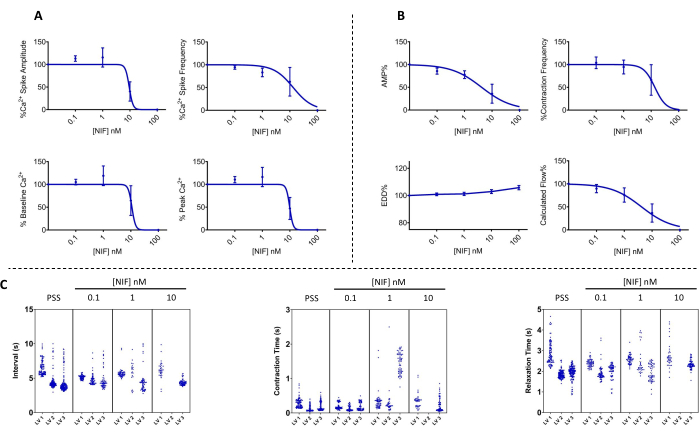
图 7:硝苯地平阻断了左心室中 Ca2+ 振荡和相应的收缩力。 (A) Ca2+ (n = 3) 和 (B) 收缩 (n = 3) 参数随着硝苯地平(一种电压依赖性 Cav1.x (Ca2+) 通道拮抗剂的加入而以浓度依赖性方式降低。(C) 具有代表性的曼哈顿图显示了收缩与收缩和松弛时间之间的平均时间间隔 (Δt)。数据以 SEM ±平均值表示。 缩写:PSS = 生理盐溶液;LV = 淋巴管;NIF = 硝苯地平;EDD = 舒张末期直径;AMP = 振幅。 请点击这里查看此图的较大版本.
讨论
由于左心室的脆弱性和体积小,因此在解剖和插管过程中必须格外小心。即使是对血管的轻微损伤也可能导致无活性左心室的发展或引起 [Ca2+]i 瞬变异常。在整个实验系列中,激发设置的一致性同样至关重要,以确保对照组和治疗组之间 [Ca2+]i 测量的可比性。如果不能保持均匀的设置,则存在高估或低估实验系列中各血管 [Ca2+]i 的巨大风险。同样,在每次实验中准确识别和监测同一血管区域也同样重要。
使用比率指示剂 Fura-2AM 可归一化由组织厚度不均匀、荧光团分布/泄漏或光漂白引起的荧光变化,这些问题在单波长染料中很常见。31 这使得本协议中描述的连续监测成为可能。然而,由于 Fura-2 通过螯合 Ca2+ 起作用,因此可能会使 LVs 超载并减少可用于收缩或药物反应的 [Ca2+]i 。在这些情况下,在没有节律性收缩的情况下,仍可能观察到 Ca2+ 尖峰。左心室长度的变化也可能导致这种现象。虽然这些 Ca2+ 测量可能仍然有效,但可能需要在重复设置中降低 Fura-2AM 的浓度,以成功实现 Ca2+ 和直径测量。我们的结果仅包括基线时同时存在 Ca2+ 尖峰和节律性收缩的 LV。
测量 Rmin 和 Rmax 是计算绝对值 [Ca2+]i 的关键步骤。因为在没有 Ca2+ 的情况下,Rmin 应该是 Fura-2 比率,因此在不含 Ca2+ 的 PSS 中添加了高浓度的 EGTA,以确保任何残留的 Ca2+ 的螯合。初步研究是在不含 Ca2+ 的 PSS 中使用 EDTA 进行的,这导致了偶发的血管收缩和相应的 Ca2+ 尖峰。对于 Rmax,已将高浓度的 Ca2+ 与离子载体离子霉素一起添加到 PSS 中,以最大化 [Ca2+]i 信号。高 Ca2+ 溶液可能会沉淀,这可能需要从 PSS 中去除 EDTA。重要的是,这些对 Rmin 和 Rmax 的额外测量提供了评估 [Ca2+]i 生理相关变化的机会,这可以提供有关膜兴奋性和收缩力机制的信息27 并允许与仅报告 Fura-2 的 340/380 比率的方案相比,实验组之间的基线比较。如果未能达到足够的 Rmin 和 Rmax 值,则无法计算绝对值 [Ca2+]i。
由于 LV 的收缩性质,该方法只能提供全局 Ca2+ 水平的测量值,而不是可以在瘫痪血管中测量的局部 Ca2+ 释放事件32。然而,与使用麻痹血管或单个细胞的方法相比,该方法有利于将绝对 [Ca2+]i 动力学的变化与收缩力相关联28,32。对于这种方法,假设测量的大部分 Ca2+ 起源于淋巴肌细胞。然而,内皮细胞也存在于这些分离的左心室中,可能有助于观察到的总 Ca2+ 信号33。这种贡献可以使用已被内皮细胞34 剥离的 LV 来估计。左心室收缩也可能导致血管壁在收缩周期中略微移入和移出焦点。因此,使用可以拉紧但又不会拉伸血管的短血管段非常重要。
除了在左心室中的应用外,该方法还可用于研究来自其他血管床(包括小动脉和静脉)的分离血管,并有望在神经生物学和血管生物学的其他分支中应用。探索靶向不同信号转导通路的各种激动剂或拮抗剂的作用是研究潜在 Ca2+ 动力学的另一种途径。此外,该技术还可用于涉及来自相应动物的对照和处理样品的比较研究。此外,这种方法适用于细胞水平的实施,例如在分离的淋巴肌细胞中,只需对灌注室和显微镜物镜进行最小的调整。总之,该方法提供了对全局 Ca2+ 动力学的生理相关见解,因为它与 LV 中的收缩性和节律性相关,并提供了对收集 LV 中 Ca2+ 动力学的潜在调节因子的稳健评估。
披露声明
作者没有要披露的利益冲突。
致谢
这项工作得到了美国国立卫生研究院的支持,包括美国国家普通医学科学研究所、生物医学研究卓越中心 (COBRE)、宿主对癌症治疗的反应研究中心 [P20-GM109005]、美国国家癌症研究所 [1R37CA282349-01] 和美国心脏协会博士前奖学金 [奖项编号:23PRE1020738; https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]。内容完全由作者负责,并不一定代表 NIH 或 AHA 的官方观点。图 1 和 图 3 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
参考文献
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。