使用流式细胞术定量突触材料的小胶质细胞吞噬
摘要
在这里,我们提出了两种方案,以使用流式细胞术量化 vGLUT1 阳性突触和 pHRodo Red 标记的粗突触体的小胶质细胞吞噬。
摘要
小胶质细胞在大脑的突触细化中起着关键作用。小胶质细胞突触吞噬的分析对于理解这个过程至关重要;然而,目前可用的识别突触小胶质细胞吞噬的方法,例如免疫组织化学 (IHC) 和成像,既费力又费时。为了应对这一挑战,我们在此提出了 体外 和 体内* 检测方法,这些检测方法允许使用流式细胞术对突触的小胶质细胞吞噬进行快速和高通量定量。
在 体内* 方法中,我们从成年小鼠大脑中分离新鲜细胞后进行细胞内 vGLUT1 染色,以量化小胶质细胞对 vGLUT1 + 突触的吞噬。在 体外突 触体吞噬试验中,我们使用从成年小鼠大脑中新鲜分离的细胞来量化小胶质细胞对 pHrodo Red 标记突触体的吞噬。这些协议共同提供了一种省时的方法来量化突触的小胶质细胞吞噬,并代表了基于劳动密集型图像分析的方法的有前途的替代方案。通过简化分析,这些分析有助于更好地了解小胶质细胞在不同疾病模型中突触精炼中的作用。
引言
小胶质细胞是中枢神经系统 (CNS) 的常驻免疫细胞1。它们不断扫描自己的微环境并提供监视 1,2。此外,它们经常与突触相互作用并介导突触活动的微调3。因此,他们已成为突触细化过程中的关键参与者。
各种研究小组已经证明了小胶质细胞通过吞噬突触在突触精化中的作用 3,4,5,6,7。这个过程的中断会导致神经发育和神经退行性疾病的病理学,如精神分裂症和阿尔茨海默病8。已经在各种神经系统疾病的小鼠模型中检测到小胶质细胞的异常突触精化 5,9,10。因此,确定小胶质细胞吞噬突触的不同机制对于理解神经发育和神经退行性疾病的病理生理学至关重要8。
靶向突触的小胶质细胞吞噬对于干预疾病进展和深入了解神经发育和神经退行性疾病的潜在机制具有巨大潜力。为了促进此类调查,需要快速和高通量的方法。目前的方法学方法包括体内、离体和体外测定,能够检测小胶质细胞内的突触物质。通常,小胶质细胞吞噬突触的检测在很大程度上依赖于免疫组织化学 (IHC) 和基于显微镜的方法 5,6,11,这些方法是劳动密集型的,并且在分析大量小胶质细胞方面显示出局限性。
鉴于这些技术限制,探索替代方法势在必行。为了克服这个问题,我们优化了一种基于流式细胞术的方法,该方法能够对突触的小胶质细胞吞噬进行高效、无偏倚和高通量的分析。我们选择海马体作为主要感兴趣的区域,因为它具有高度的突触重塑和可塑性12,但该方案可以适应各种大脑区域。虽然流式细胞术在以前的研究中已经用于检测突触13、14、15 的小胶质细胞吞噬,但我们在这里提供了一种采用目前市售的荧光团偶联 vGLUT1 抗体的分步方法。此外,我们提供了一种互补的体外 方法,用于通过使用粗突触体高通量筛选突触材料的小胶质细胞吞噬。
研究方案
实验程序的一般视图如图 1A 所示。所有涉及处理所用活体动物的实验均严格按照德国动物保护法进行,并已获得柏林地区卫生和社会服务办公室 (Landesamt für Gesundheit und Soziales, Berlin, Germany) 的批准。小鼠在标准实验室条件下分组饲养在通风笼中,在 Max Delbrück 分子医学中心 (MDC) 的动物核心设施中进行 12:12 小时的光照/黑暗循环。随意提供食物和水 。 缓冲液和试剂的组成见 表 1 ,与本协议中使用的所有试剂、仪器和材料相关的详细信息见 材料表 。对于 vGLUT1 特异性测定,我们在整个手稿中使用了术语 体内*,以承认流式细胞术需要组织匀浆和细胞分离,并且小胶质细胞在分离程序后表现出大约 95% 的活力(图 1B 和 补充图 S1)。因此,它们在短时间内保留了 在体外吞噬突触材料的能力,直到固定。因此,vGLUT1 + 小胶质细胞的定量包括 体内 和短期 离体 吞噬,直到固定步骤。
1. 细胞内 vGLUT1 染色检测小胶质细胞体内 * 吞噬谷氨酸能突触
注:以下细胞分离程序改编自16.细胞分离的所有步骤都应在冰上进行。
- 使用腹膜内注射戊巴比妥麻醉小鼠。用 10 mL 冰冷的 Dulbecco 磷酸盐缓冲盐水 (DPBS) 心内灌注小鼠 ~2 分钟。
注意:每个样品 (n) 使用一只鼠标。 - 将大脑从颅骨中取出,并将其保存在 1 mL 神经细胞培养基中。
注:神经细胞培养基,如 Hibernate-A 培养基,用于确保组织解离过程后细胞的高活力。 - 将大脑转移到装有 1 mL 冰冷神经细胞培养基的培养皿中,并如前所述解剖海马体17。
- 将海马体转移到装有 1 mL 神经细胞培养基的 Dounce 匀浆器中,并使用松散的杵以大约 ~25 次轻柔的笔触分离组织。
- 将 70 μm 过滤器放在 5 mL 聚丙烯管上,并添加 500 μL 神经细胞培养基。通过过滤器将组织匀浆转移到 5 mL 聚丙烯管中。
- 用 1 mL 冷神经细胞培养基冲洗 Dounce 匀浆器 2 次,并以 400 × g 离心样品 8 分钟。
- 吸出上清液,并通过轻轻移液将沉淀重悬于 500 μL 冰冷的 DPBS 中。确保悬浮液均匀,并使用 DPBS 完成最终体积至 1.5 mL。
- 向样品中加入 500 μL 等渗 Percoll 溶液,轻轻重悬,然后用另外 2 ml 冷 DPBS 覆盖。
- 将样品以 3,000 × g 离心 10 分钟,全加速,无制动。吸出中间阶段的顶层和髓鞘盘。
注意:如果没有特别说明,以下所有离心步骤均在 4 °C 下进行。 - 加入 4 mL 冷 DPBS,并以 400 × g 离心样品 10 分钟。吸出上清液,将细胞重悬于 100 μL 可固定活力染色溶液中,并将样品在 4 °C 下孵育 30 分钟。
- 向样品中加入 1 mL 冷 DPBS,并以 300 × g 离心样品 5 分钟。弃去上清液,加入 100 μL CD16/CD32 染色液(FACS 缓冲液中的 1/200)。涡旋 ~5 秒,并在 4 °C 下孵育 10 分钟。
注:CD16/CD32 染色是一种预处理,用于在流式细胞术等应用之前最大限度地减少抗体与携带 FcR 的细胞(如小胶质细胞)的非特异性结合。 - 向样品中加入 1 mL FACS 缓冲液,并以 300 × g 离心 5 分钟。吸出上清液并加入 100 μL 染色预混液-I(1/100 抗 CD11b/抗 CD45 + 1/200 抗 Ly6C/抗 Ly6G,溶于 1x FACS 缓冲液中)。将样品在 4°C 下避光孵育 20 分钟。
- 向样品中加入 1 mL FACS 缓冲液,并以 300 × g 离心 5 分钟。
- 将沉淀重悬于 250 μL 固定缓冲液中。在 4 °C 下孵育 25 分钟。
- 加入 2 mL 1x 透化 (PERM) 缓冲液,并以 300 × g 离心 5 分钟。
- 弃去上清液,加入 100 μL vGLUT1 或同种型对照染色液。涡旋 ~5 秒,并将样品在 4 °C 下孵育 50 分钟。
- 加入 2 mL 的 1x PERM 缓冲液,并以 300 × g 离心 5 分钟。弃去上清液,向样品中加入 2 mL FACS 缓冲液。
- 以 300 × g 离心 5 分钟,弃去上清液。将细胞重悬于 250 μL FACS 缓冲液中,并将样品通过 40 μm 过滤器过滤器。
- 使用流式细胞术分析来自单个/活/CD11b++/CD45 + 小胶质细胞的 vGLUT1 荧光强度。使用脾巨噬细胞作为每个实验的阴性对照。
- 通过 70 μm 过滤器过滤器轻轻压缩碎脾组织两次来分离脾细胞。用 40 mL DPBS 冲洗过滤器,并将悬浮液收集在 50 mL 锥形管中。
- 离心 350 × g 10 分钟,然后将所得沉淀重悬于 1 mL 红细胞裂解缓冲液溶液中。在冰上孵育 10 分钟。
- 孵育后向样品中加入 10 mL DPBS,并以 350 × g 离心 10 分钟。
- 继续执行步骤 1.11 和 1.17 之间解释的染色步骤。
注意: 补充图 S2 中提供了门控策略,用于将脾巨噬细胞定义为 CD11b ++/ CD45 ++/ 活细胞群。 - 门控策略(图 1)
- 主门:调整前向散射区 (FSC-A) [x 轴] 和侧向散射区 (SSC-A) [y 轴] 以将小胶质细胞群包含在门控区域并排除细胞碎片。
- 调整前向散射区域 (FSC-A) [x 轴] 和前向散射高度 (FSC-H) [y 轴] 以排除双峰。单峰在此点图上显示为对角线。
- 调整 CD11b-PECy7 [y 轴] 和 CD45-APC [x 轴],并将具有高表面水平的 CD11b 和中等水平 CD45 的群体设门为小胶质细胞。
- 排除 FITC[y 轴] 负门中的死细胞。可选:还要排除 FITC 阴性门中 Ly6C 和 Ly6G-FITC 阳性的细胞,以从分析中排除 CNS 相关巨噬细胞。
注:与活细胞相比,膜受损的死细胞允许可固定的活性染料进入细胞质,从而增加蛋白质标记的量18。因此,死细胞将比活细胞更亮,活细胞包含在定义的门中。 - 调整 CD45-APC [x 轴] 和 vGLUT1-PE [y 轴];高于阈值门的群体,在脾脏样本中未检测到阳性事件(内部生物阴性对照, 图 1E)被视为样本中的 vGLUT1 阳性部分。
2. 小胶质细胞体外吞噬粗突触体
- 粗突触体制备和 pHrodo Red 标记
注意:以下所有步骤都应在冰上进行。- 按照步骤 1.1 到 1.2 进行操作。
- 将大脑转移到装有 1 mL 冰冷神经细胞培养基的培养皿中,并仔细解剖海马体。始终将培养皿放在冰上。下一步使用海马体进行小胶质细胞分离。
- 将大脑的其余部分(不包括小脑和嗅球)转移到装有 1 mL 突触蛋白提取试剂的 Dounce 匀浆器中,并使用松散的研杵轻轻解离组织,敲击大约 ~30 次。每 10 mL 提取试剂补充一片蛋白酶抑制剂,并根据制造商的说明分离突触体。
注:突触蛋白提取试剂,如 SynPER19,用于制备含有生物活性突触前和突触后蛋白的突触体。 - 将粗突触体沉淀溶解在 500 μL 的 0.1 M Na2CO3 溶液中。用 10 μL 0.2 mM pHrodo Red 对突触体样品进行染色。将粗突触体样品在室温 (24-25 °C) 下孵育 1.5 小时,同时轻轻搅拌。
- 向样品中加入 1 mL 冷 DPBS,全速离心 1 分钟 (20,815 × g),然后吸出上清液。
- 重复步骤 2.1.5 总共 7 次,以从样品中去除未结合的过量 pHrodo Red。
- 在最后一次离心后,进行标准 BCA 分析以定量样品的蛋白质浓度。
- 可选:使用液氮在含有 5% DMSO 的 DPBS 中快速冷冻突触体样品,并在 -80 °C 下保存 3 周。 用铝箔覆盖管子,以保持光线暴露最少。
- In vitro 使用新鲜分离的成体小胶质细胞的粗突触体吞噬测定
- 制备 aCSF 并用 95% O2:5%CO2 平衡 30 分钟。
注:对于步骤 2.2.2-2.2.4,请按照制造商的说明制备木瓜蛋白酶消化液。 - 将 4 mL aCSF 添加到木瓜蛋白酶试剂盒中的 小瓶 2 中。将样品瓶置于 37 °C 水浴中 ~10 分钟,直到木瓜蛋白酶溶液呈澄清状态。
- 将 400 μL aCSF 添加到木瓜蛋白酶试剂盒中的 小瓶 3 中。通过缓慢移液轻轻混合 ~10 次。
- 从 样品瓶 3 向 样品瓶 2 中加入 200 μL(在步骤 2.2.3 中重建)。保存 小瓶 3 的其余部分。
- 取步骤 2.1.2 中解剖的海马体,用手术刀将解剖的海马体切碎。
- 将切碎的海马体转移到装有 2 mL 步骤 2.2.5 中制备的酶溶液的组织解离管中。将试管放入组织解离器中并运行程序: 37C_ABDK_01 (需要 ~30 分钟)。
- 将样品置于 37 °C 的水浴中 ~20 分钟,并使用 1 mL 移液管每 5 分钟研磨一次混合物,不要产生任何气泡。
注意:这个过程应该继续进行,直到组织完全解离并且看起来完全均匀,以确保有效的解离。如果未另有说明,则以下所有离心步骤均在 4 °C 下进行。 - 小心地将混浊的细胞悬液去除到新的 15 mL 试管中,并以 300 × g 离心 5 分钟。
- 在这 5 分钟内,每个样品制备以下洗涤混合物 (5 mL);将木瓜蛋白酶试剂盒中提供的 500 μL 重组白蛋白-卵类粘蛋白抑制剂溶液添加到 4.5 mL aCSF 中。将步骤 2.2.5 中小瓶 3 中的剩余溶液添加到洗涤混合物中。
- 丢弃步骤 2.2.8 中的上清液,并立即将细胞沉淀重悬于洗涤混合物溶液中。
- 将样品通过 70 μm 过滤器进入新的 5 mL 微量离心管。将样品以 300 × g 离心 5 分钟。
- 继续执行前面在步骤 1.7-1.9 中解释的 Percoll 梯度离心步骤。
- 通过缓慢上下移液,在 MACS 染色缓冲液中小心地重悬细胞。将样品在 4 °C 下孵育 15 分钟。
- 向每个样品中加入 1 mL MACS 缓冲液,并以 300 × g 离心 8 分钟。
- 将细胞重悬于 500 μL 的 MACS 缓冲液中。
- 将正数选择列放入磁性分离器中。用 3 mL MACS 缓冲液冲洗柱子来平衡柱子。
- 轻轻混合并将 500 μL 细胞悬液涂在色谱柱上。用 3 mL MACS 缓冲液洗涤色谱柱 3 次。
- 从磁性分离器中取出色谱柱,并将其放在 15 mL 锥形管上。在色谱柱上加入 5 mL MACS 缓冲液,并立即使用溶出器冲洗细胞。将样品以 300 × g 离心 10 分钟。
- 在此期间,在 DPBS 中制备 20 mL 的 40% FBS。在水浴中将每个样品 1 mL DMEM 预热至 37 °C。
- 将最终细胞沉淀溶解在 1 mL 预热的 DMEM 中。在 24 孔板中,每孔 500 μL 预热的 DMEM 中接种约 ~150,000-200,000 个细胞。作为对照,在 1-2 个额外的孔中接种相似数量的细胞。使用光学显微镜检查所有孔中细胞的汇合度。
注意:如果目标大脑区域是海马体或相对较小的大脑区域,则每个样品 (n) 可以合并 5 只小鼠以分离 ~150,000 个小胶质细胞。对于整个大脑,每 n 只小鼠 1 只就足以使用两种分离方案获得相似数量的细胞。或者,可以将 ~40,000 个细胞接种在最终体积为 100 μL 的 96 孔板中,以开始吞噬测定。这减少了分析的细胞数量,但也减少了每 n 使用的小鼠数量。由于 DMEM 中缺乏 FCS 而导致的蛋白质剥夺将触发吞噬作用。 - 将板在培养箱(37°C 和 5% CO2 )中孵育 1-2 小时。
注意:此步骤旨在使细胞在功能吞噬测定开始之前从分离程序的易受压力影响中恢复。 - 非常缓慢地从每个孔中取出 250 μL 培养基,向每个孔中加入 250 μL 新鲜预热的 DMEM,并在顶部添加 3 μg pHRodo Red 标记的突触体。使用光学显微镜检查所有孔中的细胞汇合度。
- 对于阴性对照孔,将相同量的未标记突触体添加到接种有细胞的额外孔中。
- 对于测试孔,确保孔 1 仅包含细胞;孔 2 包含 Cells+ 未标记的突触体;孔-3 含有细胞 + 3 μg pHrodo Red;孔 4 含有 DMEM + 3 μg pHrodo Red。
- 将细胞与突触体在培养箱(37°C 和 5% CO2)中孵育 2 小时。
- 取出培养基并用冷 DPBS 清洗孔。每孔加入 200 μL 胰蛋白酶/EDTA 溶液以分离细胞 35 秒。
- 每孔加入 1 mL 40% FBS 的 DPBS 溶液,并通过过滤器将细胞转移到 5 mL 聚丙烯管中。在此过程中,将板和试管都放在冰上,以促进细胞分离。
- 使用 500 μL 冰冷的 DPBS 将每个孔洗涤 2 次。将收集的样品以 500 × g 离心 5 分钟。
- 将细胞重悬于含有 1/200 CD16/CD32 的染色溶液中,溶于 100 μL FACS 缓冲液中,并在冰上孵育 10 分钟。
- 孵育后,将 CD11b 和 CD45 加入染色溶液中,每种溶液的终浓度为 1/100。将样品在 4 °C 下避光孵育 20 分钟。
- 用 1 mL FACS 缓冲液洗涤样品,并以 300 × g 离心 10 分钟。
- 将沉淀重悬于 250 μL FACS 缓冲液中,并使用流式细胞术记录至少 100,000 个总事件。分析 CD11b++/CD45 + 小胶质细胞的 pHrodo Red 荧光强度。
- 门控策略(图 2C)
- 调整主门:前向散射区 (FSC-A) [x 轴] 和侧向散射区 (SSC-A) [x 轴] 以将小胶质细胞群包含在门控区域并排除细胞碎片。
- 调整前向散射区域 (FSC-A) [x 轴] 和前向散射高度 (FSC-H) [y 轴] 以排除双峰。单峰在此点图上显示为对角线。
- 调整 CD11b-PECy7 [y 轴] 和 CD45-APC [x 轴],并将具有高表面水平 CD11b 和中等水平 CD45 的群体设门为小胶质细胞。
- 计算来自该群体的 pHrodo-PE 的中位荧光强度。使用与未标记的突触体一起孵育的相同细胞作为阴性对照。
- 制备 aCSF 并用 95% O2:5%CO2 平衡 30 分钟。
代表性结果
在这个项目中,我们优化并提出了两种方案来测量小胶质细胞对突触的 体内*和 体外 吞噬。在第一个方案中,我们专注于 体内* 吞噬 vGLUT1 阳性突触。作为起点,我们使用了之前发布的方案14。然而,该方案中使用的 FACS 抗体已停止使用,我们增加了许多优化步骤以及一种用于小胶质细胞分离的新方法16。这就是为什么这里介绍的实验方案值得与科学界分享,作为对已经发布的实验方案的全面更新。
为了量化突触的小胶质细胞吞噬,我们使用了 11-14 周龄的 C57BL/6N 雄性小鼠。海马体因其高度的突触重塑和可塑性而被选为主要感兴趣区域12。我们分析了 C57BL/6N 小鼠海马中 %vGLUT1 阳性小胶质细胞以及小胶质细胞特异性 vGLUT1-PE 荧光强度 (MFI)。每个实验使用来自相同动物的脾巨噬细胞作为生物阴性对照。我们通过证明与同种型对照和脾脏巨噬细胞相比,来自海马小胶质细胞的 vGLUT1-PE 荧光信号更高来测试 vGLUT1 抗体(图 1B-E)
此外,我们比较了小脑和嗅球中突触的小胶质细胞吞噬(作为高突触可塑性的另一个参考)20。我们发现,与海马体相比,嗅球在小胶质细胞中具有较高的 vGLUT1 荧光信号,而在小脑中的信号较低(图 1F)。在脾脏巨噬细胞中检测到最低的信号强度,作为内部阴性对照(图 1E)。此外,我们使用 Vglut-IRES-Cre/ChR2-YFP 小鼠来测试我们的 vGLUT1 抗体的免疫反应性。YFP 由这些小鼠的谷氨酸能神经元表达,表明 YFP 阳性群体还应包括 vGLUT1 阳性部分。使用这种染色方案,我们检测到 98.7% 的 YFP 阳性群体为 vGLUT1 阳性,验证了我们抗体的效率(补充图 S3)。
总体而言,这些结果验证了 vGLUT1 抗体和所提出的染色方案的效率。我们证明,与其他实验方法相比,该方案和抗体可以自信地用于以高通量和快速的方式定量 体内*突触的吞噬。
继续体外方法,我们分离了成年小胶质细胞,并将它们与从同一动物中分离的新鲜分离的 pHrodo Red 标记突触体一起孵育,以量化它们的体外吞噬(图 2A)。我们用 pHrodo Red 标记突触体,这自然会增加酸性周围 pH21 中的荧光信号。我们新鲜分离了突触体,并将它们暴露于不同的 pH 值 (pH = 4 和 pH = 11) 中。在确认低 pH 值下荧光信号的增加作为原理验证实验(图 2B)后,我们将这些突触体与新鲜分离的小胶质细胞孵育 1.5-2 小时。作为对照,我们将小胶质细胞与未标记的突触体一起孵育。接下来,我们分析了来自 CD11b++/CD45 + 小胶质细胞的 pHrodo Red-PE 荧光信号,并观察到阳性 PE 荧光,这与在 pH = 4 时从突触体获得的荧光相当(图 2C)。因此,该方法提供了对突触体体外吞噬的快速和高通量分析,并且可以在必要的优化步骤后扩展到淀粉样蛋白斑块或其他潜在靶标的吞噬。事实上,Rangaraju 等人使用类似的基于流式细胞术的方法量化了小胶质细胞对淀粉样蛋白 β 的吞噬22。总之,这两种方法在体内*和体外都提供了对突触小胶质细胞吞噬的稳健、高效和高通量定量。
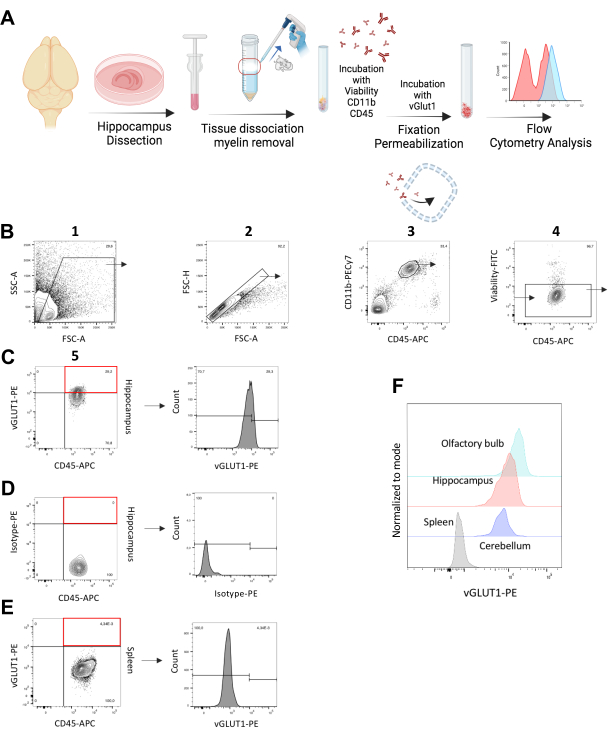
图 1:体内 vGLUT1+ 突触的小胶质细胞吞噬分析 *。 (A) 描述细胞内 vGLUT1 染色步骤的实验工作流程的图形说明。(B) 定义来自海马体的单个/CD11b++/CD45+/活细胞群的门控策略。该群体用于分析 vGLUT1-MFI 以及量化海马中 vGLUT1 + 小胶质细胞的百分比。红色矩形显示的门表示总样品中的 vGLUT1 + 细胞分数。(C) 直方图表示 vGLUT1-PE 荧光强度。(D) 红色矩形所示的门表示没有显示同种型 PE 免疫反应性的阳性细胞组分。直方图表示同种型 - PE 荧光强度。(E) 红色矩形所示的门表示脾脏巨噬细胞中没有显示 vGLUT1-PE 免疫反应性的阳性细胞组分。直方图表示 vGLUT1-PE 荧光强度。直方图上指示的门从来自脾脏的 vGLUT1-MFI 终止 (~104) 的水平开始,用于分析大脑样本中的 vGLUT1 阳性部分。(F) 叠加直方图显示了脾巨噬细胞(灰色)和海马(红色)、小脑(紫色)和嗅球(浅蓝色)的小胶质细胞的 PE 荧光强度的比较。 请单击此处查看此图的较大版本。
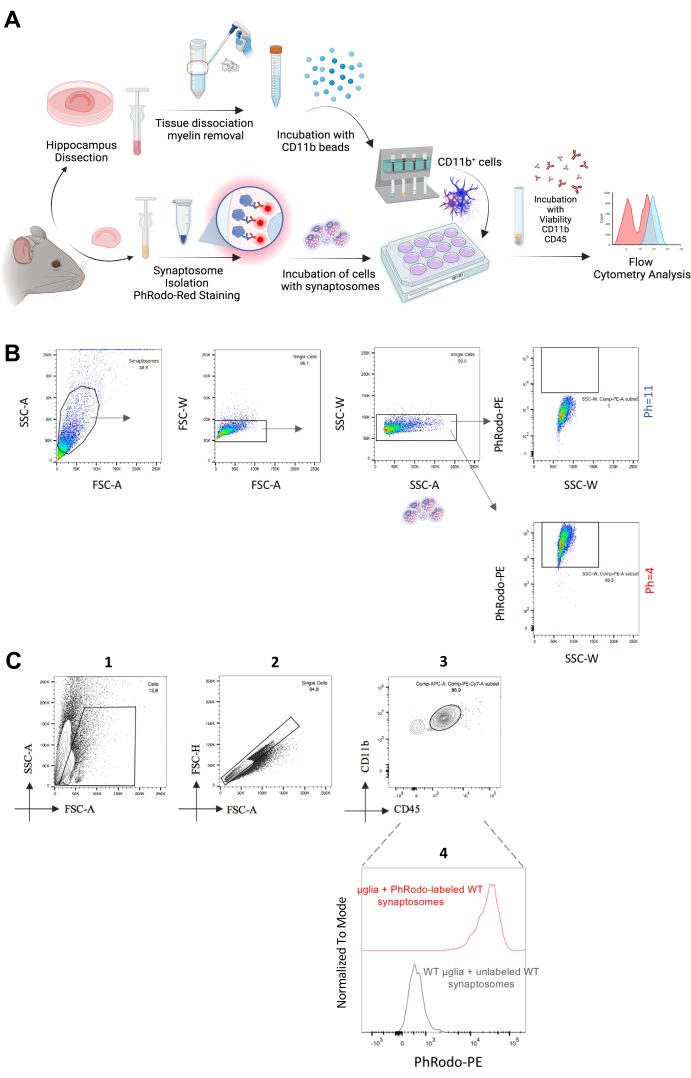
图 2:体外突触小胶质细胞吞噬分析。(A) 描述体外突触体吞噬测定步骤的实验工作流程的图形说明。(B) 在两种不同 pH 值下孵育的突触体在 pH = 11 时显示低 pHrodo Red-PE 荧光信号,在 pH = 4 时显示高 pHrodoRed-PE 荧光信号。(C) 单个/CD11b++/CD45 + 细胞群分析 pHrodo Red-PE 荧光强度。与未染色的突触体一起孵育的小胶质细胞用作阴性对照。请单击此处查看此图的较大版本。
表 1:本实验步骤中使用的缓冲液和试剂列表。请点击此处下载此表格。
补充图 S1:新鲜分离的成人小胶质细胞的代表性图像。 使用具有 20 倍物镜的光学显微镜按照基于木瓜蛋白酶的组织解离方案和基于 MACS 的 CD11b + 小胶质细胞分离获得图像。比例尺 = 50 μm。 请点击此处下载此文件。
补充图 S2:代表性的 FACS 图展示了定义脾巨噬细胞的门控策略。 脾脏在每次实验运行的实验中用作阴性对照,同时测试海马体中小胶质细胞对突触的吞噬。上面给出的 FACS 图将脾巨噬细胞定义为 CD11b++/CD45++/活细胞群。该群体用于设置阈值,以量化位于该阈值门以上的大脑样本中的 vGLUT1 + 小胶质细胞。 请点击此处下载此文件。
补充图 S3:代表性的 FACS 图,展示了测试 vGLUT1 抗体效率的门控策略。 (A) 描述 vGLUT1 染色步骤的实验工作流程的图形示意图。YFP+ 谷氨酸能神经元用于测试 vGLUT1 抗体的免疫反应性。(B) 从用作测试 vGLUT1 FACS 抗体效率的阳性对照的 Vglut-IRES-Cre//ChR2-YFP 小鼠海马体定义 YFP+ 群体的门控策略。YFP+ 组分被设门以指定谷氨酸能突触。在该人群中,分析 vGLUT1 抗体的免疫反应性以测试抗体的免疫反应性。与 (C) 同种型对照相比;97.9% 的 YFP 阳性细胞组分被检测为 (D) vGLUT1 阳性。(E) 叠加的直方图表示同种型和 vGLUT1 抗体之间的 PE 荧光比较。 请点击此处下载此文件。
讨论
通过小胶质细胞-突触相互作用进行突触细化是神经免疫学领域中一个有趣的研究领域,为小胶质细胞在神经退行性和神经发育障碍中的作用提供了有希望的见解。2011 年;Paolicelli 等人提供了小胶质细胞内存在突触物质的证据,阐明了它们参与突触吞噬过程4。另一项有趣的研究采用了延时成像和 离体 器官型脑切片培养模型,并报告说小胶质细胞参与称为胞吞作用的吞噬过程,它们吞噬突触前结构而不是整个突触结构23。最近发表的一篇使用新的转基因小鼠模型的出版物能够测量完整组织中的吞噬作用,显示 Bergmann-glia 在体内 运动学习时进行了修剪24。因此,有足够的证据表明神经胶质细胞参与突触吞噬,包括小胶质细胞。然而,这种小胶质细胞功能在多大程度上影响突触修剪的动态和选择性过程需要进一步的证据。
尽管如此,突触小胶质细胞吞噬的量化是一个有价值的指标,并提供了对小胶质细胞-突触相互作用的复杂动力学的部分见解,尤其是突触细化。一项全面的综述总结了当前用于研究小胶质细胞吞噬突触的方案25。我们想强调的是,我们的协议是根据已经在使用的现有协议进行了优化的。本研究中提出的方法提供了快速和高通量定量小胶质细胞吞噬各种解剖大脑区域中的突触。根据大脑区域,两种方法都可以在最多两天内分析至少 10,000 个小胶质细胞,这使得它们对于并行测试多个小鼠模型很有价值。
我们承认 vGLUT1 + 小胶质细胞的定量包括 体内 和短期 离体 吞噬,直到固定步骤。因此,我们建议我们的测定提供了一种快速可靠的方法来量化小胶质细胞内的突触物质,作为使用 IHC 等方法进行 体内 验证之前的初始步骤。
流式细胞术分析的另一个缺点是突触标志物抗体的可用性有限,尤其是抑制性突触。要找到市售的直接偶联抗体来显示这些标记物的明亮信号是具有挑战性的。鉴于测试靶向突触标志物的不同抗体需要大量的优化时间,因此与科学界分享使用不同抗体进行细胞内染色的良好优化程序非常重要,就像我们在这项研究中所做的那样。
关于本研究中的数据分析,我们使用同型对照作为技术阴性对照来解释 vGLUT1 抗体的非特异性结合,因为它们提供了样品中抗体非特异性结合的估计值,同时优化了基于流式细胞术的测定26。然而,同种型对照已大多经过优化以检测来自表面染色程序的非特异性背景信号,而对于细胞内染色对照来说并不是最佳选择 27,28。因此,在进行细胞内染色时,不应依赖它们来区分阴性和阳性群体,这涉及到可能影响抗原检测、自发荧光和荧光团亮度的固定和透化步骤29。这种细胞内染色程序需要使用适当的生物内参来定义细胞内标志物染色的阳性细胞群29。因此,考虑到我们使用细胞内染色方案,我们采用了内部生物阴性对照(脾巨噬细胞),并根据从同一小鼠分离的脾巨噬细胞定义了阳性和阴性群体之间的边界。我们区分了门上方的阳性群体,其中没有来自作为生物阴性对照的脾巨噬细胞的 vGLUT1 阳性事件(图 1)。
本研究中提出的两种方法都为以快速和高通量的方式初步分析突触的小胶质细胞吞噬提供了巨大的潜力,分析了来自小大脑区域的 10,000 多个细胞,这是标准显微镜技术无法实现的。因此,这些方法比劳动和时间密集型方法具有显着优势,并且通过允许分析更多的小胶质细胞,提供了更全面的突触吞噬分析。此外,本研究中提出的 体外 方法对于测试不同治疗对突触小胶质细胞吞噬的影响特别有用。它能够直接量化处理对小胶质细胞的影响,而没有与其他细胞类型相关的混杂因素。此外,它还可以作为一种间接方法来证明微环境或其他细胞类型对突触吞噬过程的潜在影响。因此,我们得出结论,这些方法,尤其是并行使用时,为突触材料的小胶质细胞吞噬分析提供了直观和有利的替代方案。
然而,通过基于 FACS 的离体 吞噬测定对新鲜分离的小胶质细胞进行分析可能会带来一些缺点。首先,采用经过充分优化的方案至关重要,该方案从成人大脑中生成新鲜分离的小胶质细胞,同时避免小胶质细胞的 离体 激活和应激反应。Dissing-Olesen 等人通过在 37 oC30 下采用组织解离程序,结合转录和翻译抑制剂来克服这个问题。另一方面,Mattei 等人提出了一种冷的机械组织解离方案,以避免诱导应激相关基因的离体表达16 ,我们在第一部分调整了该方案,以避免在细胞内 vGLUT1 染色之前应激相关小胶质细胞反应的 离体 激活。考虑到基于木瓜蛋白酶的组织解离后小胶质细胞的产量较高(数据未显示),我们在 体外 突触体吞噬测定之前的第二部分采用了酶组织解离方案。当与突触体一起孵育时,小胶质细胞在培养条件下不可避免地保持在 37 °C,并且在 37 °C 下孵育确实可以诱导小胶质细胞的变化,这是所有 体外 测定和细胞培养程序的常见缺点。因此,我们建议同时使用这两种提出的方案,以在突触的小胶质细胞吞噬方面得出更广泛的结论。
此外,重要的是要仔细定义选择 CD11b++/CD45 + 小胶质细胞的门控策略,方法是考虑到脑实质中存在其他也表达这些标志物的免疫细胞31。更重要的是,在选择专门针对小胶质细胞的标志物(例如,TMEM119、P2RY12)时,重要的是要考虑到它们在病理和炎症条件下的表达水平可能会发生变化32,并且在建立 FACS 面板以量化突触的小胶质细胞吞噬之前应考虑此类变化。最后,必须强调的是,前面讨论的两种方法,包括基于 IHC 和显微镜的 体内 方法,都不能单独捕获小胶质细胞对突触的主动和选择性修剪。这些方法无法区分小胶质细胞的主动修剪与脑实质内突触碎片的被动清除。因此,在评估和讨论数据时,必须清楚地区分这些不同的概念。
披露声明
作者声明没有利益冲突。
致谢
我们感谢 Regina Piske 在小胶质细胞分离方面的技术援助,以及 Caio Andreta Figueiredo 博士在补充图 S1 中对显微镜图像采集的帮助。我们感谢 MDC 的 FACS 设施提供的技术支持。本手稿部分展示了 2024 年提交给 Brain, Behavior and Immunity Journal 的代表性数据。图 1A、图 2A 和补充图 S3A 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL Dounce Homogenizer | Active Motif | Cat# 40401 | |
| 5 mL Tubes | Eppendorf | Cat# 0030119452 | |
| Anti-CD11b | ThermoFisher Scientific | Cat# 25-0112-82 | |
| Anti-CD45 | BD | Cat# 559864 | |
| Anti-Ly6C | BD | Cat# 553104 | |
| Anti-Ly6G | BD | Cat# 551460 | |
| BCA Protein Assay Kit | Pierce | Cat# 23227 | |
| C-Tubes | Miltenyi Biotech | Cat# 130-096-334 | |
| CD11b MicroBeads | Miltenyi Biotech | Cat# 130-093-634 | |
| CD16/CD32 Antibody | Thermo Fisher Scientific | Cat#14-0161-82 | |
| Cytofix/Cytoperm Kit | BD | Cat# 554714 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Gibco | Cat# 41966029 | |
| Dulbecco´s Phosphate Buffered Saline (DPBS) | Gibco | Cat# 14190144 | |
| Falcon Round-Bottom Polystyrene Test Tubes | Thermo Fisher Scientific | Cat# 08-771-23 | |
| fixable viability dye | Thermo Fisher Scientific | Cat# L34969 | |
| Hibernate A medium | ThermoFisher | Cat# A1247501 | |
| LS-columns | Miltenyi Biotech | Cat# 130-042-401 | |
| Papain Dissociation System | Worthington | Cat# LK003150 | |
| Percoll | Th.Geyer | Cat# 17-0891-02 | |
| Petri dishes | Thermo Fisher Scientific | Cat# 11339283 | |
| pHrodoRed | Thermo Fisher Scientific | Cat# P36600 | |
| Protease inhibitor | Roche | Cat# 5892970001 | |
| Red Blood Cell Lysis Buffer | Sigma | Cat# 11814389001 | |
| Steritop E-GP Sterile Filtration System | Merck | Cat# SEGPT0038 | |
| SynPer Solution | ThermoFisher | Cat# 87793 | |
| vGLUT1 Antibody | Miltenyi Biotech | Cat# 130-120-764 |
参考文献
- Wolf, S. A., Boddeke, H. W., Kettenmann, H. Microglia in physiology and Disease. Annu Rev Physiol. 79, 619-643 (2017).
- Hanisch, U. K., Kettenmann, H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain. Nat Neurosci. 10 (11), 1387-1394 (2007).
- Tremblay, M. &. #. 2. 0. 0. ;., Lowery, R. L., Majewska, A. K. Microglial interactions with synapses are modulated by visual experience. PLoS Biol. 8 (11), e1000527 (2010).
- Paolicelli, R. C., et al. Synaptic pruning by microglia is necessary for normal brain development. Science. 333 (6048), 1456-1458 (2011).
- Schafer, D. P., et al. Microglia contribute to circuit defects in Mecp2 null mice independent of microglia-specific loss of Mecp2 expression. eLife. 5, e15224 (2016).
- Schafer, D. P., et al. Microglia sculpt postnatal neural circuits in an activity and complement-dependent manner. Neuron. 74 (4), 691-705 (2012).
- Filipello, F., et al. The microglial innate immune receptor TREM2 is required for synapse elimination and normal brain connectivity. Immunity. 48 (5), 979-991 (2018).
- Salter, M. W., Stevens, B. Microglia emerge as central players in brain disease. Nat Med. 23 (9), 1018-1027 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Di Liberto, G., et al. Neurons under T cell attack coordinate phagocyte-mediated synaptic stripping. Cell. 175 (2), 458-471 (2018).
- Bisht, K., et al. Dark microglia: A new phenotype predominantly associated with pathological states. Glia. 64 (5), 826-839 (2016).
- Weerasinghe-Mudiyanselage, P. D. E., et al. Structural plasticity of the hippocampus in neurodegenerative diseases. Int J Mol Sci. 23 (6), 3349 (2022).
- Aw, E., Zhang, Y., Carroll, M. Microglial responses to peripheral type 1 interferon. J Neuroinflammation. 17 (1), 340 (2020).
- Brioschi, S., et al. Detection of synaptic proteins in microglia by flow cytometry. Front Mol Neurosci. 13, 149 (2020).
- Norris, G. T., et al. Neuronal integrity and complement control synaptic material clearance by microglia after CNS injury. JEM. 215 (7), 1789-1801 (2018).
- Mattei, D., et al. Enzymatic dissociation induces transcriptional and proteotype bias in brain cell populations. Int J Mol Sci. 21 (21), 7944 (2020).
- Jaszczyk, A., Stankiewicz, A. M., Juszczak, G. R. Dissection of mouse hippocampus with its dorsal, intermediate and ventral subdivisions combined with molecular validation. Brain Sci. 12 (6), 799 (2022).
- Fixable viability dyes for flow cytometry. Thermo Fisher Scientific Available from: https://www.thermofisher.com/de/de/home/life-science/cell-analysis/flow-cytometry/flow-cytometry-assays-reagents/cell-viability-assays-flow-cytometry/fixable-viability-dyes-flow-cytometry.html (2024)
- SynPER synaptic protein extraction reagent. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/87793?gclid=CjwKCAiAi6uvBhADE_iwAWiyRdigrNHuDkIAVVsaW8OaC3VJNgrPEm1I64E2P (2024)
- Wu, A., Yu, B., Komiyama, T. Plasticity in olfactory bulb circuits. Curr Opin Neurol. 64, 17-23 (2020).
- pHrodo indicators for pH determination. Thermo Fisher Scientific Available from: https://www.thermofisher.com/de/de/home/brands/molecular-probes/key-molecular-probes-products/phrodo-indicators.html (2024)
- Rangaraju, S., et al. Differential phagocytic properties of CD45low microglia and CD45high brain mononuclear phagocytes-activation and age-related effects. Front Immunol. 9, 405 (2018).
- Weinhard, L., et al. Microglia remodel synapses by presynaptic trogocytosis and spine head filopodia induction. Nat Commun. 9 (1), 1228 (2018).
- Morizawa, Y. M., et al. Synaptic pruning through glial synapse engulfment upon motor learning. Nat Neurosci. 25 (11), 1458-1469 (2022).
- Morini, R., et al. Strategies and tools for studying microglial-mediated synapse elimination and refinement. Front. Immunol. 12, 640937 (2021).
- Maecker, H. T., Trotter, J. Flow cytometry controls, instrument setup, and the determination of positivity. Cytometry. Part A: J. Int Soc Anal Cytol. 69 (9), 1037-1042 (2006).
- . Strategies for intracellular flow cytometry success Available from: https://www.biocompare.com/Editorial-Articles/582159-Strategies-for-Intracellular-Flow-Cytometry-Success/ (2022)
- . Isotype control antibodies, Key points Available from: https://www.antibodies.com/primary-antibodies/isotype-control-antibodies#:~:text=Isotype%20controls%20should%20be%20used (2024)
- Flow cytometry intracellular staining controls. Bio-Rad Available from: https://www.bio-rad-antibodies.com/flow-cytometry-intracellular-controls.html (2024)
- Dissing-Olesen, L., et al. FEAST: A flow cytometry-based toolkit for interrogating microglial engulfment of synaptic and myelin proteins. Nat Commun. 14, 6015 (2023).
- Jurga, A. M., Paleczna, M., Kuter, K. Z. Overview of general and discriminating markers of differential microglia phenotypes. Front Cell Neurosci. 14, 198 (2020).
- van Wageningen, T. A., et al. Regulation of microglial TMEM119 and P2RY12 immunoreactivity in multiple sclerosis white and grey matter lesions is dependent on their inflammatory environment. Acta Neuropathol Commun. 7 (1), 206 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。