Method Article
使用 RGD 功能化亲和素-生物素系绳研究血小板迁移的体外测定
摘要
提供了使用具有可调密度的 RGD 功能化亲和素-生物素系绳对单个迁移血小板进行成像的详细方案,揭示了血小板产生足够的力来破坏亲和素-生物素键。
摘要
尽管血小板是去核细胞片段,但其多方面能力现在被广泛认可。它们不仅会形成血栓以防止受伤后出血,而且还会在炎症性疾病期间抵抗感染并维持血管完整性。虽然止血栓需要血小板的集体激活和聚集,但它们在保护发炎血管方面的作用是在单细胞水平上进行的。在这种情况下,最近的数据表明,血小板可以自主迁移,这一过程取决于其粘附环境的机械感应。在这里,提出了一种对单血小板迁移进行成像的详细方案,利用由聚-L-赖氨酸接枝聚乙二醇 (PLL-PEG) 生物素骨架 (1)、荧光亲和素接头 (2) 和生物素环 Arg-Gly-Asp (cRGD) (3) 组成的三层涂层系统作为血小板整合素结合基序。这种还原主义方法可以精确控制底物粘附特性,并作为一种简单、标准化的 体外 测定法来研究血小板迁移的潜在机制。结果表明,与 cRGD 结合的迁移血小板施加的力能够破坏亲和素-生物素键。此外,生物素-cRGD 的密度显着影响血小板的扩散和迁移。
引言
血小板是源自骨髓中巨核细胞的小去核细胞片段。活化的血小板组装成聚集体,形成血凝块的基础,以密封生理止血中的血管病变或在病理性血栓形成中阻塞病变血管1。然而,近几十年来,很明显,血小板在炎症、感染和恶性肿瘤的病理生理学中也起着核心作用,其中与免疫细胞、癌细胞和入侵病原体的多方面相互作用对于塑造宿主免疫反应至关重要 2,3。最近的数据表明,血小板具有自主迁移的能力4。为了响应系统性菌血症,血小板被募集到肝窦,在那里它们粘附和迁移。迁移使血小板能够捕获和结合细菌,从而支持白细胞活化。值得注意的是,在此过程中,血小板保持血管内,不会迁移到内皮下组织4。此外,血小板是血管炎症的哨兵,扫描发炎的血管以查找由免疫细胞外渗引起的微损伤5,并利用迁移来保护发炎的血管 6,7。在这里,血小板使用它们的整合素结合沉积在发炎的内皮上的纤维蛋白原。然后,血小板形成层状突起,使它们能够扫描环境的粘附特性。然后血小板极化并迁移到更高密度的纤维蛋白原,这一过程称为趋触性。定向血小板迁移最终支持定位在内皮微病变处,从而防止发炎组织(包括肌肉和肺)出血。
血小板迁移在很大程度上取决于胶粘剂基材的机械性能 4,8。感应和转导环境机械特性的任务主要由整合素受体介导,整合素受体是由 α 和 β 亚基组成的跨膜异二聚体蛋白,细胞外结构域与细胞外基质上的配体结合,胞内结构域通过衔接蛋白与肌动蛋白细胞骨架结合 9,10。最丰富的血小板整合素是 αIIbβ3,其主要配体是纤维蛋白(原)11。整合素-配体结合触发信号转导事件,最终形成 Arp2/3 驱动的板状足,形成贴壁血小板的前缘7。粘附的血小板通过拉动它立即探测其粘合环境的机械性能4.当肌球蛋白 IIa 依赖性拉力克服细胞外基质(例如纤维蛋白(原))的机械稳定性时,血小板会机械地破坏弱化的配体,并使用其层状突起扫描微环境中的粘附配体,建立新的底物键,并从配体耗尽的环境中迁移出去6.由非蛋白水解、机械配体耗竭驱动的细胞迁移可能在血小板功能之外发挥作用,因为它似乎是在能够机械重塑其粘附基质的细胞中观察到的一种普遍现象8。配体消耗的速率决定了迁移速度,并取决于底物的配体稳定性和配体密度8。低配体密度的血小板能够机械破坏与玻璃盖玻片结合的工程整合素配体(环状 Arg-Gly-Asp (cRGD))6,7,生物素-亲和素系绳具有约 160 皮卡顿 (pN) 的解结合力12,13,14,15。
在这里,这些观察结果被用来开发一种简单的 体外 方案,用于产生配体不稳定的粘合表面,促进血小板迁移机制的研究。本协议中概述的粘合剂涂层由三个基本元件组成:(1) PLL-PEG-生物素骨架和 (2) 中性亲和素-荧光素异硫氰酸酯 (NA-FITC) 接头,促进 (3) 生物素-cRGD(粘合剂配体)与 PLL-PEG-生物素骨架的结合(另见 图 1B)。该构建体的稳定性取决于生物素-亲和素键的强度,该键可在 (A) PLL-PEG-生物素-NA-FITC 或 (B) FITC-NA-生物素-cRGD 界面处断裂。此外,可以通过调整底层 PLL-PEG-生物素与 PLL-PEG 的比例来调整粘附配体的密度。键 (A) 的破坏导致 FITC 从涂层中释放出来,导致迁移血小板下方的荧光信号减少。因此,该方案中描述的涂层共同允许机械和粘合剂基材特性的精确可调性,并提供基于荧光的血小板迁移的简单读数。
研究方案
本研究中进行的动物实验符合涉及小鼠研究的所有相关伦理规定,并获得了当地动物保护立法的批准(Regierung von Oberbayern,慕尼黑,190-15,2015 年)。本研究使用 8-10 周龄 (体重 20-25 g) 的雌性和雄性 C57BL/6 小鼠。所用试剂和设备的详细信息列在 材料表中。
1. 生物素-中性亲和素-生物素 cRGD 涂层
- 在 20% HNO3 中对玻璃盖玻片 (24 mm x 24 mm;# 1.5) 超声处理 1 分钟,然后在异丙醇、乙醇和 H2O 中超声处理 1 分钟。每次超声处理后,用蒸馏水 (ddH2O) 充分冲洗盖玻片,最后在培养箱中干燥。
- 在等离子清洁器中用 O2 等离子体处理预清洁的盖玻片 2 分钟,然后如前所述用粘性载玻片组装16。粘性载玻片和玻璃盖玻片将在它们之间形成一个通道(如图 1A 所示)。
注意:高效的等离子体处理很重要。使用 O2 作为血浆源。 - 用 2.5 μL 用 97.5 μL PLL-PEG (1 mg/mL) 稀释的 PLL-PEG-生物素 (1 mg/mL) 填充通道,并在室温 (RT) 下孵育 30 分钟,然后用 PBS 洗涤 3 次。PLL-PEG-生物素在后续步骤中结合中性亲和素,而 PLL-PEG 骨架形成惰性底物,可防止蛋白质和血小板的非特异性结合。
注:包被溶液中 PLL-PEG-生物素的浓度决定了 cRGD 配体的最终密度。 - 加入 100 μL 中性亲和素-FITC (25 μg/mL),在 RT 下避光孵育 30 分钟,然后用 PBS 洗涤 3 次。
注意:将中性亲和素-FITC 浓度调整为 PLL-PEG-生物素浓度。如果包被较高的 PLL-PEG-生物素密度,则增加中性亲和素-FITC 浓度。 - 加入 100 μL 环 [Arg-Gly-Asp-D-Phe-Lys (生物素-PEG-PEG)] (cRGD-生物素) (0.1-1 μM),在 RT 下孵育 30 分钟,并用 PBS 洗涤 3 次。盖玻片即可使用。涂层示意图如图 1B 所示。
2. 从血液中分离小鼠血小板
- 制备改良的 Tyrode 缓冲液,其中含有 136.9 mM NaCl、12.1 mM NaHCO3、2.6 mM KCl、5.5 mM 葡萄糖、10 mM HEPES,并将 pH 值调节至 7.4 和 6.5。
- 通过腹膜内注射 0.5 mg/kg 芬太尼、5 mg/kg 咪达唑仑和 0.05 mg/kg 美托咪定麻醉小鼠(遵循机构批准的方案)。通过脚趾捏确认麻醉深度后,用剪刀去除胸部皮肤。
- 准备一个 2 mL 注射器(26 G 针头),其中含有 150 μL 酸-柠檬酸盐-葡萄糖 (ACD) 作为抗凝剂。将针头插入胸骨左侧的第二和第三肋骨之间,从心脏抽血。之后,通过颈椎脱位对小鼠实施安乐死。
注:(1) ACD 缓冲液组成:85 mM 柠檬酸三钠脱水和 65 mM 柠檬酸一水合物在 111 mM 葡萄糖中。(2) 抽血应顺利进行,以免形成血凝块。可以从 1-8 周龄的小鼠中获得大约 10 mL 的血液。 - 将血液与 1 mL Tyrode 缓冲液 (pH 6.5) 在 5 mL FACS(聚苯乙烯圆底)管中混合,并在室温下以 70 x g 离心 20 分钟,并关闭制动器。
- 离心后,取含有富血小板血浆 (PRP) 的上部(约 1 mL)。与 3 mL Tyrode 缓冲液 (pH 6.5) 混合,并加入 100 ng/mL 前列环素 (PGI2) 以防止血小板活化。
- 在 RT 下以 1200 x g 离心 5 分钟,弃去上清液,将沉淀重悬于 500 μL Tyrode 缓冲液 (pH 6.5) 中,并使用血细胞计数器测量血小板计数。
3. 生物素-中性亲和素-生物素 cRGD 涂层上的小鼠血小板迁移
- 在改良的 Tyrode 缓冲液 (pH 7.4) 中补充 10 x 10个 3/μL 小鼠血小板、1 mM CaCl2、2 μM U46619 和 4 μM 腺苷 5′-二磷酸钠盐 (ADP),并将总体积为 240 μL 的移液器移液到步骤 1 中制备的通道中。
- 使用配备载物台培养箱的倒置显微镜记录活血小板迁移。或者,将通道在 37 °C 下在培养箱中孵育 1 小时。
- 在 RT 下用 4% 多聚甲醛固定样品 10 分钟,然后用 PBS 洗涤 5 次。
- 用 Triton-X(0.2% 的 PBS 溶液)透化血小板 5 分钟,然后用 PBS 洗涤 5 次。
- 在 100 μL PBS 中稀释 2.5 μL Alexa Fluor 594 鬼笔环肽(40x 甲醇原液)。在黑暗中与血小板孵育 30 分钟,然后用 PBS 洗涤 5 次。
- 在荧光显微镜下对载玻片进行成像。
4. 定量
注意:形成丝状伪足(手指状突起)或板状伪足(片状突起)的血小板计为粘附血小板4。迁移距离大于其直径 1 的血小板被定义为迁移血小板。
- 迁移血小板的分数:在斐济使用 多点 工具计算血小板粘附或迁移数。右键单击工具栏中 Point Tool 的下拉菜单以选择 Multi-point 工具。通过将迁移血小板的数量除以粘附血小板的数量来计算迁移血小板的分数。
- 平均迁移距离:通过使用 自由手线 工具测量中“印记”在 neutravidin-FITC 涂层中的迁移路径的长度,从固定样品中提取迁移距离。右键单击工具栏中 Straight Line 的下拉菜单,选择 Free Hand Line 工具。
- 血小板形状描述符:通过使用 阈值 函数分割荧光血小板 (Alexa594-Phalloidin) 来生成二元掩码。在工具栏中选择 Image > Adjust > Threshold 。
- 形状描述符(如面积、周长、圆度和纵横比)可以在 analyze particles 中获得。在 Analyze > Set measurements(分析设置测量值)中选择形状描述符,然后选择在 Analyze > Analyze Particles 中显示结果。
结果
活化的血小板很容易粘附并扩散在 PLL-PEG-生物素-中性亲和素-FITC-生物素-cRGD 包被的载玻片上(图 1C 和 图 2A;0 分钟和 5 分钟),随后通过在前缘形成层状足片进行极化(图 2A;10 分钟)。在此过程中,假核(血小板中心的暗区)从血小板的中心移动到后部(图 2A)。然后极化血小板开始迁移,没有明显的方向性(图 2A;15 分钟和 20 分钟以及 图 2B)。我们观察到在 PLL-PEG-生物素-中性亲和素-FITC-生物素-cRGD 涂层上迁移的血小板可以破坏中性亲和素-FITC-生物素-PLL-PEG 键,沿迁移路径荧光强度的降低证明了这一点(图 1C 和 图 2A、B)。此外,被破坏的中性亲和素-FITC-生物素-cRGD 复合物积聚在血小板表面(图 2A、B)。这种现象与以前的发现相似,其中迁移的血小板从底物中去除纤维蛋白原并将其积累在其开放的小管系统 (OCS) 中4。
为了研究配体密度如何影响血小板迁移,通过改变第一涂层中 PLL-PEG-生物素与 PLL-PEG 的比率来调整 cRGD 密度。这些数据表明,小鼠血小板在 2.5% 浓度的 PLL-PEG 生物素下实现最佳迁移。在较低 (1%) 和较高 (10%) 浓度的 PLL-PEG-生物素下,迁移均减少(图 3A,B)。迁移行为的这些底物依赖性变化伴随着血小板形态的改变(图 3C)。在低配体密度 (1%) 下,血小板不能充分扩散,投射的血小板面积和周长较低就证明了这一点(图 3C)。这表明整合素激活和由外而内的信号转导不足7。因此,血小板无法对 cRGD 配体施加力,无法重塑底物,并且不会迁移(图 3A,B)。
在中等配体密度 (2.5%) 下,血小板面积和周长显着增加(图 3C)。血小板有效扩散,机械破坏不稳定的 cRGD 配体并迁移(图 3A、B)。然而,在高配体密度 (10%) 下,尽管铺展增加,但血小板无法极化,由纵横比降低表示(图 3C)。在这些条件下,血小板保持附着在粘性底物上并且不会迁移,因为它们无法破坏不稳定的 cRGD 配体(图 3A、B)。
这些发现表明,血小板迁移在很大程度上取决于基材的粘合性能。只有当血小板与粘附配体充分结合并同时产生足够强的牵引力以克服粘附基材的张力耐受性时,它们才能迁移 4,6,7,8。
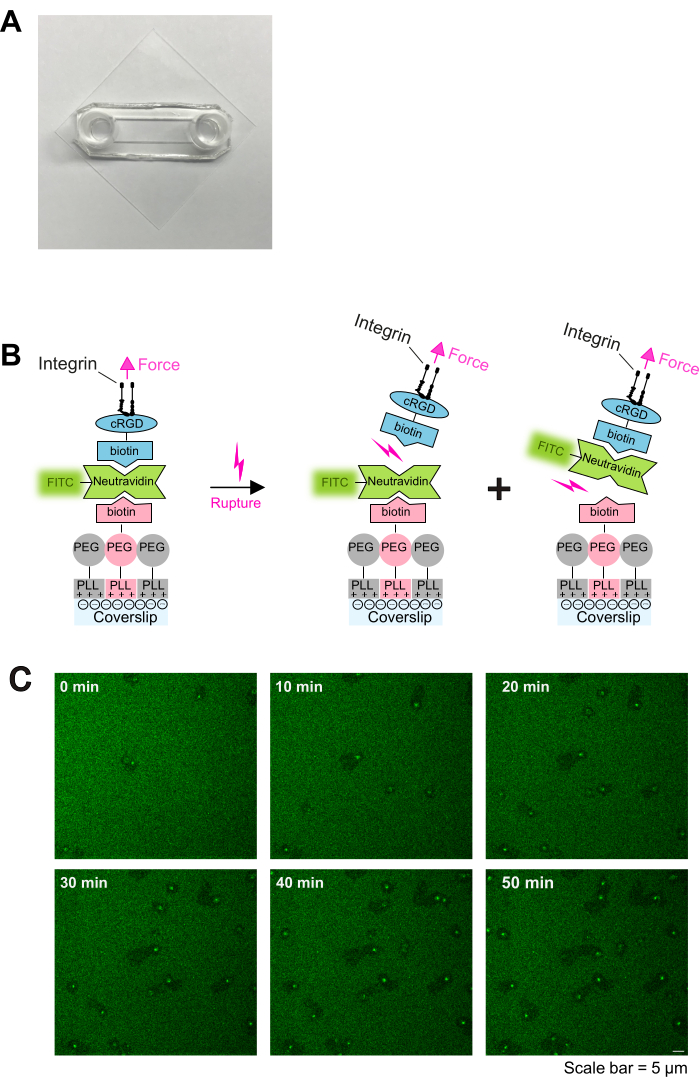
图 1:血小板-基质相互作用的涂层程序和实时成像。 (A) 组装室的照片。(B) 协议的原则。左:涂层示意图。等离子体处理的玻璃盖玻片涂有三层。第一层是 PLL-PEG 和 PLL-PEG-生物素的混合物(PLL-PEG 骨架对细胞呈惰性,可防止非特异性结合)。第二层是中性亲和素-FITC,第三层是生物素-cRGD。Neutravidin-FITC 桥接 PLL-PEG-生物素和生物素-cRGD。血小板 通过 质膜中的整合素与生物素-cRGD 结合。右图:血小板整合素解结合生物素-亲和素的图示。血小板通过整合素-cRGD 结合对底物施加力,并破坏上层 cRGD-生物素 - 中性亲和素-FITC - 键或下层中性亲和素-FITC - PLL-PEG-生物素 - 键。中性亲和素-FITC 和生物素-PLL-PEG 之间的下层键断裂导致荧光信号减弱,而生物素-cRGD 和中性亲和素-FITC 之间的上层键断裂则不会。(C) 显示血小板迁移和不稳定 cRGD 配体耗竭的时间序列。荧光减弱的区域表明血小板的迁移轨迹(另见 图 2A),荧光增强的区域表明 FTIC-中性亲和素-生物素-cRGD 在迁移的血小板上积累。比例尺:5 μm。 请点击此处查看此图的较大版本。

图 2:由重塑底物编码的血小板迁移的免疫荧光成像。 (A) 单个血小板迁移的代表性电影序列。左:迁移血小板的相差图像。血小板通过在前缘形成片状足部进行极化,随后迁移。右图:Neutravidin-FITC 从底物中去除,留下血小板迁移的“足迹”。破裂的 cRGD-生物素-中性亲和素-FITC 积聚在迁移血小板的中心。(B) 配体不稳定的 cRGD-生物素-亲和素涂层上血小板迁移的代表性图像。上图:用鬼笔环肽 (Alexa FluorTM 594) 染色的血小板显示出大的板状足形成和极化形状,让人想起迁移的血小板。迁移的血小板破坏了 cRGD-生物素-中性亲和素-FITC 键,在底物上产生迁移路径,由 FITC 信号减弱指示。下部:具有较大放大倍率的裁剪图像。(C) 在斐济用黄线手动绘制迁移轨迹。比例尺:5 μm。 请点击此处查看此图的较大版本。

图 3:PLL-PEG-生物素与 PLL-PEG 的比率决定了血小板的迁移和形状。 (A) 血小板在 1%、2.5% 和 10% PLL-PEG-生物素涂层上的代表性图像,比例尺:5μm。(B) 血小板粘附、迁移效率和迁移距离的定量,n = 4 个独立实验;平均值/标准差;单因素方差分析/Tukey;**p < 0.01;p < 0.001;p < 0.0001,ns:不显著 (C) 血小板形状描述符(面积、周长、圆度和纵横比)的定量,n = 4 个独立实验;平均值/最小值-最大值;单因素方差分析/Tukey;**p < 0.01;p < 0.001;p < 0.0001,ns:不显著。请单击此处查看此图的较大版本。
讨论
在该协议中,提出了一种三层涂层程序,包括 (1) PLL-PEG-生物素骨架和 (2) 中性亲和素-FITC 接头,促进 (3) 生物素-cRGD(粘附配体)与 PLL-PEG-生物素骨架的结合(另见 图 1B)通过改变 PLL-PEG-生物素与 PLL-PEG 的比例来精确调节机械和粘附基材特性,并提供基于荧光的简单血小板迁移读数。虽然该方案使用 FITC 偶联的中性亲和素和 Alexa Fluor 594 偶联的鬼笔环肽来跟踪血小板迁移和形状,但可以使用其他荧光团偶联的亲和素和鬼笔环肽。由于所有包被试剂,包括 PLL-PEG、PLL-PEG-生物素、中性亲和素-FITC 和 cRGD-生物素,以及血小板激活剂都是市售的,因此无需太多额外努力即可进行该实验。关键步骤是血浆处理,因为低效的血浆处理会导致 PLL-PEG/PLL-PEG-生物素与底物结合不充分,从而导致血小板粘附和迁移失败。等离子清洗机的性能很重要。一般来说,具有 13.6 MHz 发生器的等离子体清洗机的性能优于具有 40 KHz 或 100 KHz 的等离子清洗机。此外,氧气等离子体源比环境空气更合适。成功的等离子体处理后,涂层步骤几乎不容易出错。
血小板先前已被证明使用间充质迁移模式,该模式高度依赖于底物粘附 4,17。与成纤维细胞类似,低配体密度会阻碍迁移,因为血小板难以粘附在底物上,而高配体密度通过阻止牢固粘附物的脱离来阻碍迁移18(图 3)。在中等密度下,血小板确实粘附,而每个整合素键的肌球蛋白 IIA 依赖性拉力仍然足以打破粘附。值得注意的是,整合素 αIIbβ3 与其配体纤维蛋白(原)之间的高亲和力导致粘附的分解不是通过粘附配体的释放,而是通过其与底层底物(如体内内皮细胞或体外盖玻片)的破裂或分离 4,6.将纤维蛋白原从底层底物上分离所需的解结合力在很大程度上受到物理和(生物)化学性质的影响,这些性质通常难以控制,这可能导致迁移效率的显著变化。这里介绍的检测提供了一种还原论方法来解决这个问题。然而,亲和素-生物素键的断裂力固定在 160 pN 左右,因此必须使用更复杂的张力传感器,例如基于双链 DNA 系绳的传感器,来研究较低力下的血小板粘附19。
既往研究发现,血小板迁移与体内细菌感染和血管炎症有关。因此,具有迁移缺陷的血小板,例如肌球蛋白收缩力受损、肌动蛋白聚合或整合素由外而内的信号传导,显示细菌清除和血管完整性受损 4,6,7。这里介绍的测定法简单、稳定,因此适用于筛选小分子抑制剂及其对血小板迁移的影响。它提供了一种新颖的体外工具,用于探索炎症或血栓形成的治疗靶点。
披露声明
作者没有什么可披露的。
致谢
这项工作得到了 Deutsche Forschungsgemeinschaft (DFG;德国研究基金会)的项目编号 514478744 和 514477451 到 F.G.该项目由欧盟(ERC、MEKaics 101078110)资助。所表达的观点和意见仅代表作者的观点和意见,并不一定反映欧盟或欧洲研究委员会执行机构的观点和意见。欧盟和授权机构都不能对它们负责。
材料
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
参考文献
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。